Revista de Biología Tropical
versión On-line ISSN 0034-7744versión impresa ISSN 0034-7744
Rev. biol. trop vol.59 no.2 San José jun. 2011
Insectos acuáticos y calidad del agua en la cuenca y embalse del río Peñas Blancas, Costa Rica
Meyer Guevara Mora
Unidad de Cuenca del río Peñas Blancas, UEN Proyectos y Servicios Asociados, Instituto Costarricense de Electricidad, San José, Costa Rica, Apdo. 10032-1000; entomomeyer@gmail.com
Dirección de correspondencia.
Abstract
Aquatic insects and water quality in Peñas Blancas watershed and reservoir. The aquatic insects have been used to evaluate water quality of aquatic environments. The population of aquatic insects and the water quality of the area were characterized according to the natural and human alterations present in the study site. During the monthly-survey, pH, DO, temperature, water level, DBO, PO4 and NO3 were measured. Biological indexes (abundance, species richness and the BMWP-CR) were used to evaluate the water quality. No relation between environmental and aquatic insects was detected. Temporal and spatial differences attributed to the flow events (temporal) and the presence of Peñas Blancas reservoir (spatial). In the future, the investigations in Peñas Blancas watershed need to be focused on determining the real influence of the flows, sediment release and the possible water quality degradation because of agriculture activities. Rev. Biol. Trop. 59 (2): 635-654. Epub 2011 June 01.
Key words: water quality, BMWP-CR, aquatic insects, Peñas Blancas river, flow events, dams.
Resumen
La población de insectos acuáticos y la calidad del agua fueron caracterizadas tomando en cuenta las alteraciones humanas y naturales en el área de estudio. Durante los muestreos mensuales, el pH, OD, temperatura, nivel del agua, DBO, PO4 y NO3 fueron medidos. Los índices biológicos (abundancia, riqueza de especies y el BMWP-CR) se evaluaron para determinar la calidad del agua. No se detectaron relaciones entre las variables ambientales y los insectos acuáticos, pero las diferencias espaciales y temporales en la abundancia y riqueza fueron asociadas con las crecidas del río (temporal) y a la presencia del embalse Peñas Blancas (espacial). En el futuro las investigaciones en la cuenca Peñas Blancas deben de ser dirigidas a determinar la magnitud de la influencia de los caudales, liberación de sedimentos y la posible degradación de la calidad del agua por efluentes de aguas servidas que se lleguen a ubicar en la cuenca.
Palabras clave: calidad del agua, BMWP-CR, insectos acuáticos, río Peñas Blancas, crecidas del río, represas.
El método más utilizado en Costa Rica para la generación de la energía eléctrica es la hidroelectricidad, la cual requiere de la construcción de represas o embalses que ocasionan impactos en la corriente del agua y cambios en las tasas de deposición de material orgánico a lo largo del río (Grubbs et al. 2004, Sharma et al. 2005). Durante los años 90 se construyeron más de 30 proyectos hidroeléctricos, los cuales en la actualidad proporcionan aproximadamente el 80% de la electricidad consumida en Costa Rica, con costos ambientales relacionados con la distribución y abundancia de la biota con migraciones (Anderson et al. 2006).
Además de los efectos ocasionados por las represas hidroeléctricas también existen actividades humanas que cambian la composición química del agua, lo cual se refleja en la presencia o ausencia de taxones sensibles a la contaminación (Gage et al. 2004) o cambios físicos relacionados con la profundidad de pozas, sinuosidad, ancho y profundidad del cauce (Richards et al. 1994, Ometo et al. 2000, Diamond et al. 2002) lo cual repercute en las poblaciones acuáticas.
El grupo más abundante en los sistemas acuáticos es el de los insectos acuáticos, cuya permanencia en los cuerpos de agua, sensibilidad a los cambios ambientales y su rol como fuente de alimento para otros miembros de las cadenas tróficas de los ambientes acuáticos han sido razones para su estudio (Rosenberg et al. 1993a, Ramírez et al. 1998b, Ramírez et al. 1998a).
Entre los cambios que se pueden detectar con los insectos acuáticos están: alteraciones del hábitat, cambios de temperatura, sustrato y concentración de desechos domésticos e industriales (Rosenberg et al. 1993b), en función del tiempo de ocurrencia e intensidad del evento. Es así como éstas características posibilitan su uso como herramientas para la evaluación espacio temporal de los cambios en la calidad del agua de cuerpos de agua superficial mediante el seguimiento biológico (Rosenberg et al. 1993a).
En términos generales, los programas de seguimiento biológico deben considerar variables como: diversidad de hábitat, densidad de poblaciones, composición taxonómica y estructura de las comunidades bénticas en el ecosistema, lo cual proporciona criterios suficientes para estimar la condición del agua a bajo costo y con variedad de metodologías (Rosenberg et al. 1993a).
El objetivo de este trabajo fue establecer los patrones espaciales de diversidad, riqueza y abundancia de insectos acuáticos para determinar la calidad del agua y como se relaciona con la presencia del embalse Hidroeléctrico Peñas Blancas. También se analiza el patrón de distribución temporal y cómo se asocia con eventos naturales ocurridos en el área durante el periodo de estudio.
Materiales y Métodos
Área de estudio: La investigación se realizó en la cuenca del río Peñas Blancas (10°15’-10°32’ N, 84°28’-84°48’ W), la cual está influenciada por el clima del Caribe y Zona Norte de Costa Rica en lo referente a los procesos de formación de lluvias, se caracteriza por la ausencia de época seca, con marzo y abril como los meses de menor precipitación. La parte alta de la cuenca tiene el 95% bajo cobertura boscosa en régimen de protección, aledaño al Bosque Eterno de los Niños y la Reserva Biológica Monteverde. La matriz de la parte media y baja está conformada por cultivos agrícolas, pastos y poblados. De acuerdo con la clasificación de Holdridge (1978) hay 10 zonas de vida, las más representativas son: el Bosque Pluvial Premontano y el Bosque Húmedo Premontano Transición a Basal. El máximo valor hídrico es 6 de acuerdo con la clasificación de Horton (1945).
Durante el periodo de estudio (enero a noviembre 2008) se hicieron 12 recolectas de insectos acuáticos en 11 sitios de muestreo ubicados en el cauce principal del río Peñas Blancas (PA1, PA2, PC1, PC2, PC3, PR1 y PR2) y tributarios (T1, T2, T3 y T4) seleccionados de acuerdo con las facilidades de acceso y siguiendo el gradiente de la cuenca (Fig. 1). Dos de los sitios están ubicados aguas arriba del embalse (PA 1 y PA 2), tres en el sector entre la represa y la zona donde se restituye el agua luego de la generación eléctrica (PC1 a PC3; aproximadamente 4 km de distancia), dos entre los tributarios y la restitución (PR1 y PR2) y cuatro ubicados en los tributarios (T1 a T4). En cada visita a los sitios se realizó un muestreo de insectos acuáticos y cuantificación de variables físico-químicas. Únicamente el río Peñas Blancas tiene influencia directa de la represa Hidroeléctrica Peñas Blancas y las etapas tempranas de construcción del proyecto hidroeléctrico Pocosol (Fig. 1).
Variables físico químicas y ambientales: Del 8 de enero al 18 de noviembre del 2008 se realizaron muestreos en la parte media y alta de la cuenca del río Peñas Blancas. La determinación del oxígeno disuelto (O.D.±0.01ppm) y la temperatura del agua (±0.1ºC) se realizó mediante un oxigenómetro portátil YSI DO 200. El grado de acidez del agua se midió con un sensor pHTestr 2 (±0.1). La profundidad del sector de muestreo se calculó a partir de cinco mediciones al azar de en el tramo de recolecta de insectos acuáticos (χ prof). Se aplicó un ANOVA no paramétrico (Kruskall-Wallis, p≤0.05) a las variables ambientales para detectar diferencias estadísticas entre los sitios y fechas de muestreo mediante StathGraphics Centurion XV (Versión 15.1.02).
Igualmente se determinó el pH, temperatura, oxígeno disuelto, sólidos suspendidos, sólidos disueltos, sólidos totales, DBO, PO4, NO3 y turbidez en tres sitios (PA 1, PC 2 y PR 1) mediante visitas mensuales. Los sitios se seleccionaron por su representatividad respecto a las condiciones ambientales del río principal Peñas Blancas. En cada visita se tomó una muestra de agua que se transportó al Laboratorio Químico de Hidrología, ICE para su respectivo análisis de acuerdo con los parámetros establecidos enel Standard Methods for the Examination of Waster and Wastewater (APHA 1985). Diferencias estadísticamente significativas (espacial y temporal) se calcularon con ANOVA no paramétrico (Kruskall-Wallis, p≤0.05).
Muestreo de insectos acuáticos: En cada sitio de muestreo se seleccionaron cuatro micro ambientes: acumulaciones de hojas, fondo rocoso, fondo arenoso y lodoso. Durante cinco minutos, dos personas removieron el sustrato para la captura de los insectos acuáticos corriente abajo en dos redes triangulares Wildco con apertura 305 x 305 x 305mm, bolsa de 152mm de profundidad y malla de 800 x 900mm nylon multifilamento (tiempo total de esfuerzo 10min). El material colectado fue separado en bandejas de color claro para distinguir los organismos capturados. Todos los individuos fueron preservados en envases plásticos con alcohol etílico al 70% para su posterior traslado e identificación en el laboratorio.
El reconocimiento taxonómico se efectuó con las claves taxonómicas disponibles (McCafferty 1981, Edmunds et al. 1996, Evans et al. 1996, Morse et al. 1996, Polhemus 1996, Roldán 1996, Stewart et al. 1996, Westfall et al. 1996, White et al. 1996, Wiggins 1996, Springer et al. 2010 en prensa), al nivel más detallado posible, en la mayoría de los casos a nivel de género y los individuos identificados de un mismo taxón se preservaronnen frascos individuales con alcohol etílico al 70% y se registró la abundancia numérica de cada grupo.
Para determinar la calidad del agua se aplicó el índice BMWP-CR el cual emplea las familias de insectos acuáticos asociadas con los cuerpos de agua y está incorporado en la normativa ambiental de Costa Rica. Tanto la abundancia como la riqueza por fecha de muestreo y sitio fueron analizados estadísticamente mediante ANOVA no paramétrico (Kruskall-Wallis, p≤0.05) (Sokal et al. 1979) a través del paquete estadístico StathGraphics Centurion XV, Version 15.1.02.
Mediante una matriz de abundancia numérica total de los taxa por sitio de muestreo se calculó la similitud entre parejas de sitios muestreados, mediante la comparación de la frecuencia de niveles en los que existió relación con todos los lugares involucrados, se utilizó como criterio de asociación el coeficiente de comparación de Morisita-Horn y la ponderación UPGMA según el método de ligamiento simple o agrupamiento del vecino más cercano (Pielou 1984). La graficación de los resultados se generó empleando el programa ACON3.BAS (Navarro 1984).
Para estimar la diversidad entomofaunística se calculó el índice de Shannon-Wiener (H`) de acuerdo con las especificaciones de Henderson & Seaby (1997). Las diferencias estadísticamente significativas (p≤0.05) de la diversidad genérica total durante el periodo de estudio para cada par de sitios y fechas de muestreo se calculó mediante la prueba de t, siguiendo los criterios de Magurran (1988). Tanto la abundancia como riqueza genérica fueron analizadas con ANOVA no paramétrica (Kruskall-Wallis, p≤0.05) (Sokal et al. 1979) mediante StathGraphics Centurion XV, Version 15.1.02.
Resultados
Variables físico químicas: En los sitios PA 1, PC 2 y PR 1 la temperatura (KW11=19.64, p=0.0002), pH (KW11=12.43, p=0.006) y el oxígeno disuelto (KW11=12.89, p=0.0048) presentaron diferencias estadísticamente significativas. Las variables PO4, NO3 y DBO5, las cuales se asocian a contaminación orgánica, no presentaron valores en intervalos nocivos para la permanencia de poblaciones de insectos en el cauce del río Peñas Blancas (Cuadro 1). Sin embargo, las variables asociadas con el acarreo de materiales (sólidos suspendidos, sólidos disueltos y sólidos totales) presentaron valores altos, principalmente en el muestreo de octubre 2008.
De acuerdo con las variables evaluadas en la totalidad de los sitios de muestreo (pH, temperatura, oxígeno disuelto y turbidez) no se observaron valores desfavorables para el desarrollo de poblaciones de insectos acuáticos (Cuadro 2). En términos generales la turbidez es variable, aparentemente en función del caudal presente en cada uno de los muestreos. El oxígeno disuelto (KW11=30.91, p=0.000607), la temperatura (KW11=61.82, p=1.63x10-9) y el pH (KW11=28.68, p=0.0014) mostraron diferencias significativas a nivel espacial.
Variables biológicas: Se recolectaron 9 órdenes, 41 familias y 72 géneros en un total de 11 181 individuos, de los cuales el 93% fue identificado a nivel de género. La mayoría de los individuos determinados únicamente a nivel de familia corresponden al orden Diptera, del cual en Costa Rica se tiene una escasa información taxonómica de la asociación larva-adulto (Cuadro 3).
A nivel de orden los taxones que presentaron la mayor abundancia fueron Ephemeroptera (n=5 779), Trichoptera (n=3 788) y Diptera (n=1 135); el resto de los órdenes mostraron abundancias por debajo de los 200 individuos. Leptohyphidae, Hydropsychidae y Baetidae fueron las familias más abundantes (n=3 907, n=3 516 y n=1 323, respectivamente). Los géneros con mayor distribución espacial fueron: Baetodes y Leptonema (presentes en todos los sitios), seguidos de Asioplax, Calosopsyche, Camelobaetidius, Corydalus, Leptohyphes y Tricorythodes, los cuales se localizaron en 10 sitios únicamente (Cuadro 3).
Para la abundancia total por sitio de muestreo, el 83% está distribuido en los sitios denominados PC2, T4, T2, T1, T3 y PC3, todos con abundancias superiores a los mil individuos (Kruskall-Wallis, F10=28.23, p=0.0016), ubicados principalmente en los tributarios y el sector de compensación. En la riqueza genérica, los mayores valores registrados se encuentran en los tributarios y PC3 (Kruskall-Wallis, F10=44.99, p<0.0001). En general la tendencia de los sitios ubicados en el cauce de compensación es aumentar sus valores de abundancia conforme se alejan del embalse (Fig. 2).
Considerando los valores registrados por fecha de muestreo, los meses con mayor abundancia fueron: abril (n=2 986), mayo (n=2 364) y marzo (n=1 847), los cuales presentaron diferencias significativas (Kruskall-Wallis, F11,93=35.48, p<0.0001). En términos de riqueza el valor máximo se obtuvo en marzo (n=40) y el mínimo en el muestreo de enero (n=13); sin embargo, no presentan diferencias significativas (Kruskall-Wallis, F11,93=16.45, p=0.12) (Fig. 2).
Al agrupar los sitios de muestreo por sector en la cuenca (Aguas Arriba del Embalse, Compensación, Restitución y Tributario), la máxima abundancia total se detectó en Tributario (n=6 282) y Compensación (n=3 637) (Kruskall-Wallis, F3,40=18.16, p<0.0001), así mismo los valores máximos de riqueza se detectaron en estos sectores (n=59, Tributarios; n=44, Compensación) (Kruskall-Wallis, F3,40=22.5, p=5.08*10-4). En cuanto a la diversidad, el valor máximo se obtuvo en T2 (H’=2.48) y el mínimo en PC1, PR2, PR1, PC3 y PC2 (H’=0). De acuerdo con la abundancia total por sitio de muestreo la máxima se detectó en Empacadora (H’=2.30) seguido de PC1 (H’=2.28) y la mínima en PR1 (H’=1.23); de acuerdo a la fecha de muestreo la máxima total se obtuvo en noviembre (H’=2.52), la mínima se obtuvo en el primer muestreo de enero (H’=1.71) (Cuadro 4).
La prueba de t para H´ (p≤0.05) reveló que existen diferencias significativas entre la diversidad total a nivel espacial como temporal para los sitios de muestreo y las fechas de muestreo. Asimismo, existen diferencias en cuanto la diversidad total por sitio de muestreo.
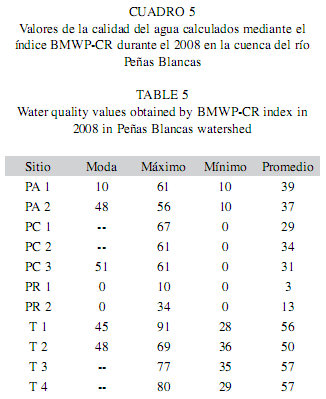
La aplicación del índice BMWP reveló que la mayoría de los sitios de muestreo tienen variaciones temporales de la calidad del agua, sin embargo, la categoría predominante es aguas de calidad mala, contaminadas; así mismo, la calidad de agua muy mala, extremadamente contaminada se detectó en aguas del río Peñas Blancas (Cuadro 5).
Según los criterios de Morisita-Horn, los sitios con mayor similitud son T2 y T1 (97% similitud), mientras que PA1y PR1 son los que más se diferencian del resto de sitios (47% de similitud) (Fig. 3).
Discusión
Los cambios ambientales tienen una fuerte influencia en la distribución, abundancia y riqueza de insectos acuáticos en los cuerpos de agua (Hawkins et al. 1982, Ometo et al. 2000, Shieh et al. 2000, Ocon et al. 2004). Ward (1992) mencionó que la temperatura, substrato, corriente y nivel del agua son los principales factores en condicionar la permanencia de estas poblaciones. Sin embargo, estos cambios pueden ser ocasionados por alteraciones antropogénicas o de carácter natural. De acuerdo con Posada et al. (2000) las variaciones estacionales de los organismos están en función del efecto que ocasionan las lluvias o las sequías en el volumen de agua transportado, el cual altera la disponibilidad de hábitats y por tanto compromete la sobrevivencia de los animales asociados con ellos.
Cuando existen alteraciones de carácter antropogénico, la condición físico química del agua presenta variaciones que limitan a las poblaciones de insectos acuáticos. El oxígeno disuelto está influenciado por la actividad biológica, temperatura y turbulencia del agua (Flanagan 1992, Roldán 2003), los ambientes contaminados son los que más se relacionan con bajos valores de oxígeno disuelto, en comparación con el rango normal de condiciones naturales (7.0-8.0mg/L) (Flanagan 1992). En el área de estudio los valores de oxígeno disuelto se encuentran en el intervalo para la permanencia de poblaciones saludables, similar a lo reportado en estudios previos (Posada et al. 2000, Ocon et al. 2004) y coincidente con lo reportado por Cortes et al. (1998) en ríos de Brasil con influencia de represas. Las diferencias estadísticamente significativas para los valores obtenidos en campo y laboratorio podrían ser atribuidas a condiciones particulares de cada hábitat, ya que en ocasiones se analizaron hábitat lóticos o lentos, en función del caudal del río, sin embargo se carece de información detallada para corroborar esta situación.
Según Flanagan (1992) el ámbito normal en el cual pueden fluctuar los valores de pH es de 6.5 a 8.0, rango en el cual se encuentran los valores detectados en el presente estudio y lo reportado por Nelson & Lieberman (2002). En el caso del área de estudio, aguas arriba del Embalse Peñas Blancas, se detectaron venas volcánicas que podrían ocasionar condiciones ácidas del agua (obs. per.), sin embargo, las pruebas estadísticas aplicadas a los valores reportados en laboratorio no detectaron diferencias estadísticamente significativas lo cual podría estar relacionado con la carga de sólidos disueltos, los cuales tienen capacidad para amortiguar los cambios en pH. Otros estudios (Courtney et al. 2000, Fjellheim et al. 2001, Bradley et al. 2002, Lepori et al. 2003) evidencian la sensibilidad de los macroinvertebrados a la acidificación del agua, por lo cual, si se mantienen las condiciones actuales, se podría descartar esta variable como una limitante para el desarrollo de las comunidades de insectos acuáticos en el río Peñas Blancas.
Las variables ambientales pueden cambiar según los gradientes altitudinales, lo cual puede ser más notorio en la temperatura del agua, generando divergencia en los patrones de distribución, abundancia y diversidad de los insectos acuáticos (Wallace et al. 1996). Los valores obtenidos para la temperatura en el presente estudio fueron similares a otros estudios realizados en sistemas lóticos (Posada et al. 2000, Figueroa et al. 2003). Las diferencias estadísticas reportadas podrían ser explicadas por cambios altitudinales entre los sitios de muestreo, el horario de muestreo y la descarga de la planta Peñas Blancas luego de la generación eléctrica, principalmente en los sitios del sector de restitución (PR1 y PR2).
Igualmente, la relativa estabilidad de los valores ambientales puede estar relacionado con la poca profundidad y volumen del embalse Peñas Blancas, lo cual fue validado por Palau (1998) quien durante tres años de investigación en el río Esera (influenciado por el Embalse Barahona) detectó que la media y la variación de la temperatura aumentaron de acuerdo con el estado de estratificación del embalse antes del vaciado, el volumen de agua embalsado y la temperatura media del embalse.
Con respecto a la turbidez para la cuenca del río Peñas Blancas, el principal aporte de sedimentos proviene de fuentes naturales asociadas con altas y frecuentes precipitaciones (Roldán 2003); sin embargo, existe un aporte antropogénico relacionado con las etapas de construcción del proyecto hidroeléctrico Pocosol aguas arriba del embalse Peñas Blancas. Así mismo disturbios naturales como deslizamientos pueden tener un impacto sobre las comunidades de animales acuáticos (por ejemplo, peces), y por lo tanto alterar los patrones normales de la abundancia que tienden a estabilizarse luego del evento (Liang-Hsien et al. 2004), situación que podría darse en la parte alta de la cuenca del río Peñas Blancas por la tendencia a deslizamientos en masa por la pendiente de las montañas.
No obstante durante la época de mayor precipitación en la cuenca de Peñas Blancas existe un aumento en la concentración de sedimentos acarreados por el agua; no se descarta que las concentraciones detectadas durante setiembre y octubre tengan un componente asociado a las maniobras de desalojo de sedimentos en los sitios aguas abajo del embalse, sin embargo, se carece de la información que permita distinguir el aporte natural antropogénico, la cual podría consistir en una propuesta futura de investigación en el área de estudio.
De acuerdo con lo estipulado por Ward (1992), quien establece que las fluctuaciones en el nivel del agua tienen influencia en los insectos acuáticos según la duración y extensión del evento, en la cuenca del río Peñas Blancas las crecidas del río y la generación eléctrica influyeron en el comportamiento de las poblaciones de macroinvertebrados, fue más notorio durante la época de mayor precipitación (abril 2008 en adelante) cuando la dinámica de los hábitats disponibles y las poblaciones cambia (Kohler 1985, Ramírez et al. 1998b, Shearer et al. 2003, Bass 2004).
De acuerdo con las condiciones ambientales observadas, el sector de restitución es de especial interés en la cuenca, debido a que en estos sitios se reportaron los valores más bajos de las variables biológicas evaluadas, lo cual se relacionó con las fluctuaciones de caudal generadas por los picos de producción eléctrica, coincidente con lo reportado en otros estudios (Malmqvist et al. 1996, Cortes et al. 1998, Nelson et al. 2002).
En términos de abundancia de macroinvertebrados, el grupo más abundante fue el de los efemerópteros, lo cual se relacionó con los múltiples ciclos de reproducción en el año (polivoltinos) y su capacidad de colonizar (Cortes et al. 1998, Palau 1998). En otras investigaciones realizadas por Malmqvist & Englund (1996) y Cortés et al. (1998) se determinó que este grupo taxonómico está fuertemente afectado por las fluctuaciones diarias de caudal en ríos regulados por represas hidroeléctricas, por lo cual se pueden considerar como un indicador de la perturbación del ambiente del río Peñas Blancas, sea por actividades humanas como las maniobras de desalojo de sedimentos o por crecidas naturales, principalmente en el sector de restitución, en el momento que se detecten disminuciones en su abundancia. En general, la entomofauna reportada continúa siendo similar a lo detectado en estudios efectuados en la cuenca del río San Carlos (Barrantes et al. 2003a, Barrantes et al. 2003b, Chaves 2007).
Según trabajos realizados por Stout (1980), Benstead (1996) y Benstead & Pringle (2004) los cúmulos de hojas y el detrito orgánico de origen natural tienen amplio valor para la alimentación y desarrollo de las poblaciones de insectos acuáticos. En el caso particular de la cuenca Peñas Blancas, al considerar que la época lluviosa afecta por igual a toda el área, el aumento en los volúmenes de agua generan la remoción y dificultan la permanencia de cúmulos de hojas, lo cual podría ser uno de los factores que disminuye la abundancia de insectos acuáticos luego del inicio del periodo de lluvias.
Sin embargo, a pesar de que los caudales también afectan a los tributarios, la máxima abundancia de efemerópteros y tricópteros en este sector de la cuenca está relacionado con la presencia de microhábitats para la permanencia de poblaciones abundantes (Ramírez et al. 1998, Reice 1980), lo cual se podría relacionar con la ausencia de represas que alteren la condición del río (Ligon et al. 1995).
Durante el periodo de menor precipitación en la cuenca del río Peñas Blancas se reportó una mayor abundancia de insectos acuáticos, la cual disminuyó cuando inició el periodo de lluvias, atribuible a que durante los eventos de crecidas del río las poblaciones de insectos se mantienen poco abundantes por la falta de hábitats y el desprendimiento de los sustratos a los cuales se adhieren (Scrimgeour et al. 1989, Nelson et al. 2002), generando un proceso denominado deriva (Anderson et al. 1968, Collier et al. 2003, Bass 2004, Callisto et al. 2005). Para el área de estudio se descarta la influencia de descargas de aguas servidas y alteraciones por los procesos agrícolas aledañas al río como condicionantes para la permanencia de poblaciones de insectos acuáticos abundantes, previamente evaluado en otros estudios (Herlihy et al. 2005, Harding et al. 2006, Kasangaki et al. 2006), por lo cual los insectos acuáticos pueden servir a futuro para observar el grado de degradación que sufra el río con respecto a la intervención humana en lo referente a las aguas negras.
Para el sector de restitución, los bajos valores de abundancia son atribuidos a las fluctuaciones e inestabilidad del hábitat por las variaciones del caudal en función de la generación eléctrica, similar a lo observado por otros autores en sistemas dulceacuícolas con influencia de represas para la generación de electricidad (Troelstrup et al. 1990, Chaves 2007).
Según Chaves (2007) para la cuenca del río Peñas Blancas la mayor abundancia y riqueza de géneros se detectó en los tributarios, coincide con el periodo en estudio. A pesar de que la represa tiene influencia en la permanencia de poblaciones de insectos acuáticos, para el área de estudio, se debe tener en cuenta que tanto los tributarios como el río Peñas Blancas tienen sustratos y patrones de caudales diferentes, los cuales pueden ser variables que alteren la interpretación de los resultados.
Considerando que el índice BMWP-CR fue diseñado de acuerdo a la tolerancia de las familias de macroinvertebrados a la contaminación del agua y sus óptimos para desarrollo (Alba-Tercedor 1996), las diferencias detectadas en la presente investigación están relacionadas con las variaciones temporales de la riqueza a nivel de familia (Morais et al. 2004). Contrario a lo propuesto por Zamora-Muñoz et al. (1995) quienes estimaron que el índice BMWP es válido por cuanto los valores obtenidos tuvieron relación con las condiciones ambientales y los valores máximos no alteraron la interpretación de la condición ambiental, para el presente estudio se detectaron valores de 0 que harían suponer que la calidad del agua mala, extremadamente contaminada en el sitio de estudio, contrario a lo detectado por medios físico químicos.
Al igual que lo reportado por Morais et al. (2004) en una cuenca del Portugal, el índice BMWP-CR en la cuenca del río Peñas Blancas no está relacionado con características físico químicas que normalmente están relacionadas con la calidad del agua (pH, temperatura, oxígeno disuelto, entre otros), por lo que otras variables como los caudales o la presencia de embalses condicionan el comportamiento de las poblaciones de insectos acuáticos, y por ende, el índice BMWP-CR.
El otro factor que influye en la composición de la entomofauna acuática en la cuenca es la presencia del embalse Peñas Blancas que genera sectorización, siendo más notables los efectos en la región adyacente a la restitución del agua luego del proceso de generación eléctrica por los fluctuaciones del caudal y transporte de sedimentos (Malmqvist et al. 1996, Cortes et al. 1998, Sharma et al. 2005).
Asociado al embalse también se tienen que desarrollar actividades de mantenimiento para liberar los sedimentos acumulados, para lo cual se aprovecha la época de mayores caudales y eventos naturales los cuales son factores que perjudican la entomofauna por la pérdida de hábitats y el arrastre por los volúmenes de agua, sin embargo, por la capacidad de recolonización que tienen los insectos acuáticos, muy rápidamente pueden aumentar en abundancia y diversidad, tal y como fue observado por Palau (1998) luego de las maniobras de mantenimiento del embalse de Barasona en España y lo reportado por Chaves (2007) para el río Peñas Blancas.
En términos generales los resultados de esta investigación evidencian el impacto de las represas hidroeléctricas en los sistemas dulceacuícolas, principalmente en el sector posterior a la restitución del agua, sin embargo, eventos naturales como las crecidas, periodo de lluvias y capacidad de transporte del agua también influyen en las poblaciones de insectos acuáticos, por lo cual se recomienda tener en cuenta estas variables cuando se interpreta su comportamiento con respecto a factores antropogénicos que causan estrés en la cuenca del río Peñas Blancas.
Agradecimientos
El desarrollo de este trabajo no hubiera sido posible sin el apoyo de Unidad de Cuenca del río Peñas Blancas, UEN PySA, ICE y el Centro de Servicio Ambiente y Cuencas, CG Toro, UEN Producción, ICE en la logística y materiales para la recolecta de insectos acuáticos. Así mismo se agradece a José F. Fernández Araya, del Laboratorio Químico de Hidrología, Centro de Estudios Básicos Ingeniería, ICE por el análisis de las variables físico químicas del agua. A Alfonso Garita y Juan José Rodríguez Alfaro en la parte de mapas y georeferenciación. Muchas gracias a Julio Gamboa Ramírez y Carlos Delgado Ledezma por la colaboración en las recolectas de campo y la preparación de las muestras de insectos acuáticos. Muchas gracias a Mauricio Herrera Campos, Armando Escobedo y revisores anónimos por su aporte de ideas y observaciones durante el desarrollo de la investigación.
Referencias
Alba-Tercedor, J. 1996. Macroinvertebrados acuáticos y calidad de las aguas de los ríos. IV Simposio del Agua en Andalucía (SIAGA). Almería 2: 203-213. [ Links ]
Anderson, E.P., C.M. Pringle & M. Rojas. 2006. Transforming tropical rivers: an environmental perspective on hydropower development in Costa Rica. Aquatic Conserv: Mar. Freshw. Ecosyst. 16: 679-693. [ Links ]
Anderson, N.H. & D.M. Lehmkuhl. 1968. Catastrophic drift of insects in a woodland stream. Ecology 49: 198-206. [ Links ]
Apha. 1985. Standard methods for the examination of water and wastewater. American Public Health Association, Washington D.C., EEUU. [ Links ]
Barrantes, U., M. Springer & G. Mora. 2003a. Condición de la fauna bentónica en ríos de la cuenca del Río San Carlos. Tecnología en Marcha 16: 110-118. [ Links ]
Barrantes, U., M. Springer & C. Moya. 2003b. La comunidad insectil en el bentos de ríos de la Cuenca del río San Carlos. Tecnología en Marcha 16: 101-109. [ Links ]
Bass, D. 2004. Diurnal stream drift of benthic macroinvertebrates on the small oceanic island of Dominica, West Indies. Caribb. J. Sci. 40: 245-252. [ Links ]
Benstead, J.P. 1996. Macroinvertebrates and the procession of leaf letter in a tropical stream. Biotropica 28: 367-375. [ Links ]
Benstead, J.P. & C.M. Pringle. 2004. Deforestation alters the resource base and biomass of endemic stream insects in eastern Madagascar. Freshwater Biol. 49: 490-501. [ Links ]
Bradley, D.C. & S.J. Ormerod. 2002. Long-term effects of catchment liming on invertebrates in upland streams. Freshwater Biol. 47: 161-171. [ Links ]
Callisto, M. & M. Goulart. 2005. Invertebrate drift along a longitudinal gradient in a neotropical stream in Serra do Cipo National Park, Brazil. Hydrobiologia 539: 47-56. [ Links ]
Collier, K.J. & J.M. Quinn. 2003. Land-use influences macroinvertebrate community response following a pulse disturbance. Freshwater Biol. 48: 1462-1481. [ Links ]
Cortes, R.M.V., M.T. Ferreira, S.V. Oliveira & F. Godinho. 1998. Contrasting impact of small dams on the macroinvertebrates of two Iberian mountain rivers. Hydrobiologia 389: 51-61. [ Links ]
Courtney, L.A. & W.H. Clements. 2000. Sensitivity to acidic pH in benthic invertebrate assemblages with different histories of exposure to metals. J. N. Am. Benthol. Soc. 19: 112-127. [ Links ]
Chaves, R. 2007. Efectos de las represas hidroeléctricas sobre las comunidades de macroinvertebrados. Tesis de Maestría, Universidad de Costa Rica, San Pedro, Costa Rica. [ Links ]
Diamond, J.M., D.W. Bressler & V.B. Serveiss. 2002. Assessing relationships between human land uses and the decline of native mussels, fish, and macroinvertebrates in the clinch and powell river watershed, USA. Environ. Toxicol. Chem. 21: 1147-1155. [ Links ]
Edmunds, G.F. & R.D. Walts. 1996. Ephemeroptera, p.126-163. In R.W. Merritt, K.W. Cummins (eds.). Aquatic insects of North America. Kendall/Hunt, EEUU. [ Links ]
Evans, E.D. & H.H. Neunzing. 1996. Megaloptera and aquatic Neuroptera, p.298-308. In R.W. Merritt, K.W. Cummins (eds.). Aquatic insects of North America. Kendall/Hunt, EEUU. [ Links ]
Figueroa, R., C. Valdovinos, E. Araya & O. Parra. 2003. Macroinvertebrados bentónicos como indicadores de calidad de agua de ríos del sur de Chile. Rev. Chil. Hist. Nat. 76: 275-285. [ Links ]
Fjellheim, A. & G.G. Raddum. 2001. Acidification and liming of River Vikedal, western Norway. A 20 year study of responses in the benthic invertebrate fauna. Water Air Soil Pollut. 130: 1379-1384. [ Links ]
Flanagan, P. 1992. Parameters of water quality. Environmental Research Unit, Irlanda. [ Links ]
Gage, M.S., A. Spivak & C.J. Paradise. 2004. Effects of land use an disturbance on benthic insects in head-water streams draining small watersheds North of Charlotte, N.C. Southeast. Nat. 3: 345-358. [ Links ]
Grubbs, S.A. & J.M. Taylor. 2004. The influence of flow impoundment and river regulation on the distribution of riverine macroinvertebrates at Mammoth Cave National Park, Kentucky, U.S.A. Hydrobiologia 520: 19-28. [ Links ]
Harding, J.S., K. Claassen & N. Evers. 2006. Can forest fragments reset physical and water quality conditions in agricultural catchments and act as refugia for forest stream invertebrates? Hydrobiologia 568: 391-402. [ Links ]
Hawkins, C.P., M.M. Murphy & N.H. Anderson. 1982. Effects of canopy, substrate composition, and gradient on the structure of macroinvertebrate communities in Cascade Range streams of Oregon. Ecology 63: 1840-1856. [ Links ]
Henderson, P. & R. Seaby. 1997. Species diversity & richness. Projecto Mamiraúa, Pennigton, Reino Unido. [ Links ]
Herlihy, A.T., W.J. Gerth, J. Li & J.L. Banks. 2005. Macroinvertebrate community response to natural and forest harvest gradients in western Oregon head-water streams. Freshwater Biol. 50: 905-919. [ Links ]
Holdridge, L. 1978. Ecología basada en zonas de vida. IICA, San José, Costa Rica. [ Links ]
Horton, R.E. 1945. Erosional development of streams and their drainage basins; hydrophysical approach to quantitative morphology. Bull. Geol. Soc. Am. 56: 275-370. [ Links ]
Kasangaki, A., D. Babaasa, J. Efitre, A. Mcneilage & R. Bitariho. 2006. Links between anthropogenic perturbations and benthic macroinvertebrate assemblages in afromontane forest streams in Uganda. Hydrobiologia 563: 231-245. [ Links ]
Kohler, S.L. 1985. Identification of stream drift mechanism: an experimental and observational approach. Ecology 66: 1749-1761. [ Links ]
Lepori, F., A. Barbieri & S.J. Ormerod. 2003. Effects of episodic acidification on macroinvertebrate assemblages in Swiss Alpine streams. Freshwater Biol. 48: 1873-1885. [ Links ]
Liang-Hsien, C., K.C.M. Chu & C. Yu-Wen. 2004. Impacts of natural disturbance on fish communities in the Tachia River, Taiwan. Hydrobiologia 522: 149-164. [ Links ]
Ligon, F.K., W.E. Dietrich & W.J. Trush. 1995. Downstream ecological effects of dams. BioScience 45: 183-192. [ Links ]
Magurran, A.E. 1988. Ecological diversity and its measurement. Princeton University, New Jersey, EEUU. [ Links ]
Malmqvist, B. & G. Englund. 1996. Effects of hydropower-induced flow perturbations on mayfly (Ephemeroptera) richness and abundance in north Swedish river rapids. Hydrobiologia 341: 145-158. [ Links ]
Mccafferty, W.P. 1981. Aquatic entomology. The fishermen’s and ecologist´s illustrated guide to the insects and their relatives. Jones and Bartlett, Londres, Inlgaterra. [ Links ]
Morais, M., P. Pinto, P. Guilherme, J. Rosado & I. Antunes. 2004. Assessment of temporary streams: the robustness of metric and multimetric indices under different hydrological conditions. Hydrobiologia 516: 229-249. [ Links ]
Morse, J.C. & R.W. Holzenthal. 1996. Trichoptera genera, p.350-386. In R.W. Merritt, K.W. Cummins (eds.). Aquatic insects of North America. Kendall/Hunt, EEUU. [ Links ]
Navarro, R. 1984. Programa computacional para el análisis numérico de comunidades Medio ambiente, Chile 7: 82-87. [ Links ]
Nelson, S.M. & D.M. Lieberman. 2002. The influence of flow and other environmental factors on benthic invertebrates in the Sacramento River, U.S.A. Hydrobiologia 489: 117-129. [ Links ]
Ocon, C.S. & A. Rodrigues. 2004. Presence and abundance of Ephemeroptera and other sensitive macroinvertebrates in relation with habitat conditions in pampean streams (Buenos Aires, Argentina). Arch. Hydrobiol 159: 473-487. [ Links ]
Ometo, J.P., L.A. Matinelli, M.V. Ballester, A. Gessner, A.V. Krusche, R.L. Victoria & M. Williams. 2000. Effects of land use water chemistry and macroinvertebrate in two streams of the Piracicaba river basin, south-east Brazil. Freshwater Biol. 44: 327-337. [ Links ]
Palau, A. 1998. Estudio limnológico del ecosistema fluvial afectado por los vaciados del embalse de Barasona. Limnética 14: 1-15. [ Links ]
Pielou, E.C. 1984. The interpretation of ecological data. A primer on classification and ordination. John Wiley and Sons, Nueva York, EEUU. [ Links ]
Polhemus, J.T. 1996. Aquatic and semiacuatic Hemiptera, p.267-297. In R.W. Merritt, K.W. Cummins (eds.). Aquatic insects of North America. Kendall/Hunt, EEUU. [ Links ]
Posada, J., G. Roldán & R. Ramírez. 2000. Caracterización fisioquímica y biológica de la calidad de aguas de la cuenca de la quebrada Piedras Blancas, Antioquia, Colombia. Rev. Biol. Trop 48: 59-70. [ Links ]
Ramírez, A. & C.M. Pringle. 1998a. Structure and production of a benthic insect assemblage in a neotropical stream. J. N. Am. Benthol. Soc. 17: 443-463. [ Links ]
Ramírez, A. & C.M. Pringle. 1998b. Invertebrate drift and benthic community dynamics in a lowland neotropical stream, Costa Rica. Hydrobiologia 386: 19-26. [ Links ]
Reice, S.R. 1980. The role of substratum in benthic macroinvertebrate microdistribution and litter decomposition in a woodland stream. Ecology 61: 580-590. [ Links ]
Richards, C. & G. Host. 1994. Examining land use influences on stream habitats and macroinvertebreates: a GIS approach. Water Resour. Bull. 30: 729-738. [ Links ]
Roldán, G. 1996. Guía para el estudio de los macroinvertebrados acuáticos del Departamento de Antioquia. Impreades Presencia, Bogotá, Colombia. [ Links ]
Roldán, G. 2003. Bioindicación de la calidad del agua en Colombia. Propuesta para el uso del método BMWP/Col. Universidad de Antioquia, Antioquia, Colombia. [ Links ]
Rosenberg, D.M. & V. Resh. 1993a. Rapid assessment approches to biomonitoring using benthic macroinvertebrates, p. 195-233. In V. Resh, H.K. Jackson (eds.). Freshwater biomonitoring and benthic macroinvertebrates. Chapman & Hall, Londres, Inglaterra. [ Links ]
Rosenberg, D.M. & V.H. Resh. 1993b. Introduction to freshwater biomonitoring and benthic macroinvertebrates, p. 1-9. In D.M. Rosenberg, V.H. Resh (eds.). Freshwater biomonitoring and benthic macroinvertebrates. Chapman & Hall, Nueva York, EEUU. [ Links ]
Scrimgeour, G.J. & M.J. Winterbourn. 1989. Effects of floods on epilithon and benthic macroinvertebrate populations in an unstable New Zealand river. Hydrobiologia 171: 33-44. [ Links ]
Sharma, C.M., S. Sharma, R. Borgstrom & I. Bryceson. 2005. Impacts of a small dam on macroinvertebrates: A case study in the Tinau River, Nepal. Aquat. Ecosyst. Health & Manag. 8: 267-275. [ Links ]
Shearer, K.A., J.D. Stark, J.W. Hayes & R.G. Young. 2003. Relationships between drifting and benthic invertebrates in three New Zealand rivers: implications for drift-feeding fish. N. Z. J. Mar. Freshw. Res. 37: 809-820. [ Links ]
Shieh, S.H. & P.S. Yang. 2000. Community structure and functional organization of aquatic insects in an agricultural mountain stream of Taiwan: 1985-1986 and 1995-1996. Zool. Stud. 39: 191-202. [ Links ]
Sokal, R.R. & F.J. Rohlf. 1979. Biometría. Principios y métodos estadísticos en la investigación biológica. H. Blume, Madrid, España. [ Links ]
Springer, M., A. Ramírez & P. Hanson. 2010. Macroinvertebrados de agua dulce de Costa Rica I. Rev. Biol. Trop. Suppl. 58 (Supl. 4). [ Links ]
Stewart, K.W. & P.P. Harper. 1996. Plecoptera, p. 217-266. In R.W. Merritt, K.W. Cummins (eds.). Aquatic insects of North America. Kendall/Hunt, EEUU. [ Links ]
Stout, J. 1980. Leaf decomposition rates in Costa Rican lowland tropical rainforest streams. Biotropica 12: 264-272. [ Links ]
Troelstrup, N. & G.L. Hergenrader. 1990. Effect of hydropower peaking flow fluctuation on community structure and feeding guilds of invertebrates colonizing artificial substrates in a large impounded river. Hydrobiologia 199: 217-228. [ Links ]
Wallace, J.B. & N.H. Anderson. 1996. Habitat, life history and behavioral adaptations of aquatic insects, p.41-73. In R.W. Merritt, K.W. Cummins (eds.). Aquatic insects of North America. Kendall/Hunt, EEUU. [ Links ]
Ward, J.V. 1992. Aquatic insects ecology. 1. Biology and habitat. John Wiley & Sons, Nueva York, EEUU. [ Links ]
Westfall, M.J. & K.J. Tennessen. 1996. Odonata, p.164-211. In R.W. Merritt, K.W. Cummins (eds.). Aquatic insects of North America. Kendall/Hunt, EEUU. [ Links ]
White, D.S. & W.U. Brigham. 1996. Aquatic Coleoptera, p. 399-473. In R.W. Merritt, K.W. Cummins (eds.). Aquatic insects of North America. Kendall/Hunt, EEUU. [ Links ]
Wiggins, G.B. 1996. Trichoptera families, p.309-349. In R.W. Merritt, K.W. Cummins (eds.). Aquatic insects of North America. Kendall/Hunt, EEUU. [ Links ]
Zamora-Muñoz, C., C.E. Sáinz-Cantero, A. Sánchez-Ortega & J. Alba-Tercedor. 1995. Are biological indices BMWP’ and ASPT’ and their significance regarding water quality seasonally dependent? Factors explaining their variations. Wat. Res. 29: 285-290. [ Links ]
Correspondencia a: Meyer Guevara Mora: Unidad de Cuenca del río Peñas Blancas, UEN Proyectos y Servicios Asociados, Instituto Costarricense de Electricidad, San José, Costa Rica, Apdo. 10032-1000; entomomeyer@gmail.com
Recibido 08-II-2010. Corregido 17-I-2011. Aceptado 18-I-2011.












 uBio
uBio