Services on Demand
Journal
Article
Indicators
-
 Cited by SciELO
Cited by SciELO -
 Access statistics
Access statistics
Related links
-
 Similars in
SciELO
Similars in
SciELO  uBio
uBio
Share
Revista de Biología Tropical
On-line version ISSN 0034-7744Print version ISSN 0034-7744
Rev. biol. trop vol.58 n.4 San José Dec. 2010
Comparación temporal de la composición y zonación de organismos en el intermareal rocoso del Parque Nacional Isla del Coco, Pacífico de Costa Rica
Jeffrey A. Sibaja-Cordero1, 2, 3 & Jorge Cortés1, 2
1. Centro de Investigación en Ciencias del Mar y Limnología (CIMAR), Universidad de Costa Rica, San Pedro, 11501-2060 San José, Costa Rica; jeffro@costarricense.cr
2. Escuela de Biología, Universidad de Costa Rica; jorge.cortes@ucr.ac.cr
3. Departamento de Ecología y Biología Animal, Facultad de Ciencias del Mar, Universidad de Vigo, España.
Dirección para correspondencia
Abstracts
Temporal comparison of the composition and zonation of rocky intertidal organisms at Cocos Island National Park, Pacific, Costa Rica. Several biological and physical factors change the rocky shore communities. The desiccation time and the tolerance of the intertidal species produce the vertical zonation. In many studies around the world, a temporal change in this zonation is presented. In Costa Rica, only studies that include temporal trends were carried out in Punta Mala and Montezuma, Pacific coast in 80`s. The rocky intertidal of the Cocos Island National Park, Costa Rica were surveyed photographically. The Chatham bay was sampled in three expeditions (January 2007, October 2007 and April 2008). Photos corresponding to 25x25cm quadrats were taken with the goal to determine diversity and composition differences in rocky shore organisms between sampling dates. The Wafer bay was sampled in January and October 2007. The intertidal of Chatham consists of basaltic rock, while Wafer has basaltic and ignimbrite boulders. The main difference between sites were the higher algae cover (erect-frondose forms) and number of organism bands at Chatham bay. Temporal change was not found in the total cover of sessile fauna and autotrophs. The barnacle Tetraclita stalactifera, that occurs above the algal fringe (lower intertidal), was the invertebrate with the highest coverage. The mobile fauna biodiversity presented no significant trend between sampled months. However, the identity of species, their cover and their abundance showed a moderate temporal change. In October 2007, when the sea surface temperature was 23ºC the infralittoral zone had an increase in green algae cover. The red algae (crust and erect-frondose forms) were dominant in January and April. The pulmonate limpet, Siphonaria gigas and a bacterial biofilm at mid littoral showed a negative association. The snails of the high littoral and the supralittoral zone showed a temporal change in their abundance, but with contrasting patterns between sites. The temporal variation in the assemblages increased from the supralittoral to the infralittoral possibly due to changes in the water temperature and climatic conditions, that could influence the intertidal zone during the high and low tide, respectively. Rev. Biol. Trop. 58 (4): 1387-1403. Epub 2010 December 01.
Key words: tropical rocky intertidal, Isla del Coco, vertical zonation, temporal change.
Resumen
La zona entre mareas rocoso de las bahías Chatham y Wafer en la Isla del Coco, Costa Rica fueron muestreadas fotográficamente con cuadrículas de 25x25cm en enero y octubre de 2007. Bahía Chatham también se visitó en abril 2008. El intermareal de Chatham estaba constituido por roca basáltica y en Wafer por basalto y cantos rodados de ignimbrita. Las principales diferencias entre sitios fueron las algas con mayor cobetura (erectas-frondosas) y el mayor número de bandas de organismos se dio en Chatham. No se encontró cambio temporal en la cobertura total de fauna sésil y de autótrofos. La mayor cobertura de invertebrados fue la del cirripedio Tetraclita stalactifera, siempre sobre la banda en la zona inferior de las algas. La diversidad de la fauna móvil no presentó tendencia significativa entre los meses de muestreo. Sin embargo, la identidad de las especies, cobertura o abundancia mostró un cambio temporal moderado. En octubre cuando el agua superficial del mar fue baja (23ºC), el infralitoral tuvo un incremento en la cobertura de las algas verdes. La dominancia en enero y abril fue de algas rojas (incrustantes y erectas-frondosas). Las lapas pulmonadas Siphonaria gigas y las cianobacterias del litoral medio mostraron una asociación negativa. Los caracoles de litoral alto y supralittoral presentaron un cambio temporal en su abundancia pero con diferentes patrones entre los sitios. Un incremento de variación en la composición de organismos se dio desde el supralitoral al infralitoral, posiblemente causado por el cambio en las condiciones del agua y el clima, que influyen en la zona entre mareas durante el alta y bajamar, respectivamente.
Palabras claves: intermareal rocoso tropical, Isla del Coco, zonación vertical, cambio temporal.
Se han desarrollado varios estudios sobre la ecología de zonas rocosas tropicales que muestran patrones de estacionalidad en las comunidades de organismos que las habitan (Ortega 1987, Williams 1993). Estos cambios están relacionados principalmente con la elevada temperatura y gran desecación que sufren en los periodos de exposición durante la marea baja y la presencia de especies durante todo el año o parte del mismo (Villalobos 1980a, Williams 1994). Tanto los factores ambientales como los patrones de zonación vertical establecen la estacionalidad (Moore 1972, Sibaja-Cordero & Vargas-Zamora 2006). Sin embargo, los patrones de zonación temporales pueden variar entre localidades, por ejemplo en Bahía Salinas, Pacífico Norte de Costa Rica, hay un cambio en la composición de algas dependiendo de la época de afloramiento (Sibaja-Cordero & Cortés 2008), pero en Bahía Panamá, Panamá, los cambios temporales son leves o ausentes (Lubchenco et al. 1984). En Punta Mala, Pacífico Central de Costa Rica, las especies presentan un gran dinamismo en su abundancia o cobertura, debido a patrones de reclutamiento o al cambio entre la estación seca y lluviosa (Ortega 1987).
Cambios en la zonación o su composición están asociados con las características del agua, debido a diferencias en nutrientes, salinidad, corrientes, oleaje, material en suspensión y exportación o entrada de larvas al sistema intermareal (Menge et al. 1997, Schiel 2004, Sibaja- Cordero & Vargas-Zamora 2006). En las Islas Galápagos se encontró que hay factores de este tipo moldeando la composición de especies en las zonas rocosas, que tienen mayor importancia a través del tiempo, seguido por diferencias entre localidades y por último el efecto de la herbivoría (Vinueza et al. 2006).
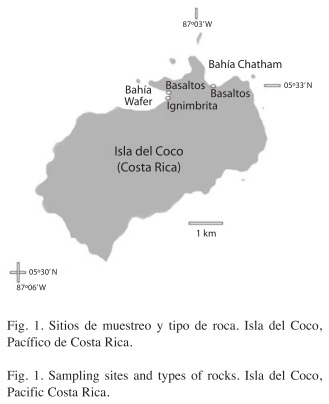
El Parque Nacional Isla del Coco (PNIC) se encuentra a más de 500km de la costa pacifica de Costa Rica (5º30’-5º34’ N y 87º01’- 87º06’ W) (Cortés 2008). La Isla presenta una costa principalmente rocosa y su clima es muy húmedo por estar influenciada por la Zona de Convergencia Intertropical (Alfaro 2008). La costa está expuesta a la Contra Corriente Ecuatorial del Norte gran parte del año (Lizano 2008). Difiere así de las Islas Galápagos, en clima y corrientes, las que presentan gran parte del año aguas frías debido a fenómenos de afloramiento en las costas cercanas y dentro del archipiélago, haciendo variar también la composición de la fauna en las formaciones rocosas (Bakus 1975, Witman & Smith 2003, Vinueza et al. 2006).
Sibaja-Cordero (2008) presentó datos sobre la estructura de las comunidades, en enero 2007, en las zonas rocosas de las bahías de la Isla del Coco. Como la Isla del Coco esta influenciada por diferentes corrientes marinas através de cada año (Lizano 2008), la flora y fauna marina de la zona intermareal podría presentar un cambio temporal en su composición. Las zonas rocosas representan una fuente de recursos alimenticios para los peces y aves costeras del Parque Nacional, por lo que dicha información permite conocer mejor la dinámica de los recursos de las Islas. En este sentido el presente trabajo tiene como objetivo brindar información sobre la estructura general y la composición de organismos en diferentes épocas del año en las zonas rocosas entre mareas de las bahías de Chatham y Wafer, de la Isla del Coco.
Materiales y métodos
El Centro de Investigación en Ciencias del Mar y Limnología (CIMAR) realizó dos expediciones a la Isla, en octubre 2007 (CIMARCOCO I) y abril 2008 (CIMAR-COCO II), donde se visitaron las bahías de Chatham y Wafer; estudiadas por Sibaja-Cordero (2008) en este aislado Parque Nacional. Las zonas rocosas entre mareas en las bahías de Chatham y Wafer en el PNIC (Fig. 1) se visitaron durante la marea baja, donde el ciclo tiene una amplitud de 4m. La bahía de Chatham fue muestreada en tres ocasiones: enero y octubre 2007 y abril de 2008. Además la Bahía Wafer se pudo visitar en dos oportunidades: enero y octubre 2007. Se recolectaron muestras en las rocas de cada zona entre mareas para corroborar su identificación geológica. Para estudiar la composición de organismos, se establecieron estratos desde el nivel infralitoral hasta el supralitoral, en cada estrato se utilizaron cuadrículas de 25x25cm para medir la cobertura y abundancia de los organismos. De cada una se tomaron fotografías digitales de 4 mega-píxeles para un total de 201 distribuidas en los estratos verticales de cada sitio. En cada visita a la Bahía de Chatham se utilizaron siete estratos cada uno de cinco cuadrículas (35 en total), mientras que en la sección de basaltos de Bahía Wafer se utilizaron 35 cuadrículas en enero y 20 en octubre. En la sección de ignimbrita en Wafer se emplearon en enero 17 cuadrículas y en octubre 24. El estrato más cercano al nivel de marea baja se le dio el código 1 y esta numeración se incrementó hasta un máximo de 8 estratos según se asciende por la zona entre mareas. La numeración es la misma utilizada en Sibaja-Cordero (2008).
El porcentaje de cobertura de cada especie sésil se estimó por medio del análisis digital de las imágenes con el software libre UTHSCSA Image Tool, desarrollado por El Centro de Salud de la Universidad de Texas, San Antonio, Texas (http://ddsdx.uthscsa.edu/dig). La estimación del porcentaje se obtuvo por tres métodos. El primero fue la medida directa del área que cada organismo ocupó en la imagen. El segundo procedimiento fue por segmentación manual de la imagen en escala de grises, creando una imagen binaria (píxeles en negro y blanco). El porcentaje de píxeles que la categoría de interés representó en la imagen se estimó con el comando "Count Black/White pixels". El tercer método se usó para organismos difíciles de distinguir en la escala de grises. Se cambió la saturación del color (Adobe Photoshop) en cada especie y por una substracción de fondo entre la imagen original y la editada, se pudo obtener el porcentaje de píxeles que ocupó cada especie en la imagen (Sibaja-Cordero & Vargas-Zamora 2006). La abundancia de las especies móviles en las cuadrículas se determinó con el comando "point" (Sibaja-Cordero & Cortés 2008).
Los moluscos se identificaron con Keen (1971) y los cirripedios con Laguna (1985).
Análisis de datos: se empleó el software libre PAST (Hammer et al. 2001) (http://folk.uio.no/ohammer/past). El porcentaje total de organismos autótrofos y fauna sésil se cuantificó para cada cuadrícula, se transformó por raíz cuarta y se realizó un análisis de variancia para cada localidad comparando el promedio de dichas variables entre los meses visitados (Quinn & Keough 2003). Si las variancias eran diferentes se usó la aproximación de Welch para F (Hammer et al. 2001).
Con la fauna móvil se estimó para cada localidad la equidad (J`) y la diversidad de Shannon-Wiener (H`) con ln (logaritmo natural) (Krebs 1999). Para tener una medida de la variación en el índice de Shannon-Weiner de cada localidad, se estimaron límites de confianza al 95% por el método de Jacknife (Krebs 1999); esto es calculando la biodiversidad, pero removiendo una de las cuadrículas, el proceso se repite cuantas cuadrículas se utilizó. Los datos de Jacknife son pseudovalores de diversidad y para cada localidad fueron comparados entre los meses por medio de análisis de varianza.
Además, para cada localidad se generó una matriz de datos (cuadrículas en las filas y especies en las columnas). En cada matriz se transformó con raíz cuarta los porcentajes de cobertura (especies sésiles) y con log (x+1) la abundancia (especies móviles). Las columnas se estandarizaron (promedio=0 y desviación estándar=1) por la diferencia en la escala de medición. Con esto se calculó una matriz de disimilaridad basada en la distancia euclidiana entre las cuadrículas y se analizó con un ANOSIM (R) de dos vías cruzado (Clarke & Warwick 1994), para determinar diferencias en la composición de organismos entre los niveles del intermareal y los meses. El valor de R indica el grado de diferencia, si R=1, los grupos son completamente diferentes uno del otro. Se realizó un análisis SIMPER (Porcentajes de similitud) con el objetivo de cuantificar cuál grupo (algas, fauna sésil o móvil) contribuye más con el cambio estacional (Clarke & Warwick 1994). Para determinar en que nivel (estrato) de la zona entre mareas de cada localidad se da la mayor variación se utilizó el índice de dispersión mutivariable basado en la matriz de distancia euclidiana en el software PRIMER 6 (Clarke & Warwick 1994). Finalmente, los promedios de los datos transformados de cada organismo por estrato, sitio y mes fueron estimados y se les aplicó un Análisis de Componentes Principales (Quinn & Keough 2003), para representar la variación temporal de los estratos, además de la tasa y dirección en que se incremento la abundancia o cobertura de los organismos (Quinn & Keough 2003). Estos promedios fueron expresados a su escala original por transformación inversa y se construyo un cuadro siguiendo el formato en Doty (1957), donde las especies en el cuadro forman una diagonal desde el nivel inferior hacia el superior.
Resultados
Zonas rocosas: Bahía Chatham tiene bloques y cantos rodados de basalto y antiguas colonias coralinas. Dichas colonias van desde un metro de diámetro hasta fragmentos pequeños esparcidos por la zona entre mareas. En las paredes rocosas inmediatas a dichas rocas se pueden notar lavas tipo aa que son lavas resultado del final del periodo eruptivo, muy viscosas (vesículas) y ásperas; y lavas en almohadillas que presentan una superficie más lisa. En Bahía Wafer se encuentra una zona entre mareas al oeste, conformada por cantos de basalto y justo en la salida del Río Genio la zona entre mareas está formada por bloques de ignimbrita que contiene roca fragmentada en una matriz, siendo también una superficie heterogénea.
Biodiversidad y grupos funcionales: En estas dos bahías durante las visitas realizadas se encontraron 27 especies en las cuadrículas (Cuadro 1). En Chatham en enero se encontraron 14 especies (cinco autótrofos, dos invertebrados sésiles y siete especies móviles), en octubre de las 16 especies cinco eran autótrofos, dos invertebrados sésiles y nueve móviles. En abril se encontraron 18 organismos (cuatro autótrofos, cinco invertebrados sésiles y ocho móviles). Los basaltos de Bahía Wafer presentaron en enero 15 organismos con cinco autótrofos, cuatro invertebrados sésiles y seis especies móviles. Para octubre se redujo en uno el número de autótrofos y de fauna sésil. La fauna móvil en octubre solo presentó dos organismos (Cuadro 1). Las rocas de ignimbrita en esta bahía presentaron en enero 2007, solamente dos autótrofos, un invertebrado sésil y cinco móviles. En octubre el número de autótrofos subió a seis, la fauna sésil paso a cinco y los móviles se mantuvieron en cinco para un total de 16 especies (Cuadro 1).
No obstante a las diferencias en los promedios totales de cobertura de los organismos autótrofos (Fig. 2a), de las zonas entre mareas, la alta variación encontrada no permitió detectar incrementos en la cobertura de este tipo de organismos entre los diferentes meses en Bahía Chatham (Welch F=1.73, g.l.=49.07, p=0.187). La cobertura de autótrofos siempre fue cercana al 5% en Chatham. Los basaltos de Wafer no presentaron un incremento importante a través del tiempo en la cobertura de autótrofos (Welch F=2.18, g.l.=12.64, p=0.164); sin embargo, en enero esta fue muy baja (Fig. 2). En las rocas de ignimbrita si se observó un aumento de la cobertura en octubre (Welch F=26.42, g.l.=28.13, p<0.001), llegando a un promedio superior al 15%. En este mes aparecen algas y líquenes en el supralitoral de esta localidad.
La fauna sésil total (Fig. 2b) no mostró un cambio significativo en ninguna de la dos bahías en cuanto a su promedio de cobertura total (Chatham, F=0.40, d.f= 2/49, p=.675), (Wafer-basaltos, Welch F=0.97, d.f. 23.09, p=0.335) y (Wafer-ignimbrita F=0.20, df=1/21, p=0.661). La contribución de dicha fauna para las formaciones rocosas en general es muy baja (menor a 12%), siendo Tetraclita stalactifera el organismo que presentó mayor cobertura. Dentro de su nivel en el intermareal llegó incluso a cubrir un 8% en Chatham (Cuadro 1).
La biodiversidad de fauna móvil (Fig. 3), no mostró tampoco una tendencia significativa hacia el aumento en alguno de los meses (Chatham, F=2.25, d.f. 2/104, p= 0.110), (Wafer-basaltos, F=1.23, df=1/54, p=0.272) y (Wafer-ignimbrita, F=0.66, d.f .=1/40, p=0.423). Pero la biodiversidad de fauna móvil siempre fue más alta en Bahía Chatham con valores altos de equidad (J´). En cambio, en los basaltos de Wafer la equidad se incrementa en octubre por la ausencia de especies con muy baja abundancia en enero. El valor de equidad se reduce en la roca de ignimbrita en octubre por la reducción en la abundancia de Siphonaria gigas, Nodilittorina aspera y Nerita scabricosta, junto al aumento de la población de Nodilittorina modesta (Cuadro 1).
Zonación vertical: Sin embargo, la composición de especies por estrato revela la existencia del patrón de zonación vertical en cada localidad. La zonación es evidente pero algunas especies se encuentran en dos o más niveles en cada localidad (Cuadro 1). El patrón es confirmado por el ANOSIM en las dos bahías (Chatham, R=0.46, p<0.001), (Wafer-balsaltos, R=0.40, p<0.001) y (Wafer-ignimbrite, R=0.39, p<0.001). En la figura 4 se observa como la zonación se presenta en cada uno de los meses en Bahía Chatham. La distribución de los taxones en las formaciones rocosas se presenta en el Cuadro 1 y la Fig. 5, donde las litorinas y neritas dominan el supralitoral. A nivel medio están las lapas pulmonadas y en los niveles bajos dominan las algas y cirripedios.
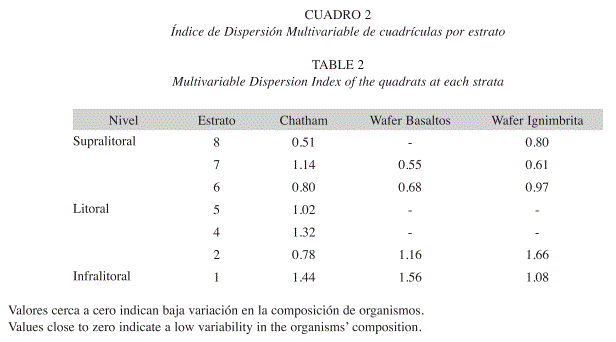
Cambio temporal de la comunidad: El índice de dispersión multivariable (Cuadro 2), indicó mayores cambios entre la composición de organismos en las cuadrículas de los estratos más cercanos al nivel de marea baja, que fueron los que presentaron una mayor variabilidad (Cuadro 2). Por ejemplo, las algas verdes son más comunes en octubre en todas las localidades (Cuadro 1). Esto es evidente en Chatham (Fig. 4). En Bahía Chatham se observa una baja variación en el estrato 2 del infralitoral (Cuadro 2), pues es dominada por T. stalactifera (Fig. 4). En el analisis de componentes principales se nota que en los estratos bajos es el menos variable entre los meses (Fig. 5A). En el estrato 7 del supralitoral, se observa, una alta variación entre las cuadriculas y los meses (Cuadro 2), debido a la distribución agregada durante la marea baja y la migración de las neritas más arriba en el supralitoral de la formación rocosa en abril (Fig. 4). Sin embargo en promedio este estrato cambia poco entre los meses (Fig. 5A). Con la prueba de ANOSIM se determinó que la composición presentó un ligero cambio entre los meses en cada una de las localidades. En la Bahía de Chatham el cambio temporal (ANOSIM, R=0.27, p<0.001) fue mas evidente por la contribución de las algas y cianobacterias (SIMPER=42%), seguida por la fauna móvil (SIMPER=39%) y la sésil (SIMPER=19%). Esta variación temporal dentro de los estratos de Bahía Chatham esta representada en la Fig. 5A. En los basaltos de Bahía Wafer la variación entre expediciones (ANOSIM, R=0.19, p=0.004), se dio por las algas y cianobacterias (SIMPER=56%), la fauna móvil (SIMPER=25%) y los invertebrados sésiles (SIMPER=19%) en ese orden. Los estratos más bajos (1 y 2) variaron más que los altos (6 y 7) como se presenta en la Fig. 5B. En la misma Bahía de Wafer en las rocas de ignimbrita el cambio temporal (ANOSIM, R=0.24, p=0.004) se da principalmente por las algas y cianobacteria (SIMPER=51%), la fauna sésil (30%) y la fauna móvil (SIMPER=19%). El cambio fue mayor en los estratos bajos al ser los que mayor variancia presentaron y donde dominan los diferentes grupos de algas (Cuadro 2).
Discusión
Zonas rocosas: En Bahía Wafer se encontraron cantos rodados de basaltos y en la desembocadura del río Genio varios bloques de ignimbrita. La Isla del Coco es de origen volcánico con unos 2 millones de años de emergencia, que se inició como un volcán submarino y terminó con erupciones subaéreas. En Punta Presidio (Fig. 1) por ejemplo, se encuentran coladas de lava tipo aa (Alvarado- Induni 2000). Las lavas aa se dan en un volcán cuando está terminando su actividad y no son un producto de punto caliente. Dichas lavas son alcalinas (más sílice), viscosas y ásperas (con vesículas), más explosivas, pueden provocar la formación de ignimbrita que es una matriz con cristales y fragmentos angulares de basaltos (V. Rojas 2010, com. pers.). Los bloques en Wafer son producto de una actividad sobre el nivel del mar. En Bahía Chatham junto a los bloques y cantos de basalto y las paredes de lava tipo aa, además se encontraron antiguas colonias de coral, éstas mostraron mayor cobertura de macroalgas (verdes y rojas en ese orden). Estas son perforadas por varios organismos como Lithophaga y sipuncúlidos. Es posible, como en Isla del Caño, Costa Pacífica de Costa Rica (Guzmán 1986), que estas colonias hayan sido arrastradas a la playa por tormentas. Las diferencias en el tipo de roca hacen que las zonas entre mareas de la Isla del Coco difieran en su composición de organismos, como se demostró en Sibaja-Cordero (2008). Las más colonizables fueron las colonias de coral muerto, las ignimbritas, las lavas aa y los cantos de basaltos en ese orden, que es además el mismo en heterogeneidad del sustrato.
Biodiversidad y grupos funcionales: El funcionamiento general de la biodiversidad dentro de cada zona rocosa parece ser estable en el tiempo porque se encontraron coberturas similares de organismos autótrofos y fauna sésil. Otros ejemplos de este patrón son el caso del cirripedio Tetraclita stalactifera que se mantuvo bastante constante en densidad en Bahía Ballena, Golfo de Nicoya, Costa Rica (Villalobos 1980a) y de igual manera ocurrió con la cobertura de este crustáceo en Punta Mala, Pacífico Central, Costa Rica (Sutherland 1987). En la Isla del Coco, solo en la zona de rocas de ignimbrita en octubre, se dio un aumento en la cobertura de autótrofos, junto al crecimiento del alga Ulva intestinalis y de un liquen en la parte supralitoral de dicha zona rocosa. En octubre la precipitación es mayor en la Isla (Alfaro 2008), así el crecimiento de dichos organismos es posiblemente debido al ingreso de agua con nutrientes por escorrentía de las paredes con vegetación terrestre sobre dicha formación rocosa o incluso por aporte de nutrientes de las aguas del río Genio que se mezcla con el mar en dicha zona entre mareas. Villalobos (1980b), menciona que en Montezuma, Puntarenas, Costa Rica, las algas verdes logran colonizar la roca supralitoral solo cuando entra la estación lluviosa debido a que la roca se mantiene húmeda y los propágulos logran establecerse. Lubchenco et al. (1984) encontraron que algunos grupos de animales sésiles solitarios y algunas formas de algas incrustantes aumentaron su presencia en las zonas rocosas de la Isla Taboguilla en Panamá, durante la época lluviosa.
A pesar de que la biodiversidad de fauna móvil en cada localidad no varió significativamente, se notó cambio en la abundancia de las especies. En los índices de diversidad como Shannon-Weiner, las formulas no toman en cuenta identidad de las especies (Burd et al. 1990). En los datos del presente estudio se dieron intercambios entre las especies en la dominancia de la abundancia de una fecha a otra. Así, las especies que eran abundantes pasan a ser las menos abundantes y la contribución específica no se nota en el índice de Shannon- Weiner, como mencionan Burd et al. (1990). Varias especies poco abundantes desparecen de un sitio y se vuelven más abundantes en otros. En los análisis de composición que usan índices multivariables, todas las especies tanto sésiles como móviles, mantienen la identidad en los algoritmos (Clarke & Warwick 1994) y así se logró determinar la existencia de los cambios temporales en la composición.
Zonación vertical y cambio temporal: El patrón de zonación vertical encontrado en enero 2007 en la Isla del Coco (Sibaja-Cordero 2008) se repitió en octubre e incluso en abril 2008 en la Bahía de Chatham. Las secciones rocosas cercanas al nivel de marea baja están dominadas por algas. En la Bahía Chatham, la zona intermareal estuvo cubierta por algas rojas tanto incrustantes (color negro) como las formas erectas-frondosas, pero en octubre se dio un incremento en el porcentaje de algas verdes, mientras que en abril vuelven a dominar las algas rojas. En enero en los basaltos de Wafer, la cobertura de algas en el infralitoral fue escasa, pero para octubre aumentó la especie de alga verde y la de rodófita incrustante (color negro). En enero 2007 en Bahía Wafer donde la roca es ignimbrita dominó el alga roja incrustante (color negro), pero para octubre apareció además el alga verde.
Según la NOAA-ESRL Physical Sciences Division, Boulder Colorado en su sitio Web:
http://www.cdc.noaa.gov/psd1/, desde 1950 en la región El Niño-3 (5ºN y 5ºS y 90º-150ºW), el promedio de temperatura superficial del mar es más bajo en octubre (25ºC), en que en enero o abril (27ºC). Además, Lizano (2008) menciona que en promedio dicha temperatura en la Isla del Coco es más baja (26.8ºC) durante octubre-diciembre que en el resto del año (27.3-28.4ºC). La Contracorriente Ecuatorial Norte se manifiesta a partir de mayo (Lizano 2008) y Garrison (2005) menciona que esta corriente trae aguas cálidas del Pacífico occidental a la Isla del Coco, siendo más intensa de agosto a setiembre. Los datos en la NOAA para la zona El Niño-3 indican que la temperatura superficial del mar para enero de 2007 fue de 26.5ºC. Durante la segunda parte del 2007, dicha temperatura descendió alcanzando los valores más bajos (23ºC) en octubre y noviembre, siendo este el punto clímax del fenómeno de La Niña. Para abril 2008 la temperatura era de 27ºC, nuevamente cálida.
El aumento de cobertura de algas verdes del infralitoral de la Isla de Coco, coincidió con el mes de octubre que presentó bajas temperaturas de las aguas superficiales. Esto concuerda con Vinueza et al. (2006), quien menciona que algas verdes del género Ulva incrementaron su cobertura en las zonas rocosas de las Islas Galápagos durante los períodos de temperaturas más frías y mayores nutrientes en el agua. Eventos de cambio de dominancia de especies de algas asociados a variaciones climáticas como ENSO se detectaron también en la costa Pacífica de México, donde especies afines al trópico se presentaron durante El Niño en 1998 y especies más afines a zonas templadas en 1999 (Carballo et al. 2002). Williams (1993) en la Bahía de Hong Kong encontró cambios en la compasión de algas y los asoció al transporte de diferentes propágalos, dependiendo si la corriente imperante era cálida o fría.
Se presentaron diferencias en la cobertura de algas entre los tres sitios cuando se visitaron en enero y octubre 2007. Las rocas de ignimbrita de Wafer al ser grandes bloques enterrados presentaron mayor cobertura de algas durante los muestreos que los cantos de basalto inestables en la misma bahía (Sibaja- Cordero 2008). Los cantos, pueden voltearse durante los periodos de fuerte oleaje o marejadas, por lo cual las formas sésiles pueden quedar en la parte inferior de la roca (Little & Kitching 1996). Además, Schiel (2004) menciona que las algas pueden diferir en la forma en que se establecen según el tipo de roca. En Chatham hay aun más algas erectas-frondosas que en Wafer, debido probablemente a que se encuentran en una zona con mayor protección del oleaje durante el año y a que los bloques de basalto son más estables y la presencia de las colonias muertas de coral en las cuales se encontró mayor cobertura de algas.
Los niveles altos de las zonas entre mareas consistían de Lottia mesoleuca, Nerita scabricosta y litorínidos. En los basaltos de Wafer desapareciron N. scabricosta y L. mesoleuca, pero en octubre solamente Nodilittorina modesta. En las ignimbritas, N. modesta es muy dominante en octubre. En Bahía Chatham las poblaciones de N. scabricosta incrementaron entre visitas y en abril se encontró más arriba en el litoral que en fechas previas. En Chatham la pared rocosa se extiende más que en los bloques o los cantos de Bahía Wafer. En enero y abril, N. modesta y L. mesoleuca, fueron más comunes que en octubre en Bahía Chatham. Dichas diferencias en la composición de las poblaciones en ambas bahías pueden deberse a disponibilidad de sustrato vertical para evitar la competencia, similar a la distribución vertical que menciona Ortega (1987), producto de la competencia interespecífica. Así como patrones de establecimiento o no de nuevos cohortes y decline de poblaciones como lo encontró Spight (1978) en Playas del Coco.
En la sección medio litoral en Bahía Chatham aparecen cianobacterias y las lapas pulmonadas Siphonaria gigas, mientras que en Wafer las cianobacterias aparecen en el infralitoral. En general, cuando S. gigas tuvo una distribución más amplia en su límite inferior abarcando la zona de crecimiento de cianobacterias se notó un descenso en la cobertura de cianobacterias. Cuando las lapas estuvieron restringidas al nivel medio del litoral las cianobacterias se incrementaron, justo por debajo de estas. Dicho evento se dio en octubre en Wafer y en enero y abril en Chatham. El efecto de la herbivoría por S. gigas ya se había mencionado en Sibaja-Cordero (2008), haciendo que prevalezcan las algas de formas incrustantes, que son pioneras (Little & Kitching 1996) y resistentes al pastoreo (Hawkins & Hartnoll 1983). Como otros gasterópodos los individuos de S. gigas controlan el crecimiento de cianobacterias sobre la roca. Williams (1994) encontró en Hong Kong que las macroalgas logran un buen crecimiento después de que las poblaciones de herbívoros decrecen. Paine (2002) encontró en el estado de Washington que las algas perennes dejan de ser dominantes en el intermareal cuando los macro herbívoros se encuentran con poblaciones reducidas o ausentes. En este sentido el desuso de una sección de la superficie rocosa por S. gigas, podría permitir el crecimiento de formas oportunistas como cianobacterias que podrían ser remplazadas por macroalgas si estos gasterópodos fueran excluidos del medio.
Los mayores cambios en composición se presentaron en los niveles más bajos de la zona}entre marea donde se observó la variación en los tipos de algas presentes tal como se mencionó anteriormente. Estos cambios tienen que ver con las diferencias en tipo de roca (basalto o ignimbrita), formación rocosa (paredes, bloques o cantos) y las condiciones cambiantes del agua marina. Al ser el infralitoral el que mayor tiempo pasa sumergido, estos cambios espacio temporales eran esperables con base en los resultados obtenidos en otras localidades de Costa Rica, como el cambio de comunidades según el gradiente estuarino del Golfo de Nicoya (Sibaja-Cordero & Vargas-Zamora 2006) o la estacionalidad asociada al afloramiento en Bahía Salinas (Sibaja-Cordero & Cortés 2008). De enero a abril las especies del infralitoral menos adaptadas a la desecación están expuestas a mayor radiación, menor humedad relativa y mayor temperatura del aire, siendo este periodo algo más "deshidratante" que el resto del año y específicamente octubre en la Isla del Coco (Alfaro 2008).
A manera de conclusión las zonas rocosas en las bahías al norte del Parque Nacional Isla del Coco, presentan zonación vertical con infralitoral dominado por algas, litoral medio por cirripedios y lapas pulmonadas y la sección alta por caracoles. La riqueza de especies resultó similar en número y la cobertura de algas o fauna sésil estable. Sin embargo existen cambios en la composición a nivel de especie, por cambios en la dominancia. Mucha de la variación se da en niveles bajos donde dominan las algas, los cambios de corrientes marinas y factores ambientales como la temperatura y los nutrientes pueden estar influenciando la variación temporal.
Agradecimientos
A Eddy Gómez y Mariana Cortés su ayuda en el muestreo de enero 2007, al personal del MY Proteus, MV Phoenix y MY Adventure. Vanessa Rojas brindó ayuda con la identificación de muestras de las rocas. A José Vargas y dos revisores anónimos por sus comentarios. Este artículo es parte del proyecto del CIMAR-UCR "Conocimiento y gestión de medios marinos y coralinos del Área de Conservación Marina Isla del Coco" No. 808-A7- 520, financiado por el Fonds Français pour l’Environnement Mondial (FFEM) y la Universidad de Costa Rica.
Referencias
Alfaro, E.J. 2008. Ciclo diario y anual de variables troposféricas y oceánicas en la Isla del Coco, Costa Rica. Rev. Biol. Trop. 56: 19-29. [ Links ]
Alvarado-Induni, G.E. 2000. Volcanes de Costa Rica: Geología, historia y riqueza natural. EUNED, San José, Costa Rica. [ Links ]
Bakus, G.J. 1975. Marine zonation and ecology of Cocos Island, off Central America. Atoll Res. Bull. 179: 1-11. [ Links ]
Burd, B.J., A. Nemec & R.O. Brinkhurst. 1990. The development and application of analytical methods in benthic marine infaunal studies. Adv. Mar. Biol. 26: 169-247. [ Links ]
Carballo, J.L., C. Olabarria & T. Garza Osuna. 2002. Analysis of four macroalgal assemblages along the Pacific Mexican coast during and after the 1997-98 El Niño. Ecosystems 5: 749-760. [ Links ]
Clarke, K.R. & R.M. Warwick. 1994. Change in Marine Communities: An Approach to Statistical Analysis and Interpretation. Bourne, Bournemouth, England. [ Links ]
Cortés, J. 2008. Historia de la investigación marina de la Isla del Coco, Costa Rica. Rev. Biol. Trop. 56: 1-18. [ Links ]
Doty, M.S. 1957. Rocky intertidal surfaces, p. 535-585. In J.W. Hedgpeth (ed.). Treatise on Marine Ecology and Paleoecology. Geol. Soc. Amer., Mem. 67: 535-585. [ Links ]
Garrison, G. 2005. Peces de la Isla del Coco/Isla del Coco Fishes. INBio, Heredia, Costa Rica. [ Links ]
Guzmán, H.M. 1986. Estructura de la comunidad arrecifal de la Isla del Caño, Costa Rica, y el efecto de perturbaciones naturales severas. Tesis de Maestría, Universidad de Costa Rica, Costa Rica. [ Links ]
Hammer, Ø., D.A.T. Harper & P.D. Ryan. 2001. Past: Paleontological statistics software package for education and data analysis. Palaeontol. Electr. 4: 1-9. [ Links ]
Hawkins, S.J & R.G. Hartnoll. 1983. Grazing of intertidal algae by marine invertebrates. Oceanogr. Mar. Biol. Ann. Rev. 21: 195-282. [ Links ]
Keen, A.M. 1971. Sea shells of tropical west-America: marine mollusls from Baja California to Peru. Universidad de Stanford, California, EEUU. [ Links ]
Krebs, C.J. 1999. Ecological Methodology. Addison-Welsey, Nueva York, EEUU. [ Links ]
Laguna, J. 1985. Systematics, Ecology and Distribution of Barnacles (Cirripedia; Thoracica) of Panama, Incluiding an Analysis of Provincialism in the Tropical Eastern Pacific. Tesis de Maestría, Universidad de California, San Diego, California, EEUU. [ Links ]
Little, C. & J.A. Kitching. 1996. The Biology of Rocky Shores. Universidad de Oxford, Oxford, Inglaterra. [ Links ]
Lizano, O.G. 2008. Dinámica de aguas alrededor de la Isla del Coco, Costa Rica. Rev. Biol. Trop. 56: 31-48. [ Links ]
Lubchenco, J., B.A. Menge, S.D. Garrity, P.J. Lubchenco, L.R. Ashkenas, S.D. Gaines, R. Emlet, J. Lucas & S. Strauss. 1984. Structure, persistence, and role of consumers in a tropical rocky intertidal community (Taboguilla Island, Bay of Panama). J. Exp. Mar. Biol. Ecol. 78: 23-73. [ Links ]
Menge, B.A., B.A. Daley, P.A. Wheeler, E. Dahlhoff, E. Sanford & P.T. Strub. 1997. Benthic-pelagic links and rocky intertidal communities: Bottom-up effects on top-down control? Proc. Natl. Acad. Sci. USA 94: 14530-14535. [ Links ]
Moore, H.B. 1972. Aspects of stress in the tropical marine environment. Adv. Mar. Biol. 10: 217-269. [ Links ]
Ortega, S. 1987. Habitat segregation and temporal variation in some tropical intertidal populations. J. Exp. Mar. Biol. Ecol. 113: 247-265. [ Links ]
Paine, R.T. 2002 Trophic control of production in a rocky intertidal community. Science 296: 736-739. [ Links ]
Quinn, G.P. & M.J. Keough. 2003. Experimental Design and Data Analysis for Biologists. Universidad de Cambridge, Cambridge, Inglaterra. [ Links ]
Schiel, D.R. 2004. The structure and replenishment of rocky shore intertidal communities and biogeographic comparisons. J. Exp. Mar. Biol. Ecol. 300: 309-342. [ Links ]
Sibaja-Cordero, J.A. 2008. Vertical zonation in the rocky intertidal at Cocos Island (Isla del Coco), Costa Rica: a comparison with other tropical locations. Rev. Biol. Trop. 56: 171-187. [ Links ]
Sibaja-Cordero, J.A. & J. Cortés. 2008. Vertical zonation of rocky intertidal organisms in a seasonal upwelling area (Eastern Tropical Pacific). Rev. Biol. Trop. 56: 91-104. [ Links ]
Sibaja-Cordero, J.A. & J.A. Vargas-Zamora. 2006. Zonación vertical de epifauna y algas en litorales rocosos del Golfo de Nicoya, Costa Rica. Rev. Biol. Trop. 54: 49-67. [ Links ]
Spight, T.M. 1978. Temporal changes in a tropical rocky shore snail community. Veliger 21: 137-143. [ Links ]
Sutherland, J.P. 1987. Recruitment limitation in a tropical intertidal barnacle: Tetraclita panamensis (Pilsbry) on the Pacific coast of Costa Rica. J. Exp. Mar. Biol. Ecol. 113: 267-282. [ Links ]
Villalobos, C.R. 1980a. Algunas consideraciones sobre el efecto de los factores físicos y biológicos en la estructura de una comunidad de algas en el Pacífico de Costa Rica. Brenesia 18: 289-300. [ Links ]
Villalobos, C.R. 1980b. Variations in population structure in the genus Tetraclita (Crustacea: Cirripedia) between temperate and tropical populations. III. T. stalactifera in Costa Rica. Rev. Biol. Trop. 28: 193-201. [ Links ]
Vinueza, L.R., G.M. Branch, M.L. Branch, & R.H. Bustamente. 2006. Top-down herbivory and bottom-up El Niño effects on Galápagos rocky-shore communities. Ecol. Monogr. 76: 111-131. [ Links ]
Williams, G.A. 1993. Seasonal variation in algal species richness and abundance in the presence of molluscan herbivores on a tropical rocky shore. J. Exp. Mar. Biol. Ecol. 167: 261-275. [ Links ]
Williams, G.A. 1994. The relationship between shade and molluscan grazing in structuring communities on a moderately-exposed tropical rocky shore. J. Exp. Mar. Biol. Ecol. 178: 79-95. [ Links ]
Witman, J.D. & F. Smith. 2003. Rapid community change at a tropical upwelling site in the Galápagos Marine Reserve. Biodiver. Conserv. 12: 25-45. [ Links ]
Correspondencia a: Jeffrey A. Sibaja-Cordero. Centro de Investigación en Ciencias del Mar y Limnología (CIMAR), Universidad de Costa Rica, San Pedro, 11501-2060 San José, Costa Rica; jeffro@costarricense.cr / Escuela de Biología, Universidad de Costa Rica / Departamento de Ecología y Biología Animal, Facultad de Ciencias del Mar, Universidad de Vigo, España.
Jorge Cortés. Centro de Investigación en Ciencias del Mar y Limnología (CIMAR), Universidad de Costa Rica, San Pedro, 11501-2060 San José, Costa Rica / Escuela de Biología, Universidad de Costa Rica; jorge.cortes@ucr.ac.cr.
Recibido 02-XI-2009. Corregido 01-VI-2010. Aceptado 02-VII-2010.