Services on Demand
Journal
Article
Indicators
-
 Cited by SciELO
Cited by SciELO -
 Access statistics
Access statistics
Related links
-
 Similars in
SciELO
Similars in
SciELO  uBio
uBio
Share
Revista de Biología Tropical
On-line version ISSN 0034-7744Print version ISSN 0034-7744
Rev. biol. trop vol.58 n.3 San José Sep. 2010
Efecto de plantaciones de pino en la artropofauna del suelo de un bosque Altoandino
Alba Lucía León-Gamboa†, Carolina Ramos1 & Mary Ruth García2
Departamento de Biología, Universidad Nacional de Colombia, Tel. 3165000-11324, Bogotá - Colombia;
1. charo.ramon@gmail.com;
2. mrgarciaco@unal.edu.co
Abstract: Effect of pine plantations on soil arthropods in a high Andean forest. One of the most common problems in the Colombian mountains has been the replacement of native vegetation by pine plantations. Soil arthropods are a fundamental component of forest ecosystem, since they participate in the organic matter fragmentation, previous to decomposition. This role is more valuable in high altitude environments, where low temperatures limit the dynamics of biological processes, where the effects of pine plantations on soil arthropods are still not well- known. In a remnant of high-andean forest (Neusa - Colombia) and a pine plantation of about 50 years-old, it was evaluated the composition, richness and abundance of arthropods at surface (S), organic horizon (O) and mineral horizon (A) of soil, to establish the differences associated to the soil use transformation. It was used "Pitfall" sampling to register the movement of the epigeous fauna, and extraction by funnel Berlese for determining the fauna density from O and A horizons. The Shannon and Simpson indexes estimated the diversity at different places and horizons, and the trophic structure of the community was evaluated. Overall, there were collected 38 306 individuals from forest and 17 386 individuals from pine plantation, mainly distributed in Collembola (42.4%), Acari (27%), Diptera (17.6%) and Coleoptera (4.6%). The most important differences were given in the surface, where the mobilization in forest (86 individuals/day) almost triplicates the one in pine plantation (33 individuals/ day). The differences in composition were given in Collembola, Araneae, Hemiptera, Homoptera and Hymenoptera. The dynamics of richness and abundance along the year had significant high values in the native forest than in the pine plantation. The general trophic structure was dominated by saprophagous (75%), followed by predators (14%) and phytophagous (9%), but in two layers of the pine plantation soil (S and O) this structural pattern was not given. Based on the results, it was concluded that pine plantations affect the diversity, composition, community dynamic and trophic structure of soil arthropods. Also, some estimators of soil stability give signals that these effects are reducing the ecosystem function in the region. Rev. Biol. Trop. 58 (3): 1031-1048. Epub 2010 September 01.
Key words: Arthropods, high-Andean forest, pine plantation, fragmentation, soil horizons, trophic structure, diversity, dominance.
El suelo es el escenario de un balance entre la adición de residuos orgánicos de las plantas y la descomposición por los organismos del suelo. El flujo de energía y el ciclado de nutrientes, requiere de la transformación de la materia orgánica en el ecosistema. En esta dinámica la fauna del suelo cumple un papel esencial, porque junto con los microorganismos transforman los restos de origen animal y vegetal, manteniendo la estructura del suelo, aumentando el número de nichos y regulando la disponibilidad de recursos para los productores (Teuben & Roelofsma 1990, Giller 1996, Moldenke et al. 1999, Adl 2003).
Dentro de la comunidad de fauna del suelo, microartrópodos como colémbolos y ácaros afectan el crecimiento vegetal, la velocidad de descomposición de la hojarasca y la velocidad de mineralización de los nutrientes; bien sea a través de sus efectos sobre la morfo-fisiología de las plantas (Hishi & Takeda 2005) o sobre la comunidad microbiana (Ponge 2000, Wardle 2002, Wells et al. 2002). La dinámica de la comunidad de los artrópodos en general se ve afectada por factores microambientales del suelo, básicamente físico-químicos y biológicos (Endlweber & Scheu 2007), y por la disponibilidad de recursos provenientes de actividades vegetales y microbianas (Ponge 2000). Si bien los efectos de las interacciones entre microartrópodos, microorganismos y rizosfera aún son objeto de estudio, entender cómo la composición de la comunidad de artrópodos es afectada por un componente estructural del ecosistema, como la vegetación y el suelo, es esencial para avanzar en el estudio del funcionamiento de los ecosistemas boscosos (Wardle 2002).
La altitud afecta la biología del suelo (Hodkinson 2005). En bosques de montaña, donde las bajas temperaturas persisten a lo largo del año, la descomposición por microorganismos se hace más lenta y la riqueza y abundancia de la fauna del suelo se ve reducida, lo cual ocasiona que gran parte de los residuos vegetales permanezcan durante un largo tiempo en el horizonte orgánico del suelo (García & Chamorro 1990, Röderstein et al. 2005, Bottner et al. 2006, Hasegawa et al. 2006, Illig et al. 2008). En los Andes tropicales, donde la temperatura media es inferior a los 10°C (Pinto 1993), los suelos presentan características ácidas y altas concentraciones de aluminio, que retardan la actividad microbiana (García & Chamorro 1990, Teuben & Roelofsma 1990, Bottner et al. 2006). Esto realza aún más la importancia de la fauna del suelo como procesador de la materia orgánica; el horizonte orgánico de este tipo de suelos normalmente conserva una densidad baja de macrofauna como lombrices de tierra, diplópodos e isópodos, mientras que la mesofauna y microfauna constituyen los organismos más abundantes (Salmon et al. 2006).
Los efectos de disturbios antrópicos en los ecosistemas andinos merecen especial atención, por cuanto podrían afectar ampliamente los procesos de ciclaje de nutrientes al alterar la diversidad de la fauna del suelo. Uno de los tipos de disturbio más comunes en Suramérica durante el último siglo ha sido el reemplazo de bosque nativo por la plantación extensiva de especies exóticas, como pino y eucalipto (Sedjo 1999, Toro & Gessel 1999, Granda 2006). Sin importar si estas plantaciones tuvieron un interés estético o maderero, las alteraciones físicas del suelo en plantaciones de pino han sido ampliamente documentadas, e incluyen una baja retención de calor (Porté et al. 2004) y una máxima evapotranspiración, afectando la dinámica hídrica a nivel regional (Oyarzún & Huber 1999, Buytaert et al. 2007). Con frecuencia, el establecimiento de estas plantaciones trae consigo la fragmentación del bosque nativo, donde los parches más pequeños pueden ser seriamente influenciados por la matriz de pino. Sin embargo, los efectos sobre la fauna del suelo, especialmente en ambientes andinos tropicales han sido poco estudiados.
A pesar de ser uno de los biomas más diversos del mundo, el bosque altoandino Colombiano ha sido fragmentado y desplazado por paisajes agropecuarios, plantaciones forestales de especies exóticas, e invadido por procesos de paramización (Cortés et al. 1990, Rodríguez et al. 2004). En este estudio, se caracterizó la comunidad de artrópodos en tres horizontes del suelo, determinando su diversidad, dinámica a lo largo de un ciclo anual, y estructura trófica, con el fin de establecer diferencias entre la edafofauna de un remanente de bosque nativo alto andino y una antigua plantación de pino. Como puede deducirse, fuertes diferencias entre estos dos ambientes podrían indicar interferencias en el funcionamiento ecosistémico, causadas por la plantación de especies exóticas.
Materiales y métodos
Zona de estudio: La zona de estudio es un bosque altoandino fragmentado e inmenso en una cobertura de plantaciones, ubicado en el departamento de Cundinamarca, jurisdicción de los Municipios de Tausa y Cogua, en terrenos contiguos al Embalse del Neusa, (5°08‘ 99" N, 73°56‘ 69" W), a una altura entre 3 000 y 3 200 msnm. Estos terrenos forman parte de una zona recreativa y son administrados actualmente por la Corporación Autónoma Regional de Cundinamarca. El clima de la región del Neusa se caracteriza por tener regímenes pluviométricos de tipo bimodal, con un promedio annual de lluvias de 972mm, picos de lluvias entre abril-mayo y octubre-noviembre y períodos de sequía en diciembre y enero; de acuerdo a la clasificación de Holdridge (1978) corresponde a bosque húmedo montano. Los suelos se originaron de areniscas, arcillas y otros materiales propios de la cordillera oriental, y han recibido aportes significativos de cenizas volcánicas (Malagón et al. 1995).
Se estudiaron los dos tipos más comunes de vegetación: el primero corresponde a un relicto de bosque alto andino, donde predominan comunidades de Weinmannia- Clusia y Drimys-Valea. El segundo es una plantación que no se explota de Pinus patula de unos 70 años de antigüedad (Cortés et al. 1990) con una extensión aproximada de 900 has y que forma parte del paisaje de la región del Neusa. Crece con una alta densidad de siembra, baja penetración de luz y agua típica monocultivos y produce una alta acumulación de acículas en el suelo. A esto se suma que a pesar de su longevidad, presenta una escasa invasión por malezas y no ha prosperado la regeneración de especies nativas.
Toma de datos: El muestreo se realizó entre septiembre de 2001 y agosto de 2002, los puntos de muestreo se distribuyeron al azar, a lo largo y ancho de las coberturas de bosque y pino, cubriendo un área aproximada de 0.3 has en cada una (Fig. 1). Para caracterizar la fauna del suelo se utilizaron los métodos de trampa de caída "Pitfall" (Uetz & Unzicker 1976) y el embudo de Berlese-Tullgren (Bordon 1994), que son considerados complementarios en el estudio de comunidades. Mientras el método pitfall captura los individuos que tienen actividad sobre la superficie del suelo (hábito epigeo), el método Berlese registra los organismos que tienen como hábitat el suelo en sus diferentes estratos u horizontes, cuantificando además la densidad (ind/m2). Se consideraron dos biotopos para realizar los muestreos mensuales: la hojarasca o mantillo con estrato orgánico (horizonte O) y el suelo o estrato mineral (horizonte A con una profundidad entre 0 y 15cm). En el bosque alto andino y la plantación de pino se tomaron por mes 7 a 8 muestras de hojarasca y de suelo, con un área aproximada de 0.031m2 por muestra, que fueron pasadas por el embudo Berlese. Para el muestreo de la fauna epígea, 14 trampas de caída fueron puestas en sitios al azar en el piso, separadas una de la otra por 20-25m de distancia, con cambio de sitio cada mes. Se calculó el promedio de individuos interceptados en cada trampa por día, como un estimador de la actividad o movimiento sobre la superficie del suelo. La colecta total fue de 328 muestras usando Berlese y 132 con pitfall.
Las muestras de los horizontes O y A fueron colocadas durante 48h bajo una bombilla de 40 V. Los organismos fueron separados, cuantificados y preservados en alcohol al 70%. La identificación de la fauna se realizó en su mayoría a nivel de familia, con la ayuda de claves de Doreste (1988), Dindal (1990), Palacios- Vargas (1990), Carrejo & González (1992), y Borror et al. (1995). La cuantificación se hizo a nivel de morfoespecie. Se realizó una colección de referencia de los diferentes grupos, la cual fue depositada en el Museo Entomológico de la Facultad de Agronomía de la Universidad Nacional de Colombia. Aunque actualmente considerada una clase, se optó por usar a Collembola como un taxón a nivel de comparación con el resto de ordenes, lo cual hizo más fácil el estudio composicional y su confrontación con otros estudios previos en los que dicho grupo aún era considerado como orden. La estructura trófica de la comunidad de fauna del suelo del bosque alto andino y la plantación de pino se estableció llevando a cabo una clasificación basada en investigaciones previas (Höfer et al. 2000, Marasas et al. 2001, Camero et al. 2005), dividiendo los invertebrados en: depredadores, fitófagos, saprófagos y omnívoros. Aunque se encontraron ejemplares con otras tendencias de alimentación, los tres primeros grupos tuvieron la mayor representatividad estadística.
En cada sitio se tomaron además 6 muestras de suelo al azar, que fueron homogenizadas para cuantificar parámetros fisicoquímicos como textura, pH, materia orgánica, densidad aparente, capacidad de intercambio catiónico (CIC) y la concentración de algunos macro y micronutrientes, del horizonte orgánico del bosque y de la plantación de pino; los análisis se llevaron a cabo en el Instituto Geográfico Agustín Codazzi (IGAC).
La curva de acumulación de morfoespecies del bosque alto andino y la plantación de pino se evaluó mediante la función tipo Chao 2, que permite calcular el número de especies esperadas en un número acumulado de muestreos a partir del número de morfoespecies observadas. Otros estimadores comunitarios, como el índice de diversidad de Shannon (H’) y el índice de dominancia de Simpson (D), fueron calculados mediante el software Estimates 7.0 (Colwell 2004) y las diferencias estadísticas entre medias se determinaron a través de una prueba t de Student. El grado de ajuste de la distribución de frecuencias de las morfoespecies, teniendo como referente esperado la distribución en el remanente de bosque, se calculó mediante una prueba de Chi-2 (X2). Se empleó ANOVA de medidas repetidas para evaluar la diferencia en riqueza y abundancia entre sitios, y ANOVA de dos vías para evaluar los efectos del nivel trófico y el tiempo sobre la riqueza y la abundancia. El análisis fue complementado con el "post hoc" de Tukey. Se utilizaron los programas Statistica 6.0 (StatSoft Inc., 2001) y Sigma Stat 3.1 (Systat Software Inc., 2004).
Resultados
Composición y diversidad de la comunidad de fauna del suelo: Durante un año de muestreo se colectaron 55 698 individuos, correspondientes a 214 morfoespecies de artrópodos. El 93% de las morfoespecies perteneció a las clases Insecta y Arachnida. Los órdenes Dermaptera y Mantodea fueron exclusivos del bosque, mientras el orden Psocopera y un par de familias del orden Coleóptera fueron exclusivos de la plantación de pino (Anexo). La clase Insecta fue la más representativa con 14 ordenes (Blattodea, Coleoptera, Dermaptera, Diplura, Diptera, Hemiptera, Homoptera, Hymenoptera, Mantodea, Mecoptera, Orthoptera, Psocoptera, Thysanura y Thysanoptera), seguida por la Clase Collembola, que tuvo representación de sus cuatro órdenes Poduromorpha, Entomobryomorpha, Symphypleona y Neelipleona, abarcando nuevos registros de 6 familias (9 nuevas especies) para Colombia (Peñaranda 2005). La Clase Arachnida estuvo representada por tres ordenes (Acari, Araneae y Opilionida) (Anexo).
En general, la superficie del suelo contiene un número de morfoespecies dos veces superior al del horizonte orgánico y tres veces superior al del horizonte mineral (Cuadro 1). En el suelo del bosque Altoandino se encontraron 105 familias, representadas por 202 morfoespecies y 38 307 individuos, mientras en la plantación de pino se encontraron 83 familias representadas por 159 morfoespecies y 17 391 individuos. La diferencia más notoria entre sitios se da en la capa superficial del suelo, donde el número de individuos en el bosque casi triplica al número de individuos en la plantación. Mediante el método de Berlese se obtuvieron valores de densidad por metro cuadrado de 5 480 y 3 677 individuos en el horizonte orgánico y de 761 y 496 individuos en el horizonte mineral, en Bosque y Plantación respectivamente.
Los resultados por el método Barber mostraron la presencia de muchas más especies que no fueron registradas en el análisis de densidad, y que se movilizaban en la superficie a través del sotobosque. Hacia los puntos de muestreo se movilizó un promedio de 86 individuos/ día en bosque nativo, y 33 individuos/ día en plantación de pino.
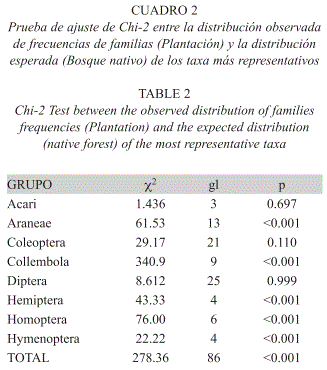
De acuerdo al estimativo Chao 2, los esfuerzos de muestreo cubrieron la expectativa de especies encontradas en un 87.6% para el bosque nativo y un 83.0% para las plantaciones de pino. El taxón Collembola es el más común en ambos sitios, pero representa una mayor proporción de la fauna del Bosque (47%) que de la plantación (28%), mientras el orden Acari también es uno de los más comunes, siendo más representativo en la plantación (34%) que en el Bosque (21%) (Fig. 2). Algunos órdenes tienden a ser característicos de la plantación, como Blattodea e Isopoda, mientras Hymenoptera y Homoptera resultan ser más frecuentes en el Bosque. La prueba de X2 que evaluó el ajuste entre la distribución de frecuencias de las familias en los órdenes más diversos, mostró que efectivamente existen diferencias significativas entre bosque y plantación, particularmente en los órdenes Araneae, Collembola, Hemiptera, Homoptera e Hymenoptera. La distribución de frecuencias general también fue significativamente distinta entre sitios (Cuadro 2).
Dinámica de la fauna del suelo: El ANOVA demostró que existen efectos significativos del sitio y del tiempo sobre la diversidad de la artropofauna, y además existe una interacción entre el tiempo y el sitio (Fig. 3, Cuadro 3). Aunque la diversidad de artropofauna a lo largo del año fue mayor en el bosque nativo que en la plantación de pino, la capa superficial del suelo no presentó un efecto del sitio durante la temporada más húmeda del año (fines de septiembre hasta fines de noviembre), ni se dieron diferencias de riqueza en el horizonte mineral durante las temporadas secas de enero y juniojulio. Tampoco se comprobó que la abundancia de artropofauna del horizonte mineral fuera significativamente mayor en el bosque que en la plantación. Los horizontes superficial y orgánico tuvieron dos picos de abundancia (febrero y mayo-junio), que tendieron a coincidir con los máximos de riqueza, mientras el horizonte mineral mostró una dinámica más homogénea de la diversidad.
Estructura trófica: El 98.8% de los individuos colectados fue clasificado en el nivel trófico correspondiente. La comunidad en general estuvo conformada en un 75% por organismos saprófagos, 14% depredadores, 9% fitófagos y 2 % omnívoros. El ANOVA, usando los tres niveles tróficos más importantes, mostró que la riqueza por nivel varía con el sitio (F3,449 =42.24, p<0.01) y el horizonte (F6,898=202.21, p<0.01) (Fig. 4). En el bosque nativo se encontró que sin importar las diferencias de riqueza entre horizontes, los grupos tróficos se distribuyen de acuerdo al patrón general. Por otra parte, en el horizonte mineral de la plantación de pino no hubo diferencias entre la riqueza promedio de depredadores (1.66±1.22 morfosps./trampa) y saprófagos (2.00±1.73 morfosps./trampa), ni tampoco entre la riqueza de fitófagos (5.9±2.04 morfosps./trampa) y depredadores (5.74±2.4 morfosps./trampa) del horizonte superficial (prueba de Tukey, α=0.05).
Caracterización físico-química del suelo: Los análisis físico-químicos del suelo indicaron notorias diferencias entre los dos tipos de ecosistemas. El suelo del bosque presenta una mejor formación de agregados y una menor densidad aparente en comparación con el suelo de la plantación de pino. En cuanto a la composición química, ocho de diez bioelementos evaluados están en mayor concentración en el bosque nativo (Cuadro 4); tres de ellos superan alrededor de tres veces las concentraciones correspondientes en la plantación de pino (Ca, Mn, Zn). El contenido de materia orgánica, medido como porcentaje de carbono orgánico, también fue ampliamente superior en el bosque nativo. Los suelos de este sitio, aunque más ácidos, muestran tener además una mayor capacidad de intercambio catiónico y un mayor porcentaje de acidez intercambiable.
Discusión
En este estudio se logró caracterizar la comunidad de artrópodos en un remanente de bosque altoandino y en la matriz de plantaciones pino. Aunque en general el remanente de bosque nativo presentó un importante número de individuos, la riqueza de artrópodos es relativamente menor a la reportada para un bosque nublado Colombiano en alto estado de conservación (Kattan et al. 2006). Este podría ser un ejemplo de los efectos negativos de la fragmentación de bosques sobre las comunidades del suelo (Davies & Margules 1998, Ims et al. 2004). La reducción de biodiversidad se atribuye básicamente a una limitación en la movilidad de los individuos en un paisaje de parches de bosque pequeños y aislados (Hunter 2002, Murrel & Law 2000), condición que en este estudio parece evidenciarse con el hecho de que transitan en promedio 2.5 veces más artrópodos epigeos en el bosque nativo que en la plantación de pino. Una mayor oferta de nichos dentro del bosque andino, particularmente por la presencia de bromelias, también puede contribuir a la diferencia de biodiversidad encontrada entre sitios (Paoletti et al. 1991, Richardson 1999, Ospina-Bautista et al. 2004).
Para todos los estratos, la riqueza y abundancia fue mayor en el remanente de bosque que en la plantación de pino, y en el caso de la riqueza esta diferencia fue persistente a lo largo del año. Usando las interpretaciones de Magurran (1989), los índices calculados muestran que en el bosque los horizontes orgánico y mineral presentan una diversidad intermedia, pero la fauna epigea es poco diversa al representar pocas morfoespecies con una amplia abundancia de individuos; en la plantación de pino la diversidad de los horizontes orgánico y mineral es baja y la diversidad epigea es intermedia. En ambos sitios, la artropofauna presentó una alta dominancia, lo cual es indicativo de ecosistemas perturbados.
Pese a ser mucho menor a lo reportado para diversos ecosistemas palearticos (Deharveng 1996, Fukuyama et al. 1999, Wiwatwitaya & Takeda 2005), la densidad de artrópodos en el bosque altoandino fue cercana a la que se presenta en zonas inundables de la amazonía Peruana (Tapia-Coral et al. 2002) y a las selvas tropicales en México (Prieto et al. 1999) y Costa Rica (Heneghan et al. 1999). Sin importar el sitio, la abundancia y riqueza en superficie superaron ampliamente a los horizontes orgánico y mineral. Aunque la fauna que transita en superficie puede incluir especies provenientes de la cobertura arbórea, existe una notoria afinidad de la dinámica comunitaria con la fauna censada en el horizonte orgánico (Fig. 3). Algunos autores advierten sobre la subestimación de la diversidad debido al método de muestreo o a la separación de fauna en embudo Berlese (André et al. 2002).
Al evaluar la composición de la artropofauna del suelo, se encontraron importantes diferencias entre el bosque nativo y la plantación de pino. En el bosque nativo dominó el grupo Collembola, con una representatividad del 42.4% y una abundancia similar a la de otros ecosistemas de bosque natural (Franklin et al. 2001, Wiwatwitaya & Takeda 2005), mientras que la plantación de pino estuvo dominada por el grupo Acari con un 34% (Fig. 2). Los resultados se ajustan a la composición reportada en otros estudios donde se registra una discreta participación del orden Acari en bosques nativos, mientras bosques de pino y sus plantaciones muestran una importante participación de este grupo en la fauna del suelo. También coinciden con este estudio al reportar una mayor participación de Isopoda, Blattodea y Araneae en plantaciones de pino (Bird et al. 2004, Camero et al. 2005, Kattan et al. 2006).
En la superficie y el horizonte orgánico, el bosque altoandino mostró picos importantes de abundancia y riqueza que tienden a coincidir con los meses de febrero (primeras lluvias de año) y mayo (pico de precipitación anual); la respuesta al clima es similar a la reportada por Wiwatwitaya & Takeda (2005), quienes argumentan que las especies dominantes tienen sus picos de abundancia en las temporadas húmedas. La estacionalidad en el bosque altoandino estaría también marcada por una precipitación media (alrededor de 1 000mm) mucho menor a la que se da en otros bosques tropicales siempreverdes (superior a 3 000mm), donde la presencia de lluvias en medio del verano conlleva a un bajo contraste estacional y a una escasa variación de la biodiversidad del suelo en relación con el clima (Anu et al. 2009).
El efecto significativo de la interacción tiempo-sitio se refleja en el hecho que difícilmente hay coincidencias entre los picos de riqueza y abundancia de los dos sitios, con dinámicas que en la plantación de pino tienden a ser homogéneas a lo largo del año. Esto sugiere que en la plantación los ciclos reproductivos y de desarrollo de las especies son alterados, posiblemente reduciendo la respuesta a señales ambientales como el microclima (Harte et al. 1996), o la calidad del recurso alimenticio del suelo (Smith et al. 1998), que resulta ser menos rico en bioelementos en comparación con el bosque altoandino (Cuadro 4).
La caracterización química del suelo en Neusa podría explicar las diferencias en la estructura trófica entre sitios. Además de la baja disponibilidad de cationes que es consecuente con la tala de bosques (Negrete-Yankelevich et al. 2007), la hojarasca de pinos es típicamente pobre en nutrientes, con características químicas desfavorables para la descomposición (Salamanca et al. 1998, Lemma et al. 2007). Frente a la evidente reducción de las poblaciones de microorganismos, grupos saprófagos como los colémbolos serían los primeros en verse afectados, mientras que grupos predominantemente depredadores como Acari se harían más frecuentes (Fig. 2). Por otra parte, el alto nivel de diversidad vegetal en el bosque nativo posiblemente brindará una alta diversidad de calidad de la hojarasca, que será utilizada de manera complementaria por la edafofauna; de esa manera la diversidad vegetal puede contribuir de manera directa con la diversidad trófica de la fauna del suelo (Hooper et al., 2000).
Se encontraron adicionalmente algunas diferencias tróficas entre estratos de suelo en la plantación (Fig. 4). La hojarasca de pino tiene una baja capacidad de absorción (Ibrahima et al. 1995), favoreciendo así la evaporación directa en la superficie, mientras el agua que logra filtrarse al suelo es rápidamente integrada al sistema de evapotranspiración de la plantación (Cortés et al. 1990, Oyarzún & Huber 1999, Buytaert et al. 2007). Esto, sumado a la baja tasa de descomposición, conlleva a que el horizonte mineral sea más seco, menos agregado, y con un contenido de detrito orgánico menor al del bosque nativo (Cuadro 4). Algunos grupos, como Collembola y Acari responden positivamente a la humedad del suelo, y otros como Araneae y Formicidae están negativamente relacionados con ella; se ha documentado además que la artropofauna se distribuye de acuerdo a la temperatura (Ferguson 2001).
Aunque menos diversa, la plantación de pinos mantuvo una estructura trófica general similar a la del bosque nativo. Además la riqueza y abundancia por muestreo, y durante épocas adversas como la temporada seca, fueron similares en los dos sitios. Esto podría apoyar la hipótesis de que los grupos funcionales en un ecosistema son redundantes, con varias especies ejerciendo el mismo papel; de este modo la función persiste en el tiempo y el espacio a pesar de la reducción de la riqueza (Ekschmitt & Griffiths 1998, Hunt & Wall 2002, Franklin et al. 2004). Se ha estimado que incluso al eliminar todas las especies de un grupo funcional, la abundancia de la fauna restante es poco afectada; al igual que el funcionamiento ecosistémico, medido como mineralización de nitrógeno y productividad primaria (Hunt & Wall 2002).
Sin embargo, otros planteamientos indican que una alta diversidad de edafofauna puede incrementar la eficiencia de la descomposición de la materia orgánica, a través de una interacción sinérgica entre los organismos, lo cual contribuye a incrementar la disponibilidad de nutrientes y la productividad vegetal (Lavelle 1996, Heemsbergen et al. 2004, Brussaard et al. 2007). Sin entrar en un estudio detallado de las interacciones tróficas, se deben resaltar diferencias gremiales encontradas entre el bosque y la plantación, con dos familias dominantes del orden Araneae: Linyphiidae, constructores de telas sábanas, más abundantes en la plantación, mientras que Ctenidae son vagabundos del suelo, más abundantes en el bosque (Flórez 1998, 2000) (Anexo). Es evidente que en la plantación las arañas dispondrían de más de insectos voladores y arborícolas que de insectos en el suelo como alimento. Las notorias diferencias en rasgos estructurales del suelo como la densidad, textura y porosidad, encontradas en este estudio, demostrarían que efectivamente la funcionalidad ecosistémica está siendo reducida debido a la plantación de pinos.
En conclusión, las plantaciones exóticas forestales causan reducción de la diversidad, alteran la dinámica y la estructura trófica de las comunidades del suelo, efectos que persisten a largo plazo (Nummelin & Zilihona 2004, Bardgett 2005, Kattan et al. 2006). Aunque estos fenómenos no necesariamente traen consecuencias en el funcionamiento ecosistémico, es recomendable profundizar en el de grupos funcionales dentro de los niveles tróficos, y determinar cómo se ve afectada la eficiencia de los procesos biológicos por causa de las plantaciones de pino en la región Andina.
Agradecimientos
Este proyecto fue financiado por la Universidad Nacional de Colombia. Agradecemos la valiosa colaboración de la Administración del Embalse del Neusa y de la Corporación Autónoma Regional de Cundinamarca (CAR) por suministrar los permisos necesarios para el trabajo de campo. A la bióloga Bertha Cobo por el acompañamiento técnico en el laboratorio. En memoria de Alba Lucía León (e.p.d.)
Resumen
Los artrópodos del suelo son un componente fundamental de los ecosistemas de bosque, ya que participan en la fragmentación de los residuos orgánicos previa a la descomposición. Esta función es más valuable en ambientes de altura, donde las bajas temperaturas limitan la dinámica de los procesos biológicos. Sin embargo, uno de los problemas más comunes en las montañas colombianas ha sido el reemplazo de vegetación nativa por plantaciones de pino. Los efectos sobre los artrópodos del suelo aún son poco conocidos. En un remanente de bosque Altoandino (Embalse del Neusa–Colombia) con una plantación adyacente de unos 50 años (aprox. 900 has), fue evaluada la composición, riqueza y abundancia de artrópodos en los estratos superficial (S) orgánico (O) y mineral (A) del suelo, para establecer las diferencias asociadas con la transformación del uso del suelo. Se utilizaron trampas "Pitfall" para registrar el movimiento de fauna epígea, y embudos Berlese para estimar la densidad de fauna de los horizontes O y A. Se calcularon los índices de Shannon y Simpson para estimar la diversidad en diferentes lugares y horizontes, además fue evaluada la estructura trófica de la comunidad. Se recolectaron 38 306 individuos en el bosque y 17 386 en la plantación, principalmente distribuidos en los taxa Collembola, (42.4%), Acari (27%), Diptera (17.6%) y Coleoptera (4.6%). Las diferencias más importantes se dieron en la superficie, donde la movilización en bosque (86 individuos/día) casi triplicó la movilización en la plantación (33 individuos/día). Las diferencias en la composición se dieron en los taxa Collembola, Araneae, Hemiptera, Homoptera e Hymenoptera. La dinámica de la riqueza y abundancia a lo largo del año tuvo picos significativos en el bosque, no observados en la plantación. La estructura trófica fue dominada por saprófagos (75%), depredadores (14%) y fitófagos (9%), pero en dos estratos de la plantación de pino (S y O) no se dio este patrón de estructura. Con base en los resultados se concluyó que las plantaciones de pino afectan la diversidad, composición, dinámica comunitaria y estructura trófica de los artrópodos del suelo. Además algunos evaluadores de la estabilidad del suelo señalan que los efectos de las plantaciones están reduciendo la funcionalidad ecosistémica en la región.
Palabras clave: Artrópodos, bosque Altoandino, plantación de pino, fragmentación, horizontes del suelo, estructura trófica, diversidad, dominancia.
Recibido 19-VII-2009. Corregido 08-I-2010. Aceptado 10-II-2010.
Referencias
Adl, S.M. 2003. The ecology of soil decomposition. CAB International, Wallingford, Reino Unido. [ Links ]
André, H.M., X. Ducarme & P. Lebrum. 2002. Soil biodiversity: Myth, reality or conning? Oikos 96: 3-24. [ Links ]
Anu, A., T.K. Sabu & P.J. Vineesh. 2009. Seasonality of litter insects and relationship with rainfall in a wet evergreen forest in south Western Ghats. J. Insect. Sci. 9: 1-10. [ Links ]
Bardgett, R. 2005. The soil Biology: community and ecosistem approach. Oxford University, New York, EEUU. [ Links ]
Bird, S.B., R.N. Coulson & R.F. Fisher. 2004. Changes in soil and litter arthropod abundante following tree harvesting and site preparation in a loblolly pine (Pinus taeda L.) plantation. Forest Ecol. Manag. 202: 195-208. [ Links ]
Bordon, C. 1994. Embudo de Berlese modificado. Bol. Entomol. Venez. 9: 131-134. [ Links ]
Borror, D., C. Triplehorn & N. Johnson. 1995. An introduction to the study of insects. Philadelphia Saunders College, Philadelphia, EEUU. [ Links ]
Bottner, P., M. Pansu, L. Sarmiento, D. Hervé, R. Callisaya-Baudista & K. Metselaar. 2006. Factors controlling decomposition of soil organic matter in fallow systems of the high tropical Andes: A field simulation approach using 14C- and 15N- labelled plant material. Soil Biol. Biochem. 38: 2162-2177. [ Links ]
Brussaard, L., M. Pulleman, E. Oue´draogo, A. Mando & J. Six. 2007. Soil fauna and soil function in the fabric of the food web. Pedobiologia 50: 447-462. [ Links ]
Buytaert, W., R. Célleri, B. de Bièvre & V. Iñiguez. 2007. The Impact of pine plantations on water yield: A case study from the Ecuadorian Andes. Proceedings 3rd International Symposium on Integrated Water Resources Management. Bochum, Germany. [ Links ]
Camero, E., J.E. Díaz, A. Salinas, L. Téllez & D. Agudelo. 2005. Estudio de la artropofauna asociada a suelos de dos tipos de ecosistema en la cuenca del Río Cauca–Colombia. Acta Biol. Colomb. 10: 35-44. [ Links ]
Carrejo, N. & R. González. 1992. Introducción al conocimiento de los Diptera. Centro Editorial Universidad del Valle, Cali, Colombia. [ Links ]
Colwell, R.K. 2004. Estimates, version 7: Statistical estimation of species richness and shared species from samples (Software and User’s Guide). Electronic resource for Windows and Mac OS. [ Links ]
Cortés, A., C. Chamorro & A. Vega. 1990. Cambio en el suelo por la implantación de praderas, coníferas y eucaliptos en un área aledaña al Embalse del Neusa (Páramo de Guerrero, Cundinamarca, Colombia.). IGAC, Investigaciones 2: 100-114. [ Links ]
Davies, K.F. & C.R. Margules. 1998. Effects of habitat fragmentation on carabid beatles: experimental evidence. J. Anim. Ecol. 67: 460-471. [ Links ]
Deharveng, L. 1996. Soil collembola diversity, endemism, and reforestation: A case study in the Pyrenees (France). Conserv. Biol. 10: 74-84. [ Links ]
Dindal, D.L. 1990. Soil biology guide. J. Wiley, New York, EEUU. [ Links ]
Doreste, E. 1988. Acarología. Instituto Interamericano de Cooperación para la Agricultura Colección, Investigación y desarrollo. San José, Costa Rica. [ Links ]
Ekschmitt, K. & B.S. Griffiths. 1998. Soil biodiversity and its implications for ecosystem functioning in a heterogeneous and variable environment. Appl. Soil Ecol. 10: 201-215. [ Links ]
Endlweber, K. & S. Scheu. 2007. Interactions between mycorrhizal fungi and Collembola: effects on root structure of competing plant species. Biol. Fertil. Soils 43: 741-749. [ Links ]
Ferguson, S.H. 2001. Changes in trophic abundance of soil arthropods along a grass-shrub-forest gradient. Can. J. Zool. 79: 457- 464. [ Links ]
Franklin, E., J.W. Morais & E.M.R. Santos. 2001. Density and biomass of acari and collembola in primary forest, secondary regrowth and polycultures in Central Amazonia. Andrias 15: 141-154. [ Links ]
Franklin E., T. Hayek, E.P. Fagundes & L.L. Silva. 2004. Oribatid mite (Acari: Oribatida) contribution to decomposition dynamic of leaf litter in primary forest, second growth, and polyculture in the Central Amazon. Braz. J. Biol. 64: 59-72. [ Links ]
Fukuyama, K., A.I. Averensky, T.C. Maximov, A.P. Isaev & K. Takahashi. 1999. Soil micro-arthropods in a Siberian permafrost area at 1 year and 5 years after wild fire. Edaphologia 63: 75-80. [ Links ]
García, M.R. & C. Chamorro. 1990. Algunos Aspectos de la Ecología del bosque alto andino. IGAC, Investigaciones 2: 35-41. [ Links ]
Giller, P.S. 1996. The Diversity of soil communities, the poor man’s tropical rainforest. Biodivers. Conserv. 5: 135-168. [ Links ]
Granda, P. 2006. Monoculture tree plantations in Ecuador. World Rainforest Movement, Montevideo, Uruguay. [ Links ]
Flórez, D.E. 1998. Estructura de comunidades de arañas (Araneae) en el departamento del Valle, suroccidente de Colombia. Caldasia 20: 173-192. [ Links ]
Flórez, D.E. 2000. Comunidad de arañas de la región Pacífica del departamento del Valle del Cauca, Colombia. Rev. Colomb. Entomol. 26: 77-81. [ Links ]
Harte, J., A. Rawa & V. Price. 1996. Effects of manipulated soil microclimate on mesofaunal biomass and diversity. Soil Biol. Biochem. 28: 313-322. [ Links ]
Hasegawa, M., M.T. Ito & K. Kitayama. 2006. Community structure of oribatid mites in relation to elevation and geology on slope of Mount Kinabalu, Sabah, Malaysia. Eur. J. Soil Biol. 42: 191-196. [ Links ]
Heemsbergen, D.A., M.P. Berg, M. Loureau, J.R. van Hal, J.F. Faber & H.A. Verhoef. 2004. Biodiversity effects on soil processes explained by interspecific functional dissimilarity. Science 306: 1019-1020. [ Links ]
Heneghan, L., D.C. Coleman, X. Zou, D.A. Crossley & B.L. Haines. 1999. Soil microarthropod contributions to decomposition dynamics: Tropical–Temperate comparisons of a single substrate. Ecology 80: 1873- 1882. [ Links ]
Hishi, T. & H. Takeda. 2005. Dynamics of heterorhizic root systems: protoxylem groups within the fine-root system of Chamaecyparis obtusa. New Phytol. 167: 509-521. [ Links ]
Hodkinson, I.D. 2005. Terrestrial insects along elevation gradients: species and community responses to altitude. Biol. Rev. 80: 489-513. [ Links ]
Höfer, H., C. Martius, W. Hanagarth, M. Garcia, E. Franklin, J. Römbke & L. Beck. 2000. Soil fauna and litter decomposition in primary and secondary forests and a mixed culture system in Amazonia. Final report of SHIFT project ENV 52, Bonn, Germany. [ Links ]
Holdridge, L.R. 1978. Ecología basada en zonas de vida. Instituto Interamericano Ciencias Agrícolas, San José, Costa Rica. [ Links ]
Hooper, D.U., D.E. Bignell, V.K. Brown, L. Brussaard, J.M. Dangerfield, D.H. Wall, D.A. Wardle, D.C. Coleman, K.E. Giller, P. Lavelle, W.H. van der Putten, P.C. de Ruiter, J. Rusek, W.L. Silver, J.M. Tiedje & V. Wolters. 2000. Interactions between aboveground and belowground biodiversity in terrestrial ecosystems: patterns, mechanisms, and feedbacks. BioScience 50: 1049-1061. [ Links ]
Hunt, H.W. & D.H. Wall. 2002. Modelling the effects of loss of soil biodiversity on ecosystem function. Glob. Change Biol. 8: 33-50. [ Links ]
Hunter, M.D. 2002. Issues in agricultural and forest entomology: Landscape structure, habitat fragmentation, and the ecology of insects. Agr. Forest. Entomol. 4: 159-165. [ Links ]
Ibrahima, A., R. Joffre & D. Gillon. 1995. Changes in litter during the initial leaching phase: An experiment on the leaf litter of Mediterranean species. Soil Biol. Biochem. 27: 931-939. [ Links ]
Illig, J., H. Schatz, S. Scheu & M. Maraun. 2008. Decomposition and colonization by micro-arthropods of two litter types in a tropical montane rain forest in southern Ecuador. J. Trop. Ecol. 24: 157-167. [ Links ]
Ims, R.A., H.P. Leinaas & S. Coulson. 2004. Spatial and temporal variation in patch occupancy and population density in a model system o fan Arctic Collembola species assemblage. Oikos 105: 89-100. [ Links ]
Kattan, G.H., D. Correa, F. Escobar & C. Medina. 2006. Leaf-litter arthropods in restored forests in the Colombian Andes: A comparison between secondary forest and tree plantations. Restor. Ecol. 14: 95-102. [ Links ]
Lavelle, P. 1996. Diversity of soil fauna and ecosystem function. Biol. Int. 33: 3-16. [ Links ]
Lemma, B., I. Nilsson, D.B. Kleja, M. Olson & H. Knicker. 2007. Decomposition and substrate quality of leaf litters and fine roots from three exotic plantations and a native forest in the Southwestern highlands of Ethiopia. Soil Biol. Biochem. 39: 2317-2328. [ Links ]
Malagón, D., C. Pulido, R. Llinas & C. Chamorro. 1995 Suelos de Colombia, origen, evolución, clasificación, distribución y uso. Canal Ramírez Antares Ltda, Santafé de Bogotá, Colombia [ Links ]
Magurran, A.E. 1989. Diversidad ecológica y su medición. Vedra, Barcelona, España. [ Links ]
Marasas, M.E., S.J. Sarandon & A.C. Cicchino. 2001. Changes in soil arthropod functional group in a wheat crop under conventional and no tillage systems in Argentina. Appl. Soil Ecol. 18: 61-68. [ Links ]
Moldenke, A., M. Pajutee & E. Ingham. 1999. The functional roles of forest soil arthropods: The soil is a living place. Proceedings of the California Forest Soils Council Conference on forest Soils Biology and Forest Management, Albany, Nueva York, EEUU. [ Links ]
Murrel, D.J. & R. Law. 2000. Beetles in fragmented woodlands: A formal framwork for dynamics of movement in ecological landscapes. J. Anim. Ecol. 69: 471-483. [ Links ]
Negrete-Yankelevich, S., C. Fragoso, A.C. Newton & W. Heal. 2007. Successional changes in soil, litter and macroinvertebrate parameters following selective logging in a Mexican cloud forest. Appl. Soil Ecol. 35: 340-355. [ Links ]
Nummelin, M. & I.J.E. Zilihona. 2004. Spatial variation of arthropod communities in virgen and managed sites in the Kibale Forest, western Uganda. Forest Ecol. Manag. 195: 107-114. [ Links ]
Ospina-Bautista, F., J.V. Estévez-Varón, J. Betancur & E. Realpe-Rebolledo. 2004. Estructura y composición de la comunidad de macroinvertebrados acuáticos asociados a Tillandsia turneri Baker (Bromeliaceae) en un bosque Alto andino Colombiano. Acta Zool. Mex. 20: 153-166. [ Links ]
Oyarzún, C.E. & A. Huber. 1999. Balance hídrico en plantaciones jóvenes de Eucalyptus globulus y Pinus radiata en el sur de Chile. Terra 17: 35-44. [ Links ]
Palacios-Vargas, J.G. 1990. Manuales y guías para el estudio de microartrópodos: I. Diagnosis y clave para determinar las familias de los Collembola de la Región Neotropical. Bogotá, Colombia. [ Links ]
Paoletti, M.G., R.A.J. Taylor, B.R. Stinner, D.H. Stinner & D.H. Benzing. 1991. Diversity of Soil Fauna in the Canopy and Forest Floor of a Venezuelan Cloud Forest. J. Trop. Ecol. 7: 373-383. [ Links ]
Peñaranda, M.R. 2005 Colémbolos (Hexápoda: Collembola) de Colombia. Tesis de Maestría, Universidad Nacional de Colombia, Bogotá, Colombia. [ Links ]
Pinto, P. 1993. Vegetación y flora de Colombia. Fundación Segunda Expedición Botánica. Fondo Nacional Universitario, Bogotá, Colombia. [ Links ]
Ponge, J.F. 2000. Vertical distribution of Collembola (Hexapoda) and their food resources in organic horizons of beech forests. Biol. Fertil. Soils 32: 508-522. [ Links ]
Porté, A., F. Huard & P. Dreyfus. 2004. Microclimate beneath pine plantation, semi- mature pine plantation and mixed broadleaved-pine forest. Agr. Forest Meteorol. 126: 175-182. [ Links ]
Prieto, D., M.M. Vázquez & C. Rodríguez. 1999. Comunidades de la mesofauna edáfica en una selva baja inundable de la Reserva de la Biósfera de Sian Kaan, Quintana Roo, México. Rev. Biol. Trop. 47: 489-492. [ Links ]
Richardson, B.A. 1999. The bromeliad microcosm and the assessment of faunal diversity in a neotropical forest. Biotropica 31: 321-336. [ Links ]
Röderstein, M., D. Hertel & C. Leuschner. 2005. Aboveand below-ground litter production in three tropical montane forest in southern Ecuador. J. Trop. Ecol. 21: 483-492. [ Links ]
Rodríguez, N., D. Armenteras, M.H.A. Rincón, M. Morales & S. Sua. 2004. Forest biodiversity indicators in the Colombian Andes. Instituto de Investigación de Recursos Biológicos Alexander von Humboldt, Bogotá, Colombia. [ Links ]
Salamanca, E.F., N. Kaneko & S. Katagiri. 1998. Effects of leaf litter mixtures in the decomposition of Quercus serrata and Pinus densiflora using field and laboratory microcosm methods. Ecol. Eng. 10: 53-73. [ Links ]
Salmon, S., J. Mantel, L. Frizzera & A. Zanella. 2006. Changes in humus forms and soil animal communities in two developmental phases of Norway spruce on an acidic substrate. Forest Ecol. Manag. 237: 47-56. [ Links ]
Sedjo, R.A. 1999. The potential of high-yield plantation forestry for meeting timber needs. New Forest. 17: 339-359. [ Links ]
Smith, C.K., H.L. Gholz & F. de Assis Oliveira. 1998. Fine litter chemistry, early stage decay, and nitrogen dynamics under plantations and primary forest in lowland Amazonia. Soil Biol. Biochem. 30: 2159-2169. [ Links ]
Tapia-Coral, S., B. Pashanasi & D. del Castillo. 2002. Estudio preliminar de la microfauna del suelo en áreas de varillales y chamizales de la Amazonía peruana. Fol. Amazon. 13: 65-86. [ Links ]
Teuben, A. & T.A. Roelofsma. 1990. Dynamic interactions between functional groups of soil arthropods and microorganisms during decomposition of coniferous litter in microcosm experiments. Biol. Fertil. Soils 9: 145-151. [ Links ]
Toro, J. & S. Gessel. 1999. Radiata pine plantations in Chile. New Forests 18: 33- 44. [ Links ]
Uetz, G.W. & J.D. Unzicker. 1976. "Pitfall" trapping in ecological studies of wandering spiders. J. Arachnol. 3: 101-111. [ Links ]
Wardle, D.A. 2002. Communities and ecosystems–linking the aboveground and belowground components. Princeton University, New Jersey, EEUU. [ Links ]
Wells, C.E., D.M. Glenn & D.M. Eissenstat. 2002. Soil insects alter fine root demography in peach (Prunus persica). Plant Cell Environ. 25: 431-439. [ Links ]
Wiwatwitaya, D. & H. Takeda. 2005. Seasonal changes in soil arthropod abundante in the dry evergreen forest of north-east Thailand, with special reference to collembolan communities. Ecol. Res. 20: 59-70. [ Links ]