Revista de Biología Tropical
versión On-line ISSN 0034-7744versión impresa ISSN 0034-7744
Rev. biol. trop vol.58 no.1 San José mar. 2010
Actividad fagodisuasiva y sistémica de una formulación derivada de un extracto de ruda (Ruta chalepensis, Rutaceae) sobre larvas de Hypsipyla grandella (Lepidoptera: Pyralidae)
Javier Barboza1, Luko Hilje2*, Julio Durón1, Víctor Cartín3 & Marco A. Calvo1
1. Escuela de Química, Universidad Nacional (UNA). Heredia, Costa Rica; titobazu@gmail.com
2. Departamento de Agricultura y Agroforestería, Centro Agronómico Tropical de Investigación y Enseñanza (CATIE). Turrialba, Costa Rica, Fax (506) 2558-2043; lhilje@catie.ac.cr
3. Escuela de Ciencias Agrarias, Universidad Nacional (UNA). Heredia, Costa Rica * Autor de correspondencia.
Abstract: Phagodeterrent and systemic activity of a fomulation derived from an extract of common rue (Ruta chalepensis, Rutaceae) on Hypsipyla grandella (Lepidoptera: Pyralidae) larvae. A key neotropical pest of mahoganies (Swietenia spp.) and cedars (Cedrela spp.), the larva of Hypsipyla grandella (Zeller) commonly bores into the main shoot of these valuable timber species, causing forking of the stems. Therefore, it would be desirable to count upon a phagodeterrent and systemic product which could readily protect young tissues. Since crude extracts of common rue foliage (Ruta chalepensis L.) have phagodeterrent activity on H. grandella larva, a product was formulated by combining such an extract with a number of coadjuvants, and was assessed on 75-100cm tall Spanish cedar (Cedrela odorata L.) trees, inside a greenhouse. A completely randomized design was used, with 10 trees per each one of the following treatments: the formulated product, an absolute control (distilled water), a relative control (carbofuran, 1%m/v in water), and the relative control without the crude extract. Number of attacks to the main shoot, fallen leaves and frass piles were recorded, as well as tunnel length. Regarding these variables, the formulated product provided excellent protection to treated trees, with only 0.1 attacks to the main shoot, on the average, at the end of the evaluation period. Likewise, when the systemic activity of the crude extract was assessed, substances present in it were able to translocate and get assimilated by the trees, thereafter causing phagodeterrence to larvae. Finally, an espectrophotometry analysis (performed at a wavelength of 355nm) allowed us to determine the concentration (403±1mg/l) and percentage (0.40%) of the flavonoid rutin in the crude extract, which eventually may be used as an analytical marker compound, should an industrial formulation be developed. Rev. Biol. Trop. 58 (1): 15-29. Epub 2010 March 01.
Key words: Hypsipyla grandella, mahogany shootborer, Ruta chalepensis, common rue, phagodeterrence, systemic activity, rutin.
Debido a la sobreexplotación de maderas preciosas presentes en los bosques neotropicales, como las caobas (Swietenia spp.) y cedros (Cedrela spp.) (Meliaceae), la forma más evidente de enfrentar la carencia de este recurso es el establecimiento de extensas plantaciones comerciales. No obstante, en América Latina y el Caribe históricamente ello ha sido impedido por el gusano barrenador de las meliáceas, Hypsipyla grandella (Zeller) (Lepidoptera: Pyralidae), que de varias maneras afecta dichas especies, y especialmente por la perforación de los brotes nuevos (Schabel et al. 1999). Así, cuando el brote terminal es atacado, el árbol se bifurca, ramifica o deforma, anulándose su valor comercial.
A pesar de que se han investigado numerosas opciones para el manejo de esta plaga (Newton et al. 1993, Mayhew & Newton 1998), aún no se dispone de métodos viables tanto operativa como económicamente, lo cual se explica por el nivel de tolerancia tan bajo, de apenas una larva por árbol (Schabel et al. 1999).
Sin embargo, se podría recurrir a un enfoque preventivo basado en sustancias que afecten el comportamiento de búsqueda o selección del hospedante por parte de H. grandella, como algunos compuestos fagodisuasivos. Al respecto, se ha demostrado que varios extractos vegetales crudos y algunas de sus fracciones causan dicho efecto, como los provenientes de la madera y el follaje del hombre grande (Quassia amara L. ex Blom, Simaroubaceae) (Mancebo et al. 2000) y del follaje de la ruda (Ruta chalepensis L., Rutaceae) (Mancebo et al. 2001, Soto et al. 2007, Barboza et al. 2010). Asimismo, se ha demostrado que ambos compuestos son sistémicos, por lo que, una vez dentro del árbol, podrían desplazarse hacia los nuevos brotes y protegerlos del ataque de la larva de H. grandella (Soto et al. 2007). No obstante, esto se demostró para plántulas creciendo in vitro, por lo que aún requiere ser confirmado en árboles. Por tanto, el objetivo de esta investigación fue estudiar la actividad sistémica de un producto formulado experimental (derivado del extracto crudo del follaje de ruda), aplicado sobre árboles pequeños de cedro amargo (Cedrela odorata L.)
Materiales y métodos
Localización: Los experimentos entomológicos se efectuaron en un invernadero y laboratorio del Centro Agronómico Tropical de Investigación y Enseñanza (CATIE), ubicado en Turrialba, Costa Rica. En tanto que los aspectos químicos de la investigación se desarrollaron en la Escuela de Química de la Universidad Nacional (UNA), en Heredia, Costa Rica.
Larvas de H. grandella: Las larvas se tomaron de una colonia existente en el Laboratorio de Entomología del CATIE, mantenida según un protocolo establecido (Vargas et al. 2001), descrito en términos generales en Barboza et al. (2010).
Actividad fagodisuasiva del producto formulado: Antes de iniciar los experimentos se realizó una breve prueba para descartar cualquier riesgo de fitotoxicidad del eventual producto formulado (cuya composición aparece después) sobre pequeños árboles, en el invernadero. Para ello se aplicó la formulación sin el extracto a tres árboles, la cual se comparó con tres árboles tratados con agua, y a las 24h se observaron para detectar cualesquiera síntomas de fitotoxicidad (corrugamiento, pérdida de pigmentación y/o deshidratación de los folíolos).
El producto experimental se formuló a partir de follaje de ruda adquirido en julio de 2006, en el jardín etnobotánico El Arca de las Hierbas, en Santa Bárbara de Heredia. En este sitio, a 1200m y con suelo de origen volcánico, la precipitación anual alcanza 2300mm y hay cuatro meses secos bien definidos. La identificación de la ruda fue confirmada por el especialista Luis J. Poveda (Escuela de Ciencias Ambientales, UNA).
La composición del producto formulado incluyó el extracto crudo (3.2%m/v) obtenido de una solución hidroalcohólica de metanol al 70%v/v (Barboza et al. 2010) y el etanol como vehículo, así como varios coadyuvantes (humectantes, dispersantes, emulgentes, adherentes y espesantes), cuya mención se omite por razones de confidencialidad relativas a aspectos de propiedad intelectual; además, se utilizó agua como el medio dispersante en mayor proporción dentro de la formulación.
Los árboles de cedro, de 75-100cm de alto y unos seis meses de edad, se obtuvieron de semilla de una progenie proveniente de Pococí, Limón, y se les abonó y cuidó por varios meses, para que fueran aptos para los experimentos. Se les eliminaron las hojas inferiores, procurando dejar únicamente las ocho hojas superiores en cada uno; éstas también se podaron a la altura del quinto par de folíolos más viejos, para evitar el contacto entre hojas de árboles vecinos durante los experimentos.
Los experimentos se realizaron en un invernadero, y el producto formulado se aplicó directamente al follaje de árboles sembrados en macetas de 2000ml (Comtec 300). Se les aplicó una sola dosis, comparándosele con tres testigos: absoluto (agua destilada), comercial (carbofurán al 1%m/v, en agua) y relativo (producto formulado, pero sin el extracto de ruda); el carbofurán (Furadan, FMC Corp. and Mobay Chem. Corp.) es un insecticida carbamato que puede matar la larva de H. grandella, al actuar de manera sistémica en árboles de cedro (Wilkins et al. 1976).
Las sustancias correspondientes a cada tratamiento se aplicaron a los respectivos arbolitos fuera del invernadero, para evitar la contaminación entre ellos. Esto se hizo con un atomizador DeVilbiss 15 de punta ajustable (The DeVilbiss), conectado a una bomba de vacío marca GAST, modelo DOA-P104-AA (GAST Manufacturing Corp. Benton Harbor, Michigan) y con una presión constante de 0.7kg/cm2. Una vez aplicado cada tratamiento, los arbolitos se reintrodujeron al invernadero.
Dadas las condiciones homogéneas en el invernadero, se empleó un diseño completamente al azar, con 10 repeticiones por tratamiento. La unidad experimental la constituyó un solo árbol. Cada uno se inoculó con tres larvas de instar I de H. grandella, colocadas con un pincel fino, 30min después de aplicar los tratamientos.
Los daños se evaluaron a los dos días, una semana y dos semanas después de la aplicación de los tratamientos. Las variables de respuesta fueron las siguientes: a) ataque al brote principal (dañado o muerto); b) número de hojas caídas (el criterio para considerar una hoja como muerta fue la presencia de hojas colgantes del tallo, o de marcas o cicatrices resultantes de su caída); c) número de montículos (frescos y viejos), tanto en el brote principal como en otras partes del árbol (brotes laterales, raquis de hojas o el tronco). Además, un mes después los árboles se cortaron en la base para medir la longitud de los túneles construidos por las larvas.
A cada una de estas cuatro variables se les efectuó un análisis de varianza, y las medias de cada tratamiento se compararon mediante la prueba de jerarquización múltiple de Tukey, con un valor de significancia fijo (α=0.05). Se empleó el paquete estadístico InfoStat (2001).
Actividad sistémica del producto formulado. Para determinar esto, semanalmente y durante un mes después de la aplicación de los tratamientos, de cada árbol se tomaron tres folíolos, uno en cada estrato: a) hojas cercanas al brote terminal; b) hojas de la parte media; y c) hojas más viejas e inferiores del árbol.
De cada folíolo se cortó un disco de 1.2cm de diámetro con un sacabocados, de modo que cada árbol aportó tres discos, los cuales se identificaron y codificaron según la edad de las hojas. Los discos se llevaron al laboratorio, donde se expusieron a larvas de instar I para determinar si los principios fagodisuasivos de la ruda podrían traslocarse en el árbol de manera sistémica y evitar que los discos fueran consumidos. A cada larva, que estuvo en ayuno por 3h dentro de frascos de vidrio de 30ml, se le suministró un disco, en forma individual. Los frascos se colocaron en bandejas, dentro de una cámara bioclimática Percival I-35L, a 25ºC y un fotoperíodo 12 L:12 O.
La variable de respuesta fue el área consumida en cada disco, lo que se registró porcentualmente a las 24h de exposición a la larva, según la escala visual del programa Distrain 1.0 (Tomerlin & Howell 1988). La persistencia se midió como el tiempo en el que los discos provenientes de cada árbol continuaban ejerciendo fagodisuasión sobre las larvas. El análisis estadístico fue similar al indicado previamente.
Cuantificación del glicósido rutina en el extracto crudo. Debido a que la rutina se ha reportado cualitativamente en R. chalepensis y se ha demostrado su actividad fagodisuasiva contra la larva de H. grandella (Barboza et al. 2010), se procedió con la realización de su cuantificación mediante un análisis espectrofotométrico. Para ello se preparó una disolución madre del extracto crudo de ruda, a una concentración de (10.044 ± 0.008)% m/v en metanol al 70% en agua. De la disolución obtenida se aplicaron 7ml con una micropipeta, sobre una placa de cromatografía de capa preparativa (Merck, gel de sílice 60, sin indicador fluorescente, 20 x 20cm, espesor de capa 0.5mm).
Tal procedimiento se realizó en cinco placas, para un volumen total de 35ml. El sistema de solventes cromatográficos empleado fue acetato de etilo: etilmetilcetona: ácido fórmico: agua (50:30:10:10) (Stahl 1990). La cromatografía se realizó contra un patrón de rutina, para identificar la mancha correspondiente al glicósido flavónico, y así extraer la misma de los cromatofolios en los que se aplicó la disolución de extracto crudo.
El gel de sílice extraído se lavó con cinco porciones de 50ml cada una de metanol caliente, para asegurarse de la extracción del compuesto. Los lavados se recolectaron en un mismo beaker, para luego filtrar al vacío. El filtrado se concentró hasta un volumen aproximado de 50ml, para depositarlo en un balón aforado de 100ml. De dicha disolución se tomó una alícuota de 2ml y se transfirió a un balón aforado de 25ml. Ambas disoluciones, se llevaron hasta la marca de aforo con metanol, grado HPLC (Cromatografía Líquida de Alta Eficiencia, por sus siglas en inglés).
Por otra parte, se construyó una curva de calibración con el patrón rutina (Sigma, pureza ≥95%, grado HPLC) de las siguientes concentraciones: 3.0±0.2, 6.0±0.2, 9.0±0.2, 12.0±0.4 y 15.0±0.4mg/l, a partir de una disolución madre de 250±2mg/l. Todas las disoluciones se prepararon en metanol, grado HPLC.
Tanto a la disolución del extracto crudo, como a la obtenida de la extracción de la mancha del cromatofolio de gel de sílice y al patrón de rutina de 15.0±0.4mg/l, se les realizó un espectro UV/Visible. El propósito principal era comprobar cuán satisfactoriamente se aisló la rutina de muchos de los otros metabolitos secundarios presentes en la disolución de ruda, así como escoger la longitud de onda idónea para la realización del análisis espectrofotométrico, haciendo una comparación de los máximos de absorción del espectro del patrón con respecto al espectro de la disolución obtenida de los cromatofolios.
Se efectuó un espectro UV/Visible de 800 a 200nm en un equipo marca Perkin- Elmer, modelo Lambda 2. Seguidamente se realizaron las lecturas espectrofotométricas de cada uno de los patrones, para la construcción de la curva de calibración, y finalmente la de la disolución que contenía el glicósido flavónico, a una longitud de onda de 355nm en un espectrofotómetro Thermo Electron Corporation, modelo Spectronic 20D+.
Resultados
Actividad fagodisuasiva del producto formulado. En la prueba preliminar para detectar riesgos de fitotoxicidad del producto formulado (pero sin el extracto), no hubo síntomas de ésta. Resuelto esto, la actividad fagodisuasiva del producto formulado se determinó mediante el registro del número de hojas caídas, el ataque al brote principal, y el número de montículos.
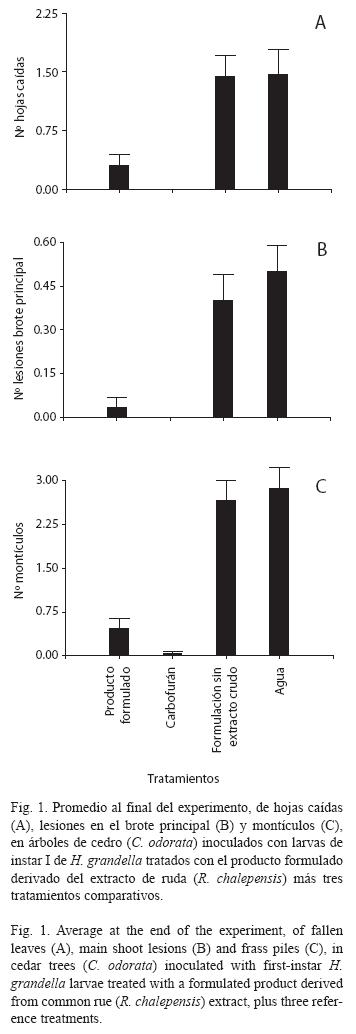
En cuanto al número de hojas caídas, hubo grandes diferencias tanto entre tratamientos (F=11.37, g.l.=3, p<0.0001) como entre evaluaciones (F=11.28, g.l.=2, p<0.0001), así como para las interacciones entre tratamientos y evaluaciones (F=10.03, g.l.=11, p<0.0001). En la 1ª evaluación no hubo diferencias entre los tratamientos, pero para la 2ª y 3ª evaluaciones sí (p<0.05). En éstas no hubo caída de hojas en los árboles tratados con carbofurán, mientras que en los tratados con el producto formulado se alcanzó un promedio de 0.30 hojas caídas, pero sin diferencias entre ambos (p>0.05). El testigo absoluto mostró la mayor caída de hojas, sin diferir del testigo relativo, en tanto que ambos sí difirieron de los dos primeros (p<0.05), durante las tres evaluaciones (Fig. 1A).
En relación con el número de ataques al brote principal, hubo grandes diferencias tanto entre tratamientos (F=15.04, g.l.=3, p<0.0001) como entre evaluaciones (F=8.59, g.l.=2, p<0.0003), así como para las interacciones entre tratamientos y evaluaciones (F=10.75, g.l.=11, p<0.0001). En la 1ª evaluación no hubo diferencias entre los tratamientos, pero para la 2ª y 3ª evaluaciones sí (p<0.05). En la 2ª no hubo ataques en los árboles tratados con carbofurán ni con el producto formulado, aunque en la 3ª estos últimos resultaron afectados, con un promedio de 0.10 ataques; no obstante, no hubo diferencias entre ambos (p>0.5). El testigo absoluto mostró el mayor ataque, sin diferir del testigo relativo, en tanto que ambos sí difirieron de los dos primeros (p<0.05), en las tres evaluaciones (Fig. 1B).
Con respecto al número de montículos (frescos y viejos), hubo grandes diferencias tanto entre tratamientos con respecto al número de montículos (F=30.58, g.l.=3, p<0.0001), como entre evaluaciones (F=2.16, g.l.=2, p<0.1196), así como para las interacciones entre tratamientos y evaluaciones (F=10.51, g.l.=11, p<0.0001). Desde la 1ª evaluación hubo diferencias entre los tratamientos (p<0.05). Por una parte, el testigo absoluto y el relativo mostraron el mayor número de montículos, sin diferir entre sí, en tanto que los árboles tratados con carbofurán no tuvieron montículos, y éstos alcanzaron un valor de apenas 0.47 en aquellos tratados con el producto formulado. Aunque para la 2ª evaluación un árbol tratado con carbofurán mostró montículos, estas tendencias se mantuvieron para las demás evaluaciones (Fig. 1C).
Asimismo, al medir la longitud de los túneles tras la última evaluación, se observaron grandes diferencias entre los tratamientos (F=8.68, g.l.=3, p<0.0002). Los árboles tratados con carbofurán no mostraron túneles, mientras que en aquellos tratados con el producto formulado éstos alcanzaron una longitud de 1.35 cm, en promedio, sin diferir entre sí (p> 0.05). En cambio, en el testigo absoluto y el relativo la longitud correspondió a 15.54 y 12.24 cm, en promedio, respectivamente sin diferir entre sí (p>0.05).
Actividad sistémica del producto formulado. Para cada una de las cuatro semanas en que se efectuó la evaluación, hubo grandes diferencias entre los tratamientos, así: 1ª semana (F=30.58, g.l.=3, p<0.0001), 2ª semana (F=24.03, g.l.=3, p<0.0001), 3ª semana (F=5.65, g.l.=3, p<0.0012) y 4ª semana (F=7.47, g.l.=3, p<0.0194). En todos los casos, las tendencias fueron congruentes con las observadas en los experimentos previos, con ambos testigos mostrando los mayores niveles de consumo, sin diferir entre sí, pero en fuerte contraste con los discos provenientes de árboles tratados con carbofurán y el producto formulado.
En la 1ª semana, tales diferencias se detectaron tanto en el estrato superior (F=11.51, g.l.=3, p<0.0001) como en el medio (F=9.3, g.l.=3, p<0.0001) y el inferior (F =8.90, g.l.=3, p<0.0002). Como promedio para los tres estratos, los discos provenientes de árboles tratados con carbofurán y el producto formulado mostraron valores de consumo de apenas 0.33 y 1.33%, respectivamente, sin diferencias entre sí (p>0.05). Asimismo, en la 2ª semana hubo marcadas diferencias entre tratamientos para el estrato superior (F=6.75, g.l.=3, p<0.0010), el medio (F=13.77, g.l.=3, p<0.0001) y el inferior (F=8.47, g.l.=3, p<0.0002), con un consumo promedio final de apenas 0.37 y 1.97%, respectivamente.
En cambio, para las otras dos semanas ocurrió una situación atípica en cuanto al estrato superior, pues en éste no hubo diferencias entre los tratamientos, así: 3ª semana (F=0.38, g.l.=3, p<0.7707) y 4ª semana (F =0.66, g.l.=3, p<0.5806) (Fig. 2A).
Para los otros dos estratos también hubo grandes diferencias entre tratamientos para el estrato medio (F=5.62, g.l.=3, p<0.0029) y el inferior (F=9.14, g.l.=3, p<0.0001) en la 3ª semana, así como para el estrato medio (F=6.70, g.l.=3, p<0.010) y el inferior (F=3.74, g.l.=3, p<0.0194) en la 4ª semana (Fig. 2B, 2C). Sin embargo, el único tratamiento que siempre se diferenció fue el carbofurán, en tanto que el producto formulado no mostró diferencias con ninguno de los testigos (Fig. 2D).
Cuantificación del glicósido rutina en el extracto crudo. Mediante las cromatografías de capa preparativa, se determinó que la mancha correspondiente al desplazamiento de la rutina era la amarillo claro, al observarla a la luz ambiente. Dicha tonalidad se presentó como la franja más oscura del cromatofolio al exponerlo a la longitud de luz de onda larga (366nm).
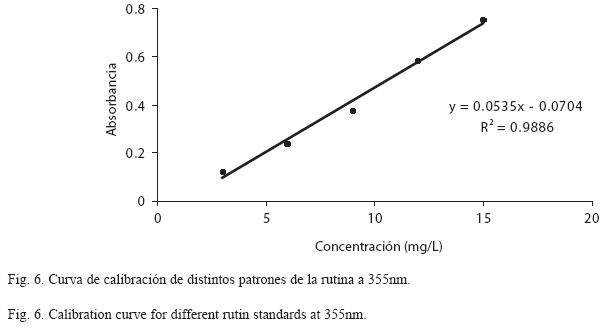
Además, mediante los espectros UV/Visible se determinó que el flavonoide se separó bien, debido a su poca semejanza con el espectro del extracto crudo (Fig. 3) y a que presenta uno de sus picos de máxima absorbancia a una longitud de onda de 354.73nm (Fig. 4), la cual es casi idéntica a la del espectro del patrón a 358.63nm (Fig. 5). De acuerdo con estos resultados, se realizaron las lecturas espectrofotométricas de los patrones y de la muestra a 355nm. Construida la curva de calibración (Fig. 6), se determinó una concentración y un porcentaje de rutina en el extracto de 403±1mg/l y 0.40% respectivamente.
Discusión
Tanto Mancebo et al. (2001) como Soto et al. (2007) demostraron que el extracto crudo de ruda tiene clara actividad fagodisuasiva sobre larvas de H. grandella, la cual fue confirmada por Barboza et al. (2010), quienes a su vez demostraron que fue mayor en la partición hexano. Sin embargo, para la presente investigación se eligió el extracto crudo, debido al notable ahorro de tiempo, y de algunos procesos y técnicas involucrados con la investigación fitoquímica que elevan los costos, así como por la eventual facilidad para formularlo como parte de un proceso a escala industrial.
En cuanto a la concentración a utilizar, si bien la actividad fagodisuasiva del extracto crudo (hidroalcohólico) se había detectado a 0.32%m/v, era riesgoso extrapolar esta cifra, obtenida en bioensayos de laboratorio, a las condiciones más rigurosas de temperatura y luz propias de un invernadero, y sobre todo tratándose de una formulación experimental algo rústica. Por tanto, de las tres concentraciones más altas (1.0, 3.2 y 10%m/v) evaluadas por Barboza et al. (2010), se eligió la intermedia.
Asimismo, aunque lo deseable era formular el extracto como un producto granulado, para que fuera directamente comparable con el carbofurán, era riesgoso hacerlo en una etapa tan prematura de la investigación. Por tanto, se optó por preparar una macro-emulsión, aplicable al follaje de los árboles de cedro. Esta fue una emulsión de aceite en agua, consistente en la disolución del principio activo en un líquido orgánico dispersado como glóbulos finos en una fase acuosa, y de apariencia turbia. Se escogió por ser líquida, de fácil aplicación, y porque su formulación era relativamente sencilla.
Además, era necesario agregar sustancias auxiliares (tanto inertes como coadyuvantes) al ingrediente activo, para favorecer la aplicación del producto formulado en forma homogénea, y que éstas fueran de origen natural. Ello no era sencillo, dado que el componente mayoritario de dicho producto era el agua y debían incorporársele algunos compuestos no polares presentes en el extracto crudo. Finalmente, era preciso descartar los riesgos de fitotoxicidad del producto formulado (pero sin el extracto), como efectivamente ocurrió.
Como síntesis general de los experimentos efectuados, fue muy evidente cómo los árboles tratados con el carbofurán tuvieron completa protección contra las larvas de H. grandella debido a su efecto tóxico, confirmando los hallazgos previos, tanto de laboratorio (Soto et al. 2007) como de campo (Wilkins et al. 1976). Asimismo, aquellos tratados con el producto formulado mostraron muy buena protección, con pocos daños para todas las variables evaluadas. Aunque en este caso las larvas podrían haber migrado hacia otras partes, como todo el árbol fue tratado con el producto, ellas no podían escapar, muriendo por inanición.
Por el contrario, la mayoría de los árboles testigos (absoluto y relativo) mostraron valores altos en todas las variables de daño, al finalizar la evaluación. El hecho de que algunos árboles no sufrieran ataques serios podría obedecer a que las larvas se desprendieran poco después de realizada la inoculación, o a la competencia por el alimento, lo que quizás provocó canibalismo y el consecuente daño entre ellas, causándoles la muerte; este fenómeno, que es común cuando las larvas de H. grandella crecen en condiciones de hacinamiento (Luko Hilje, obs. pers.), posiblemente se expresó más en el estrato superior, que fue donde se colocaron, por estar ahí el brote principal.
En cuanto a la capacidad del producto formulado para desplazarse sistémicamente en los árboles, podría cuestionarse que no se hubiese aplicado solamente a la raíz, sino a todo el follaje, donde habría sido absorbido directamente. Sin embargo, esto debió hacerse así, por las razones ya anotadas, y el método no impidió detectar ese efecto sistémico.
En realidad, en cada una de las cuatro semanas de evaluación, el patrón de consumo de los discos fue análogo al observado para las otras tres variables. Es decir, el producto formulado y el carbofurán fueron muy eficaces en prevenir el daño, sin diferir entre sí en términos estadísticos, pero contrastaron marcadamente con los dos testigos.
Sin embargo, surgió como excepción el estrato superior en la 3ª y 4ª semanas, en el cual no hubo diferencias entre los cuatros tratamientos evaluados; es decir, ni siquiera el carbofurán fue capaz de proteger a los árboles. Esto carecería de lógica, dada su notable eficacia como insecticida sistémico contra las larvas de H. grandella (Wilkins et al. 1976). No obstante, en este caso los discos tomados para los bioensayos de persistencia provenían de hojas nuevas que, por tanto, no habían sido atomizadas con ninguno de los tratamientos.
Por tanto, estos datos sugieren que, aunque las sustancias activas se absorbieron donde se aplicaron, no pudieron ser transportadas en una concentración suficiente para proteger los nuevos puntos de crecimiento del árbol, ya fuera mediante toxicidad (carbofurán), o fagodisuasión (producto formulado). En los otros dos estratos el carbofurán siempre protegió a los árboles, en tanto que el producto formulado perdió su actividad de manera paulatina después de dos semanas de notable eficacia.
De manera indirecta, esto aporta sustento a los hallazgos de Soto et al. (2007), quienes demostraron que el extracto crudo de ruda se puede desplazar de manera sistémica en plántulas de cedro, causando la muerte de las larvas de H. grandella, por inanición.
En los experimentos de dichos autores se aplicó una técnica de cultivo de tejidos, agregando el extracto a un medio apto para las plántulas cultivadas in vitro, por lo que el medio de cultivo homogéneo y suave, más las condiciones de asepsia y el tamaño de la planta, evitaron la presencia de obstáculos físicos o biológicos que impidieran la absorción y rápido transporte del extracto.
En cambio, en la presente investigación se trataba de árboles pequeños pero ya leñosos, con una estructura interna más compleja que la de las plántulas, y creciendo en macetas con suelo, cuyas características podrían haber afectado el flujo expedito del producto dentro del árbol, de manera directa o indirecta. Asimismo, la baja cantidad de residuos del producto obedeció a que se trataba de una formulación apenas experimental, en lo cual debe desarrollarse investigación, para su mejoramiento.
Aunque la utilización de insecticidas convencionales para el combate de H. grandella implica algunos problemas, como el alto costo de las aplicaciones repetidas, la rápida penetración de la larva en el brote tras emerger del huevo, el lavado por las lluvias y los métodos de aplicación per se para árboles altos, algunos de ellos podrían subsanarse. De contarse eventualmente con una formulación de alta cantidad de residuos, derivada de la ruda, se podría utilizar preventivamente, aplicándola antes de que la larva penetre en el brote.
En tal sentido, cabría desarrollar varios tipos de formulaciones de liberación controlada, diferenciadas según la edad de los árboles. Para las etapas iniciales de una plantación sería pertinente aplicar un producto microencapsulado, y una vez que los árboles alcancen un diámetro adecuado, se podría recurrir a una formulación líquida aplicable mediante microinyecciones a su sistema vascular, o a una apta para insertarse en el tronco, como lo son los implantes (Hilje & Mora 2006), las cuales evitarían la exposición del producto a la lluvia y la radiación solar.
Como el período crítico por lo general corresponde a los primeros seis años de establecida una plantación de caobas o cedros (Hilje & Cornelius 2001), los esfuerzos de manejo deberían concentrarse en dicho período solamente, para reducir los costos de mantenimiento de la plantación.
En cuanto a las propiedades de la ruda, es una planta con amplia trayectoria y credenciales como planta medicinal (Al-Said et al. 1990, Günaydin & Savci 2005). No obstante, debe evitarse el uso tópico, ya que puede ocasionar dermatitis alérgica (Gonçalo et al. 1989). En el caso de ser ingerida puede producir gastroenteritis, dolor del epigastrio, vómitos, náuseas, salivación, convulsiones, y en sobredosis podría ser mortal (Cáceres 1996); asimismo, en mujeres embarazadas podría ocasionar hemorragias y promover el aborto (Ososki et al 2002, Ciganda & Laborde 2003).
No obstante lo anterior, la ruda podría utilizarse en una formulación apta, considerando la forma de aplicación y la relativamente baja concentración a la que se emplearía, con lo cual se podrían evitar efectos indebidos en las personas y la fauna silvestre.
Una de sus ventajas es que se presta para ser sembrada y propagada en amplia escala, ya sea en áreas abiertas o quizás incluso en sistemas agroforestales, lo que garantizaría su disponibilidad, además de que, por ser el follaje la estructura vegetal que aporta el extracto, se podría cosechar de manera continua, sin tener que sacrificar las plantas.
En el eventual caso de poder desarrollarse formulaciones de liberación controlada, sería importante disponer de un método para garantizar la calidad y estabilidad del producto. Así, se podría recurrir al flavonoide rutina como un compuesto marcador analítico, tal y como se hace hoy en la industria farmacéutica (Joseph- Charles et al. 2001, Dubber & Kanfer 2004).
En tal sentido, se utilizó la espectrofotometría para la cuantificación de la rutina, para lo cual se obtuvo el espectro UV/Visible del patrón, que presentó tres bandas máximas de absorción (a 209.42, 257.32 y 358.63nm). Las dos primeras longitudes de onda son características de compuestos que presentan anillos aromáticos dentro de su estructura y que permiten que ocurran transiciones de tipo ∏→∏* (Pavia et al. 2001). No obstante esas bandas de absorción pueden presentar cambios debido a la presencia de sustituyentes que poseen electrones no enlazantes (electrones n), como el grupo hidroxilo, dándose la posibilidad de transiciones de tipo n →∏* (Pavia et al. 2001).
Asimismo, la última longitud de onda se encuentra en el intervalo de 330-375nm, que es característico de los flavonoides de tipo flavonol, como la rutina (Domínguez 1998). Por lo tanto, el análisis se efectuó a 355nm, considerando no solo la presencia de esa longitud de onda en el patrón y muestra, sino también la limitante del equipo que permite realizar determinaciones a partir de 300nm.
Los resultados obtenidos de la cuantificación de rutina pudieron no ser muy exactos, quizás por aspectos metodológicos. Por ejemplo, Kreft et al. (2002) compararon los resultados obtenidos al determinar la concentración de rutina por dos métodos espectrofotométricos y uno por HPLC. En uno de los métodos se realizaron las lecturas con y sin la adición de cloruro de aluminio (AlCl3) y el otro se basó en lo descrito por la AOAC (Association of Analytical Chemists), dando como promedio resultados más altos (30 y 140%, respectivamente) que los obtenidos en la determinación por HPLC.
Por tanto, para la óptima cuantificación de rutina y el establecimiento de una técnica para verificar la estabilidad y calidad del producto, debería recurrirse al desarrollo e implementación de métodos por HPLC, con los que se han obtenido resultados muy satisfactorios en muchas investigaciones implicadas con la determinación de dicho flavonoide (Dawidowicz et al. 2003, Anli et al. 2006, Zheng-Ming et al. 2007).
Agradecimientos
A Arturo Ramírez y Francisco Soto (CATIE), su apoyo en los experimentos y valiosas sugerencias, respectivamente. A las autoridades del Departamento de Agricultura y Agroforestería del CATIE y de la Escuela de Química de la UNA, por permitir la realización de los experimentos en sus instalaciones.
Resumen
Para el manejo de Hypsipyla grandella (Zeller), cuya larva barrena el brote principal de caobas (Swietenia spp.) y cedros (Cedrela spp.), sería deseable contar con un producto fagodisuasivo y con buena actividad sistémica, para que proteja rápidamente los tejidos jóvenes. Por tanto, conociendo que un extracto crudo del follaje de ruda (Ruta chalepensis L.) posee actividad fagodisuasiva contra dicho insecto, se formuló un producto combinando dicho extracto con varios coadyuvantes, y se evaluó en árboles de cedro amargo (Cedrela odorata L.) de 75- 100cm de altura, en un invernadero. Se utilizó un diseño completamente al azar, con 10 árboles por cada tratamiento, los que correspondieron al producto formulado, a un testigo absoluto (agua destilada), un testigo relativo (carbofurán al 1%m/v en agua) y el testigo relativo a la formulación sin el extracto crudo. Las variables medidas fueron los ataques al brote principal, el número de hojas caídas, el número de montículos y la longitud de los túneles. Para dichas variables, el producto formulado aportó excelente protección a los árboles tratados, con apenas 0.1 ataques al brote principal, en promedio, al final del período de evaluación. Asimismo, al evaluar la actividad sistémica del extracto, las sustancias presentes en él pudieron desplazarse y ser asimiladas por los árboles, causando fagodisuasión en las larvas. Finalmente, el análisis espectrofotométrico (a una longitud de onda de 355nm) permitió determinar la concentración (403±1mg/l) y el porcentaje (0.40%) del flavonoide rutina en el extracto crudo, lo cual eventualmente podría utilizarse como un compuesto marcador analítico, si llegara a desarrollarse una formulación industrial.
Palabras clave: Hypsipyla grandella, barrenador de meliáceas, Ruta chalepensis, ruda, fagodisuasión, actividad sistémica, rutina.
Referencias
Al-Said, M., M. Tariq, M.A. Al-Yahya, S. Rafatullah, O.T. Ginnawi & A.M. Ageel. 1990. Studies on Ruta chalepensis, an ancient medicinal herb still used in traditional medicine. J. Ethnopharm. 28: 305-312. [ Links ]
Anli, E., N. Vural, S. Demiray & M. Özkan. 2006. Transresveratrol and other phenolic compounds in Turkish red wines with HPLC. J. Wine Res. 17: 117-125. [ Links ]
Barboza, J., L. Hilje, J. Durón, V. Cartín & M. Calvo. 2010. Fagodisuasión de un extracto de ruda (Ruta chalepensis, Rutaceae) y sus particiones sobre larvas de Hypsipyla grandella (Lepidoptera: Pyralidae). Rev. Biol. Trop. 58: 1-14. [ Links ]
Cáceres, A. 1996. Plantas de uso medicinal en Guatemala. Universitaria, Ciudad de Guatemala, Guatemala. [ Links ]
Ciganda, C. & A. Laborde. 2003. Herbal infusions used for induced abortion. Clin. Toxicol. 41: 235-239. [ Links ]
Dawidowicz, A., D. Wianowska, J. Gawdzik & D. Smolarz. 2003. Optimization of ASE conditions for the HPLC determination of rutin and isoquercitrin in Sambucus nigra L. J. Liq. Chromat. Relat. Tech. 26: 2381-2397. [ Links ]
Domínguez, X. 1988. Métodos de investigación fitoquímica. Limusa, México D.F., México. [ Links ]
Dubber, M. & I. Kanfer. 2004. High-performance liquid chromatography determination of selected flavonols in Ginkgo biloba solid oral dosage forms. J. Pharm. Pharm. Sci. 7: 303-309. [ Links ]
Gonçalo, S., C. Correia, J.S. Couto & M. Gonçalo. 1989. Contact and photo-contact dermatitis from Ruta chalepensis. Cont. Derm. 21: 200-201. [ Links ]
Günaydin, K. & S. Savci. 2005. Phytochemical studies on Ruta chalepensis (Lam.). Nat. Prod. Res. 19: 203-210. [ Links ]
Hilje, L. & J. Cornelius. 2001. ¿Es inmanejable Hypsipyla grandella como plaga forestal? Man. Integ. Plagas No. 61, Hoja Técnica 39. p. i-iv. [ Links ]
Hilje, L. & G.A. Mora. 2006. Promissory botanical repellents/deterrents for managing two key tropical insect pests, the whitefly Bemisia tabaci and the mahogany shootborer Hypsipyla grandella, p. 379- 403. In M. Rai & C. Carpinella (eds.). Naturally occurring bioactive compounds: a new and safe alternative for control of pests and diseases. Advances in phytomedicine Vol. 3. Elsevier, Amsterdam, Holanda. [ Links ]
InfoStat, Software Estadístico. 2001. Versión 1.0. Estadística y Biometría. Facultad de Ciencias Agropecuarias, Universidad Nacional de Córdoba, Argentina. [ Links ]
Joseph-Charles, J., M. Montagut, M.-H. Langlois, C. Boyer & J.-P. Dubost. 2001. Simultaneous determination of rutin and benzocaine in suppositories by reversed- phase high-performance liquid chromatography. Anal. Lett. 34: 2685-2692. [ Links ]
Kreft, S., B. Štrukelj, A. Gaberšcik & I. Kreft. 2002. Rutin in buckwheat herbs grown at different UV-B radiation levels: comparison of two UV spectrophotometric and an HPLC method. J. Exp. Bot. 53: 1801-1804. [ Links ]
Mancebo, F., L. Hilje, G. Mora & R. Salazar. 2000. Antifeedant activity of Quassia amara (Simaroubaceae) extracts on Hypsipyla grandella (Lepidoptera: Pyralidae) larvae. Crop Prot. 19: 301-305. [ Links ]
Mancebo, F., L. Hilje, G. Mora, V. Castro & R. Salazar. 2001. Biological activity of Ruta chalepensis (Rutaceae) and Sechium pittieri (Cucurbitaceae) extracts on Hypsipyla grandella (Lepidoptera: Pyralidae) larvae. Rev. Biol. Trop. 49: 501-508. [ Links ]
Mayhew, J.E. & A.C. Newton. 1998. The silviculture of mahogany. CABI, Wallingford, United Kingdom. [ Links ]
Newton, A., P. Baker, S. Ramnarine, J. F. Mesén & R.R.B. Leakey. 1993. The mahogany shoot borer: Prospects for control. For. Ecol. Manage. 57: 301-328. [ Links ]
Ososki, A., P. Lohr, M. Reiff, M. Balick, F. Kronenberg, A. Fugh-Berman & B. O`Connor. 2002. Ethnobotanical literature survey of medicinal plants in the Dominican Republic used for women`s health conditions. J. Ethnopharm. 79: 285-298. [ Links ]
Pavia, D., G. Lampman & G. Kriz. 2001. Introduction to spectroscopy. Harcourt College, Orlando, Florida, EEUU. [ Links ]
Schabel, H., L. Hilje, K.S.S. Nair & R.V. Varma. 1999. Economic entomology in tropical forest plantations: An update. J. Trop. For. Sci. 11: 303-315. [ Links ]
Soto, F., L. Hilje, G. Mora, M.E. Aguilar & M. Carballo. 2007. Systemic activity of plant extracts in Cedrela odorata (Meliaceae) seedlings and their biological activity on Hypsipyla grandella (Lepidoptera: Pyralidae) larvae. Agric. For. Entomol. 9: 221-226. [ Links ]
Stahl, E. 1990. Thin-layer chromatography; a laboratory handbook. Springer, Berlín, Alemania. [ Links ]
Tomerlin, J. & T. Howell. 1988. Distrain: A computer program for training people to estimate disease severity on cereal leaves. Plant Dis. 72: 455-459. [ Links ]
Vargas, C., P. Shannon, R. Taveras, F. Soto, L. Hilje. 2001. Un nuevo método para la cría masiva de Hypsipyla grandella. Man. Integ. Plagas No. 62, Hoja Técnica No. 39. p. i-iv. [ Links ]
Wilkins, R., G. Allan & R. Gara. 1976. Protection of Spanish cedar with controlled release insecticides, p. 63-70. In J.L. Whitmore (ed.). Studies on the shootborer Hypsipyla grandella (Zeller). Lep. Pyralidae. Vol. III. IICA Misc. Publ. No. 101. IICA, Turrialba, Costa Rica. [ Links ]
Zheng-Ming, Q., L. Hui-Jun, L. Ping, R. Mei-Ting & T. Dan. 2007. Simultaneous qualitation and quantification of thirteen bioactive compounds in Flos loniraceae by high-performance liquid chromatography with diode array detector and mass spectrometry. Chem. Pharm. Bull. 55: 1073-1076. [ Links ]












 uBio
uBio