Services on Demand
Journal
Article
Indicators
-
 Cited by SciELO
Cited by SciELO -
 Access statistics
Access statistics
Related links
-
 Similars in
SciELO
Similars in
SciELO  uBio
uBio
Share
Revista de Biología Tropical
On-line version ISSN 0034-7744Print version ISSN 0034-7744
Rev. biol. trop vol.57 suppl.1 San José Nov. 2009
Época reproductiva y distribución geográfica del sapo Incilius aucoinae (Bufonidae) en Golfito, Costa Rica
Susy Segura-Solís1 & Federico Bolaños2
1. Escuela de Biología, Universidad de Costa Rica. Dirección actual: Instituto Costarricense de Electricidad - Exploración Subterránea; SSeguraS@ice.go.cr
2. Escuela de Biología, Universidad de Costa Rica, 11501-2060, San José, Costa Rica; bolanosv@biologia.ucr.ac.cr
Abstract: Reproductive period and geographic distribution of the toad Incilius aucoinae in Golfito, Costa Rica. The biology of neotropical amphibians is not well known. Some toad species of the Bufonidae family are common, thus allowing the study of their populations. We studied a population in río Cañaza, Golfito, Costa Rica, in a sector 360 m upstream of Barrio Ureña, divided in 36 sectors of 10 m. The study was carried out for five years, but taking samples of adults in January 1995, 1997, 1998 (except March), and 1999. We also studied tadpoles during four days in 1997. In total, 443 males and 7 females were marked, with 315 males recaptured and no females. Females are bigger (91.1 mm) than males (61.3 mm). Most recaptured individuals occurred in the same or adjacent sectors, with a maximum movement of 28 sectors. One individual was recaptured repeatedly in all the samples. This indicates that they survived at least five reproductive cycles. The reproductive cycle takes place during the dry season, between December and April. We found more individuals during the reproductive cycle of 1997 and less during 1995. Sector 6 had the most number of males and sector number 4 had the least. Sectors with semi-open vegetation had more males compared to sectors with more forest cover. February is the month with the highest abundance of males. There are intermediate values in December and January, and fewer individuals in March and April. In every month, except February, the abundance of individuals was greater where there were beaches. Tadpoles were found both during the day and night in the 31 river sectors, but it was less likely to find tadpoles in the river section during the night. During the day all tadpoles were found scattered around the river, at night they congregated near river margins. The reproductive cycle of this toad occurs during the dry season and females are present only in the reproductive season, resulting in an almost only male sex ratio (only seven females were found). Males can reproduce at least in 5 reproductive cycles, and –unexpectedly– day and night distribution of tadpoles varies. Rev. Biol. Trop. 57 (Suppl. 1): 301-311. Epub 2009 November 30.
Key words: Incilius aucoinae, breeding season, population, sex ratio, site fidelity, Bufonidae, Costa Rica.
Se estima que la mayoría de los anfibios pueden llegar a vivir hasta 20 años, sin embargo existe muy poca información acerca de la esperanza de vida y la longevidad e incluso esa poca información es principalmente de animales en cautiverio. Los anfibios que han vivido más tiempo son salamandras como Salamandra salamandra (hasta 50 años) y Andrias japonicus (con 55 años), que a la vez es el máximo registrado. Las especies más grandes viven más que las pequeñas y en general las salamandras viven más que los anuros (Duellman & Trueb 1986). Algunos registros de vida de anuros (Bowler 1977) son Leptodactylus pentadactylus (15 años), Bufo bufo (36), Dendrobates auratus (8) y Lithobates catesbeianus (16). La rana Hypsiboas rosenbergi puede vivir tres y medio años en cautiverio, pero en la naturaleza no llegan a vivir más de dos años (Kluge 1981).
Individuos de especies de anuros de latitudes altas requieren más tiempo para alcanzar la madurez sexual, según Duellman & Trueb (1986) el promedio para 8 especies en machos es 3.4 años (2-4) y en hembras 3.6 años (2.5-6). En los ambientes tropicales el promedio de tiempo en 12 especies de anuros para alcanzar la madurez reproductiva es de 10.8 meses en machos (6-15 meses) y 11.0 meses (8-15) en hembras (Duellman & Trueb 1986).
Los anfibios, típicamente tienen una alta fidelidad a los sitios reproductivos y vuelven año con año exactamente al mismo charco o a la misma sección del río o quebrada. Un estudio hecho con Taricha rivularis en California, muestra como muchos individuos regresan al segmento del río donde se criaron, incluso después de 11 años desde que se observaron por primera vez (Pough et al. 1998). Otro ejemplo de anuros fieles a su sitio reproductivo es Lithobates sylvaticus que utiliza charcos temporales en las montañas de Virginia para poner los huevos, luego de 7 años de observación, hay adultos que son recapturados en el mismo sitio en el que se marcaron o en charcos cercanos en un área de 250 a 1000 m (Berven & Grudzien 1990). También Epidalea calamita utiliza charcos de crianza en un área de unos 3 km, a los que regresa todos los años durante la época reproductiva (Pough et al. 1998).
En los trópicos existe gran diversidad en las formas que tienen los anfibios para reproducirse (Duellman 1992), Costa Rica no es la excepción y los anuros tienen diferentes formas de independencia del agua, así se han determinado varias estrategias reproductivas (Scott & Limerick 1991, Pough et al. 1998, Savage 2002, Bolaños 2003), eso permite también patrones reproductivos, en donde se reconocen aquellos que son reproductores explosivos es decir quienes invierten toda su energía en un período muy corto y los que son reproductores prolongados, es decir que reparten su inversión reproductiva ya sea en varios momentos, o un momento largo, o que son capaces de reproducirse todo el año (Duellman & Trueb 1986, Jorgensen 1988, Stebbins & Cohen 1995, Pough et al. 1998).
Las especies pertenecientes a Bufo (sensu lato) mantienen un comportamiento reproductivo que las obliga a depender de un cuerpo de agua para reproducirse (con huevos y larvas en el agua), este cuerpo de agua es permanente o temporal de acuerdo a la especie (Duellman & Trueb 1986). También depende de la especie si se usa agua en movimiento o estancada así como si la reproducción habita durante la estación lluviosa o la seca. En la familia Bufonidae para Costa Rica, excluyendo las tres especies de Atelopus y las tres de Crepidophryne, hay 11 especies de sapos, siete utilizan cuerpos de agua sin movimiento y temporales, tres ríos o quebradas y una usa tanto ríos y quebradas como charcos para reproducirse (Scott & Limerick 1991, Savage 2002). En las especies que se reproducen en agua en movimiento es frecuente que lo hagan durante la época seca especialmente cuando se trata de quebradas que no se secan, época en la que hay menos posibilidad de que se den avenidas (Metter 1968, Duellman & Trueb 1986). Incilius aucoinae es uno de los sapos de Costa Rica y Panamá que se reproduce en ríos durante la época seca (Savage 2002, O´Neill & Mendelson 2004, Bolaños 2005), esta especie, como muchos otros anfibios, se conoce poco en aspectos ecológicos, reproductivos y poblacionales, habita en zonas de bosques lluviosos de los 20 a los 1 100 m de altitud (Mendelson et al. 1999). Su distribución coincide aproximadamente con el área faunística Suroeste, propuesta por Savage (2002) y solamente hay un espécimen recolectado en la región de Chiriquí, Panamá.
La distribución de renacuajos se debe a varios factores, en primera instancia están presentes solo donde sus padres escogieron ovipositar, pero se sabe que otros agentes como cantidad de luz, cantidad de alimento y por ende presiones selectivas producto de la competencia, disminución del riesgo de depredación y de desecación también influyen en su presencia (Duellman & Trueb 1986, Stebbins & Cohen 1995). Es frecuente encontrar mención en la literatura de que los renacuajos forman agrupaciones (Hoff et al. 1999) y poco se entiende el significado de estás. A veces se les asocia con mecanismos de protegerse contra la depredación, mejora en el forrajeo o en la termorregulación (Bertram 1978, Pulliam & Caraco 1978). Las agrupaciones de renacuajos se llaman escuelas o grupos de comportamiento temporal de acuerdo a la especie (Duellman & Trueb 1986). También depende de la especie si se usa agua en movimiento o estancada así como si la reproducción habita durante la estación lluviosa o la seca. En la familia Bufonidae para Costa Rica, excluyendo las tres especies de Atelopus y las tres de Crepidophryne, hay 11 especies de sapos, siete utilizan cuerpos de agua sin movimiento y temporales, tres ríos o quebradas y una usa tanto ríos y quebradas como charcos para reproducirse (Scott & Limerick 1991, Savage 2002). En las especies que se reproducen en agua en movimiento es frecuente que lo hagan durante la época seca especialmente cuando se trata de quebradas que no se secan, época en la que hay menos posibilidad de que se den avenidas (Metter 1968, Duellman & Trueb 1986). Incilius aucoinae es uno de los sapos de Costa Rica y Panamá que se reproduce en ríos durante la época seca (Savage 2002, O´Neill & Mendelson 2004, Bolaños 2005), esta especie, como muchos otros anfibios, se conoce poco en aspectos ecológicos, reproductivos y poblacionales, habita en zonas de bosques lluviosos de los 20 a los 1 100 m de altitud (Mendelson et al. 1999). Su distribución coincide aproximadamente con el área faunística Suroeste, propuesta por Savage (2002) y solamente hay un espécimen recolectado en la región de Chiriquí, Panamá.
La distribución de renacuajos se debe a varios factores, en primera instancia están presentes solo donde sus padres escogieron ovipositar, pero se sabe que otros agentes como cantidad de luz, cantidad de alimento y por ende presiones selectivas producto de la competencia, disminución del riesgo de depredación y de desecación también influyen en su presencia (Duellman & Trueb 1986, Stebbins & Cohen 1995). Es frecuente encontrar mención en la literatura de que los renacuajos forman agrupaciones (Hoff et al. 1999) y poco se entiende el significado de estás. A veces se les asocia con mecanismos de protegerse contra la depredación, mejora en el forrajeo o en la termorregulación (Bertram 1978, Pulliam & Caraco 1978). Las agrupaciones de renacuajos se llaman escuelas o grupos de comportamiento de renacuajos. Se agrupan por varias razones, algunos autores opinan que les brinda protección contra depredadores, por medio de un comportamiento de alarma o la liberación de sustancias realzando la efectividad de las defensas químicas y para adquirir, más rápidamente, un aprendizaje de huida (Waldman 1982). En otras especies, la formación de agregaciones aparentemente tiene un fuerte componente social y no está basada solamente en masas para la explotación de alimento u otros factores no sociales como sucede en Xenopuslaevis (Wassersug & Hessel 1971). El hecho de que las escuelas estén formadas por renacuajos de tamaño similar sugiere que pueden ser individuos hermanos y que eclosionaron de la misma masa de huevos. Sin embargo, esto también puede ser otra evidencia de que los adultos escogen el sitio de reproducción (Blaustein & O´Hara 1987).
Esta investigación interpreta la información de cuatro años de estudio en un periodo de cinco años, de una población de I. aucoinae en Golfito, Costa Rica; su época reproductiva, la proporción de sexos en el sitio reproductivo, el tamaño, cuanto crecen, la estructura poblacional de los machos, la proporción de recapturas, la distribución a lo largo del río y su relación con características físicas como profundidad del agua, velocidad de la corriente, presencia de playones y paredones o con la cobertura vegetal del entorno. sí como busca estudiar la distribución de los renacuajos a lo largo del río y su comportamiento de agrupación con respecto al día y la noche.
Materiales y métodos
La investigación se realizó en el Río Cañaza, Golfito, Puntarenas, Costa Rica; en una sección de 360 m del río aguas arriba del Barrio Ureña 8°4040" N y 83°1128 W. La información de adultos se generó en cuatro períodos: enero de 1995, ocho días en enero de 1997, tres días durante todos los meses restantes de 1997 y todos 1998 (excepto marzo) y en enero de 1999. Con los renacuajos se trabajó del 20 al 23 de enero de 1997. El sitio posee bosque de ribera de crecimiento secundario en algunos sectores, pero en general es una zona con vegetación alterada que recibe la influencia del poblado cercano. La sección estudiada se dividió en sectores de 10 m, cinco sectores aguas arriba en un tributario, cinco en el río aguas arriba de la confluencia del tributario y 26 sectores aguas abajo. Los sectores del 1-31 están en el cauce principal de forma consecutiva y comenzando con el primero en el sector más aguas arriba. En cada sector se midió la velocidad del agua (medida con una regla de madera que se dejaba flotar los 10 m del sector y se medía el tiempo), profundidad del agua (medida en varios puntos con una cinta métrica al cm más cercano) y presencia de playones o paredones a la orilla del río. Además se describieron características de la vegetación de las márgenes (abierta, semiabierta, semicerrada, cerrada).
El muestreo para los adultos inició a las 19:00 hr con una duración aproximada de 5 hr, cuando se encuentran sapos. A cada individuo se le midió la longitud hocico-ano (LHA, con una regla al mm más cercano), el sexo y si estaba en amplexo, se marcó (con corta de dedos, con combinaciones donde solo se cortó un dedo por extremidad y nunca el dedo pulgar de la mano) y se anotó el sector y la fecha, considerando toda la noche como parte del día anterior y se dejó donde se encontró. Los renacuajos se muestrearon de día y de noche. Se anotó si estaban dispersos o agrupados, en el segundo caso se contó el número de grupos en el sector. La Estación Meteorológica del Instituto Meteorológico Nacional más cercana y con datos en el periodo de estudio es Coto 47 (8 msnm, localizada a unos 25 km en línea recta del sitio de estudio), donde se obtuvo la información de temperatura, humedad relativa y precipitación.
Resultados
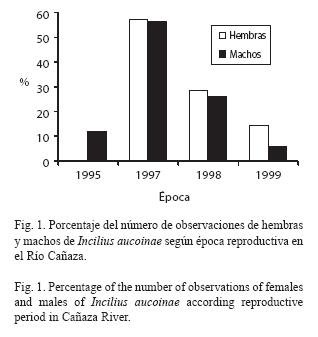
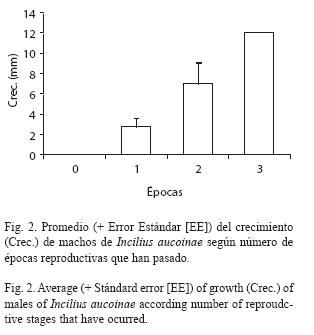
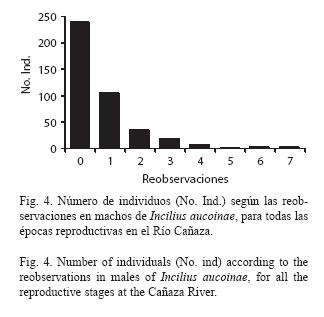
Durante todo el período de estudio, se observaron siete hembras y 443 machos adultos de I. aucoinae en el Río Cañaza con un total de 765 observaciones (315 reobservaciones de machos) y no se vio ningún juvenil. El número de observaciones de machos y hembras es proporcional entre las cuatro épocas reproductivas estudiadas (Fig. 1, G= 2.32, gl= 3, p=0.508, analizado con los conteos de individuos) con una relación de sexos de 63.3 machos por cada hembra. Las hembras son de mayor tamaño con un promedio de 91.1 mm (s= 7.5, ámbito= 78-99) y el de machos es de 61.3 mm (6.9, 40-78; t= 11.29, gl = 436, p<0.001). El crecimiento corporal de los machos sigue una relación exponencial con respecto al número de épocas reproductivas que han pasado (Fig. 2, F[3,323] = 104.56, p<0.001, analizado con transformación logarítmica de x+1). El máximo de crecimiento fue 9 mm cuando ha pasado una época y 20 cuando han pasado dos (dos individuos con tamaños iniciales de 50 y 57), el único individuo que se observó con tres épocas de diferencia creció 12 mm (LHA 54 mm al inicio), dentro de la misma época reproductiva la mayoría de las reobservaciones fueron sin crecimiento ( = 0.1, s = 0.4 mm, máximo = 4 mm). Uno de los machos marcados en los primeros muestreos de 1995 se recapturó en las épocas reproductivas de 1997, 1998 y 1999, es decir un total de cinco épocas reproductivas. El número de sectores que se mueven los machos entre observaciones tiene una distribución asimétrica, con una mayoría de observaciones en el mismo sector (Fig. 3), cuando el movimiento es de ocho o más sectores la frecuencia del número de observaciones se mantiene por debajo de 10 individuos. De las 765 observaciones solo 39 corresponden al afluente del río Cañaza (30 machos, 9 reobservaciones), siendo el sector cercano a la confluencia el que tuvo la mayoría (15); no se observaron hembras ni huevos y había pocos renacuajos; es por esto que de aquí en adelante no se considera el afluente en los análisis. Sin considerarlo hay un total de 306 re-observaciones de los machos (Fig. 4) para un máximo de siete con tres individuos, la mayoría (240) no se reobservaron, seguidos de los reobservados solo una vez (105).
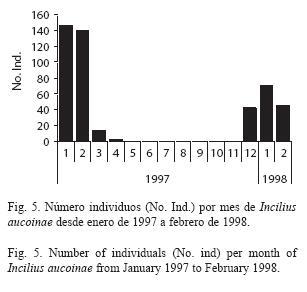
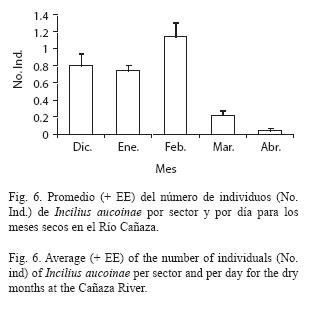
Los machos están presentes en el río sólo durante los meses secos del año (Fig. 5), siendo muy comunes de diciembre a febrero, con una disminución en marzo y abril y ausentes de mayo a noviembre. Se muestran sólo los datos desde enero de 1997 hasta febrero de 1998 por ser continuos, en enero de 1995 se observaron 53 machos, en 1998 no se muestreó en marzo pero de abril a diciembre no se encontró ningún individuo, finalmente en enero de 1999 se contabilizaron 40 machos. En 1998 los machos fueron más abundantes en enero, mientras que en 1997 el número de individuos fue similar en enero y febrero. Comparando el número de individuos observados mensualmente pero corrigiendo por el número de días de muestreo se encuentran diferencias significativas (x2= 550.37, gl= 13, p<0.001).
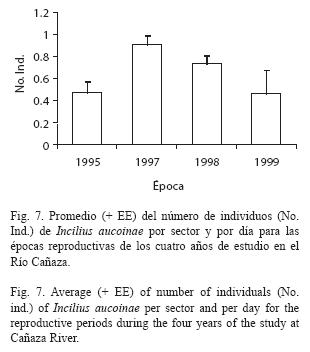
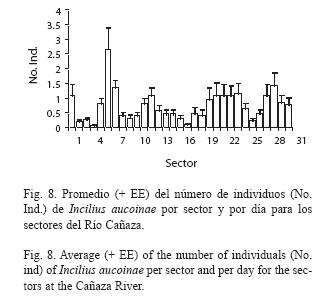
Para el promedio del número de machos por sector y día con los factores mes, año y sector; considerando solo la estación seca que es cuando hay actividad reproductiva, y siendo diciembre el inicio de la época reproductiva del año siguiente; se encuentra que existen diferencias significativas en los meses (Fig. 6, F[4,923]= 12.13, p<0.001), épocas reproductivas (Fig. 7, F[3,923]= 9.54, p<0.001) y sectores del río (Fig. 8, F[30,923]= 3.70, p<0.001). Marzo y abril son diferentes de diciembre, enero y febrero (Diferencia Mínima Significativa[DMS]:α 0.05), también febrero es a la vez diferente de todos los demás meses. Las cuatro épocas reproductivas estudiadas difieren en que la de 1997 tuvo más, mientras que 1995 tuvo menos, la de 1997 también difiere de las de 1998 y 1999 (DMS:α 0.05). Hay diferencias entre los sectores del río, el sector 6 es el que tuvo más individuos y el 4 el que tuvo menos.
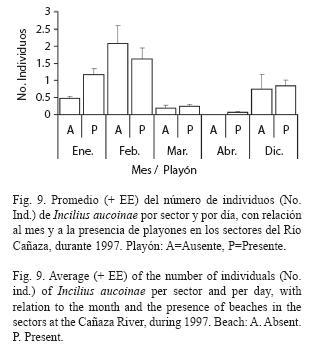
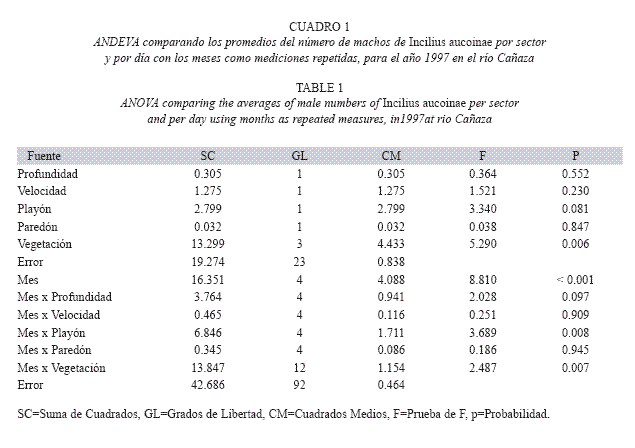
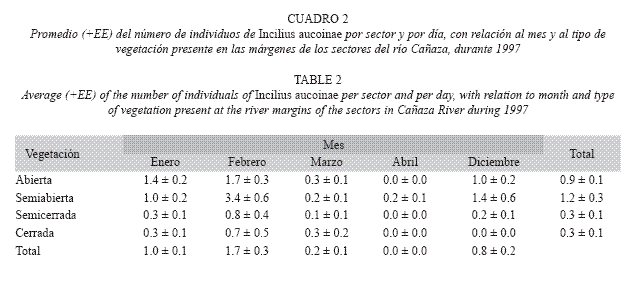
Al comparar el promedio del número de machos por sector y por día con los meses como mediciones repetidas y para 1997, el año en que se tiene información de vegetación, profundidad del río, velocidad de la corriente, presencia de playones y paredones; los efectos significativos son (Cuadro 1): vegetación y mes (Cuadro 2), y las interacciones de los factores playones (Fig. 9) y vegetación con el mes (Cuadro 2). La vegetación es el factor que más influye (Cuadro 2), la mayor cantidad de individuos se encontró en los sectores con vegetación semiabierta, seguidos de los de una condición abierta, los sectores con vegetación semicerrada o cerrada son lo que tienen menos individuos. La interacción de mes y vegetación se debe a que en diciembre, febrero y abril las abundancias de acuerdo a vegetación siguen el patrón descrito anteriormente, pero en enero es en vegetación abierta donde se da el máximo, mientras que en marzo esto ocurrió en la condición cerrada. La interacción del mes con la presencia de playones se debe a que en todos los meses, con excepción de febrero, la abundancia de machos fue mayor en los sectores donde había playones. En los 31 sectores del río se encontraron, en alguna de las cuatro fechas, al menos renacuajos de día o de noche, siendo solo el sector 3 el que nunca presentó en la noche, los sectores 4 y del 13-16 ocasionalmente no tuvieron. Es más frecuente encontrar renacuajos durante el día en algún sector (Día= 93.5%, Noche= 84.7%; Prueba exacta de Fisher p=0.040).
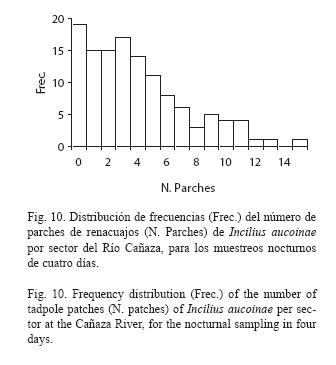
Durante el día todas las observaciones de renacuajos fueron dispersas, mientras que durante la noche los grupos se encontraban agregados a la orilla del río, encontrándose hasta 15 parches por sector y con una distribución asimétrica (Fig.10, = 4.0, s= 3.4 parches).
Discusión
La gran diferencia en la abundancia de machos/hembras en este estudio es característico de especies que se agregan en sitios reproductivos donde las hembras entran, encuentran pareja, ovipositan y se van (Duellman & Trueb 1986). La especie estudiada se reproduce en el río pero vive en las áreas de bosque y zonas alteradas circundantes a éste donde se encuentran tanto individuos adultos como juveniles (observación personal) y en los sitios reproductivos lo que se observan son principalmente machos cantando para atraer hembras, las que se presentan en muy poca abundancia. Ese patrón reproductivo es diferente al de especies que viven y se reproducen en los mismos sitios, que está bien documentado en especies muy territoriales como Oophaga pumilio (Donnelly 1989) y O. granulifera (Bolaños 1991) en las que se encuentran números equivalentes de machos y hembras. Pero no siempre esa relación de sexos es equitativa en la abundancia, Husting (1965) reporta que en Ambystoma maculatum hay más hembras que machos.
Se sabe que los metamorfos de esta especie miden 18 mm (observación personal) y aunque en este trabajo no se obtuvo información del tiempo en que se alcanza la madurez sexual, los datos muestran que por lo menos los machos pueden ser sexualmente activos a partir de los 40 mm, es decir cuando han crecido 22 mm a partir de su desarrollo a la vida terrestre. Es muy posible entonces que en esta especie la madurez sexual se alcance en el periodo que hay entre las dos épocas reproductivas y que se reproduzcan activamente ya en la siguiente como habita en gran cantidad de especies (Blair 1953, Zug & Zug 1979, Kluge 1981, Duellman & Trueb 1986).
El que se reobserven cerca de donde se vieron la última vez (Fig. 3) y que no se vean muchas veces (Fig. 4) hace pensar que se comportan parecido a C. marinus donde la población reproductiva de machos es establey se mantiene, aunque cada día se presente sólo una fracción de esa población (Evans et al. 1996). Con los datos obtenidos no se puede comprobar la longevidad de I. aucoinae, pero muy interesante es que por lo menos un macho se observó en todas las épocas reproductivas analizadas por lo que si se puede asegurar que por lo menos vive cinco épocas activo reproductivamente. Esto es mucho más de lo que se reporta Kluge (1981) en Hypsiboas rosenbergi la cual puede vivir hasta 3.5 años de vida en cautiverio pero en la naturaleza no hay machos que sobrevivan más de 2 años. Talvez esta gran diferencia se deba a que en términos generales los bufónidos tiene altos grados de toxicidad en su piel que les da un eficiente mecanismo de defensa ante depredadores (Flier et al. 1980).
La época reproductiva de este sapo es en la estación seca (Fig. 5 y 6) y están ausentes del río en los meses lluviosos. La actividad reproductiva de C. marinus coincide con la de este sapo y fueron observados reproduciéndose en los mismos sitios. En la transición entre la estación seca y la lluviosa con fuertes lluvias y con tormentas es cuando se reproducen I. fastidiosus (Lips & Krempels 1995), I. holdridgei (Novak & Robinson 1975) e I. periglenes (Jacobson & Vandenberg 1991) los que utilizan charcos estacionales pequeños. Mientras que otras especies se reproducen cuando las lluvias son permanentes, como R. haematiticu (McDiarmid & Altig 1989, Scott 1983), I. coccifer (McDiarmid & Foster 1981) e I. luetkenii (Köhler et al. 2000). La mayor abundancia habita en febrero mes con los valores más bajos de precipitación (73.8 mm) y la menor humedad relativa (79.3%). Al igual que esta especie muchas ranas y sapos que se reproducen en ríos lo hacen en la estación seca, ejemplos son Smilisca sordida y S. sila (Savage 2002, Bolaños 2003) que también comparten los mismos sitios con I. aucoinae.
Posiblemente el que la mayor abundancia del sapo se diera en sitos con vegetación semiabierta (Fig. 4) es comparable con la observación que Evans y otros (1996) realizan con C. marinus especie que utilizó solo algunas áreas potencialmente importantes como sitios de crianza y la preferencia por un cuerpo de agua estaba relacionada a la interacción de diversos factores y a la ubicación en un hábitat particular. Aunque aquí se hace un aporte grande al conocimiento de esta especie durante la época reproductiva, sigue siendo una especie de la que tenemos muy poca información. En la época no reproductiva se encuentra en la hojarasca del bosque (Savage 2002) pero nunca se le encuentra como una especie común (observación personal), también se dice que es una especie de dependencia a sitios poco alterados (ONeil & Mendelson 2004) aunque también se le observa en sitios relativamente alterados pero con bosque cercano (observación personal). El sitio estudiado aunque tiene bosque en muy buenas ondiciones erca, es realmente un sitio alterado con plantaciones de bambú y efectos importantes de visitantes. Posiblemente sí es la condición llana descrita por Savage (2002) en los sitios reproductivos pero este río, por lo menos en el área del estudio es poco rocoso con un sustrato dominado por grava. El que los renacuajos se encuentren dispersos durante el día y agrupados en la orilla durante la noche puede deberse a varios factores. Durante el día se dispersaban para alimentarse, comían perifiton en el sustrato (obs. pers., Umaña 2005). Mientras que en la noche sugerimos formaban agregaciones para defenderse de los depredadores. En la misma localidad se han realizado observaciones de que estos renacuajos son depredados principalmente por peces y langostinos (Umaña 2005) pero también se han observado cangrejos y aves utilizándolos como alimento. Las agrupaciones nocturnas ocurrían principalmente a la orilla, minimizando la exposición del grupo a depredadores acuáticos.
Agradecimientos
Agradecemos a José Manuel Mora y Gerardo Umaña por sus sugerencias certeras en esta investigación y las revisiones del manuscrito. Mauricio Vega, Guillermo Marín, Carlos Ugalde y Marianela Solís fueron clave como asistentes durante el trabajo de campo. Al Instituto Meteorológico Nacional por la información climática; y a Mahmood Sasa Marín por su exhaustiva y enriquecedora revisión del manuscrito.
Resumen
Se estudian algunos aspectos de la biología reproductiva del sapo Incilius aucoinae en una población en el río Cañaza, Golfito, Costa Rica; en una sección de 360 m aguas arriba dividida en 36 sectores de 10 m. La duración del estudio con adultos fue de cuatro años, con muestreos en enero de 1995, 1997, 1998 (excepto marzo) y enero de 1999; los renacuajos se estudiaron en cuatro días de 1997. Se marcaron 443 machos (con 315 reobservaciones) y 7 hembras (no fueron recapturadas). Un individuo fue recapturado en todos los periodos de estudio, lo que indica que por los menos sobreviven a 5 épocas reproductivas. La época reproductiva corresponde a los meses secos, de diciembre a abril. En la época reproductiva de 1997 se encontró más individuos y menos en 1995; el sector 6 es el que tiene más machos y el 4 menos; la mayor cantidad de machos se encontró en sectores con vegetación semiabierta, los sectores con mayor cobertura vegetal tienen menos; febrero es el mes con mayor abundancia de machos, con valores intermedios en diciembre y enero, y con muy pocos individuos en marzo y abril. En todos los meses, excepto febrero, la abundancia fue mayor donde había playones. Este sapo se reproduce en la época seca, y en el sitio reproductivo las hembras apenas entran a reproducirse. Se da una relación de sexos de casi solo machos, pues solo hubo 7 hembras observadas, y sorprende los cambios de distribución entre el día y la noche en los renacuajos.
Palabras clave: Incilius aucoinae, época reproductiva, población, proporción de sexos, fidelidad de sitio, Bufonidae, Costa Rica.
Recibido 18-X-2007. Corregido 10-X-2008. Aceptado 16-XI-2008.
Referencias
Bertram, B.C.R. 1978.Living in groups: predators and prey. p. 64-96. In J.R. Krebs & N.B. Davies. Behavioural Ecology an Evolutionary Approach. Blackwell Sci. Publ. Oxford, Inglaterra. [ Links ]
Berven, K.A. & T.A. Grudzien. 1990. Dispersal in the Wood frog (Rana sylvatica): implications for genetic population structure. Evolution 44: 2047-2056. [ Links ]
Blair, W. 1953. Growth, dispersal and age at sexual maturity of the Mexican toad (Bufo valliceps Weigmann). Copeia 1953: 208-212. [ Links ]
Blaustein, A.R. & R.K. O´Hara. 1987. Aggregation behavior in Rana cascadae tadpoles: Association preferences among wild aggregations and responses to nonkin. Anim. Behav. 35: 1549-1555. [ Links ]
Bolaños, F. 1991. Actividad de canto y territorialidad en Dendrobates granuliferus Taylor 1958. Tesis de Maestría. Sistema de Estudios de Posgrado. Universidad de Costa Rica. San José, Costa Rica. [ Links ]
Bolaños, F. 2003. Ciclos de vida de los anfibios, con énfasis en Costa Rica, p. 89-108. In R.A. Acuña (ed.). La biodiversidad. Universidad de Costa Rica, San José, Costa Rica. [ Links ]
Bolaños, F. 2005. Los Anfibios de Golfito, p. 181-192. In J. Lobo & F. Bolaños (eds.) Instituto Nacional de Biodiversidad. Heredia, Costa Rica. [ Links ]
Bowler, J.K. 1977. Longevity of reptiles and amphibians in North American collection. Soc. Stud. Amph. Rept. Herp. Circ. 6: 1-32. [ Links ]
Duellman, W.E. 1992. Reproductive strategies of frogs. Sci. Am. 267: 80-87. [ Links ]
Duellman, W.E. & L. Trueb. 1986. Biology of amphibians. McGraw Hill Book Company, EEUU. Donnelly, M.A. 1989. Effects of reproductive resource supplementation on space-use patterns in Dendrobates pumilio. Oecologia 81: 212-18. [ Links ]
Evans, M., C. Yaber & J. Hero. 1996. Factor influencing choice of breeding site by Bufo marinus in its natural habitat. Copeia 4: 04-912. [ Links ]
Flier, J., M.W. Edwards, J.W. Daly & C.W. Myers. 1980. Widespread occurrence in frogs and toads of skin compounds interacting with the ouabain site of NA+, K+ ATPase. Science 208: 503-505. [ Links ]
Hoff, K.S., A.R. Blaustein, R.W. McDiarmid & R. Altig. 1999. Interactions and their consequences. p. 215-239. R.W. In cDiarmid & R. Altig (eds.). Tadpoles: the Biology of Anuran Larvae. University of Chicago, Chicago, EEUU.
Husting, E.L. 1965. Survival and breeding structure in a population of Ambystoma maculatum. Copeia 1965: 352-362. [ Links ]
Jacobson, S.K. & J.J. Vandenberg. 1991. Reproductive ecology of the endangered Golden toad (Bufo periglenes). J. Herpetol. 25: 321-27. [ Links ]
Jorgensen, C.B. 1988. The role of endogenus factors in seasonal maturation in Temprate Zone female toads, Bufo bufo. J. Herpetol. 22: 295-300. [ Links ]
Kluge, A. 1981. The life history, social organization and parental behavior of Hyla rosenbergi Boulenger, a nest-building gladiator frog. Misc. Pub. Mus. Zool. Univ. Mich. 160: 1-170. [ Links ]
Köhler, G., E. Leer & J.R. McCraine. 2000. The tadpole of the Central American toad Bufo luetkenii Boulenger. J. Herpetol. 34: 303-306. [ Links ]
Lips, K.R. & D.M. Krempels. 1995. Eggs and tadpole of Bufo fastidiosus Cope, with comments on reproductive behavior. Copeia 1995: 741-746. [ Links ]
McDiarmid, R.W. & R. Altig. 1989. Description of a bufonid and two hylid tadpoles from western Ecuador. Alytes 8: 51- 60. [ Links ]
McDiarmid, R.W. & S. Foster. 1981. Breeding habits of the toad Bufo coccifer in Costa Rica, with a description of the tadpole. Southwest Nat. 26: 353-363. [ Links ]
Mendelson III, J.R., P.C. Ustach & A.N. Montes de Oca. 1999. Description of the tadpole of Bufo tutelarius, natural history notes on the Bufo valliceps group,and a key to the tadpoles of the group. J. Herpetol. 33: 324-328. [ Links ]
Metter, D.E. 1968. The influence of floods on population structure of Ascaphus truei Stejneger. J. Herpetol. 1: 105-106. [ Links ]
Novak, R.M. & D.C. Robinson. 1975. Observations on the reproduction and ecology of the tropical mountain toad, Bufo holdridgei Taylor in Costa Rica. Rev. Biol. Trop. 23: 213-237. [ Links ]
O´Neill, E.M. & J.R. Mendelson III. 2004. Taxonomy of Costa Rican toads referred to Bufo melanochlorus COPE, with the description of a new species. J. Herpetol. 38: 487-494. [ Links ]
Pough, F.H., R.M. Andrews, J.E. Cadle, M.L. Crump, A.H. Savitzky & K.D. Wells. 1998. Herpetology. PrenticeHall, Nueva Jersey, [ Links ] EEUU.
Pulliam, H.R & T. Caraco. 1978. Living in groups:Is there a optimal Group size? p. 122-147. In J.R. Krebs & N.B. Davies. Behavioural Ecology an Evolutionary Approach. Blackwell Sci. Publ.,Oxford, Inglaterra. [ Links ]
Savage, J.M. 2002. The Amphibians and Reptiles of Costa Rica: A Herpetofauna between Two Continents, between Two Seas. University of Chicago, Chicago, EEUU. [ Links ]
Scott, N.J. 1983. Bufo haematiticus (sapo, toad), p. 385. In D.H. Janzen (ed.). Costa Rican natural history. University of Chicago, Chicago, EEUU. [ Links ]
Scott, N.J. & S. Limerick. 1983. Reptiles and Amphibians, p. 351-367. In D.H. Janzen (ed.). Costa Rican natural history. University of Chicago, Chicago, EEUU. [ Links ]
Stebbins, R. & N. Cohen. 1995. A natural history of amphibians. Princeton University, Princeton, Nueva Jersey, EEUU. [ Links ]
Umaña, G. Los ríos de la cuenca del Golfo Dulce. p. 67-79.In J. Lobo y F. Bolaños (eds.) Instituto Nacional de Biodiversidad. Heredia, Costa Rica. [ Links ]
Waldman, B. 1982. Sibling association among schooling toad tadpoles: Field evidence and implications. Anim. Behav. 30: 700-713. [ Links ]
Wassersug, R.J. & C.M. Hessel. 1971. Tadpole behavior. Aggregation in larval Xenopus laevis. Anim. Behav. 19: 386-389. [ Links ]
Zug, G.R. & P.B. Zug. 1979. The marine toad, Bufo marinus: a natural history resume of native populations. Smithson. Contr. Zool. 284: 31-50. [ Links ]