Services on Demand
Journal
Article
Indicators
-
 Cited by SciELO
Cited by SciELO -
 Access statistics
Access statistics
Related links
-
 Similars in
SciELO
Similars in
SciELO  uBio
uBio
Share
Revista de Biología Tropical
On-line version ISSN 0034-7744Print version ISSN 0034-7744
Rev. biol. trop vol.57 n.1-2 San José Mar./Jun. 2009
Selectividad del zooplancton y solapamiento trófico entre tallas del pez Menidia humboldtiana (Atheriniformes: Atherinopsidae) en el embalse Danxhó, México
Regina Sánchez Merino, Miriam Y. Fermín Benítez & Angélica Mendoza Estrada
Facultad de Estudios Superiores Iztacala. Av. De los Barrios # 1 Los Reyes Iztacala, Tlalnepantla, estado de México, c.p. 54090 México; regmer14@yahoo.com.mx, miriamfermin@hotmail.com, efimerangie@yahoo.com.mx
Abstract: Selectivity of zooplankton and trophic overlap between size Menidia humboldtiana fish
(Atheriniformes: Atherinopsidae) in the reservoir Danxhó, Mexico. The Menidia humboldtiana silverside is considered one of the most important species in fisheries in some states of Mexico. Knowing the choice that this species exercises over its food gives us an understanding of the behavior of zooplankton in presence of zooplanktonic fish, and tells us if the silverside choose amongst bigger prey fish, and if there is competition for food between the native and introduced fish in the reservoir. The purpose of this study was to determine if M. humboldtiana selects its food, and in which genera, and to establish whether there was an overlap in the diet of the different sizes of silverside. The fish were catched with a 88 mm mesh net, in six sampling points during one year, from Danxhó (19°5´17" – 53´46" N, 99° 32´42" – 35´40" W) reservoir. Samples of filtered zooplankton were also taken with a 125 micron net. The analysis of stomach contents was carried out in fish grouped by regular size intervals during each season of the year, using the volumetric method and Chessons selectivity coefficient. To evaluate the trophic overlap between the different size groups, the Morisita index, modified by Horn, was used. The zooplankton community was represented by twelve genera: Mastigodiaptomus and Cyclops (Copepoda); Bosmina, Diaphanosoma, Daphnia, Ceriodaphnia, Moina, Alonopsis and Camptocercus, (Cladocera); Asplanchna, Conochillus and Filinia (Rotifera). Mastigodiaptomus was the most abundant throughout the year. The silverside consumed only four genera: Bosmina, Mastigodiaptomus, Daphnia and Ceriodaphnia; the group measuring 5 to 8.9 cm consumed a high percentage of Bosmina, Mastigodiaptomus and Daphnia, and a lesser percentage of Ceriodaphnia. The larger fish (9 to 10.9 cm) consumed only Mastigodiaptomus and Daphnia. In accordance with the selectivity values, the small and medium size silverside selected their prey, with more intensity on the genera Bosmina and Daphnia, while the bigger fish concentrated on Daphnia and Mastigodiaptomus. During spring, the silverside between 3 to 8.9 cm showed overlap in diet; in summer the bigger size group (7-10.9 cm) showed the overlap. In autumm the overlap ocurred in all sizes, and in winter it was shown only in the medium size fish (5-8.9 cm). Rev. Biol. Trop. 57 (1-2): 187-194. Epub 2009 June 30.
Key words: Menidia, Atherinopsidae, charal, artificial lake, silverside, food selectivity.
El charal Menidia humboldtiana pertenece a la familia Atherinopsidae (Millar 2005) y es característico de la Meseta central Mexicana, esta especie, y en general los charales, tienen gran importancia al mantener una fuerte industria pesquera en el estado de Michoacán (Rojas 2006).
Las variaciones alimentarias desde un punto de vista ontogénico, y la selectividad que puedan ejercer los peces sobre su alimento, suelen relacionarse con alteraciones en las condiciones ambientales o con los requerimientos energéticos de los individuos (Vilchis 2000). Estas variaciones y selectividad involucran cambios en el tamaño y tipo de presas consumidas, así como un aumento en las cantidades de alimento ingerido, lo cual es de gran importancia para comprender el comportamiento de las poblaciones del zooplancton en presencia de peces zooplanctófagos. Al respecto Brooks y Dodson (1965), Wells (1970) y vanderploeg y Scavia (1979b), mencionan que al existir un gran número de peces zooplanctófagos en sistemas naturales, disminuyen sensiblemente las poblaciones del zooplancton de tallas grandes a la vez que propician un aumento en el fitoplancton. Por el contrario, si la abundancia de estos peces es baja, aumentan las poblaciones de zooplancton de tallas grandes, disminuyendo con ello el fitoplancton, a la vez que se da una acumulación de nutrimentos. Se ha demostrado una selectividad de estos peces por determinadas tallas de presa, lo que hace que exista una estrecha relación entre el zooplancton de tamaño grande con la presencia de los mismos. El conocimiento generado por este tipo de estudios ha sido empleado para llevar a cabo la biomanipulación de tramas tróficas en lagos (Shapiro y Wright 1984). Asimismo, nos permite entender el comportamiento de los peces nativos en los cuerpos de agua en los que se han realizado introducciones de peces exóticos, y que en muchos casos compiten por el alimento en alguna etapa de su vida. (Navarrete y Sánchez 1991).
Finalmente, se podrían plantear estrategias adecuadas para su cultivo, si se considera el alimento vivo que se suministre en las diferentes etapas del desarrollo de los charales, de ahí que el objetivo de este trabajo fue determinar si el charal Menidia humboldtiana selecciona su alimento, y si es así, sobre qué géneros la realiza, y establecer si existe traslape en la dieta entre las diferentes tallas del charal.
Materiales y métodos
El presente estudio se realizó en el embalse Danxhó localizado entre los 19º5117"-5346" N y los 99º3242"-3540" W, a una altura de 2 560 msnm con una extensión de 3.96 km2. El clima de la zona, según Köppen modificado por García (1973), es el más húmedo de los templados subhúmedos.
En el embalse se establecieron seis estaciones de muestreo con base a sus características, en cada una se obtuvo una muestra de zooplancton por medio del filtrado de 10 l de agua a través de una red de 125 µm de abertura de malla que posteriormente fue fijada con formol al 4% (Gaviño et al. 1982).
Para recolectar los peces se utilizó un chinchorro de 8 mm de luz de malla, los charales fueron fijados con formol al 10% para detener los procesos digestivos.
El zooplancton fue determinado a nivel genérico mediante las claves de Pennak (1989) y Dussart y Defaye (1995), y se registró el número de organismos (por unidad de volumen) para cada género.
Para el análisis de los contenidos estomacales se agruparon los peces en intervalos de longitud estándar para cada época del año. La determinación de los grupos presentes en los contenidos se realizó a nivel de género con las claves antes mencionadas. El método utilizado para el análisis de los contenidos estomacales fue el volumétrico propuesto por Laevastu (1971), y el coeficiente de selección fue de acuerdo a Chesson (1978, 1983), el cual relaciona la proporción de la presa en la dieta, su contraparte en el ambiente, y el número total de tipos de presa. Para evaluar el traslape trófico entre las tallas, se utilizó el índice de Morisita modificado por Horn (Arcifa et al. 1991).
Resultados
La comunidad zooplanctónica estuvo representada por doce géneros de los cuales Mastigodiaptomus (Copepoda) fue el más abundante en las cuatro épocas del año (3 774-6 668 org/10 l), seguido de Bosmina y Diaphanosoma (Cladocera) que registraron abundancias máximas de 2 247 org/10 l y 877 org/10 l respectivamente (Cuadro 1). Los demás géneros presentaron máximas abundancias menores a los 700 org/10 l; Daphnia, Ceriodaphnia (Cladocera) 610 org/10 l y 476 org/10 l respectivamente; Asplanchna (Rotifera) 445 org/10 l; Conochillus (Rotifera) 220 org/10 l; Cyclops (Copepoda) 292 org/10 l; Moina, Alonopsis y Camptocercus (Cladocera) 43 org/10 l, 25 org/10 l y ocho org/10 l respectivamente, y Filinia (Rotifera) 25 org/10 l. De los doce géneros encontrados en el embalse solo Bosmina, Mastigodiaptomus, Daphnia y Ceriodaphnia fueron consumidos por los charales.
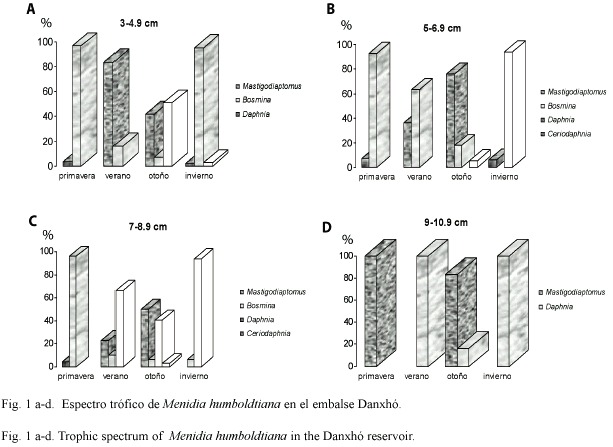
Se analizó un total de 1 200 charales, los peces pequeños de 3-4.9 cm de longitud consumieron altos porcentajes de Bosmina en primavera e invierno (96.6 y 95.01% respectivamente), Mastigodiaptomus fue consumido en forma importante en verano (83.66%), y Daphnia en otoño contribuyendo con un 50.99% a la dieta (Fig. 1a).
Los charales de 5-6.9 cm (Fig. 1b) consumen a Bosmina en primavera (92.76%), y en verano (63.51%), a diferencia del otoño, cuando ingieren a Mastigodiaptomus (76.14%), y en invierno a Daphnia (93.61%).
El género Daphnia fue consumido en verano e invierno (66.56 y 93.84% respectivamente) por los peces de 7-8.9 cm; Bosmina (95.8%) en primavera, y Mastigodiaptomus (50.03 %) en otoño (Fig. 1c).
Los charales más grandes (9-10.9 cm) solo consumen a Mastigodiaptomus en primavera y otoño (100 y 83.66% respectivamente), y a Daphnia (100 %) en verano e invierno (Fig. 1d).
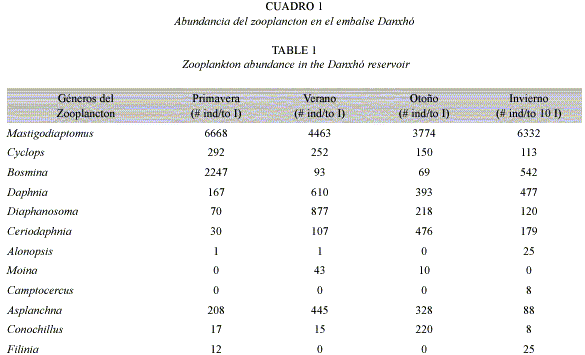
Con respecto a la selectividad de Menidia humboldtiana podemos observar en primavera que el género Bosmina (Fig. 2a) fue seleccionado por los peces de 3 a 8.9 cm, y Mastigodiaptomus por los charales de 9-10.9 cm. En verano la selección de los charales recae sobre Bosmina (3-8.9 cm), Daphnia por los peces de 7-8.9 cm, y Mastigodiaptomus por los grandes (9-10.9 cm) (Fig. 2b). Para el otoño las tallas de 3-4.9 cm y 7-8.9 cm seleccionaron a Daphnia y Bosmina, los charales de 5-6.9 cm de longitud solo seleccionaron a Bosmina, y Mastigodiaptomus fue seleccionado solo por los charales grandes (Fig. 2c). Finalmente para el invierno el género más seleccionado fue Daphnia, por los charales de 5 a 10.9 cm, y Bosmina por las tallas pequeñas (3-4.9 cm) (Fig. 2d).
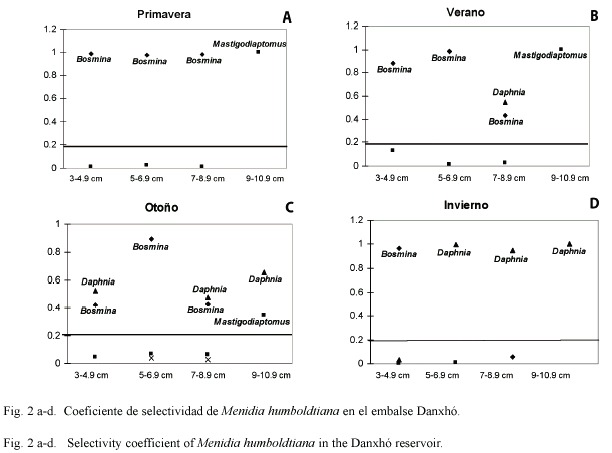
Con respecto al traslape entre las tallas del charal en las diferentes épocas del año (Fig. 3), se observó en primavera un marcado traslape 0.99 (considerando que el índice de Morisita va de cero hasta uno cuando hay traslape total) entre los intervalos de tallas de 3-8.9 cm, a diferencia del verano cuando las tallas grandes (7-10.9 cm) fueron las que traslaparon sus dietas (0.8834). En otoño el traslape se dio en todas las tallas con valores superiores a 0.736, y finalmente en el invierno solo las tallas de 5-8.9 cm presentaron traslape (0.99).
Discusión
Al notar la amplitud en su dieta, puede considerarse al charal Menidia humboldtiana como un especialista (Hyslop 1980), ya que consume pocos tipos de presa. De los doce géneros de zooplancton existentes en el ambiente, éste consumió solo cuatro, lo que se puede explicar si se toma en cuenta que la ictiofauna en el embalse estuvo representada por Cyprinus carpio, Carassius auratus y Algansea tincella, que registraron abundancias elevadas y que son especies que consumen organismos zooplanctónicos en las primeras etapas de su desarrollo (Navarrete y Sánchez 1991).
Al comparar la composición de los grupos alimentarios en la dieta de Menidia humboldtiana con la disponibilidad de las presas en el ambiente, se observan preferencias alimentarias (Hyslop 1980) sobre los géneros Bosmina, Daphnia y Mastigodiaptomus, y se da una diferenciación de las mismas con relación a los diferentes intervalos de longitud; así los aterínidos de 3-4.9 cm ingieren preferentemente a Bosmina en primavera e invierno concordando con sus máximas abundancias en el ambiente. Para el verano el alimento principal fue el copépodo Mastigodiaptomus, y es importante mencionar que si bien en esta época no se registró la máxima abundancia del mismo, éste sin embargo fue el género más abundante durante las cuatro épocas del año. Finalmente en el otoño comparten importancia en los contenidos Daphnia y Mastigodiaptomus.
Para las tallas intermedias (5-6.9 cm) el componente principal en primavera y verano fue Bosmina; Mastigodiaptomus en otoño, y Daphnia en invierno. Los charales de 7-8.9 cm de longitud se alimentaron en mayor proporción del género Daphnia en verano, otoño e invierno. Cabe mencionar que si bien Daphnia no registró elevadas abundancias en el ambiente en estas épocas (5.06-7.54% del zooplancton), sí contribuye con buenos porcentajes a la dieta de los charales, a diferencia de la primavera cuando el género mas importante en los contenidos estomacales fue Bosmina, coincidiendo con la máxima abundancia del bosmínido en el ambiente.
Los charales más grandes de 9-10.9 cm ingieren solo dos géneros, Mastigodiaptomus en primavera y otoño, y Daphnia en verano e invierno. Es importante remarcar que las tallas pequeñas e intermedias consumen preferentemente a Bosmina, que es sustituida por Daphnia en las tallas grandes. Además, hay una disminución en el número de géneros zooplanctónicos ingeridos por estas últimas, observado que existe una relación aparente entre el tipo y cantidad de presas consumidas y las diferentes tallas del pez (Wootton 1992). Esta alimentación diferencial que presenta el aterínido es una estrategia mediante la cual se disminuye la competencia intraespecífica que se da entre los organismos de una población (Krebs 1985). Estos resultados concuerdan con los reportados por Navarrete y Cházaro (1992).
M. humboldtiana es un depredador selectivo positivo ya que consume mayores proporciones que las correspondientes en el ambiente sobre el género Bosmina (por las tallas de 3-8.9 cm en las cuatro épocas del año), y Daphnia (por los charales de 3-10.9 cm en verano, otoño e invierno). Es importante mencionar que a pesar del amplio intervalo de tallas que seleccionan a estos géneros, se observa por los valores de selección, que los peces pequeños seleccionan de manera más intensa al género Bosmina, las tallas intermedias a ambos géneros, y las tallas grandes la realizan más sobre Daphnia. Este mismo comportamiento fue observado en Chirostoma jordani, por Navarrete et al. 1996. La selectividad sobre los cladóceros, y en especial sobre estos géneros, se ha tratado de explicar con base en características como la presencia de un ojo compuesto relativamente grande en relación a su cabeza, de color rojo intenso, que los hace más visibles para el depredador (Zaret 1972, Zaret y Kerfoot 1975, Saegror et al. 1996). De igual manera el tamaño y los movimientos lentos y regulares que presentan en general los cladóceros propician una mayor vulnerabilidad de los mismos (OBrien 1979, Vinyard 1980, Li et al. 1985). Otras características que presentan en especial las dafnias son un intestino que contrasta con el resto del medio (vinyard y OBrien 1975), y su tamaño relativamente grande. Al respecto Brooks y Dodson (1965) y Galbraith (1967) consideran que un organismo de talla grande propiciará una mayor detectabilidad del mismo, ésta será proporcional al tamaño del propio organismo (Werner y Hall 1974, OBrien 1979) operando de esta manera una selectividad por tallas. Es importante mencionar que es muy probable que este tipo de selectividad la estén llevando a cabo las tallas grandes sobre el género Mastigodiaptomus y Daphnia. Clements y Livingston (1984), afirman que la vulnerabilidad de una especie a la depredación está en función de su detectabilidad y facilidad de captura, y que dependen de su morfología, comportamiento y distribución en el microhábitat. Por su parte, Wootton (1992), sugiere que la dieta de un animal es el resultado de algunas causas como su capacidad para obtener presas, la disponibilidad de las mismas en el ambiente o las necesidades energéticas. Y han observado que existe una relación aparente entre el tipo y cantidad de presas consumidas y las diferentes tallas del pez.
Resumen
El charal Menidia humboldtiana es considerado como una de las especies de gran importancia en la industria pesquera de algunos estados de México. Es necesario conocer el efecto que esta especie ejerce sobre su alimento para saber si seleccionan las presas de mayor talla, si hay competencia por el alimento entre especies nativas e introducidas, y para comprender el comportamiento del zooplancton ante peces zooplanctófagos. Se determinó si M. humboldtiana selecciona su alimento, sobre qué géneros lo hace, y si existe traslape en la dieta entre las diferentes tallas. Los peces se recolectaron por medio de un chinchorro de 88 mm de abertura de malla, en seis estaciones de muestreo durante un año, en el embalse Danxhó, y una muestra de zooplancton fue recolectada por filtrado con una red de 125 µm. El análisis de los contenidos estomacales se realizó en peces agrupados en intervalos de longitud estándar para cada época del año, por medio del método volumétrico. Para evaluar el traslape trófico entre los diferentes intervalos de longitud, se utilizó el índice de Morisita modificado por Horn. El zooplancton estuvo representado por doce géneros: Mastigodiaptomus y Cyclops (Copepoda); Bosmina, Diaphanosoma, Daphnia, Ceriodaphnia, Moina, Alonopsis y Camptocercus (Cladocera); Asplanchna, Conochillus y Filinia (Rotifera). Durante la primavera, los charales de 3-8.9 cm presentaron un marcado traslape, para el verano fueron los grandes (7-10.9 cm), en otoño el traslape fue en todas las tallas, y en invierno solo las tallas intermedias (5-8.9 cm) lo presentaron.
Palabras clave: Menidia, Atherinopsidae, charal, lago artificial, selectividad alimentaria.
Referencias
Arcifa, M.S., T.G. Norticote & O. Froehlich. 1991. Interactive ecology of two cohabiting characin fisher (Astyanax fasciatus and Astyanax bimaculatus) in a eutrophic Brazilian reservoir. J. Trop. Ecol. 7: 257-268. [ Links ]
Brooks, J.L. & S.I. Dodson. 1965. Predation body size and competition of plankton. Science 150: 28-35. [ Links ]
Clements, H.W. & R.J. Livingston. 1984. Prey selectivity of the fringed filefish Monacanthus ciliatus (Pisces:Monacanthidae): role of prey accessibility. Mar. Ecol. Prog. Ser. 16:291-295. [ Links ]
Chesson, J. 1978. Measuring preference in selective predation. Ecology 59: 211-215. [ Links ]
Chesson, J. 1983. The estimation and analysis of preference and its relationship to foraging models. Ecology 64: 1297-1304. [ Links ]
Dussart, B. & D. Defaye. 1995. Guides to the identification of the microinvertebrates of the continental waters of the World : Introduction to the Copepoda. Academic, Londres, Inglaterra. 277 p. [ Links ]
Galbraith, M.G. 1967. Size-selective predation on Daphnia by rainbow trout and yellow perch. Trans. Am Fish. Soc. 96: 1-10. [ Links ]
García, E. 1973. Modificación del sistema de clasificación (adaptado a las condiciones de la República Mexicana). Instituto de Geografía, UNAM, México. 357 p. [ Links ]
Gaviño, G., J.C. Juárez & H.H. Figueroa. 1982. Técnicas biológicas selectas de laboratorio y de campo. Limusa, México. 251 p. [ Links ]
Hyslop, E.J. 1980. Stomach contents analysis. A review of methods and their application. J. Fish Biol. 17: 411-429. [ Links ]
Krebs, M.E. 1985. Ecología estudio sobre la distribución y abundancia. Harla, México. 369 p. [ Links ]
Laevastu, T. 1971. Manual de métodos de biología pesquera. Acribia, España. 250 p. [ Links ]
Li, K.T., J.K. Wetterer & N.G. Hairston. 1985. Fish size, visual resolution, and prey selectivity. J. Ecology. 66: 1729-1735. [ Links ]
Millar, R.R. 2005. Freshwater fishes of Mexico. University of Chicago, Chicago, EEUU. 490 p. [ Links ]
Navarrete, S.N. & R. Sánchez. 1991. Variaciones alimenticias de los peces del embalse Danxhó, en tres épocas del año. (Resumen).II Congreso Nacional de Ictiología.Monterrey, Nuevo León, México.2-50 p. [ Links ]
Navarrete, S.N. & S. Cházaro. 1992 Espectro trófico del charal Chirostoma humboldtianum del embalse San Felipe Tiacaque, Estado de México. Revista de Zoología. ENEPI, UNAM, México, D.F., México. 3: 28-34. [ Links ]
Navarrete, S.N., R. Sánchez & M.L. Rojas. 1996. Selección del zooplancton por el charal Chirostoma jordani (Atheriniformes:Atherinidae). Rev. Biol. Trop. 2: 757-761. [ Links ]
OBrien, W.L. 1979. The predator prey interaction of plaktivorous fish and zooplankton. Am. Scien. 67: 572-581. [ Links ]
Pennak, R.W. 1989. Freshwater invertebrates of the United States. Wiley, Nueva York, Nueva York, EEUU. 803 p. [ Links ]
Rojas, C.P. 2006. Aspectos reproductivos del "charal prieto" Chirostoma attenuatum (Meek, 1902) del lago de Pátzcuaro, Michoacán. Nuevas líneas de investigación en atherinópsidos de México. Hidrobiológica. 1: 1-9. [ Links ]
Saegror, H., A. Hobaek & J.H. LAbee-Lund. 1996. Vulnerability of melanic Daphnia to brown trout predation. J. Plankton 18: 2113-2118. [ Links ]
Shapiro, J. & D.I. Wrigth. 1984. Lake restoration by biomanipulation: Round lake, Minesota the first two years. Freshwater Biol. 14: 371-378. [ Links ]
Vanderploeg, H.A. & D. Scavia. 1979b. Two selectivity indices for feeding with special reference to zooplankton grazing. J. Fish. Res. Board Can. 36: 362-365. [ Links ]
Vilchis, M.O. 2000. Modelos nulos en interacciones biológicas, una propuesta: depredación en Chirostoma riojai-zooplancton. Ciencia Ergo Sum. 7:153-156. [ Links ]
Vinyard, G.L. 1980. Differential prey vulnerability and predator selectivity: effects of evasive prey an bluegill (Lepomis macrochirus) and pumpkinseed (L. gibbosus) predation. J. Fish. Aquat. Sci. 37: 2294-2299. [ Links ]
Vinyard, G.L. & W.J. OBrien. 1975. Dorsal ligth response as a index of prey preference in bluegill (Lepomis macrochir). J. Fish. Res. 32: 1860-1863. [ Links ]
Wells, L. 1970. Effects of alewife predation on zooplankton populations in lake Michigan. Limnology 15: 556-565. [ Links ]
Werner, E.E. & D.J. Hall. 1974. Optimal foraging and the size selection of prey by the bluegill sunfish (Lepomis macrochirus). Ecology 55: 1042-1052. [ Links ]
Wootton, R. 1992. Fish ecology. Blackie, Nueva York, EEUU.. 212 p. [ Links ]
Zaret, T.M. 1972. Predator, invisible prey and the nature of polimorphism in the cladoceras (Class Crustacea). Limnology. 17: 171-184. [ Links ]
Zaret, T.M. & W.C. Kerfoot. 1975. Fish predation on Bosmina longirostris, body size selection versus visibility selection planktivores. Ecology. 56: 232-237. [ Links ]