Services on Demand
Journal
Article
Indicators
-
 Cited by SciELO
Cited by SciELO -
 Access statistics
Access statistics
Related links
-
 Similars in
SciELO
Similars in
SciELO  uBio
uBio
Share
Revista de Biología Tropical
On-line version ISSN 0034-7744Print version ISSN 0034-7744
Rev. biol. trop vol.57 n.1-2 San José Mar./Jun. 2009
Nivia J. Ríos Carrera1, Misael Chinchilla Carmona1, 2, Olga M. Guerrero1 & Alfredo Castro Castillo1
1. Departamento de Parasitología, Facultad de Microbiología, Universidad de Costa Rica.
2. Departamento de Investigación y Cátedra de Parasitología, Universidad de Ciencias Médicas (UCIMED). De la Pops Sabana Oeste 400 mts Oeste, San José, Costa Rica. Tel (506) 231-0332, Fax: (506) 231-4368.
Correos: (N. Ríos) toxogondii@gmail.com, (M. Chinchilla) chinchillacm@ucimed.com; (O. Guerrero) abriceno@racsa.co.cr; (A. Castro) alfredo.castro@cariari.ucr.ac.cr
Abstract: The immunosuppressant effect of T. lewisi (Kinetoplastidae) infection on the multiplication of Toxoplasma gondii (Sarcocystidae) on alveolar and peritoneal macrophages of the white rat. The immunosuppressant effect of T. lewisi infection on the multiplication of T. gondii was compared in peritoneal (MP) and alveolar macrophages (MA) of white rat. Two animal groups were infected with T. lewisi and sacrificed after four days and seven days post infection. A group without infection was maintained as a control. The number of intracellular parasites (tachyzoites) (IT) was counted by light microscopy, calculating the rate infection rate per 100 total cells (TC) and per infected cells (IC) for each group of phagocyte cells. The relation quotient IT, TC or IC multiplied percent, provided a statistical ratio (RE) of the relative number of parasites in both cellular types for each time interval. MA as well as MP obtained after 4 days showed a significant increase in the multiplication of T. gondii with respect to the control. Unlike the MP (which had an increase in the multiplication of T. gondii the fourth day of infection with T. lewisi diminishing towards the seventh day), the MA had an increase in the multiplication of the parasite from the fourth to the seventh day. This difference can be related to the route of infection used for the experiments, that affect the MP directly with a greater effect in comparison with the MA of the lungs. Lung compartment will be affected later, when the infection becomes systemic between the fourth and sixth day of infection. The immunity against T. gondii is similar between both phagocytes, but the time of infection and the compartment where the cells are located, makes the difference in the response time against T. gondii. Supernatants from macrophage cultures or T. lewisi by rat did not induced any immunosuppression. Rev. Biol. Trop. 57 (1-2): 13-22. Epub 2009 June 30.
Key words: Toxoplasma gondii, Trypanosoma lewisi, alveolar macrophages, peritoneal macrophages, immunosupression.
Toxoplasma gondii es un parásito intracelular obligado, como todos los miembros del phylum Apicomplexa (Morrisette y Sibley 2002). Este parásito es reconocido como un patógeno oportunista por producir una enfermedad diseminada fulminante en hospederos inmunosupresos (Ryning y Remington 1977). Probablemente es el protozoario que con más frecuencia produce infección en el ser humano ya que la mitad de la población mundial posee anticuerpos contra este parásito (Black et al. 2000, Sibley 2003). Usualmente, la infección con T. gondii es asintomática en hospederos inmunocompetentes, pero en individuos inmunodeficientes en especial pacientes con el síndrome de inmunodeficiencia adquirida (SIDA), personas con transplantes de órganos o niños infectados en el útero de la madre, pueden presentar la enfermedad produciéndose en ellos, encefalitis toxoplásmica y la triada de Sabin y Felman, caracterizada por retinocoroiditis, hidrocefalia y calcificaciones cerebrales, entre otras manifestaciones (Carruthers y Silbley 1997, Carruthers 2002).
Modelos animales y modelos en cultivo celular, son importantes en la investigación de T. gondii, ya que por implicaciones éticas no se realizan estudios con seres humanos. La rata blanca, ha sido utilizada como modelo satisfactorio para reproducir la infección de T. gondii en humanos, debido a la similitud en su infección clínica y a la resistencia natural de ambos hospederos intermediarios contra este parásito (Chinchilla et al. 1982, Dubey y Frenkel 1998). A diferencia del ratón, la rata blanca resiste la infección aguda del parásito, desarrollándose en ellas una infección crónica en donde el papel de diferentes células implicadas en la respuesta inmune como los linfocitos CD4+ y CD8+ (Denker et al. 1993, Denker 1999), las células NK (Denker y Sher 1997, Nakano et al. 2002; Korbel et al. 2004), las células microgliales (Suzuki et al. 2005) y los macrófagos, (McCabe y Remington 1986, Catarinella et al. 1999, Chinchilla et al. 2004) pueden ser estudiados.
Mecanismos efectores de la respuesta inmune iguales a los observados en el ser humano contra la infección de parásitos como Schistosoma mansoni y T. gondii han sido ampliamente demostrados en ratas (Capron y Capron 1986, Dubey y Frenkel 1998).
Estudios previos describen el incremento en la multiplicación de T. gondii en macrófagos peritoneales obtenidos de ratas infectadas previamente con T. lewisi, lo que indica una fuerte inmunosupresión que altera la resistencia natural de la rata contra este parásito, principalmente entre los días cuarto y quinto después de la infección (Guerrero et al. 1997, Catarinella et al. 1999, Chinchilla et al. 2004). Este modelo ha sido empleado para medir el efecto de macrófagos alveolares contra Cryptococcus neoformans, demostrándose que T. lewisi causa efectos inmunosupresores transitorios sobre la actividad de macrófagos alveolares contra este hongo, sugiriendo el uso de este modelo para estudiar nuevas terapias contra este organismo (Gross et al. 2006).
El presente estudio pretende comparar la multiplicación de T. gondii entre macrófagos peritoneales y alveolares en el modelo de inmunosupresión con T. lewisi.
Materiales y métodos
Animales
Ratas machos de la cepa WISTAR Hannover (HsdBrlHan: WIST), con peso corporal entre 300-350 g fueron utilizados como fuente de macrófagos.
Ratones de la cepa NGP (25-35 g de peso corporal) se utilizaron para obtener taquizoitos de T. gondii para las infecciones experimentales.
Parásitos
Taquizoitos de la cepa RH de T. gondii (5174 genotipo I, American Type Culture Collection) fueron obtenidos a partir de exudados peritoneales de ratones y contados en la cámara de Neubauer ajustando la concentración de parásitos a 107 organismos por mL.
Tripomastigotos de la cepa TL2 de T. lewisi (aislada en Costa Rica en 1977 de una rata gris, Rattus norvergicus) son obtenidos por sangrado de ratas Sprague-Dawley en donde es mantenida la cepa por pasajes semanales.
Inoculación de animales
Las ratas se separaron en tres grupos, cada uno de tres animales. El primero y segundo se inocularon intraperitonealmente (ip) con T. lewisi, 106 tripomastigotos a los 7 días y 4 días antes de ser sacrificados; el tercer grupo no se infectó con T. lewisi. Una vez sacrificados todos los animales, se extrajeron los macrófagos alveolares y peritoneales.
Todos los experimentos se repitieron tres veces de tal manera que al final el estudio se realizó con nueve ratas por grupo. Sin embargo, se realizaron experimentos aparte para garantizar la reproducibilidad del modelo.
Obtención de macrófagos peritoneales
Las ratas fueron sacrificadas usando una sobredosis de pentobarbital sódico (60 mg/ml) y luego se utilizó la metodología descrita por Chinchilla et al (1982), en donde el exudado peritoneal fue obtenido utilizando el medio mínimo esencial Eagle (MEM) suplementado con 20% de suero fetal bovino (SFB), penicilina 100 U/ml y Streptomicina 100 µg/ml. La suspensión de macrófagos peritoneales (MP) fue concentrada por centrifugación y las células se contaron en una cámara de Neubauer y se ajustó la concentración a 105 células por ml.
Obtención de macrófagos alveolares
A la rata utilizada para la obtención de MP se le practicó una incisión en el área abdominal; la aorta abdominal y la vena cava inferior fueron cortadas, para drenar la mayor cantidad de sangre desde el espacio intravascular. La tráquea fue expuesta y liberada del tejido conectivo y el tórax se abrió para permitir la máxima expansión de los pulmones. La tráquea fue cerrada en la parte superior con una pinza hemostática para prevenir el reflujo a través de la misma y una aguja estéril número 20 fue insertada lavando las cavidades pulmonares cinco veces por inyección de 5 mL de solución salina balanceada de Hanks estéril (HBSS) a 4°C. El líquido aspirado, en su mayoría macrófagos alveolares (MA), fue mantenido en baño de hielo, centrifugado, resuspendido en MEM con 20% SFB y las células contadas en una cámara de Neubauer con un ajuste de la concentración a 105 células por ml.
Modelo general de experimentación
Las células obtenidas (MA y MP) fueron sembradas en cubreobjetos #1 estériles e incubadas a una temperatura de 37°C (5% CO2, 95% O) con 90% de humedad relativa durante una hora. Pasado este período, los macrófagos adheridos se infectaron con taquizoitos de T. gondii en relación 10:1 (taquizoitos: macrófago) y los cubreobjetos se incubaron bajo las mismas condiciones de temperatura y humedad descritas antes. Después de 1, 24 y 48 horas de la infección se sacaron dos cubreobjetos de cada uno de los períodos, se introdujeron en metanol para que las células se fijaran y posteriormente se tiñeron con Giemsa por 8 minutos.
El número de taquizoitos intracelulares (TI) fue contado para establecer una relación de 100 células totales (CT) y 100 células infectadas (CI) usando un microscopio de luz a una magnificación de 100X. Este cociente de relación es una razón estadística (RE) de la tasa de multiplicación del parásito para cada intervalo de tiempo. (Chinchilla y Frenkel 1978, Reyes y Chinchilla 1987)
RET = TI / CT x 100
REI = TI / CI x 100
RE
Efecto del sobrenadante obtenido de la extracción de macrófagos peritoneales aislados de ratas infectadas con T. lewisi sobre la multiplicación de T. gondii
Posterior a la obtención y siembra de los macrófagos en cubreobjetos se incubaron por una hora y luego se les retiró el medio de cultivo, añadiéndole 300 ul del sobrenadante extraído de macrófagos peritoneales provenientes de ratas infectadas con T. lewisi en periodos de 0, 4 y 7 días. Se incubaron por 24 horas a 37°C, en una atmósfera de 5% de CO2 y 95% de oxígeno y una humedad relativa del 90%. Pasado el tiempo de incubación, se descartó el sobrenadante y se lavó el cultivo con medio fresco. Las células se infectaron con taquizoitos en una proporción 1:10 macrófago-parásito, incubándose nuevamente en condiciones antes descritas, sacando muestras a 1, 24 y 48 horas post-infección para determinar el efecto del sobrenadante sobre la multiplicación de T. gondii en el transcurso del tiempo.
Efecto del lisado de T. lewisi sobre la multiplicación de T. gondii
Preparación del lisado. Ratas WISTAR con 8 días post-infección con 106 tripomastigotos de T. lewisi fueron sacrificadas, sangrándolas del corazón y recolectando entre 4-5 ml de sangre en un tubo estéril con anticoagulante. Posterior a ello, se diluyó un mililitro de sangre en dos mililitros de NaCl 0.15 M y se mezcló bien, agitando suavemente. En un tubo de centrífuga estéril se estratificaron dos mililitros de la mezcla de sangre/NaCl sobre tres mililitros de Ficoll, evitando que se mezclaran.
El tubo se centrifugó a 3500 rpm por 40 minutos a temperatura ambiente (Chinchilla and Reyes 1990). Luego se procedió a separar la capa intermedia de los estratos formados, donde se encontraban leucocitos, plaquetas y los tripomastigotos.
A esta capa se le añadió tres mililitros de NaCl 0.15 M y se centrifugó nuevamente por 10 minutos para retirar los residuos de Ficoll (Sigma) de la muestra.
Después de eliminar el sobrenadante, se resuspendió el sedimento en 1.0 ml de MEM y se determinó el número de parásitos por mililitro mediante el empleo de una cámara de Neubauer. Se ajuntó la concentración con MEM a 107 tripomastigotos por mililitro y se procedió a aplicar 10 ciclos de congelación – descongelación para la obtención del lisado.
Exposición de macrófagos alveolares o peritoneales al lisado de T. lewisi
A diferencia de los ensayos anteriores se utilizaron ratas sin infección experimental, a las cuales se les extrajo sus macrófagos alveolares y peritoneales utilizando los mismos procedimientos descritos anteriormente.
Una hora después de haber sembrado los macrófagos peritoneales y alveolares se les retiró el medio de cultivo y se lavaron las células con medio de cultivo fresco. Se añadieron diluciones del lisado de T. lewisi 1:100 y 1:500 incubándose por 24 horas a 37°C, a una atmósfera de 5% de CO2 y 95% de oxígeno con una humedad relativa del 90%. Pasado este período, se lavó el cultivo de macrófagos con MEM fresco, infectando luego los macrófagos con taquizoitos de T. gondii en proporción 1:10 macrófago-parásito. Un grupo de macrófagos no tratados fue agregado como control.
Resultados
Todos los datos presentados son el resultado de al menos tres experimentos repetidos, siguiendo la misma metodología.
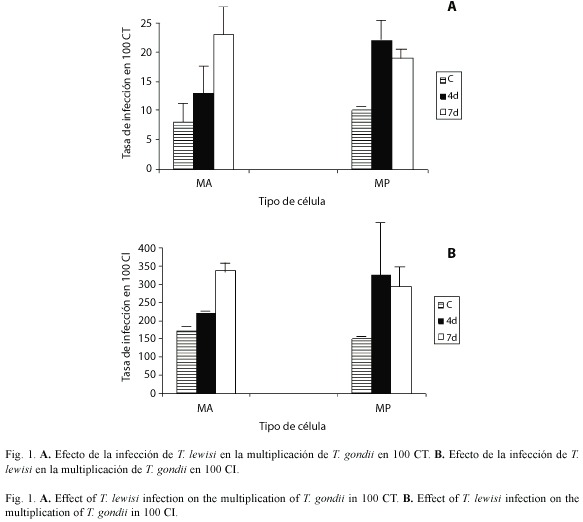
En macrófagos alveolares aislados de animales con 4 y 7 días de infección con T. lewisi se observó incrementada multiplicación de T. gondii en comparación con las aisladas de animales sin infección, para 100 células totales así como para 100 células infectadas (Fig. 1A y Fig. 1B). En macrófagos alveolares provenientes de animales con 7 días de infección se observó un aumento en la multiplicación del parásito después de 24 horas de infección por T. gondii, sin embargo esta diferencia con los macrófagos peritonales no fue significativa.
Al comparar la multiplicación de T. gondii en 100 células fagocíticas prevenientes tanto del peritoneo, como del pulmón de animales con 4 y 7 días con infección con T. lewisi se observa una mayor multiplicación de los taquizoitos en relación con lo observado en las aisladas de animales sin infección (control); valores de p: 4 d p= 0.010, 7 d p = 0.001)
Efecto del sobrenadante extraído de macrófagos peritoneales de ratas infectadas previamente con T. lewisi sobre la multiplicación de T. gondii
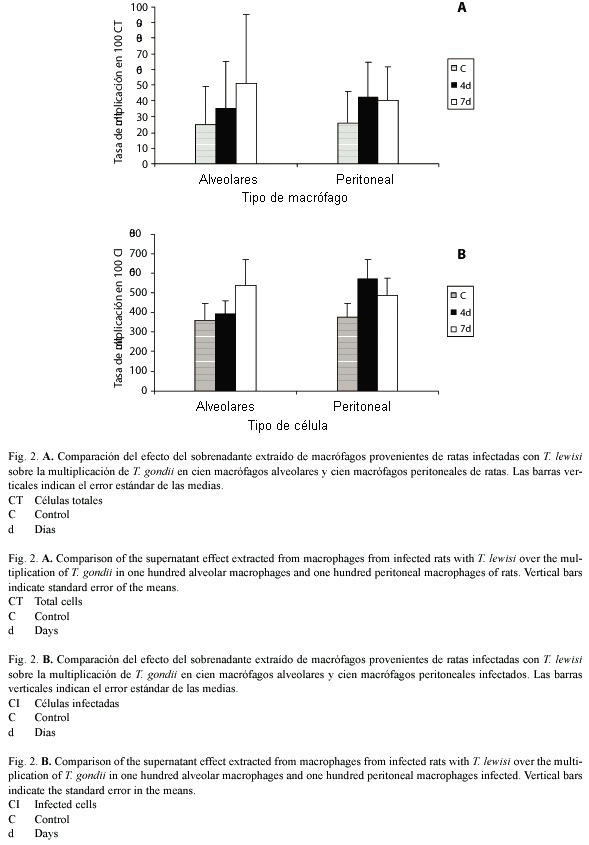
Cuando se cultivaron macrófagos alveolares o peritoneales y se les añadió el sobrenadante extraído de macrófagos peritoneales provenientes de ratas con 4 y 7 días de infección con T. lewisi, no se observaron diferencias en la multiplicación de T. gondii a la hora ni a las veinticuatro horas, tanto si se trataba de cien células totales (4d p= 0.897; 7d p=0.978; Figura 2A), como cien células infectadas (4d p= 0.863; 7d p= 0.806; Figura 2B) con relación a los observado en células aisladas de animales sin infección experimental.
Efecto del lisado de T. lewisi sobre la multiplicación de T. gondii
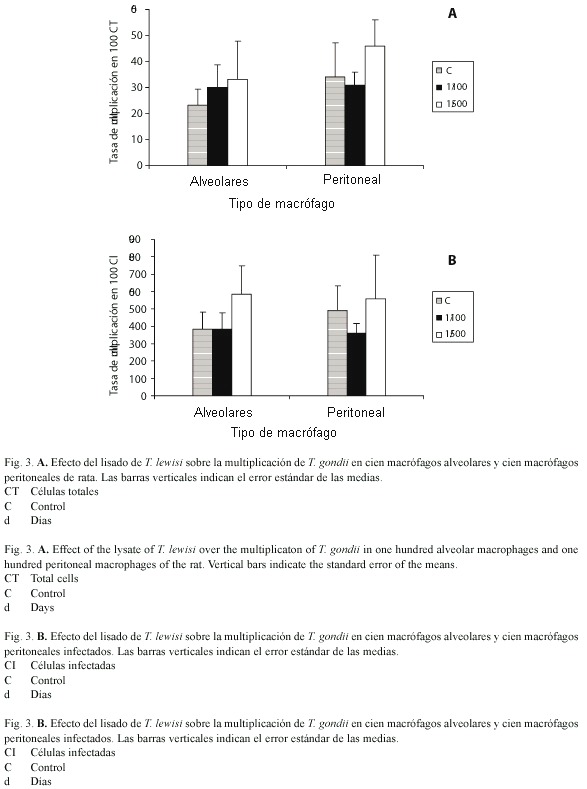
Cuando se cultivaron cien macrófagos alveolares o peritoneales y se les adicionó diluciones 1/100 o 1/500 del lisado de 108 tripomastigotos de T. lewisi, no se observaron diferencias en la multiplicación de T. gondii ni a una hora ni a las veinticuatro horas en relación con el control, tanto en cien células totales (1/100 p= 0.765; 1/500 p= 0.454, figura 3 A), como en cien células infectadas (1/100 p= 0.989; 1/500 p= 0.713, Figura 3 B).
Discusión
Las infecciones experimentales en roedores son ampliamente utilizadas como modelo para el estudio de interacciones parásito-hospedero, así como también, en fenómenos de inmuno-supresión de protozoarios con otros parásitos como por ejemplo en el caso de las infecciones con tripanosomas africanos y T. cruzi (Krettli 1977, Bakhiet et al. 1990, Olsson et al. 1991, Darji et al. 1992, Sztein y Kierszenbaum 1993). Infecciones exitosas con ooquistes (esporozoitos), tejido quístico (bradizoitos) y taquizoitos de T. gondii pueden darse en ratas, lo cual permite estudiar diferentes aspectos clínicos de la infección de acuerdo con el estadio del parásito y su ruta de transmisión (Guerrero et al. 1997, Catarinella et al. 1999).
La rata es un excelente modelo para varias infecciones como Schistosoma mansoni (Capron y Capron 1986) y la de T. gondii en donde varios de los mecanismos efectores de la respuesta inmune son comparables con los del ser humano (Araujo et al. 1976, Dubey y Frenkel 1998). En los estudios aquí descritos, se encontró que existen diferencias en la respuesta inmune entre células fagocíticas obtenidas de la región peritoneal de ratas y los obtenidos de los pulmones del mismo animal (Figuras 1A y B). Al respecto ha sido claramente establecido que las diferentes colonias de macrófagos actúan en forma disímil, tanto en la defensa contra agentes infecciosos como en los procesos inmunes (Sibille y Reynolds 1990, Nakamura et al. 1996). Además, recientemente se ha demostrado que la respuesta inmune contra este parásito suele darse por compartimientos, siendo muy compleja y específica especialmente a nivel del sistema nervioso central y la placenta (Filisetti y Candolfi 2004). Las diferencias encontradas en estos experimentos, posiblemente se deban a que el inóculo inicial lo reciben directamente los MP por lo cual el efecto se presenta en ellos antes en comparación con los MA en donde el efecto se observa más marcado días después cuando la infección se vuelve sistémica en el animal entre los 5 y 7 días después de la infección (Nakamura et al. 1996). Además, la presencia de diferentes capas epiteliales relacionadas con la inmunidad de la mucosa pulmonar juega también un papel muy importante en el desarrollo de una inmunidad contra T. gondii a nivel de este compartimiento (Subauste y Remington 1993).
Dado que se sugirió en algún momento que la inmunosupresión inducida por tripanosomas africanos podría deberse a un factor liberado en animales infectados, o algún componente del tripanosomátido se estudió el sobrenadante y el lisado de T. lewisi cuya preparación se indicó antes. Sin embargo ninguno de los análisis dieron resultados promisorios (Figuras 2 A y B, 3 A y B), lo que podría indicar que T. lewisi se comporta en forma diferente a los tripanosomas africanos. Más estudios al respecto deben ser hechos para determinar si tales factores son importantes.
La inmunosupresión observada en animales infectados con T. lewisi es rápida en comparación con la obtenida utilizando animales tratados con acetato de cortisona u otros immunodepresores pues en esta última se da entre la cuarta y quinta semana de tratamiento (Sumyuen et al. 1996, Djurkovic-Djakovic y Melenkovic 2001). Por lo tanto el modelo aquí descrito resulta accesible y rápido por lo que se puede utilizar para la valoración de la respuesta inmune contra diferentes microorganismos patógenos tales como T. gondii y Cryptococcus neoformans (Chinchilla et al. 2004, Gross et al. 2006) en un tiempo considerablemente más corto. Este aspecto evita en cierto modo las variantes experimentales a que pueden ser sometidos los animales por efecto del tiempo de exposición a inmunodepresores (Gross et al. 1996).
Agradecimientos
Al Servicio de Intercambio Académico Alemán (DAAD) por el apoyo económico ofrecido. A la Universidad de Costa Rica y la Universidad de Ciencias Médicas (UCIMED) por el uso del material e instalaciones durante la realización de éste estudio, además de la excelente ayuda brindada.
Resumen
El efecto inmunosupresor de la infección de T. lewisi sobre la multiplicación de T. gondii fue comparado en macrófagos peritoneales (MP) y alveolares (MA) de rata. El número de parásitos (taquizoitos) intracelulares (TI) fue contado por microscopía de luz. Los macrófagos alveolares y peritoneales (MP) de animales con 4 días de infección con T. lewisi muestran un aumento significativo en la multiplicación de T. gondii. A diferencia de los MP (que muestran un aumento en la multiplicación de T. gondii al cuarto día de infección con T. lewisi disminuyendo hacia el séptimo día), los MA mantienen un aumento en la multiplicación del parásito desde el cuarto, aumentando hacia el séptimo día de infección. Esta diferencia se puede deber a la ruta de infección utilizada para los experimentos que afectan directamente los MP donde se observa un efecto mayor y más temprano en comparación con los MA aislados de los pulmones, compartimiento afectado cuando la infección se vuelve sistémica entre el cuarto y sexto día de infección. La inmunidad contra T. gondii es similar entre ambas células fagocíticas, pero el tiempo de infección y el compartimiento donde se encuentren las células hace la diferencia en el tiempo de respuesta contra un parásito dado, en nuestro caso T. gondii. No hubo evidencia de que los sobrenadantes de cultivos de macrófagos provenientes de ratas infectadas ni el lisado de tripanosomas indujeran el efecto inmunosupresor.
Palabras clave: Toxoplasma gondii, Trypanosoma lewisi, Macrófagos alveolares (MA), Macrófagos peritoneales (MP), inmunosupresión.
Referencias
Araujo, F.G., D.M. Williams, F. C. Grument & J. Remington. 1976. Strain-dependent differences in murine susceptibility to Toxoplasma. Infect. Immun. 13: 1528-1530. [ Links ]
Bakhiet, M., T. Olsson, P.H. Van der Meide & K. Kristensson. 1990. Depletion of CD8 T-cells suppresses growth of Trypanosoma brucei and interferon gamma production in infected rats. Clin. Exp. Immunol. 81: 195-199. [ Links ]
Black, M. W. & J. C. Boothroyd. 2000. Lytic cycle of Toxoplasma gondii. Microbiol. Mol. Rev. 64: 607-623. [ Links ]
Capron, M. & A. Capron. 1986. Rats, mice and menmodels for immune effector mechanisms against schistosomiasis. Parasitol. Today. 2: 69 – 75. [ Links ]
Carruthers, V.B. 2002. Host cell invasion by the opportunistic pathogen Toxoplasma gondii. Acta Tropica. 81: 111-122. [ Links ]
Carruthers, V. B. & L. D. Sibley. 1997. Sequential protein secretion from three distinct organelles of Toxoplasma gondii accompanies invasion of human fibroblasts. Eur. J. Cell Biol. 73: 114-123. [ Links ]
Catarinella, G., M. Chinchilla, O.M. Guerrero & A. Castro. 1999. Infection of white rats peritoneal macrophages wiht Toxoplasma gondii (Coccidia: Sarcocystidae) after Trypanosoma lewisi (Kinetoplastida: Trypanosomatidae) infection. Rev. Biol. Trop. 47: 483- 488. [ Links ]
Chinchilla, M. & J. K. Frenkel. 1978. Mediation of immunity to intracellular infection (Toxoplasma and Besnoitia) within somatic cells. Infect. Immun. 19:999-1012. [ Links ]
Chinchilla, M., O.M. Guerrero & E. Solano. 1982. Lack of multiplication of Toxoplasma in macrophages of rats in vitro. J. Parasitol. 68: 952-955. [ Links ]
Chinchilla, M., O.M. Guerrero, & A. Castro. 2004. Effect of Trypanosoma lewisi infection on the Toxoplasma gondii multiplication in white rat peritoneal macrophages. Parasitol. Latinoam. 59: 3-7. [ Links ]
Darji, A., R. Lucas, E. Magez, J. Torreele, M. Palacios, E. Sileghem, S. Bajyana, R. Hamers & P. De Baetselier. 1992. Mechanismis underlying trypanosome elicited immunosupression. Ann. Soc. Belg. Med. Trop. 72: 27 – 38. [ Links ]
Denker, E.Y. 1999. T lymphocyte-dependent effector mechanisms of immunity to Toxoplasma gondii. Microbes Infect. 1: 699 – 708. [ Links ]
Denker, E.Y. & A. Sher. 1997. Role of natural killer cells & NK1+ T cells in regulating cell-mediated immunity during Toxoplasma gondii infection. Biochem. Soc. Trans. 25: 699 – 703. [ Links ]
Denker, E.Y., R.T. Gazzinelli, D. Martin & A. Sher. 1993. Emergence of NK1.1+ cells as effectors of immunity to Toxoplasma gondii in MHC class I-deficient mice. J. Exp. Med. 178: 1465 – 1472. [ Links ]
Djurkovic-Djakovic, O. & V. Milenkovic. 2001. Murine model drug-induced reactivation of Toxoplasma gondii. Acta Protozool. 40: 99-106. [ Links ]
Dubey, J.P. & J. K. Frenkel. 1998. Toxoplasmosis of rats: a review, with considerations of their value as an animal model and their possible role in epidemiology. Vet. Parasitol. 77: 1-32. [ Links ]
Filisetti, D. & E. Candolfi. 2004. Immune response to Toxoplasma gondii. Ann. Ist. Super Sanita. 40: 71 – 80. [ Links ]
Gross, N.T., M. Chinchilla, P. Camner & C. Jarstrand. 1996. Anticryptococcal activity by alveolar macrophages from rats treated with cortisone acetate during different periods of time. Mycopathologia. 136: 1-8. [ Links ]
Gross, N., O.M. Guerrero, M. Chinchilla & C. Jarstrand -Hall. 2006. Trypanosoma lewisi-induced immunosupression: The effects on alveolar macrophages activities against Cryptococcus neoformans. Exp. Parasitol. 113: 262-266. [ Links ]
Guerrero, O.M., M. Chinchilla & E. Abrahams. 1997. Increasing of Toxoplasma gondii (Coccidia, Sarcocystidae) infections by Trypanosoma lewisi (Kinetoplastida, Trypanosomatidae) in white rats. Rev. Biol. Trop. 45: 877-882a. [ Links ]
Korbel, D.S., O.C. Finney & E.M. Riley. 2004. Natural killer and innate immunity to protozoan pathogens. Inter. J. Parasitol. 34: 1517-1528. [ Links ]
Krettli, A.U. 1977. Exacerbation of experimental Trypanosoma cruzi infection in mice by concomitant malaria. J. Protozool. 24: 514-518. [ Links ]
McCabe, R.E., & J.S. Remington. 1986. Mechanisms of killing Toxoplasma gondii by rat peritoneal macrophages. Infect. Immun. 52: 151-155. [ Links ]
Morrissette, N.S. & L.D. Sibley. 2002. Cytoskeleton of Apicomplexan Parasites. Microbiol. Mol. Biol. Rev. 66: 21-38. [ Links ]
Nakamura, Y., T. Murai & Y. Ogwa. 1996. Effect of in vitro and in vivo administration of dexamethasone on rat macrophages functions: comparison between alvealar macrophages and peritoneal macrophages. J. Eur. Respire. 9: 301-306. [ Links ]
Nakano, Y., H. Hisaeda, T. Sakai, H. Ishikawa, M. Zhang, Y. Maekawa, T. Zhang, M. Takashima, M. Nishitani, R.A. Good & K. Himeno. 2002. Roles of NKR cells in resistance against infection with Toxoplasma gondii and in expression of heat shock protein 65 in the host macrophages. Microbes. Infect. 4: 1-11. [ Links ]
Olsson, T., M. Bakhiet, B. Hojeberg, P.H. Van der Meide & K. Kristensson. 1991. Bidirectional activating signals between Trypanosoma brucei and CD8 T cells: a tripanosome-released factor triggers interferon gamma production that stimulates parasites growth. Eur. J. Immunol. 21: 2447-2454. [ Links ]
Reyes, L. & M. Chinchilla. 1987. Growth inhibition of Trypanosoma cruzi in cultured murine myocardial cells mediated by a specifically induced lymphokine. Infect. Immun. 55: 1513-1516. [ Links ]
Ryning, F.W. & J. S. Remington. 1977. Effect of alveolar macrophages on Toxoplasma gondii. Infect. Immun. 18: 746 – 753. [ Links ]
Sibille, y. & H.Y. Reynolds. 1990. Macrophages and polymorphonuclear neutrophils in lung defense and injury. Am. Rev. Respir. Dis. 141: 471-501. [ Links ]
Sibley, L.D. 2003. Toxoplasma gondii: perfecting an intracellular life style. Traffic. 4: 581- 586. [ Links ]
Subauste C.S. & J.S. Remington. 1993. Immunity to Toxoplasma gondii. Current Opinion Immunol. 5: 532 – 537. [ Links ]
Sumyen, M.H., y.J.F. Garin & F. Dérouin. 1996. Effect of immunosuppressive drug regimens on acute and chronic murine toxoplasmosis. Parasitol. Res. 82: 681-686. [ Links ]
Suzuki, Y., J. Claflin, X. Wang, A. Lengi & T. Kikuchi. 2005. Microglia and macrophages as innate producers of interferon-gamma in the brain following infection with Toxoplasma gondii. Int. J. Parasitol. 35: 83-90. [ Links ]
Sztein, Y. & F. Kierszenbaum. 1993. Mechanisms of development of immunosuppression during Trypanosoma infections. Parasitol. Today. 9: 424-428. [ Links ]