Revista de Biología Tropical
versión On-line ISSN 0034-7744versión impresa ISSN 0034-7744
Rev. biol. trop vol.56 no.3 San José sep. 2008
Tolerancia experimental de las especies vegetales Nicotiana glauca, Jacaranda mimosifolia, Tecoma stans, Medicago sativa y Spinacea oleracea al boro, en Argentina
Marta L. de Viana & Silvia Albarracín Franco
Instituto de Ecología y Ambiente Humano, CIUNSa, Universidad Nacional de Salta, Buenos Aires Nº 177, 4400, Salta, Argentina; mldeviana@arnet.com.ar
Abstract: Experimental tolerance to boron of the plant species Nicotiana glauca, Jacaranda mimosifolia, Tecoma stans, Medicago sativa y Spinacea oleracea in Argentina. The activity of boron industries is a punctual and diffuse source of air, soil and water pollution. Therefore, it is a priority to study possible ways of reducing this impact. A relatively new technology for reducing soil pollution is phytoremediation, which uses plants and associate microorganisms. The first step in phytoremediation is to detect tolerant plant species, which is the objective of this work. A laboratory experiment to assess the germination, survival and growth of different species at different boron concentrations was carried out following a factorial design with two factors: plant species and boron concentration. Boron concentrations were determined at the beginning and the end of the experiment, taking into account substrates with and without vegetation. We found significant differences for treatment, species and the interaction species*treatment. N. glauca, M. sativa and J. mimosifolia were the most tolerant species. The other species had a decrease in the response variables, with the concentration of the pollutant. All the species had a low survival at the highest boron concentration. The reduction in boron concentration at the end of the experiment was higher in the 30 ppm treatment with M. sativa and the lower was registered in the 20 ppm treatment with J. mimosifolia and in 30 ppm with T. stans and S. oleraceae. We conclude that N. glauca, M. sativa and J. mimosifolia can be considered in remediation plans. Rev. Biol. Trop. 56 (3): 1053-1061. Epub 2008 September 30.
Key words: boron, contamination, tolerant plants, phytoremediation.
Argentina es el tercer productor mundial de boratos que se explotan y procesan principalmente en las provincias de Salta y Jujuy. En los procesos de extracción y especialmente de industrialización de los boratos, se contaminan grandes extensiones de suelos y aguas (superficiales y subterráneas) con sales y desechos con boro que superan los niveles permitidos en la legislación vigente. En el Valle de Lerma (donde se encuentra la ciudad de Salta), existen cuatro plantas procesadoras de boratos y otros derivados (Flores 2004) que constituyen fuentes puntuales y difusas de contaminación del aire, suelo y aguas. En la Ciudad de Salta, existe un predio de 6ha donde funcionó hasta el año 1990, una empresa procesadora de boratos. La Municipalidad compró el terreno y con excavadoras y aplanadoras mezcló los residuos y escombros del sitio, pero no exigió ni realizó ningún trabajo de remediación, a pesar de las denuncias de los vecinos por contaminación (Cardozo y de Viana 2007). En la actualidad en el sitio no crece ninguna especie vegetal y las determinaciones de boro en el suelo superan los 980 ppm (Albarracín Franco 2008). Es interesante destacar que La Ley Nacional 24.051, considera al boro un residuo peligroso, estableciendo un valor límite de 2 ppm para suelos de uso agrícola. Por lo tanto, el estudio y la experimentación acerca de las posibles formas de contrarrestar este impacto constituyen una prioridad.
El boro es un micronutriente esencial para el crecimiento de las plantas (Karen y Bingham 1985). Concentraciones de 0.2 mg B/l son necesarias para la germinación, crecimiento y producción de las mayoría de las plantas (Davis et al. 2002). Es necesario en la síntesis y transporte de carbohidratos, en el metabolismo de los ácidos nucleicos (Frick 1985), en la división, desarrollo y diferenciación celular y de tejidos y en el metabolismo de giberelinas (Barceló Coll et al. 1998). Las plantas absorben boro del suelo bajo la forma iónica de ácido bórico. Los límites entre deficiencia y toxicidad son muy estrechos (Gupta 1983). Concentraciones de 0.3 ppm pueden resultar tóxicas para especies sensibles (Bohn et al. 1993). Los síntomas de toxicidad en las plantas incluyen una reducción del vigor, disminución del desarrollo, necrosis de las hojas y disminución en el número, tamaño y peso de los frutos (Paull et al. 1992, Nable et al. 1997).
Se conoce desde hace tiempo que algunas especies vegetales pueden ser usadas en la recuperación de suelos contaminados. La fitorremediación se basa en la capacidad de algunas especies de absorber, transformar, secuestrar o degradar directa o indirectamente algunos contaminantes que se encuentran en la zona radicular (Cunningham y Ow 1996, Raskin 1996, EPA 2000). Algunas ventajas de la fitorremediación comparada con otras técnicas, es que restituye las propiedades funcionales y estructurales del suelo, promueve la actividad de microorganismos de la rizósfera y es de menor costo comparativo (Trapp y Karlson 2001).
Para aplicar fitorremediación, las especies se seleccionan teniendo en cuenta la tolerancia al contaminante, que está relacionada con mecanismos fisiológicos que permiten el normal funcionamiento en presencia de altas concentraciones de tóxicos potenciales (Baker 1987). Por lo tanto, el primer paso en la fitorremediación consiste en evaluar la germinación y el crecimiento de distintas especies en experimentos de laboratorio, que serán la base para la toma de decisiones en aplicaciones en campo (Trapp y Karlson 2001).
El objetivo de este estudio fue evaluar el potencial de cinco especies de germinar y crecer en altas concentraciones de boro.
Materiales y métodos
Se realizó un experimento en germinador con fotoperíodo de 12 h, temperatura media de 25 ±2.1 ºC y humedad relativa media de 60 ±5.4%, siguiendo un diseño en bloques completos al azar con dos factores: especie vegetal y concentración de boro (0, 10, 20 y 30 ppm), con cuatro repeticiones para cada tratamiento. Las especies empleadas fueron Nicotiana glauca, Jacaranda mimosifolia, Tecoma stans, Medicago sativa y Spinacea oleracea. Estas se eligieron a partir de experiencias previas de tolerancia donde se estudió la respuesta de germinación y supervivencia en altas concentraciones de boro de un mayor número de especies (Albarracín Franco y de Viana 2006, Albarracín Franco 2008).
En cada unidad experimental (recipientes plásticos de 10X15X3 cm), se colocaron 20 semillas (las semillas se lavaron con una solución de NaClO al 10% para evitar el ataque de hongos durante el experimento) que se sembraron en 200 g de arena (sustrato) esterilizada en autoclave (1 atm y 120 ˚C, durante 1 h y posteriormente secada en estufa a 130 ˚C durante 18 h). El sustrato se mezcló con las concentraciones correspondientes de boro, que se prepararon a partir de una solución madre de 1 000 ppm. de Na(BO3)4 (Cicarelli pro analisis). El riego se realizó diariamente con agua destilada y se complementó una vez por semana con 55 ml de solución nutritiva Rorisson sin B, a partir de la emergencia de las plántulas (Hendry y Grime 1993).
Durante un período de 30 días se registró diariamente el número de semillas germinadas, tomando como indicador el brote de la radícula, a excepción de N. glauca, para la que se registró la emergencia de los cotiledones, debido al tamaño de la semilla (0.5 mm de longitud).
Determinación de boro: el boro se determinó al comienzo y final del experimento por colorimetría a 420 nm. (4802 UV/VIS Double Beam Spectrophotometer) con el método de Azomethina-H (Rump y Krist 1992). Las determinaciones se realizaron en el sustrato en todos los tratamientos, por triplicado para cada tratamiento, utilizando 5 g de sustrato. Para diferenciar la degradación del boro natural o por bacterias de la realizada por las plantas, cada tratamiento consistió de un control adicional de sustrato con las distintas concentraciones de boro (0, 10, 20 y 30 ppm B) a las que no se les adicionó las semillas (sustratos no vegetados). Estos tratamientos se mantuvieron en las mismas condiciones y con la misma frecuencia de riego hasta el final del experimento
Análisis de los datos: para cada especie y tratamiento se estimó el porcentaje y la velocidad de germinación hasta los 30 días y el porcentaje de supervivientes a intervalos mensuales hasta finalizar el experimento (110 días). La velocidad de germinación (S), se estimó según Ahmed y Wardle (1994) como:
S = [N1 / 1 +N2 /2 + N3 /3 + . + Nn/n]x100
donde N1, N2, N3, , Nn, es la proporción de semillas que germinaron en los días 1, 2, 3, , n durante el bioensayo. S varía entre 100 (si todas las semillas germinan el primer día) y 0 (si las semillas no germinaron al final del experimento).
Las variables respuesta (porcentaje de germinación a los 30 días, velocidad de germinación y sobrevivientes a los 110 días), se compararon para las especies y los tratamientos con M (ANOVA) de dos factores. La concentración de boro en el sustrato se comparó para cada tratamiento y cada especie, empleando la relación: concentración final de boro en el sustrato vegetado / concentración final de boro en el sustrato no vegetado X 100. Estos datos se analizaron con ANOVA (Systat 1992).
Resultados
Las especies empleadas en el experimento mostraron amplias diferencias en las variables respuesta analizadas. En M. sativa la germinación comenzó el primer día de iniciado el experimento, fue máxima y sin diferencias entre los tratamientos. N. glauca comenzó a germinar a partir del sexto día y fue menor en la mayor concentración de boro, hasta el día 17. Posteriormente no se registraron diferencias entre los tratamientos. J. mimosifolia comenzó a germinar a partir del tercer día. En esta especie, la germinación fue baja en todos los tratamientos y en el control no superó el 38%. T. stans mostró sensibilidad al boro aún en la menor concentración. La germinación fue máxima en el control y a la mayor concentración de boro, disminuyó un 29% con relación al control. S. oleracea germinó rápidamente, sin mostrar diferencias entre los tratamientos hasta el día 20 del experimento, donde comenzó a registrarse mortandad de las plántulas (Fig. 1).
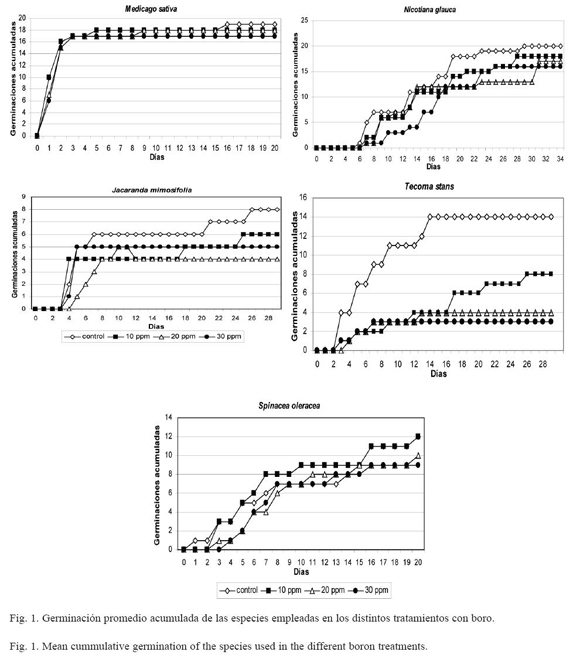
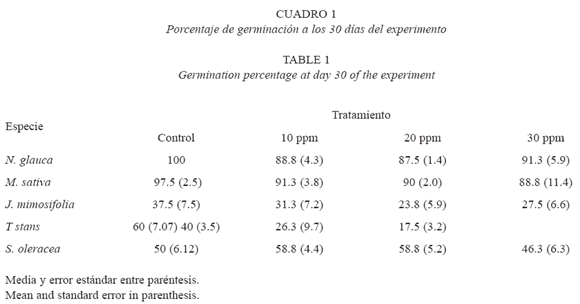
Se encontraron diferencias significativas en la germinación a los 30 días con relación a la especie (F=121.57, p<0.0005), al tratamiento (F=7.07, p<0.0005) y a la interacción especie*tratamiento (F=2.2, p=0.023). Las especies con mayor porcentaje de germinación en todas las concentraciones de boro probadas fueron N. glauca, M. sativa y S. oleracea. Las otras especies presentaron una disminución en el porcentaje de germinación con el aumento de la concentración de boro. J. mimosifolia y T. stans, evidenciaron menor germinación en todas las concentraciones empleadas con relación al control en los primeros 30 días del experimento. En el análisis para cada especie, T. stans es la única que presentó diferencias en el porcentaje de germinación (F=8.26, p=0.003), siendo menor en el tratamiento con 30 ppm de boro. M. sativa no mostró diferencias en la misma variable (F=0.892, p=0.473), al igual que J. mimosifolia (F=0.737, p=0.550), N. glauca (F=2.3, p=0.129) y S. oleracea (F=1.469, p=0.272) (Cuadro 1).
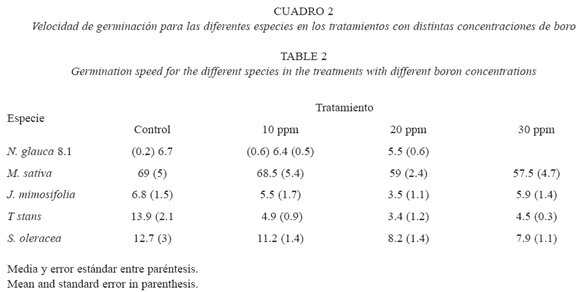
Se encontraron diferencias significativas en la velocidad de germinación, con relación a la especie (F=452.404, p<0.0005), al tratamiento (F=7.10, p<0.0005) aunque no en la interacción especie*tratamiento (F=1.3, P=0.243). La velocidad de germinación fue menor con el aumento en la concentración de boro en la mayoría de las especies, aunque las diferencias no fueron significativas en M. sativa (F=1.798, P=0.201), J mimosifolia (F=0.728, p=0.550) y S. oleracea (F=1.582, p=0.245) (Cuadro 2).
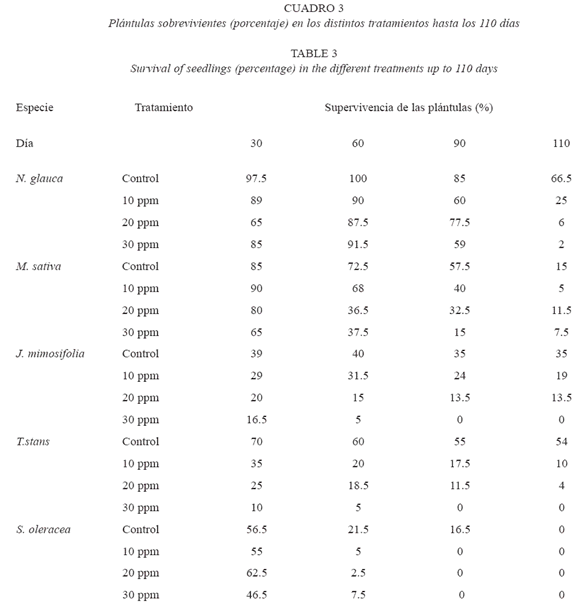
Con relación al porcentaje de sobrevivientes se encontraron diferencias significativas debidas a la especie (F=27.525, p<0.0005), al tratamiento (F=32.909, p<0.0005) y a la interacción especie*tratamiento (F =7.29, p<0.0005). S. oleracea presentó una alta mortalidad a partir de los 30 días del experimento en todos los tratamientos, incluso en el control. En J. mimosifolia, T. stans y N. glauca se encontraron diferencias en la supervivencia (F=16.491, p<0.0005; F=46.549, p<0.0005, F=3.091, p=0.068, respectivamente). En todos los casos, la mayor supervivencia de plántulas fue en el control (a excepción de S. oleraceae) y en las menores concentraciones de boro. En las mayores concentraciones, disminuyó la cantidad de sobrevivientes. En todos los tratamientos, N. glauca y M. sativa presentaron la mayor cantidad de plántulas sobrevivientes. Sin embargo para N. glauca se registró una supervivencia de plántulas del 7% con relación al control en el tratamiento con 30 ppm de boro y del 44% en el tratamiento con 10 ppm de boro. En M. sativa la supervivencia de las plántulas al finalizar el experimento no tuvo relación con el tratamiento. En J. mimosifolia y T. stans la supervivencia fue elevada en el control y a bajas concentraciones de boro (10 y 20 ppm) (Cuadro 3).
Determinación de boro en el sustrato: en todos los tratamientos iniciados con 10, 20 y 30 ppm de boro, la concentración detectada al final del experimento (110 días) en los sustratos no vegetados varió entre 89 y 99%, mientras que la determinada en los sustratos vegetados varió entre 68% y un 92%. Tanto la reducción máxima como la mínima de boro en los sustratos vegetados ocurrió con S. oleraceae en los tratamientos con 10 y 30 ppm de boro.
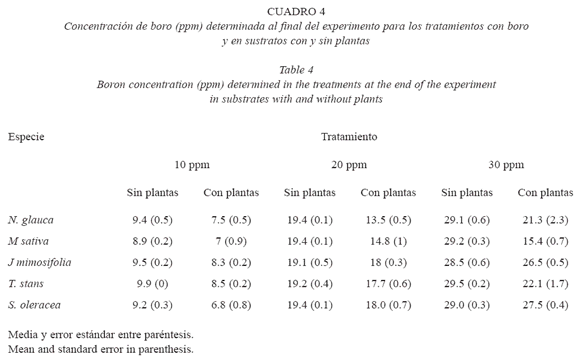
En los tratamientos iniciados con 10 ppm de boro, M. sativa y N. glauca ocasionaron una reducción de un 25 a 30% de boro, mientras que J. mimosifolia y T. stans redujeron un 13 y un 15% de boro a los 110 días. En los tratamientos comenzados con 20 ppm de boro, la reducción de boro en los sustratos con N. glauca yM. sativa fue de 32 y 26% respectivamente. Finalmente en los tratamientos comenzados con 30 ppm de boro, la reducción de boro en los sustratos con N. glauca y M. sativa fue de 29 y 49% respectivamente (Cuadro 4).
En el análisis para cada especie, se encontraron diferencias significativas en la concentración de boro en los sustratos vegetados y no vegetados para los distintos tratamientos en M. sativa (F=4.52, p=0.04) y en T. stans (F=3.83, p=0.06), con la mayor disminución de la concentración de boro en los tratamientos de 30ppm. En S. oleracea (F=4.44, p=0.04) y J. mimosifolia (F=3.4, p=0.08), la mayor reducción de la concentración ocurrió en los tratamientos de 10 ppm de boro. En N. glauca se encontraron diferencias entre tratamientos (F=71.9, p<0.0005), con la mayor reducción en los tratamientos iniciados con 20 ppm de boro.
Discusión
Las concentraciones empleadas en este trabajo superan ampliamente los límites establecidos en la Ley Nacional de Argentina 24.051 de Residuos Peligrosos. El boro ejerce un efecto tóxico en la mayoría de las especies cuando está presente en el agua y/o suelo en niveles que superen los 4 ppm.
Si bien son escasos los trabajos publicados de tolerancia al boro, resultados similares fueron obtenidos por Bañuelos et al. (1999), que emplearon dos germoplasmas de tomate, maíz y alfalfa, obteniendo porcentajes de germinación superiores al 60% en 20 y 40 ppm de boro, y por Albarracín Franco, de Viana y Flores (2007) con Aspidosperma quebracho blanco y Lolium multiflorum con una supervivencia superior al 70% en 50 ppm de boro de suelo extraído de la planta Baradero (Provincia de Salta) y diluido con arena hasta llegar a la concentración mencionada.
Los resultados de este trabajo indican que M. sativa, N. glauca y T. stans podrían considerarse prometedoras en la remediación de suelos con concentraciones de boro de hasta 30 ppm, ya que produjeron una reducción del boro en el sustrato de entre 29 y 48%. Sin embargo, la supervivencia hasta los 110 días fue baja.
Teniendo en cuenta tanto la reducción del boro en el sustrato como la supervivencia, podemos concluir que N. glauca, M. sativa, J. mimosifolia y T. stans podrían ser empleadas en remediación de sustratos con menores concentraciones de boro. Estas plantas tienen características ecológicas que son de importancia a la hora de seleccionar especies tolerantes para remediación in situ, ya que son de amplia distribución, de rápido crecimiento, la reproducción es temprana en el ciclo vital (en especial N. glauca y T. stans), las raíces se extienden en profundidad y horizontalmente y son longevas (especialmente J. mimosifolia y T. stans), por lo que podrían secuestrar y mantener el contaminante en su biomasa, por un período de tiempo interesante (superior a los 20 años), con la ventaja adicional que se podría incorporar la recuperación de sitios contaminados en programas relacionados con secuestro de carbono, en el marco del Protocolo de Kyoto.
Además, la combinación con las especies comerciales de ciclos de vida más cortos y extensión más superficial de las raíces, podría tener efectos sinérgicos en la absorción del contaminante.
Los resultados también indican que de las especies comerciales probadas, M. sativa sobrevivió en 30 ppm de boro y en estos sustratos se produjo la mayor reducción en la concentración de boro al final del experimento. S. oleracea, que es considerada en diversos trabajos como tolerante, no sobrevivió en ningún tratamiento, incluso en el control. Esto podría ser atribuido al lote de semillas adquirido, ya que la germinación fue inferior al 60% en todos los casos y tal vez a los requerimientos de nutrientes de esta especie que no fueron suplidos con las concentraciones empleadas de la solución Rorison. Es importante extender la escala temporal de los experimentos y además, realizar la determinación de boro en el tejido vegetal.
Agradecimientos
Agradecemos especialmente a Horacio Flores, Hugo González y Enrique Soria del Instituto de Beneficio de Minerales de la Universidad Nacional de Salta por el apoyo brindado en la realización de las determinaciones de boro en las muestras de suelo.
Resumen
La actividad de las industrias borateras constituye una fuente puntual y difusa de contaminación del aire, suelo y aguas superficiales y profundas. Por lo tanto, el estudio y experimentación acerca de las posibles formas de contrarrestar este impacto constituye una prioridad. Una técnica relativamente nueva para descontaminar suelos es la fitorremediación, que emplea plantas y microorganismos asociados. El primer paso es detectar las especies vegetales tolerantes, lo que constituye el objetivo de este trabajo. Se realizó un experimento en laboratorio para evaluar la germinación, la supervivencia y el crecimiento de distintas especies en diferentes concentraciones de boro. Al comienzo y al final del experimento se determinó la concentración de boro en el sustrato para cada tratamiento y para sustratos con y sin vegetación. Se encontraron diferencias significativas debidas al tratamiento, la especie y la interacción especie *tratamiento. M. sativa, N. glauca y J. mimosifolia fueron las especies de mayor tolerancia al boro. Las otras especies presentaron una disminución en todas las variables-respuesta en función de la concentración del contaminante. Todas presentaron una baja supervivencia en la máxima concentración. La disminución de boro fue máxima en el tratamiento de 30 ppm de boro con M. sativa y la menor se registró en los tratamiento de 20 ppm de boro con J. mimosifolia y de 30 ppm de boro con T. stans y S. oleraceae. Se concluye que N. glauca, M. sativa y J. mimosifolia podrían considerarse como prometedoras en remediación.
Palabras claves: boro, contaminación, plantas tolerantes, fitorremediación.
Recibido 27-VI-2007. Corregido 30-VI-2008. Aceptado 31-VII-2008.
Referencias
Ahmed, M. & D.A. Wardle. 1994. Allelopathic potencial of vegetative and flowering ragwort (Senecio jacobea L.) plants against associated pasture species. Plant Soil 64: 61-68. [ Links ]
Albarracín Franco, S. & M.L. de Viana 2006. Evaluación de la tolerancia de especies nativas al boro. Sociedad Boliviana de la Ciencia del Suelo, Selección de Trabajos del IV Congreso Nacional, Bolivia. [ Links ]
Albarracín Franco, S., M.L. de Viana & H. Flores. 2007. Germinación y supervivencia de dos especies vegetales en altas concentraciones de boro. Avances en Energías Renovables y Ambiente. Vol 11: 49-56. [ Links ]
Albarracín Franco, S. 2008. Fitorremediación: evaluación del potencial de especies nativas en la remediación de suelos contaminados con boro. Tesis de grado, Salta, Argentina. [ Links ]
Baker, A.J.M. 1987. Metal tolerance. New Phytologist 106: 93-111. [ Links ]
Bañuelos, G.S., H.A. Ajwa, L. Caceres & D. Dyer. 1999. Germination responses and boron accumulation in germplasm from Chile and United States grown with boron-enriched water. Ecotoxicol. Env. Safety 43: 62-67. [ Links ]
Barceló, Coll, J., N.G. Rodrigo, B. Sabater García & R. Sanchez Tames. 1998. Fisiología Vegetal. Pirámides S.A., Madrid. España. [ Links ]
Bohn, H.L., B.L. McNeal & G.A. O`Connor. 1993. Química del suelo. Limasa, México D.F., México. [ Links ]
Cardozo, P. & M.L. de Viana. 2007. El Derecho a la información ambiental y los estudios de impacto ambiental (EIAyS). III Jornadas de Comunicaciones Internas y I Jornadas de Enseñanza de la Ciencias Naturales, Salta, Argentina. [ Links ]
Cunningham, S.D. & D.W. Ow 1996. Promises and prospects of phytoremediation. Plant Physiology 110: 715-719. [ Links ]
Davis S., K. Drake & K. Maier 2002. Toxicity of boron to the duckweed, Spirodella polyrrhiza. Chemosphere 48: 615-620. [ Links ]
Flores, H.R. 2004. Beneficio de los boratos. Crisol, Salta, Argentina. [ Links ]
Frick, H. 1985. Boron tolerance and accumulation in the duckweed, Lemma minor. Plant Nutrition 8: 1123-1129. [ Links ]
Hendry, G.A.F & J.P. Grime. 1993. Methods in comparative plant ecology. Chapman & Hall, London, Reino Unido. [ Links ]
Gupta, U.C. 1983. Boron deficiency and toxicity symptoms for several crops as related to tissue boron levels. Plant Nutrition 6: 387-395. [ Links ]
Karen, E. & F.T. Bingham. 1985. Boron in water, soils and plants. Advances in Soil Science 1: 230-276. [ Links ]
Lomniczi, I., H. Musso & R. Pereyra. 1997. Assessment of boron concentration in surface and groundwaters in the Lerma and Calchaqui Valleys (Prov. of Salta – Argentina). An. Asoc. Quím.Arg. 85: 283-293. [ Links ]
Nable, R.O., G.S. Bañuelos & J.G. Paull. 1997. Boron toxicity. Plant Soil 198: 181-198. [ Links ]
Paull, J.G., R.O. Nable & A.J. Rathjen 1992. Physiological and genetic control of the tolerance of wheat to high concentrations of boron and implications for plants breeding. Plant Soil 146: 251-260. [ Links ]
Raskin, I. 1996. Plant genetic engineering may help with environmental cleanup. Proceed. Nat. Acad. Sci. 93: 3164-3166. [ Links ]
Rump, H.H & H. Krist. 1992. Laboratory manual for the examination of water, waste and soil. Wiley-VCH, Weinheim, Alemania. [ Links ]
Systat. 1992. Systat for Windows, version 5. Systat, Evanston, Illinois, EEUU. [ Links ]
Trapp, S. & U. Karlson. 2001. Aspects of phytoremediation of organic pollutants. Soil & Sediments 1: 37-43. [ Links ]
Referencia de Internet
EPA(Environmental Protection Agency). 2000. Introduction to Phytoremediation. EPA-report EPA/600/R-99/107. Mai 2003 (Consultado:20 abril 2008; http://clu-in. org/techpubs.htm) [ Links ]












 uBio
uBio 

