Revista de Biología Tropical
versión On-line ISSN 0034-7744versión impresa ISSN 0034-7744
Rev. biol. trop vol.56 no.3 San José sep. 2008
Cuatro compuestos nuevos del extracto no polar de la planta Amyris brenesii (Rutaceae) de Costa Rica
Max Chavarría1, Victor Castro1, Luis Poveda2 & Renato Murillo1
1. Centro de Investigación en Productos Naturales (CIPRONA), Universidad de Costa Rica, San José, Costa Rica; mcharria@equi.ucr.ac.cr; vhcastro@equi.ucr.ac; crrenato@equi.ucr.ac.cr
2. Escuela de Ciencias Ambientales, Facultad de Ciencias de la Tierra y el Mar, Universidad Nacional, Heredia, Costa Rica; lpoveda@una.ac.cr
Abstract: Four new compounds from the non-polar extract of the plant Amyris brenesii (Rutaceae) from Costa Rica. Fractionation of a non polar extract of the aerial parts of Amyris brenesii collected in Río Cuarto, Grecia, Costa Rica has resulted in the isolation of four new compounds, 6-hidroxy-6-O-(3-hidroxymethyl-3methylalyl)-angelicin 1, 6-(N-acetyl-2-etanamin)-2,2-dimethyl-2H-cromen 2, the lignan 2,5-dehidrohinokinin 3 and N-acetyl-O-(geranyl)-tiramine 4. In addition, we isolated six previously known compounds: the lignans hinokinin 5 and Justicidin E 6, the coumarins scopoletin 7 and marmesin 8, 24-moretenoic acid 9, and the nitrogen compound O-(3,3-dimethylalyl)-halfordinol 10. All the separations were done with chromatographic techniques and the structures were elucidated by using 1D and 2D NMR techniques. Rev. Biol. Trop. 56 (3): 1043-1052. Epub 2008 September 30.
Key words: Rutaceae, Amyris, brenesii, lignans, furocoumarin, cromen.
La familia Rutaceae comprende a nivel mundial unos 150 géneros y alrededor de 900 especies distribuidas principalmente por los trópicos y regiones templadas, particularmente en África del Sur y Australia. En Costa Rica se han reportado 19 géneros según datos del Instituto Nacional de Biodiversidad (INBio, 2005). La familia tiene gran importancia debido a los frutos (cítricos) de muchas de sus especies, así como a la producción de aceites esenciales y sustancias medicinales.
Un género importante de esta familia es el Amyris, el cual ha generado mucho interés entre los fitoquímicos por la variedad de compuestos que presentan (Hasbun-Pacheco y Castro-Castillo 1988). Por ejemplo de la especie Amyris plumieri se aislaron un grupo de nicotinamidas (Basil y Parkins 1978), de A. simplicifolia (Cordova y Garelli 1974), A. madrensis (Domínguez et al. 1977), A. marshii (Dominguez et al. 1985) y A. bar bata (Hasbun-Pacheco y Castro-Castillo 1986, Hasbun-Pacheco y Calderón 1990) una serie de cumarinas y piranocumarinas, y de A. brenesii las conocidas cumarinas marmesina y xantiletina, además de compuestos nitrogenados como el O-(3,3-dimetilalil)-halfordinol, el 2-(3′-piridil)-5-(3",4"metilendioxi)-5"-metoxioxazol y la p-O-(3,3-dimetilalil)-benzami da (Hasbun-Pacheco y Castro-Castillo 1988). Además de la variedad de compuestos, en este género existen un número importante de espe cies con actividad biológica: la A. brenesii pre- senta actividad antifúngica (Hasbun-Pacheco y Caderón 1990, Hasbun-Pacheco y Castro- Castillo 1988), la A. pinnata presenta propie dades citotóxicas (Seida 1979) y en medicina popular se han utilizado especies como la A. barbata en el tratamiento de enfermedades en la piel (Holdridge y Poveda 1985).
En el presente trabajo se reportan los resultados en un nuevo estudio fitoquímico de una muestra de A. brenesii recolectada en Costa Rica.
Materiales y métodos
Equipo y materiales: las separaciones primarias se realizaron con Silica Gel (60 a 200 µm) Merck y Silica Gel (40 a 60 µm) Merck para la separación en columna con presión media. Los platos cromatográficos (TLC1) se prepararon con una mezcla 1:1 de gel de sílice 60 F254 Merck y yeso. Para la separación de fracciones con masas menores se utilizaron cromatofolios de gel de sílice 20x20 cm gel de sílice 60 F254 Merck (TLC2). El control de las separaciones se llevó a cabo mediante radiación ultravioleta (lámpara UV marca Vpland, UVLS-28) y Resonancia Magnética Nuclear (1H-RMN).
La elucidación estructural de los compuestos puros se llevó a cabo con espectros de una y dos dimensiones obtenidos con un Espectrómetro de Resonancia Magnética Nuclear RMN de 400 MHz Varian Mercury 400, a saber, 1H-RMN, 13C-RMN, DEPT, H,H-COSY, gHSQC, gHMBC y NOE (Efecto Nuclear Overhauser).
Material vegetal: las partes aéreas de la planta se recolectaron en Río Cuarto, Grecia, Costa Rica en Febrero del año 2002. Se conserva una muestra de esta planta en el Herbario Juvenal Valerio de la Universidad Nacional, número 9154.
Extracción y aislamiento: la planta se secó a temperatura ambiente y se molió obteniéndose una masa de 1 000 g de hojas y 850 g de troncos. Posteriormente, se maceró de forma separada por 24 h con una mezcla de éter tertbutilmetílico (MTBE) y metanol (MeOH) en una proporción 9:1.
Extracto obtenido de las hojas: se desengrasó el extracto con metanol a una temperatura de -20 °C obteniéndose una masa de 11.8 g. La masa del extracto se fraccionó en una columna (CC) de gel de sílice (60-200 µm) utilizando como fase móvil mezclas de disolventes secos con polaridad creciente. Se obtuvieron cinco fracciones: Fr1 hexano:MTBE 85:15, Fr2 hexano:MTBE 65:35, Fr3 hexano:MTBE 40:60, Fr4 MTBE 100%, Fr5 MTBE: MeOH 85:15.
La fracción Fr2 se separó utilizando una columna de presión media utilizando como fase móvil mezclas de disolventes secos con polaridad creciente (hexano:éter 95:5, hexano:éter 85:15, hexano:éter 75:25, hexano:éter 50:50, éter 100 %). De esta separación se obtuvieron siete fracciones (Fr21-Fr27) de las cuales se conservaron las fracciones Fr26 y Fr27. La fracción Fr26 se separó con fase reversa obteniéndose cinco fracciones (Fr261-Fr265) de las cuales se conservan las fracciones Fr261 y Fr265. La fracción Fr261 se separó en TLC2 con CHCl3:benceno 8:2 obteniéndose el compuesto 5. El compuesto 5 fue purificado en TLC2 con benceno. La fracción Fr265 se separó en TLC1 con benceno: CH2Cl2:éter etílico 4,5:4,5:1 obteniéndose el compuesto 9 de forma pura. La fracción Fr27 se separó en TLC1 con benceno:CH2Cl2:acetato de etilo 4,5:4,5:1 obteniéndose tres fracciones (Fr271Fr273). La fracción Fr272 se separó en TLC2 con benceno:CH2Cl2:éter etílico 4,5:4,5:1 obteniéndose el compuesto 10.
Por otro lado, la fracción Fr3 se separó utilizando una columna de presión media utilizando como fase móvil mezclas de disolventes secos con polaridad creciente (hexano:éter 95:5, hexano:éter 85:15, hexano:éter 75:25, hexano:éter 50:50, éter 100 %). De esta separación se obtuvieron ocho fracciones (Fr31-Fr38) de las cuales se conservaron las fracciones Fr32, Fr33, Fr36 y Fr38. Las fracciones Fr32 y Fr36 precipitaron a –20 ºC obteniéndose los compuestos 6 y un derivado de ácido benzoico. La fracción Fr33 se separó en TLC1 con tolueno:MTBE 95:5 obteniéndose dos fracciones (Fr331 y Fr332). La fracción Fr332 corresponde al compuesto 3 el cual se purificó en TLC2 con tolueno:MTBE 8:2. La Fracción Fr38 se separó en TLC1 con éter:hexano 8:2 obteniéndose tres fracciones (Fr381-Fr383) de las cuales la fracción Fr383 correspondía al compuesto 4. Finalmente, la fracción Fr382 se separó en TLC2 con éter:hexano 6:2 obteniéndose el compuesto 1.
Extracto obtenido de los troncos: se desengrasó el extracto con metanol a una temperatura de -20 °C obteniéndose una masa de 11.5 g. La masa del extracto se disolvió en cloroformo, y se fraccionó en una columna (CC) de gel de sílice grueso (60-200 µm) utilizando como fase móvil mezclas de disolventes secos con polaridad creciente. Se obtuvieron cinco fracciones: FrT1 hexano:MTBE 85:15, FrT2 hexano:MTBE 65:35, FrT3 hexano:MTBE 40:60, FrT4 MTBE 100 %, FrT5 MTBE:MeOH 85:15. La fracción FrT4 se separó en TLC1 con CH2Cl2:acetato de etilo 9:1 obteniéndose cinco fracciones (FrT41-FrT45). En la fracción FrT44 se encontraba el compuesto 8 de forma pura y la fracción FrT43 se separó en TLC2 con CH2Cl2:acetato de etilo 9:1 obteniéndose el compuesto 7. La fracción FrT5 se separó en TLC1 con CH2Cl2:acetato de etilo 9:1 obteniéndose seis fracciones (FrT51-FrT56). La fracción FrT55 se separó en TLC2 con CH2Cl2:acetato de etilo 95:5 obteniéndose el compuesto 2.
Resultados
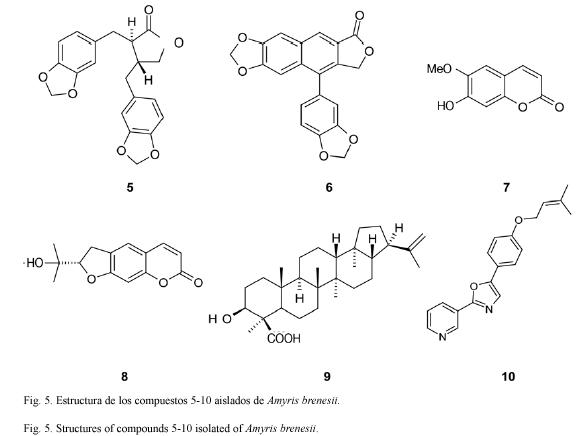
Del estudio fitoquímico de las partes aéreas de Amyris brenesii se obtuvo un total de diez compuestos puros de los cuales 1, 2, 3 y 4 son de estructura novedosa.
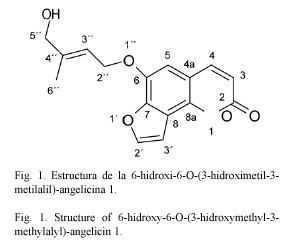
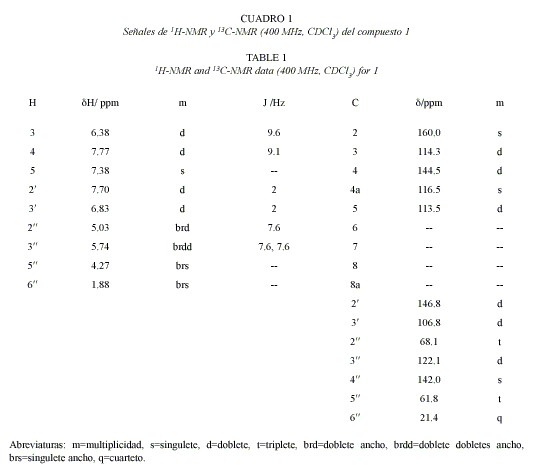
Compuesto 1: 6-hidroxi-6-O-(3-hidroximetil-3-metilalil)-angelicina. C16H14O4: 270.29 g/mol. Compuesto de estructura novedosa, 30 mg. Rf=0.46 CH2Cl2: benceno:éter etílico 4.5:4.5:1 (TLC2).
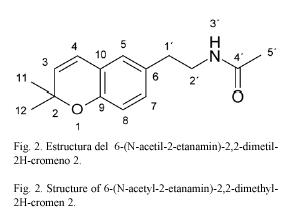
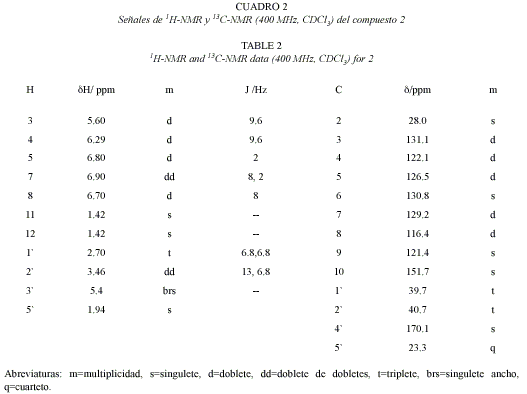
Compuesto 2: 6-(N-acetil-2-etanamin)2,2-dimetil-2H-cromeno. C15H19NO2 245.32 g/mol. Compuesto de estructura novedosa, 10 mg. Rf=0.54 CH2Cl2:acetato de etilo 95:5 (TLC2).
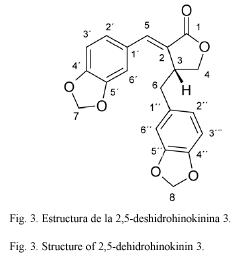
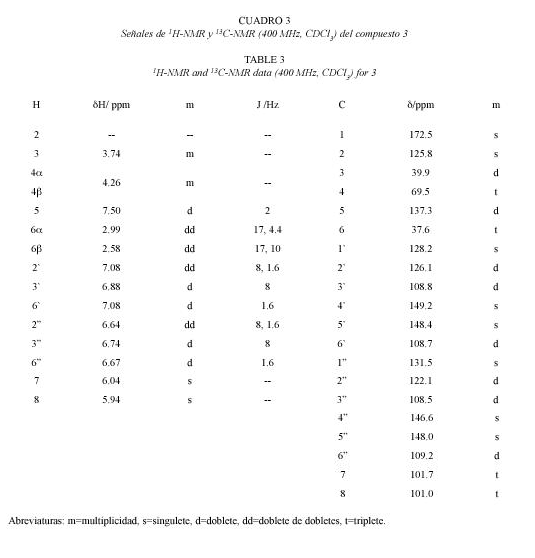
Compuesto 3: 2,5-deshidrohinokinina. C20H16O6 352.35 g/mol. Compuesto de estructura novedosa, 35 mg. Rf=0.37 benceno (TLC2).
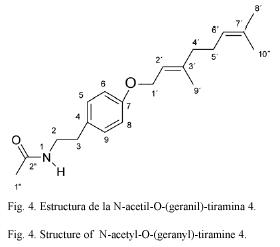
Compuesto 4: N-acetil-O-(geranil)tiramina. C20H29NO2315.46 g/mol. Compuesto de estructura novedosa, 50 mg. Rf=0.13 éter etílico:hexano 7:3 (TLC2).
Compuesto 5: Hinokinina. C20H18O6 354.36 g/mol. Compuesto de estructura conocida (Tada y Nakatsuka 1968, Kato et al. 1990), 135 mg. Rf=0.71 CHCl3:benceno 7:3 (TLC2).
Compuesto 6: Justicidina E. C20H12O6 348.32 g/mol. Compuesto de estructura conocida (Shen et al. 2004, Therien et al. 1993, Subbaraju y Pillai 1996), 41 mg. Rf=0.77 CH2Cl2: benceno:éter etílico 4.5:4.5:1 (TLC2).
Compuestos 7: Escopoletina. C10H8O4 192.19 g/mol Compuesto de estructura conocida (Hasbun-Pacheco y Calderón 1990), 10 mg. Rf=0.69 CH2Cl2:acetato de etilo 9:1 (TLC2).
Compuesto 8: Marmesina. C14H14O4 246.27 g/mol. Compuesto de estructura conocida (Hasbun-Pacheco y Castro-Castillo 1988), 100 mg. Rf=0.33 CH2Cl2 (TLC2).
Compuesto 9: Acido 24-moretenoico. C30H48O3 456.72 g/mol. Compuesto de estructura conocida (Hwang et al. 2003), 30 mg. Rf=0.58 CHCl3:benceno 7:3 (TLC2).
Compuesto10: O-(3-3-dimetilalil)halfordinol. C19H18N2O2: 306.37 g/mol. Compuesto de estructura conocida (Hasbun-Pacheco y Castro-Castillo 1988), 30 mg. Rf=0.44 CH2Cl2: benceno:éter etílico 4.5:4.5:1 (TLC2).
Discusión
De los extractos de MTBE: Metanol 9:1 de las partes aéreas de A. brenesii (hojas y troncos) se lograron aislar cuatro compuestos que no han sido reportados en la literatura. La elucidación estructural se realizó con la ayuda de técnicas espectroscópicas de Resonancia Magnética Nuclear (RMN) de una y dos dimensiones, a saber, 1H-RMN, 13C-RMN, DEPT, H,H-COSY, gHSQC, gHMBC y NOE (Efecto Nuclear Overhauser) para la determinación de la estereoquímica de los compuestos.
Los datos espectrales de 1H-RMN de 1 muestran desplazamientos químicos y multiplicidades que concuerdan con la estructura de una cumarina del tipo de la escopoletina (Cuadro 1). Sin embargo, uno de los singuletes aromáticos no se encuentra presente, sugiriendo así un nuevo patrón de sustitución. De los espectros de desacoplamiento homo- y heteronuclear se pudo deducir la presencia de un hidroximetilmetilalilo enlazado en O-6. La estereoquímica del doble enlace del sistema de isopreno se plantea Z por comparación con sistemas análogos (Kalinowski 1984). Además es posible ver del gHSQC dos carbonos (δ 106.8 d y δ 146.8 d) y dos hidrσgenos (δ 6.83 d y δ 7.70 d) que acoplan entre sν con una constante de acoplamiento de 2 Hz; este sistema de acoplamiento y los respectivos cambios químicos es típico de los anillos de furano (Murillo y Jakupovic 2000). En base a estos planteamientos se puede concluir que el compuesto 1 corresponde a una furocumarina angular con estructura análoga a la angelicina pero con un patrón de sustitución hasta ahora no reportado en O-6.
Del espectro 1H-RMN, H,H-COSY y gHSQC de 2 se puede deducir la presencia de un anillo aromático 1,2,4 trisustituido, un doble enlace cis, un sistema CH2CH2NH y un grupo acetilo. Por correlaciones del CH2 a δ 2.70 t con tres seρales del anillo aromático a δ 130.8 s, δ 129.2 d y δ126.5 d se deduce la presencia de un derivado del fragmento C6C2N; del espectro gHMBC se deriva que el NH se encuentra acetilado. Los cinco carbonos restantes sugieren la presencia de un prenilo; los dos metilos (singulete a δ 1.42) presentan correlaciones J2 y J3con δ 76.2 s y δ131.1 d (uno de los carbonos del doble enlace cis a J1con δ 5.60 d) y el hidrσgeno restante del doble enlace cis presenta correlaciones en el gHMBC con las señales del anillo aromático a δ 121.4 s, δ 126.5 d y δ 151.6 s. Estas ϊltimas observaciones concuerdan con el sistema de cromona planteado para el compuesto 2. Las correlaciones restantes en el gHMBC coinciden con la estructura indicada.
De los espectros 1H-RMN y 13C-RMN de 3 y de las correlaciones J1 obtenidas del experimento gHSQC puede detectarse para este compuesto la presencia de dos anillos aromáticos 1,3,4 trisustituidos, seis carbonos y la presencia de dos singuletes anchos en 1H-RMN (que integran para dos hidrógenos cada uno) a δ 5.94 y δ 6.04 y que correlacionan en J1 respectivamente con carbonos a δ 101.0 t y 101.7 t sugieren la presencia de dos dioxometilenos. Estas observaciones sugieren que el compuesto se trata de un lignano. Del experimento gHMBC se observa que H-5 (δ 7.50 d) presenta correlaciones heteronucleares a larga distancia con carbonos aromáticos (δ 126.1d, δ 108.7d) y ademαs con C-1 (δ 172.5 s), se sugiere que en este fragmento del fenilpropanoide el carbono C-1 se encuentra oxidado a carboxilato. Al presentar las señales de H-4, δ 4.26 m correlaciones J3 con C-1 y con C-6 (Cuadro 3), y al presentar H-6 correlaciones heteronucleares a larga distancia con tres carbonos del otro anillo aromático (δ 131.5 s, δ 122.1 d y δ 109.2 d), se pueden identificar no solo la secuencia del otro fenilpropanoide, sino también el tipo de acoplamiento que se dio entre las dos unidades C6C3, a saber, del tipo del matairesinol. Además, se puede observar que los cambios químicos de los hidrógenos de uno de los anillos aromáticos se encuentran desplazados a campo más bajo con respecto al otro. La presencia de un doble enlace entre C2 y C5 es la causante del desplazamiento a campo bajo de las señales de uno de los anillos aromáticos, además, el desplazamiento de H-5 a δ 7.50 d concuerda con su posición paralela al carbonilo y además bencílica. El compuesto posee una raíz carbonada análoga al conocido lignano hinokinina el cual también fue aislado en este trabajo (compuesto 5) pero presenta un doble enlace entre los carbonos 2 y 5 (Fig. 3). Este compuesto es un derivado de la hinokinina que no ha sido descrito en la literatura hasta el momento.
Finalmente, observando los espectros 1H-RMN y 13C-RMN del compuesto 4 se observa la presencia de un sistema aromático para sustituido, un sistema CH2CH2NH y un grupo acetilo. El sistema de la N-acetil tiramina coincide con las correlaciones observadas en el H,H-COSY y el gHMBC. Además de esto se observan diez señales en el espectro 13C-RMN, dos dobles enlaces trisustituidos, tres metilos alílicos, un alcohol alílico y dos metilenos alílicos. Estos datos concuerdan con la estructura del geranilo enlazado al oxígeno de la tiramina y de configuración E, como lo corrobora el cambio químico a δ 16.2 q de C-9`(Kalinowski 1984).
Debido a que los demás compuestos aislados (Fig. 5) ya han sido previamente descritos no se discute su elucidación estructural.
El re-estudio de la planta Amyris brenesii, revela al comparar con los metabolitos obtenidos en estudios previos de esta planta, que especímenes morfológicamente idénticos, poseen compuestos estructuralmente diferentes, lo cual sugiere que los factores geográficos y climáticos son importantes en determinar los tipos de metabolitos presentes en las plantas. La determinación de las causas de tales diferencias, escapa de los objetivos del presente trabajo.
Agradecimientos
A la fundación Volkswagen por el apoyo económico en la realización de este proyecto.
Resumen
El estudio fitoquímico de las partes aéreas de Amyris brenesii (Rutaceae) recolectadas en Río Cuarto, Grecia, Alajuela (Costa Rica) mostró la presencia de cuatro nuevos compuestos: la 6-hidroxi-6-O-(3-hidroximetil-3-metilalil)angelicina 1, el 6-(N-acetil-2-etanamin)-2,2-dimetil-2Hcromeno 2, el lignano 2,5-deshidrohinokinina 3 y la N-acetil-O-(geranil)-tiramina 4. Adicionalmente se aislaron los lignanos hinokinina 5, y justicidina E 6, las cumarinas escopoletina 7 y marmesina 8, el ácido 24-moretenoico 9 y el O-(3,3-dimetilalil)-halfordinol 10. Las separaciones se llevaron a cabo mediante la aplicación de técnicas cromatográficas y la elucidación de las estructuras se realizó con la ayuda de técnicas espectroscópicas de Resonancia Magnética Nuclear (RMN) de una y dos dimensiones.
Palabras Clave: Rutaceae, Amyris, brenesii, lignanos, furocumarina, cromona.
Recibido 14-II-2007. Corregido 30-VI-2008. Aceptado 13-III-2008.
Referencias
Basil, A.B. & H. Parkins. 1978. Amyris of Jamaica. Nicotinamides of Amyris plumieri. Tetrahedron Lett. 30: 2723-2726. [ Links ]
Cordova, H.E. & L.E. Garelli. 1974. A new coumarin in Amyris simplicifolia. Phytochemistry 13: 758-760. [ Links ]
Domínguez, X.A., G. Cano, I. Luna & A. Dieck. 1977. Two coumarins from the aereal parts of Amyris madrensis. Phytochemistry 16: 1090. [ Links ]
Dominguez, X.A., R. Franco, G. Cano, S. García, A. Dieck, A. Celia, A. Pedroza & I. Martínez. 1985. Three Pyranocoumarins from Amyris marshaii standl. Rev. Latinoamer. Quim. 16: 52-53. [ Links ]
Hasbun-Pacheco, C. & M. Calderón. 1990. 2,5-Diaryloxazols and coumarins from roots of Amyris brenesii. Fitoterapia 61: 88. [ Links ]
Hasbun-Pacheco, C. & O. Castro-Castillo. 1986. Coumarins from bark of Amyris barbata. J. Nat. Prod. 49: 948-949. [ Links ]
Hasbun-Pacheco, C. & O. Castro-Castillo. 1988. Ocurrence of coumarins and amides in the bark of three Amyris species from Costa Rica. Spect. Intern. J. 6: 181-184. [ Links ]
Hasbun-Pacheco, C. & O. Castro-Castillo. 1988. A new benzamide from bark of Amyris brenesii. J. Nat. Prod. 51: 817-818. [ Links ]
Holdridge, L.R. & L.J. Poveda. 1975. Árboles de Costa Rica, Centro Científico Tropical, San José, Costa Rica. [ Links ]
Hwang, B.Y., H.B. Chai, B.S. Leonardus, S. Riswan, N.R. Farnsworth, G.A. Cordell, J.M. Pezzuto & A.D. Kinghorn. 2003. Cytotoxic triterpens from the twigs of Celtis phiplipinensis. Phytochemistry 62: 197-201. [ Links ]
Kalinowski, H.O., S. Berger & S. Braun. 1984. 13C NMR Spektroskopie. Georg Thieme Stuttgart, Alemania. [ Links ]
Kato, M.J., M. Yoshida & O.R. Gottlieb. 1990. Lignoids and arylalkanones from fruit of Virola elongata. Phytochemistry 29: 1799-810. [ Links ]
Murillo, R. & J. Jakupovic. 2000. Clerodanos y secoclerodanos de Croton jimenezii. Ing. Cienc. Quim. 19:68. [ Links ]
Seida, A. 1979. A Isolation, identification and structure elucidation of cytotoxic and antitumor principles from Ailantus integrifolia, Amyris pinnata and Balanites aegyptiaca. Diss. Abstr. Int. (Sci). 39: 4843. [ Links ]
Shen, C.C., C.L. Ni, Y.L. Huang, R.L. Huang & C.C. Chen. 2004. Furanolabdane diterpenes from Hypoestes purpurea. J. Nat. Prod. 67: 1947-194 [ Links ]
Subbaraju, G.V. & K.R. Pillai. 1996. Lignans from Justicia diffusa Willd. Indian J. Chem. 35: 1233-1234. [ Links ]
Tada, T. & T. Nakatsuka. 1968. Wood extractives of Asunaro. Mokuzai Gakkaishi. 14: 344. [ Links ]
Therien, M., B.J. Fitzsimmons, J. Scheigetz, D. Macdonald, L.Y. Choo, J. Guay, J.P. Falgueyret & D. Riendeau. 1993. Justicidin E: a new leukotriene biosynthesis inhibitor. Bioorg. Med. Chem. Lett. 3: 2063-2066. [ Links ]
Referencias de Internet
Instituto Nacional de Biodiversidad INBio. 2005. (Consultado: Junio, 2005; http://www.inbio.ac.cr/ bims/k03/p13/c045/o0133/f01656.htm). [ Links ]












 uBio
uBio