Services on Demand
Journal
Article
Indicators
-
 Cited by SciELO
Cited by SciELO -
 Access statistics
Access statistics
Related links
-
 Similars in
SciELO
Similars in
SciELO  uBio
uBio
Share
Revista de Biología Tropical
On-line version ISSN 0034-7744Print version ISSN 0034-7744
Rev. biol. trop vol.55 n.1 San José Mar. 2007
Obtención de masas ovígeras del caracol lancetilla, Strombus pugilis (Mesogastropoda: Strombidae) en condiciones de laboratorio
Andrés Martín Góngora Gómez1,3, Ana Laura Domínguez Orozco1, Norma Patricia Muñoz Sevilla1 & Luis Alfonso Rodríguez Gil2
Recibido 20-V-2004. Corregido 07-III-2006. Aceptado 15-XII-2006.
Abstract: Obtaining of egg masses of the snail, Strombus pugilis (Mesogastropoda: Strombidae) under laboratory conditions. The survival, reproduction and embryonic development of Strombus pugilis, were determined during a period of ten months under laboratory conditions. Seven progenitors were collected in Contoy Island, Quintana Roo, Mexico and later transferred to the laboratory, where they were placed in aquarium with 80 l of sea water and fed with "pellets". A total of 30 egg masses were collected, one on September and the other on April. The estimated total length of one egg mass was 11.24 m; the mean number of embryos obtained per 2 cm was 264, obtaining an estimated total of 157 500 embryos in the egg mass. The means of the physical-chemical parameters during the study were: salinity 37.6±0.5 , pH 7.5±0.5 and temperature 28±0.2 °C. The maintenance and water recirculation system used to sustain the breading stock is excellent both for reproduction of the organism and for obtaining egg masses under controlled conditions. Rev. Biol. Trop. 55 (1): 183-188. Epub 2007 March. 31.
Key words: Strombus pugilis, Strombidae, egg masses, aquaculture, Mexico.
El caracol "lancetilla", S. pugilis (Linnaeus, 1758) es una de las seis especies de gasterópodos del género Strombus distribuidos ampliamente desde el sudeste de la Florida, las Islas Bermudas, América Central, el sureste del Golfo de México, incluyendo la Península de Yucatán, y por todo el Caribe 1977, Aldana y Patiño 1998). Si bien la importancia comercial de esta especie es menor a aquella atribuida al caracol rosado, S. gigas (Linnaeus, 1758), su pesquería representa una fuente laboral y alimenticia para los habitantes de la región Caribeña. En México, se extrae de manera intensiva en las costas del Golfo de México (Aldana y Baqueiro 1997, Aldana y Patiño 1998). La producción en 1983 alcanzó un máximo de 1 250 ton en Yucatán, lo cual generó ingresos a los pescadores de aproximadamente US $200 000. La alta demanda del recurso y factores alternos, como es el desarrollo de la actividad turística en la región han propiciado que estos organismos disminuyan en abundancia (Solís 1994, Baqueiro 1997, hasta Venezuela y Brasil (Morris 1975, Linder Brito et al. 1998, Brito et al. 1999, Brito y Aldana 2000). Es debido a la sobreexplotación a la cual está siendo sometida esta especie, que se consideró necesario realizar este trabajo, el cuál, con sus resultados auxiliará en el manejo y recupe ración de la pesquería de este molusco, cuya explotación controlada podría ser interesante en términos pesquero-comerciales para los países en donde este ejemplar habita. El objetivo del presente estudio fue determinar la producción masiva de puestas de masas ovígeras del caracol lancetilla S. pugilis en el laboratorio.
Materiales y métodos
Tratamiento del agua de mar: El agua de mar fue tratada con un filtro de arena (Baker Hydro, modelo TSF-24), filtros de cartucho de polipropileno y celulosa (Cole Parmer) con una capacidad de retención de 25, 15 y 5 µm. Finalmente el agua pasó por una batería de luz ultravioleta (Rodríguez 1995, Brito et al. 1998, Brito et al. 1999, Góngora 1999).
Colecta y establecimiento de los progenitores: Siete progenitores fueron recoleccióndos mediante buceo autónomo en diferentes puntos de Isla Contoy, Quintana Roo, México a profundidades de 3.5-4 m, sobre arena fangosa y el pasto marino Syringodium filiforme (Kutzing, 1860) y Thalassia testudinum (Banks ex Koning, 1805). De los siete progenitores recoleccióndos, cinco fueron hembras y dos machos, éstos fueron colocados en contenedores de plástico con agua de mar a 28 ºC y salinidad de 38 . Posteriormente, fueron trasladados al laboratorio teniendo cuidado que durante el traslado la temperatura no rebasara los 32 ºC (Rodríguez 1995, Góngora 1999).
Sistema de mantenimiento de los progenitores: Los progenitores fueron colocados en un acuario de 80 l con agua de mar previamente filtrada y esterilizada con luz UV, velocidad de flujo de 200 ml/min con una tasa de recambio de volumen total de 5 h y filtro biológico formado de arena, graba, tul, lámina de fibra de vidrio y tubos de PVC respectivamente. Se aplicó aireación y calefacción al agua para conservar la temperatura a 28 ºC. Se tomaron lecturas periódicas de pH, salinidad y temperatura. Los progenitores fueron nutridos con alimento peletizado (Rodríguez 1986).
Obtención, limpieza y observación de las masas ovígeras: Las masas ovígeras obtenidas fueron tamizadas con la ayuda de un colador de 1 mm de luz de malla para eliminar el exceso de arena. Con la finalidad de eliminar protozoarios y otras especies indeseables se procedió a pasar las masas de huevos por cuatro contenedores, el primero de ellos con una solución de cloro comercial (NaClO) y agua de mar filtrada al 0.2 % entre 30 y 40 s. Inmediatamente después se colocaron en otros tres recipientes conteniendo agua de mar filtrada para eliminar la solución de cloro (Berg 1976, Siddall 1979, Berg 1981, Pillsbury 1985, Rodríguez 1995, Brito et al. 1998, Brito y Aldana 2000). Las masas ovígeras fueron observadas bajo un microscopio óptico de campo oscuro para verificar que los huevos fueran fértiles, viables, y que se encontraran en el mismo estadio de desarrollo, es decir con la membrana de fertilización presente.
Incubación: La masa de huevos fue desplegada y fraccionada en 15 secciones de 2 cm para contar el número de embriones presentes en cada fracción y en toda la masa ovígera. Cada fracción se colocó en un vaso de precipitado de 1 000 ml con agua de mar filtrada a una salinidad 37 ppm y temperatura de 28 ºC, luego los vasos fueron colocados en incubadoras con agua de mar con los mismos parámetros físicoquímicos, esto para llevar a cabo el desarrollo embrionario y posteriormente la eclosión. Se tomaron lecturas semanales de salinidad, pH y temperatura. Con la finalidad de evitar contaminación del medio externo, las tinas se cubrieron con malla y con un sistema de aireación en el agua (Rodríguez 1990, Aldana y Patiño 1998, Góngora 1999).
Resultados
Las conchas de los gasterópodos strombidos carecen de dimorfismo sexual, por lo que para la determinación del sexo, es necesario observar las partes blandas buscando la presencia o ausencia de pene. Las hembras depositaron en el fondo del acuario un total de 30 masas ovígeras (septiembre de 1996 a junio de 1997), formando una gran freza, las cuales son cubiertas con granos de arena. Al inicio del experimento, durante el mes de septiembre, se recolecciónron 11 masas ovígeras, posteriormente se observó una disminución drástica de éstas, durante el mes de octubre, fue durante los meses de noviembre a febrero que no se obtuvo ninguna masa ovígera. Es durante el mes de marzo en que nuevamente se aprecia un notable aumento en el número de masas de huevos, siendo el mes de abril donde se obtuvo el mayor valor. Posteriormente, éstas disminuyen gradualmente hasta la finalización del experimento en junio (Fig. 1). El tiempo registrado de eclosión, a una temperatura de 28 ºC, fue de 70 h. El número total de embriones obtenidos fue estimado mensual-mente con base en la relación del peso de la masa ovígera de una sola hembra (1.031 g) y el número de embriones (148 368) presentes en toda la masa de huevos (Fig. 2). La longitud total de la masa de huevos fue de 11.24 m y el número de embriones contados en 2 cm fue 264.
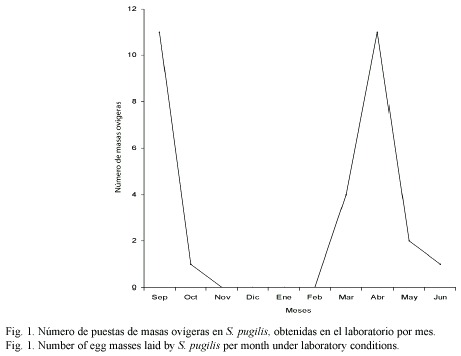
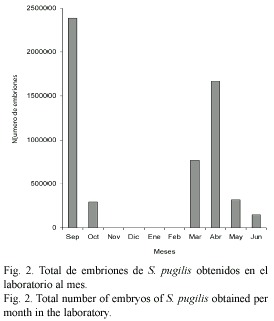
Los resultados promedio de los parámetros físico-químicos fueron los siguientes: temperatura 28±0.2 ºC, salinidad 37.5±0.5 y pH 7.5±0.5.
Discusión
No se observó ninguna relación entre la longitud-peso de los organismo con respecto al número total de masas de huevos y la frecuencia de ovoposición, cada organismo ovopositó más de una vez (Cuadro 1). Sin embargo, existen notorias diferencias tanto en el número total de embriones como en la longitud de la masa ovígera entre diversas especies de caracoles del mismo género obtenidas en laboratorio.
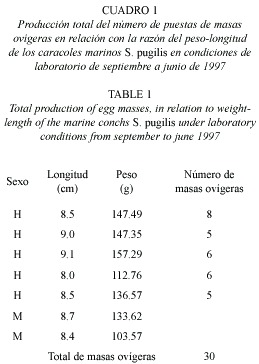
La longitud de la masa ovígera para S. pugilis en este estudio y el número de embriones por masa ovígera, así como el número de éstos por mm, se pueden considerar que el promedio en este estudio coincide con lo registrado para otros strombidos (Cuadro 2). S. tricornis (Lightfoot, 1786) presentó una longitud en la masa de huevos de 3-4 m, el número total de embriones por masa ovígera fue de 1 800-2 800 y de 6-7 cigotos por cm (Robertson 1959); mientras que S. gigas presentó una longitud en la masa ovígera de 22.6 m, el número total de embriones en toda la masa fue de 385 000-430 000 y con 17-19 cigotos por milímetro (Eisawy y Sorial 1968). Fecundidades altas en animales van acompañadas de mortalidades larvales altas (Spight 1976). Una hembra, en promedio, produce tal cantidad de huevos durante su ciclo de vida que asegura que al menos una hembra de su descendencia sobreviva y se reproduzca, como Spight (1975) dedujo de estudios sobre fecundidad, estructura de tallas y conteo de jóvenes de Thais lamellosa (Gmelin, 1791).
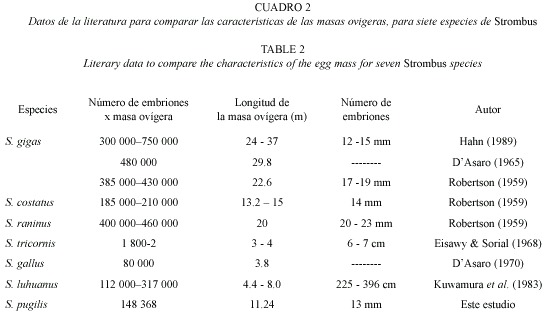
La temperatura tiene un impacto significativo en el desarrollo larvario, este hecho es claro en los estudios realizados con otras especies de strombidos: como lo ocurrido para S. costatus (Gmelin, 1791) a una temperatura del agua de 28 ºC, el desarrollo tomó 100 h hasta la eclosión, el periodo de desarrollo de S. gigas para esa misma temperatura hasta la fase de eclosión tarda solamente 82.5 h, mientras para S. raninus (Gmelin, 1791) la eclosión resultó ser de 80 h. En el presente trabajo el tiempo registrado de eclosión para S. pugilis a una temperatura de 28 ºC resultó ser de 70 h, el cual es rápido, si es comparado con otras especies de strombidos (Robertson 1959). La temperatura en nuestro estudio (28 ºC) fue similar a la temperatura del agua en el campo de marzo a septiembre, periodo en el que se efectúa el desove en el medio natural (Bandel 1976). La comparación entre estas especies se realizó con base en que éstas son las que representan una fuente laboral y alimenticia para los habitantes de la región caribeña.
Roller y Stickle (1989) encontraron que salinidades bajas retardan el desarrollo intra-capsular del murícido Thais haemastoma canaliculata (Gray, 1839). Gallardo (1994) también demostró el mismo efecto en Concholepas concholepas (Brugiere, 1789). En este trabajo, la salinidad no afectó el desarrollo intracapsular de S. pugilis. Se recomienda para futuros experimentos sobre desarrollo intracapsular, poner más atención en mantener estables las condiciones de temperatura y salinidad de los sistemas de cultivo.
Las condiciones empleadas, así como el sistema de mantenimiento de los progenitores, resultaron ser excelentes para la obtención de las masas ovígeras en el laboratorio, así como la supervivencia y reproducción de los progenitores en condiciones controladas. Los resultados de esta investigación aportaron información necesaria para la biología de esta especie de reciente importancia pesquera.
Agradecimientos
Esta investigación fue financiada por CONACYT, proyecto 950503 (Implantación de una biotecnología para el cultivo masivo de larvas de caracol S. costatus de interés comercial para su repoblación y preservación en la Península de Yucatán).
Resumen
Se determinó la supervivencia, reproducción y el desarrollo embrionario del caracol Strombus pugilis, por un periodo de diez meses en condiciones de laboratorio. Siete progenitores fueron recolectados en Isla Contoy, Quintana Roo, México y posteriormente trasladados al laboratorio donde fueron colocados en acuarios de 80 l con agua de mar y alimentados con alimento granulado. Un total de 30 masas ovígeras fueron recolectadas, lográndose un aumento en el número de masas de huevos en abril. La longitud total estimada de una sola masa ovígera fue de 11.24 m, el número promedio de embriones encontrados en 2 cm fue de 264, obteniéndose un total de 157 500 embriones en toda la masa de huevos. Los resultados promedio de los parámetros físico-químicos a lo largo del periodo de estudio fueron los siguientes: salinidad de 37.5±0.5 , pH 7.5±0.5 y temperatura de 28±0.2 °C. Con los datos aportados en este estudio se infiere que este sistema de mantenimiento y recirculación de los progenitores es excelente tanto para la reproducción como para la obtención de las masas ovígeras en condiciones controladas.
Palabras clave: Strombus pugilis, Strombidae, masas ovígeras, acuicultura, México.
Referencias
Aldana, A.D. & E. Baqueiro. 1997. Los moluscos en México: estudio y aprovechamiento. Academia 27: 33-45. [ Links ]
Aldana, A.D. & V. Patiño. 1998. Overview of diets used in larviculture of three Caribbean conchs: queen conch Strombus gigas, milk conch Strombus costatus and fighting conch Strombus pugilis. Aquaculture 167: 163-178. [ Links ]
Bandel, K. 1976. Die Gelege Karibischer Vertreter aus den Uberfamilien Strombacea, Naticacea und Tonnacea (Mesogastropoda) sowie Beobachtungen im Meer und Aquarium. Mitt. Inst. Colombo-Aleman. Invest. Cient. 8: 105-139. [ Links ]
Baqueiro, C.E. 1997. The molluscan fisheries of Mexico, p. 39-49. In C.L. MacKenzie, Jr., V.G. Burrell, Jr., A. Rosenfield & W.L. Hobart (eds.). The history, present condition and future of the molluscan fisheries of North and Central American and Europe. U.S. Dep. Commer., NOAA Tech. Rep. NMFS 128. [ Links ]
Berg, C.J. 1976. Growth of the queen conch Strombus gigas, with a discussion of the practicality of its mariculture. Mar. Biol. 34: 191-199. [ Links ]
Berg, C.J. 1981. Queen conch fisheries and mariculture meeting. The Wallece Groves Foundation, Freeport, Bahamas. 46 p. [ Links ]
Brito, M.N. & D. Aldana. 2000. Embrionary development of Strombus pugilis (Mesogastropoda: Strombidae) in the laboratory. Rev. Biol. Trop. 48: 59-64. [ Links ]
Brito, M.N., D. Aldana & T. Brulé. 1998. Development, growth and survival of larvae of the fighting conch Strombus pugilis L. (Mollusca, Gastropoda) in the laboratory. Bull. Mar. Sci. 64: 201-208. [ Links ]
Brito, M.N., D. Aldana & T. Brulé. 1999. Effects of photoperiod on development, growth and survival of larvae of thefighting conch Strombus pugilis in the laboratory. Aquaculture 167: 27-34. [ Links ]
Eisawy, A. & A. Sorial. 1968. The egg-masses, development and metamorphosis of Strombus (Monodactylus) tricornis Lamarck. Institute of Oceanography and Fisheries, Al-Gardaga, United Arab Republic. Proc. Malac. Soc. Lond. 38: 13-26. [ Links ]
Gallardo, C.S. 1994. Efecto de diferentes salinidades en la supervivencia embrionaria y desarrollo intracapsular del gastrópodo Concholepas concholepas (Brugiere, 1789) en condiciones de laboratorio. Rev. Biol. Mar. 29: 263-279. [ Links ]
Góngora, G.A. 1999. Efecto de la temperatura sobre el desarrollo embrionario del caracol marino Strombus pugilis (L). Tesis de Licenciatura, Universidad Autónoma de Yucatán, Mérida, México. 38 p. [ Links ]
Linder, G. 1977. Moluscos y caracoles. Omega, Nueva York, EEUU. 112 p. [ Links ]
Morris, P.A. 1975. A field guide to shell of the Atlantic and Gulf coast and the West Indies. Houghton Miflin, Boston, EEUU. p. 167-170. [ Links ]
Pillsbury, K.S. 1985. Relative food value and biochemical composition of five Phytoplankton diets for queen conch, Strombus gigas (L) larvae. J. Exp. Mar. Biol. Ecol. 74: 241-257. [ Links ]
Robertson, R. 1959. Observation on the spawn and veligers of conch (Strombus) in the Bahamas. Proc. Malac. Soc. Lond. 33: 164-171. [ Links ]
Rodríguez, G.A. 1986. Desarrollo embrionario y metamorfosis del caracol rosado Strombus gigas. Tesis de Maestría, Centro de Investigación y Estudios Avanzados, Mérida, México. 43 p. [ Links ]
Rodríguez, G.A. 1990. Cría del caracol rosado, Strombus gigas (L) en dos sistemas diferentes. 43rd. Annual Proc. Gulf and Carib. Fish. Inst. Inc. (GCFI), EEUU. p. 4-9. [ Links ]
Rodríguez, G.A. 1995. Eclosión del caracol de leche, Strombus costatus basado sobre el desarrollo embrionario. Rev. del Centro de Graduados e Invest. I.T.M 23: 1-18. [ Links ]
Roller, R.A. & W.B. Stickle. 1989. Temperature and salinity effects of the intracapsular development, metabolic rates, and survival to hatching of Thais haemastoma canaliculata (Gray) (Prosobranchia: Muricidae) under laboratory conditions. Am. Malac. Bull. 6: 189-197. [ Links ]
Siddall, S.E. 1979. Temporal changes in the salinity and temperature requirements of tropical mussel larvae. Proc. World Mariculture Soc. 9: 546-566. [ Links ]
Solís, R.M. 1994. Mollusca de la península de Yucatán, México. Recursos faunísticos del litoral de la Península de Yucatán. Universidad Autónoma de Campeche, Mérida, México. p. 2-32. [ Links ]
Spight, T.M. 1975. On a snails chances of becoming a year old. OIKOS 26: 9-14. [ Links ]
Spight, T.M. 1976. Ecology of hatching size for marine snails. Oecologia, Berlin. 24: 283-294. [ Links ]














