Services on Demand
Journal
Article
Indicators
-
 Cited by SciELO
Cited by SciELO -
 Access statistics
Access statistics
Related links
-
 Similars in
SciELO
Similars in
SciELO  uBio
uBio
Share
Revista de Biología Tropical
On-line version ISSN 0034-7744Print version ISSN 0034-7744
Rev. biol. trop vol.55 n.1 San José Mar. 2007
¿Controla la biomasa de pastos marinos la densidad de los peracáridos (Crustacea: Peracarida) en lagunas tropicales?
Ignacio Winfield1, Sergio Cházaro-Olvera1 & Fernando Álvarez2
1 Laboratorio de Ecología de Crustáceos, Facultad de Estudios Superiores Iztacala. Universidad Nacional Autónoma de México, Ap. Postal 314, Tlalnepantla, Estado de México. C.P. 54090. Telef/Fax +56231147 ; ignacioc@servidor. unam.mx
2 Colección Nacional de Crustáceos, Instituto de Biología. Universidad Nacional Autónoma de México, México DF, México
Recibido 20-X-2003. Corregido 02-XII-2005. Aceptado 29-VIII-2006.
Abstract: Does sea-grass biomass control the density of peracarids (Crustacea: Peracarida) in tropical lagoons? We analyzed the time-space variation of the peracarid crustaceans that inhabit seagrasses of the Alvarado Lagoon System, Veracruz, Gulf of Mexico. The organisms were collected from 108 samples in six sites with Ruppia maritima beds (December 1992 to November 1994). The assemblage was composed of 11 species. Eight species of Amphipoda (Hourstonius laguna, Cerapus benthophilus, Apocorophium louisianum, Grandidierella bonnieroides, Leptocheirus rhizophorae, Gammarus mucronatus, Melita longisetosa and Haustorius sp.), one of Isopoda (Cassidinidea ovalis) and two of Tanaidacea (Discapseudes holthuisi and Leptochelia savignyi) were identified. Taxocoenosis, density and biomass of peracarids showed seasonal pulses related to R. maritima biomass, salinity variation, epicontinental affluent and inlets. The species C. ovalis, G. mucronatus, A. louisianum and D. holthuisi were dominant. Rev. Biol. Trop. 55 (1): 43-53. Epub 2007 March. 31.
Key words: Ruppia maritima, Alvarado Lagoon System, Gulf of Mexico.
La vegetación acuática sumergida (VAS) constituye un hábitat importante en los ecosistemas costeros (Álvarez et al. 1996) al capturar y almacenar nutrientes y estabilizar los sedimentos (Macia y Lirman 1999). Su cobertura y distribución, desde los mares tropicales hasta los templados-fríos (Jernakoff et al. 1996), están determinadas por la salinidad, la temperatura (Livingston et al. 1998), la luz (Herzka y Dunton 1997), la materia orgánica disuelta (Peterson y Heck 1999) y la fuerza del viento (Bostroem y Bonsdorff 2000). Diferentes especies de larvas, juveniles y adultos de peces e invertebrados utilizan la VAS para alimentación, reproducción, crianza y refugio (Bostroen y Mattila 1999, Castillo- Rivera y Kobelkowsky 2000, Minello et al. 2003); facilitando diferentes actividades pesqueras regionales (Scott-Denton 1999, Howe y Wallace 2000).
La VAS en el Golfo de México (GM) tiene una extensión amplia en la zona costera (Onuf 1996), representada por Thalassia testudinum Banks y Soland ex Köening, 1805; Halodule wrightii Ascherson, 1868; Syringodium filiforme Kützing, 1860 y Ruppia maritima (L) (Lot et al. 1999). Los crustáceos peracáridos asociados a estas praderas constituyen un grupo dominante de la epifauna (Markham et al. 1990, Winfield et al. 2001), son un recurso alimenticio para los peces (Mason y Zengel 1996) y presentan variaciones en su abundancia, densidad y riqueza de especies con base en la arquitectura ambiental (Lewis 1987, Knowels y Bell 1998).
En particular, en el sistema lagunar de Alvarado (SLA) domina R. maritima con base en su cobertura y extensión (Winfield et al. 2001), por lo que constituye un hábitat fundamental para alimentación, reproducción, refugio y crianza de la epifauna asociada. Así, este estudio analizó la relación entre la variación de la densidad de los peracáridos y los cambios de la profundidad, la temperatura, la salinidad y la biomasa de R. maritima en el SLA, estado de Veracruz, suroeste del Golfo de México.
Material y métodos
El SLA (18º43-18º54 N; 95º44-95º57 W) se compone de tres lagunas: Camaronera, Buen País y Alvarado (Fig. 1), con una extensión de 86 609 km2 y una longitud de 26 km. Se comunica con el mar mediante una boca permanente, Boca de Alvarado (BA) y un canal artificial, Boca Camaronera (BC) (Anónimo 1977). Las praderas de R. maritima se distribuyen en la parte interna de la barra de laguna de Alvarado y en los márgenes de las lagunas Buen País y Camaronera. El SLA es oligohalino durante los meses de lluvias y nortes y, durante los meses de estío, polihalino-mesohalino (Cházaro et al. 2002).
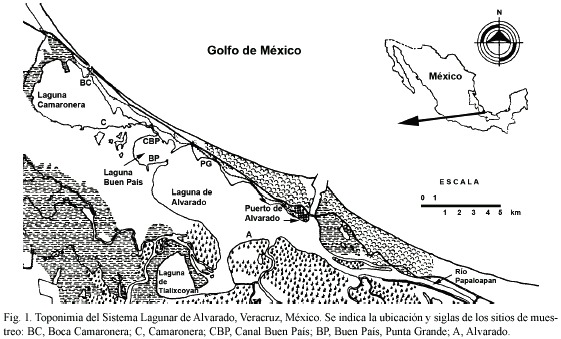
Fueron ubicados seis sitios de muestreo a lo largo del SLA (Fig. 1), de diciembre de 1992 a noviembre de 1994, con una periodicidad de muestreo cada 40 días y un total de 108 muestras colectadas. En cada localidad se delimitó un área de 0.042 m2, donde se cubrió la zona foliar con una red de nylon (600 µm de abertura de malla) cortándose de la parte basal. Las muestras se fijaron con formaldehído para posteriormente separar los peracáridos y preservarlos con etanol al 70 % en el Laboratorio de Ecología de Crustáceos. La biomasa de los pastos se obtuvo por el pesado de las hojas, libres de fauna y sedimento y se expresó en gramos peso húmedo (gph·m-2) siguiendo el protocolo propuesto por Ott (1990). El peso se determinó en una balanza semianalítica (±0.001 mg de precisión). En el campo se midió la profundidad (m) con un flexómetro de campo, la temperatura (°C) con un termómetro de cubeta y la salinidad () con un refractómetro American Optical.
El análisis estadístico de los datos ambientales, incluyó un análisis de ordenación por componentes principales (ACP), usando la matriz de correlación para comprobar la existencia de patrones temporales entre la profundidad, la temperatura, la salinidad y la biomasa de R. maritima (Pielou 1984, Ludwing y Reynolds 1988). Con los organismos separados se procedió a cuantificar su densidad, expresada como número de individuos por metro cuadrado (N·m-2) por cada localidad y mes de muestreo (Phillips y McRoy 1990), así como una correlación múltiple entre los parámetros ambientales, la biomasa de R. maritima y la densidad de los peracáridos. El procesamiento de los datos se efectuó con el paquete de cómputo BioDiversity Professional Beta I (McAleece 1997) y ANACOM V.3 (de la Cruz 1994).
Resultados
Parámetros ambientales: el SLA presentó variaciones temporales en la profundidad, la temperatura y la salinidad superficial, así como en la biomasa de R. maritima. El intervalo de profundidad fue de 0.46 a 0.99 m. Se diferenció un esquema recurrente en los dos años de estudio marcado por el descenso en la profundidad de diciembre a febrero y por un incremento de agosto a principios de noviembre. La temperatura superficial del agua fluctuó entre 16 y 33 ºC, con un decremento de noviembre a febrero y un incremento desde abril hasta agosto (Fig. 2A). La salinidad promedio varió de 0.5 a 16.8 . Las condiciones oligohalinas (salinidad de 0.5 a 5.0 ) prevalecieron desde julio hasta febrero, a diferencia de marzo a junio, donde predominaron las condiciones mesohalinas (salinidad de 5.0 a 18.0 ) (Fig. 2B). La biomasa de R. maritima varió de 961 a 4 544 gph·m-2. Se reconoció un esquema polimodal en el incremento de biomasa en 1993 con dos ligeros aumentos en enero y abril y un máximo de agosto a septiembre. En el año 1994, la biomasa tuvo un comportamiento unimodal con un máximo entre julio y septiembre (Fig. 2C).
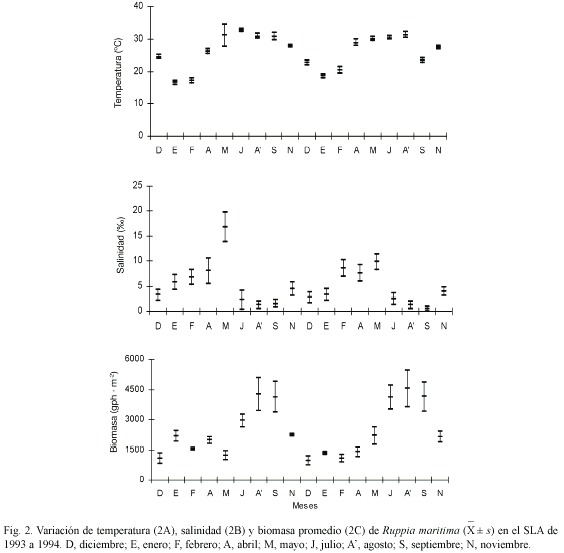
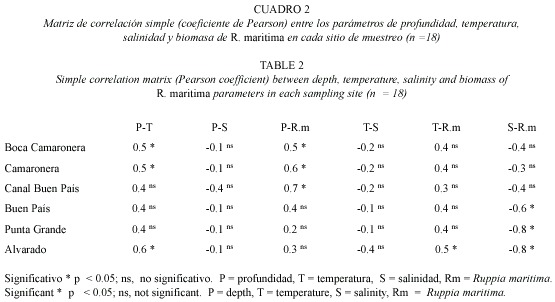
En el SLA, la profundidad mayor se localizó en los canales de navegación, las bocas de comunicación con el mar y en la conexión con los ríos. Se diferenció una disminución en la profundidad hacia Camaronera (C) y la parte central de la barra de laguna de Alvarado. La temperatura superficial fue constante entre 26 y 27 ºC. Este sistema se consideró como oligohalino, particularmente en Alvarado (A) y Buen País (BP); a diferencia de C donde predominaron las condiciones mesohalinas en los dos años de estudio. Se reconoció a Boca Camaronera (BC), Canal Buen País (CBP) y A como las áreas con biomasa menor de R. maritima, a diferencia de C, BP y Punta Grande (PG) con los valores más altos (Cuadro 2).
Con base en el ACP, la biomasa de R. maritima y la salinidad explicaron el 83.8 % de la variabilidad total: 57.6 % para el componente I y 26.2 % para el componente II. Al representar gráficamente el comportamiento de los meses por el ACP, se diferenciaron cuatro grupos: el primero formado por abril y mayo, el segundo por diciembre, enero y febrero, el tercero por noviembre y el cuarto por julio, agosto y septiembre (Fig. 3). Los meses de abril y mayo representaron la temporada de secas, que se caracterizó por un incremento en la salinidad en el sistema lagunar y un ligero aumento de la biomasa de R. maritima, particularmente en la barra interna y parte sureste con condiciones oligohalinas. La temporada de nortes se presentó de diciembre a febrero con una disminución en la biomasa de esta macrófita y en la salinidad, y finalmente, la temporada de lluvias de julio a septiembre con un descenso en la salinidad en todo el sistema y un incremento en la biomasa de R. maritima.
En BC y C la correlación fue significativa (Spearman p<0.05) entre la biomasa de R. maritima y la profundidad, y entre la temperatura y la profundidad. Para CBP solamente se correlacionaron significativamente (Spearman p<0.05) la profundidad y la biomasa de R. maritima. Por otra parte, para BP y PG se presentó una correlación significativa (Spearman p<0.05) entre la salinidad y la biomasa de R. maritima, y finalmente, para A la correlación fue significativa (Spearman p<0.05) entre la profundidad y la temperatura, la temperatura y la biomasa de R. maritima, y la salinidad y la biomasa de R. maritima (Cuadro 2).
Componente biótico: un total de 124 689 organismos fueron recolectados, agrupados en tres órdenes, ocho familias y 11 especies (Apéndice 1). El orden Amphipoda se diferenció por su abundancia mayor con un total de 65 318 individuos (52 %), el orden Isopoda con 44 335 individuos (36 %) y el orden Tanaidacea con 15 036 individuos (12 %). La densidad de los crustáceos peracáridos en el SLA varió temporalmente entre 2 335 a 15 251 N·m-2. Para el año 1993, el valor mínimo fue en diciembre con 3 363 N·m-2 y el máximo para agosto con 13 817 N·m-2. Para 1994 el valor mínimo fue en febrero con 2 335 N·m-2, contrariamente a agosto con 15 251 N·m-2. Se diferenció durante el primer año de estudio un esquema polimodal en la densidad de los peracáridos: dos ligeros incrementos durante enero y abril, con un aumento diferencial entre julio y septiembre. Para el segundo ciclo anual ocurrió un esquema bimodal con un aumento ligero en enero y un repunte, nuevamente diferencial, entre julio y septiembre (Fig. 4).

Las regiones centrales del SLA con una incidencia mayor de R. maritima, por ejemplo, la región SE de la laguna Camaronera, BP y sector medio de la barra interna de laguna de Alvarado, registraron las densidades mayores (2 390 a 3 825 N·m-2); a diferencia de las áreas de comunicación con el mar, el canal de navegación y las zonas con influencia epicontinental, donde las densidades disminuyeron (1 059 a 557 N·m-2). La C registró el número mayor de individuos durante el ciclo bianual con 42 075 N·m-2 y un promedio de 3 825 N·m-2(Cuadro 1). Del análisis de correlación múltiple entre los parámetros ambientales versus la densidad de peracáridos, se obtuvieron relaciones significativas (Pearson p<0.05) entre la biomasa, a diferencia de CBP con la menor densidad (6 129 N·m-2) y un promedio de 557 N·m-2 de R. maritima (r= 0.9 p<0.05), la profundidad (r= 0.7 p<0.05), y de manera negativa con la salinidad (r= -0.6 p<0.05) (Cuadro 2).
DISCUSIÓN
Parámetros ambientales: González-Gutiérrez (1977) y Verhoeven (1979) documentaron la temperatura como un factor determinante en la biomasa y la distribución del género Ruppia. Kinney y Roman (1998) informaron un incremento de cerca del 50 % en la biomasa de R. marítima en los humedales del estado de Maine entre junio y agosto. Rojas-Galaviz et al. (1992) consideraron que los valores más altos en la biomasa de pastos marinos en la laguna de Términos, suroeste del Golfo de México, ocurrieron durante la temporada de secas y los más bajos en lluvias y nortes. A diferencia, en el SLA los valores máximos de biomasa de R. maritima se registraron durante la época de lluvias, con una disminución para nortes y principios de secas. Así, las variaciones temporales en la biomasa de R. maritima fueron el reflejo de las fluctuaciones en la salinidad principalmente, y secundariamente, de la profundidad en las zonas litorales del sistema y del incremento de la columna de agua.
Como producto de estos patrones, la salinidad en el estrato superficial de la columna de agua tuvo gran importancia en el régimen hidrológico con valores de 2.4 a 6.7 y un promedio anual de 4.4 , lo que lo caracterizó como oligohalino; no obstante en la época de secas pudo comportarse como mesohalino. Asimismo, se presentó un gradiente de 6.7 a 5.0 de la boca de comunicación hacia el interior del sistema, inclusive hasta la laguna Buen País con características mesohalinas; a diferencia de laguna de Alvarado, donde existieron condiciones oligohalinas, resultado de la influencia de los ríos adyacentes a lo largo del eje y el canal principal del sistema (Cházaro et al. 2002).
Los sitios C, PG y BP, caracterizados por una estabilidad ambiental, disminución de perturbaciones hidrológicas y una influencia directa de los ríos Papaloapan, Acula y Limón, constituyeron los sitios con las densidades mayores de R. maritima. Knox (1986) menciona que la entrada de agua dulce proveniente de los afluentes epicontinentales incorpora nutrientes y materia orgánica particulada y disuelta. Sistemáticamente, se genera un efecto de trampa de nutrientes en los sedimentos de los pastos marinos derivado de las características sedimentarias, los patrones de circulación, la salinidad y la biodepositación de detrito que ocasionan un incremento de la biomasa de R. marítima (Kinney y Roman 1998). Por otro lado, los sitios de transición como BC, CBP y A, con un incremento en el transporte, la circulación, la mezcla entre parcelas de agua y las perturbaciones derivadas de los vientos, registraron los valores de biomasa más bajos.
Componente biótico: en el SLA la variación en la densidad de los crustáceos peracáridos asociados a praderas de R. maritima presentó ciclos anuales recurrentes, correlacionados de manera significativa con las fluctuaciones en la biomasa de esta fanerógama (como una medida de la arquitectura), y secundariamente, por la salinidad superficial y la profundidad en el SLA. Abele (1974, 1982) señaló que la variación en la densidad de la epifauna en la VAS es producto de los cambios de la temperatura, la salinidad y los cambios de marea. Stoner (1983) relacionó la biomasa con la superficie de las hojas, Livingston (1984) la asoció a la dinámica ambiental, los patrones de reclutamiento e interacción presa-depredador. Nelson et al. (1982) argumentaron que la variación en la densidad de los peracáridos presenta una correlación significativa con la estacionalidad de la densidad de los peces y decápodos en la VAS. Heck y Wetstone (1977), Heck y Orth (1980), den Hartog (1982) y Lewis (1987) la atribuyeron a la arquitectura de la VAS.
Particularmente, para el SLA con el inicio de la temporada de lluvias y la dinámica ambiental (disminución de la salinidad, el incremento en los aportes epicontinentales y la profundidad), la densidad de estos crustáceos se favoreció al incrementarse la producción de biomasa de R. maritima, a diferencia de la temporada de nortes y secas donde decrece la densidad de peracáridos en todo el SLA, producto de la disminución en la cobertura foliar de R. maritima y el aumento en la salinidad dentro del sistema.
Con el incremento en la biomasa de R. maritima durante la época de lluvias y con ello un aumento en la arquitectura de los pastos, se presentaron las condiciones propicias para que la densidad de los peracáridos aumentara. Los sitios con mayor producción de R. maritima (C, BP y PG) registraron los máximos en la densidad y la biomasa de esta carcinofauna. Tal consideración se atribuyó a que los pastos marinos proporcionan un espacio preferencial para el establecimiento de organismos epibénticos y un incremento en microhábitat para refugio, reproducción, crianza y alimentación (Vicente 1992, Knowles y Bell 1998). Asimismo, el incremento de esta macrófita incide en la reducción del flujo del agua, en la perturbación hidrodinámica, en las trampas de sedimentos y en la tasa de sedimentación en la columna de agua, factores que favorecen el establecimiento de la epifauna (Heck y Wetstone 1977, Knox 1986, Stoner y Acevedo 1990, Phillips 1992). Por otro lado BC, CBP y A, sitios de transición y con una mayor dinámica ambiental, en cuanto a la mezcla de agua marina y dulceacuícola se refiere, presentaron los valores menores de densidad, fundamentalmente por la reducción en la biomasa de R. maritima, producto de los gradientes ambientales y la energía cinética en cada una de las temporadas.
Los crustáceos peracáridos representan del 89.1 % al 94.8 % de la fauna asociada a diferentes especies de macrófita (Knowles y Bell 1998). La variación espacial en la densidad promedio (557 a 3 825 N·m-2) de la asociación de crustáceos peracáridos registrada para este estudio, fue semejante a las cuantificadas por algunos autores (Nelson 1980, Stoner 1980, Nelson et al. 1982, Stoner 1983) en praderas de Halodule y Syringodium en el Golfo de México. Kikuchi y Péres (1977), y Stoner et al. (1983) sustentan al respecto que las diferentes especies de VAS tienen distintos patrones de crecimiento, los que afectan la calidad y naturaleza del hábitat para pequeños organismos debido a la diversidad alta del hábitat creada por las hojas amplias, y por ende, un aumento en la complejidad del hábitat. Así, Zostera y Thalassia presentan valores mayores de biomasa, densidad y riqueza específica de los peracáridos que Halodule, Syringodium y Ruppia. Por otro lado, los valores altos en el número de individuos de esta asociación pudieron ser atribuidos, en parte, a que los miembros de la comunidad presentan ciclo de vida más corto, y por lo tanto, muestran fluctuaciones mayores en número y desarrollo como una respuesta a las variaciones ambientales espaciales (den Hartog y van der Velde 1988).
Particularmente, para los crustáceos peracáridos asociados a praderas marinas, diferentes autores han analizado que la organización de sus componentes se encuentra sustentada en gran medida en la disponibilidad y tipo de alimento, establecimiento en diferentes estratos de los pastos marinos, hábitos y estrategias de vida, y competencia (Ledoyer 1986, Edgar 1990, Edgar y Aoki 1993, Gaston et al. 1995, Jernakoff et al. 1996), lo que ocasiona que algunas especies dominen en la comunidad u asociación. Así, en praderas de R. maritima de Alvarado cuatro especies de peracáridos fueron dominantes por su amplia distribución, permanencia y densidad: C. ovalis, G. mucronatus, A. louisianum y D. holthuisi. Las otras especies del elenco faunístico estuvieron en una posición altamente variable entre estacionales y ocasionales; sin embargo, M. longisetosa, C. benthophilus y Haustorius sp. siempre fueron componentes raros.
Como respuesta a la pregunta inicial respecto a si la densidad de los peracáridos es controlada por la biomasa de pastos marinos en sistemas costeros tropicales, se considera que en el sistema lagunar de Alvarado, Veracruz, existe una correlación significativa entre el incremento de la biomasa de R. maritima y el aumento en la densidad de los crustáceos peracáridos (anfípodos, isópodos y tanaidaceos) asociados.
Agradecimientos
A Manuel Ortiz por su ayuda en la identificación y cuantificación de los peracáridos. A Juan Pablo Carricart y Alfonso Lugo por sus comentarios y sugerencias al manuscrito.
Resumen
Se analizó la variación en tiempo y espacio de los crustáceos peracáridos que habitan las praderas de Ruppia maritima del sistema lagunar de Alvarado, Veracruz, Golfo de México. El muestreo de esta asociación de crustáceos se realizó de diciembre de 1992 a noviembre de 1994. Los organismos se obtuvieron de 108 muestras recolectadas en seis sitios con R. maritima. La asociación de crustáceos incluyó 11 especies. Ocho especies en Amphipoda (Hourstonius laguna, Cerapus benthophilus, Apocorophium louisianum, Grandidierella bonnieroides, Leptocheirus rhizophorae, Gammarus mucronatus, Melita longisetosa y Haustorius sp.), una en Isopoda (Cassidinidea ovalis) y dos en Tanaidacea (Discapseudes holthuisi and Leptochelia savignyi). La taxocenosis, la densidad y la biomasa de estos organismos mostraron pulsos estacionales relacionados positivamente con la variación de la biomasa de R. maritima, la salinidad, los afluentes epicontinentales y las bocas de comunicación. Las especies C. ovalis, G. mucronatus, A. louisianum y D. holthuisi fueron componentes dominantes en la asociación de peracáridos.
Palabras clave: Ruppia maritima, sistema lagunar de Alvarado, Golfo de México.
Referencias
Abele, L. G. 1974. Species diversity of decapod crustaceans in marine habitats. Ecol. 55: 156-161. [ Links ]
Abele, L. G. 1982. Biogeography, p. 241-304. In D. E. Bliss & L. G. Abele (eds.). The Biology of Crustacea: Systematics, the fossil record and Biogeography, Part 6. Nueva York, Nueva York, EEUU. [ Links ]
Álvarez, F., A. J. Sánchez & L. A. Soto. 1996. Efficiency of two samplers of epibenthic macrofauna in a tropical seagrass meadow. Rev. Invest. Mar. 17: 17-27. [ Links ]
Anónimo. 1977. Recursos naturales de la cuenca del Papaloapan. Tomo I y II.. Instituto Mexicano de los Recursos Naturales Renovables, México, DF. 498 p. [ Links ]
Bostroem, C. & J. Mattila. 1999. The relative importance of food and shelter for seagrass-associated invertebrates: a latitudinal comparison of habitat choice by isopod grazers. Oecologia 120: 162-170. [ Links ]
Bostroem, C. & E. Bonsdorff. 2000. Zoobenthic community establishment and habitat complexity -the importance of seagrass shoot-density, morphology and physical disturbance for faunal recruitment. Mar. Ecol. Prog. Ser. 205: 123-138. [ Links ]
Castillo-Rivera, M. & A. Kobelkowsky. 2000. Distribution and segregation of two sympatric Brevoortia species (Teleostei: Clupeidae). Estuar. Coast. Shelf Sci. 50: 593-598. [ Links ]
Cházaro, S., I. Winfield, M. Ortiz & F. Álvarez. 2002. Peracarid crustaceans from three inlets in the southwestern Gulf of Mexico: new records and range extensions. Zootaxa 123: 1-16. [ Links ]
De la Cruz, G. 1994. NACOM: Sistema para el Análisis de Comunidades en computadoras personales. Versión 3.0. México DF, México. 99 p. [ Links ]
Den Hartog, C. 1982. Architecture of macrophyte-dominated aquatic communities, p. 222-234. In J. J. Symoens, S. S. Hooper & P. Compère (eds.). Studies on aquatic vascular plants. Royal Botanic Society Belgium. Bruselas, Bélgica. [ Links ]
Den Hartog, C. & G. van der Velde. 1988. Structural aspects of aquatic communities, p. 113-153. In J.J. Symoens (ed.). Vegetation of Inland waters, Kluwer Academic, La Haya, Holanda. [ Links ]
Edgar, G.J. 1990. The influence of plant structure on the species richness, biomass and secondary production of macrofaunal assemblages associated with Western Australian seagrass beds. J. Exp. Mar. Biol. Ecol. 137: 215-240. [ Links ]
Edgar, G.J. & M. Aoki. 1993. Resource limitation and fish predation: Their importance to mobile epifauna associated with Japanese Sargassum. Oecologia 95: 122-133. [ Links ]
Gaston, G.R., S.S. Brown, C.F. Rakocinski, R.W. Heard & J.K. Summers. 1995. Trophic structure of macrobenthic communities in northern Gulf of Mexico estuaries. Gulf Res. Rep. 9: 111-116. [ Links ]
González-Gutiérrez, M. 1977. Observaciones sobre un comportamiento atípico de Ruppia maritima L., en una laguna costera tropical. Bol. Soc. Bot. Méx. 37: 53-68. [ Links ]
Heck, K. L. & G. S. Wetstone. 1977. Habitat complexity and invertebrate species richness and abundance in tropical seagrass meadows. J. Biog. 4: 135-142. [ Links ]
Heck, K. L. & R. J. Orth. 1980. Seagrass habitat: the role of habitat complexity competition and predation in structuring associated fish and motile macroinvertebrate assemblages, p. 449-464. In V. S. Kennedy (ed.) Estuarine Perspective, Academic, Nueva York, EEUU. [ Links ]
Herzka, S.Z. & K.H. Dunton. 1997. Seasonal photosynthetic patterns of the seagrass Thalassia testudinum in the western Gulf of Mexico. Mar. Ecol. Prog. Ser. 152: 103-117. [ Links ]
Howe, J.C. & R.K. Wallace. 2000. Relative Abundance of Postlarval and Juvenile Penaeid Shrimps in Submerged Aquatic Vegetation and Emergent Marsh Habitats. Gulf Mex. Sci. 18: 130-137. [ Links ]
Jernakoff, P., A. Brearley & J. Nielsen. 1996. Factors affecting grazer-epiphyte interactions in temperate seagrass meadows, p. 109-162. In A.D. Ansell, R.N. Gibson & M. Barnes (eds.). Oceanography and Marine Biology, an annual review, Vol. 34. University College Londres. [ Links ]
Kikuchi, T. & J.M. Pérès. 1977. Animal communities in seagrass beds: a review, p. 147-193. In C.P. McRoy & C. Helfferich (eds.). Seagrass ecosystems: a scientific perspective. Marcel Dekker, Nueva York, EEUU. [ Links ]
Kinney, E. & Ch. Roman. 1998. Response of primary producers to nutrient enrichment in a shallow estuary. Mar. Ecol. Prog. Ser. 163: 89-98 [ Links ]
Knox, G.A. 1986. Estuarine ecosystems:ASystemsApproach. Vol. I. CRC, Boca Ratón, Florida, EEUU. 289 p. [ Links ]
Knowles, L. & S. Bell. 1998. The influence of habitat structure in faunal-habitat associations in a Tampa Bay seagrass system, Florida. Bull. Mar. Sci. 62: 781-794. [ Links ]
Ledoyer, M. 1986. Fauna Mobile des Herviers de Phanerogames marines (Halodule et Tahalassia) de la Laguna de Términos (Mexique, Campeche) II. Les Gammariens (Crustacea). An. Inst. Cienc. Mar Limnol. 13: 171-200. [ Links ]
Lewis, F.G. 1987. Crustacean epifauna of seagrass and macroalgae in Apalachee Bay, Florida, USA. Mar. Biol. 94: 219-229. [ Links ]
Livingston, R.J. 1984. Trophic response of fishes to habitat variability in coastal seagrass systems. Ecol. 65: 1258-1277. [ Links ]
Livingston, R. J., S. E. McGlynn & X. Niu. 1998. Factors controlling seagrass growth in a gulf coastal system: Water and sediment quality and light. Aquat. Bot. 60: 135-159. [ Links ]
Lot, A., A. Novelo, M. Olvera & P. Ramírez-García. 1999. Catálogo de Angiospermas acuáticas de México. Cuadernos del Instituto de Biología 33. UNAM, México, DF, México. 161 p. [ Links ]
Ludwing, J.A. & J.F. Reynolds. 1988. Statistical Ecology. A primer on Methods and Computing. Wiley, Nueva York, Nueva York, EEUU. 337 p. [ Links ]
Marcia, S. & D. Lirman. 1999. Destruction of Florida Bay seagrasses by a grazing front of sea urchins. Bull. Mar. Sci. 65: 593-601. [ Links ]
Markham, J.C., F.E. Donath, J.L. Villalobos & A.C. Díaz. 1990. Notes on the shallow-water marine Crustacea of the Caribbean coast of Quintana Roo, Mexico. An. Inst. Biol. Univ. Nac. Autón. México. Ser. Zool. 61: 405-446. [ Links ]
Mason, W. & S. Zengel. 1996. Foods of juvenile spotted seatrout in seagrasses at seahorse key, Florida. Gulf Mex. Sci. 14: 89-104. [ Links ]
McAleece, N. 1997. BioDiversity Professional Beta 1. The Natural History Museum & The Scottish Associations for Marine Science, Londres, Inglaterra. [ Links ]
Minello, T.J., K.W. Able, M.P. Weinstein & C.G. Hays. 2003. Salt marshes as nurseries for nekton: testing hypotheses on density, growth and survival through meta-analysis. Mar. Ecol. Prog. Ser. 246: 39-59. [ Links ]
Nelson, W.G. 1980. A comparative study of amphipods in seagrasses from Florida to Nova Scottia. Bull. Mar. Sci. 30: 80-89. [ Links ]
Nelson, W.G., K.D. Cairns & R.W. Virnstein. 1982. Seasonality and spatial patterns of seagrass associated amphipods of Indian River lagoon Florida. Bull. Mar. Sci. 32: 121-129. [ Links ]
Onuf, C.P. 1996. Biomass patterns in seagrass meadows of the Laguna Madre, Texas. Bull. Mar. Sci. 58: 404-420. [ Links ]
Ott, J.A. 1990. Biomass, p. 55-60. In R. C. Phillips & P. C. McRoy (eds.). Seagrass Research Methods. UNESCO, Paris, Francia. [ Links ]
Peterson, B.J. & K.L. Heck Jr. 1999. The potential for suspension feeding bivalves to increase seagrass productivity. J. Exp. Mar. Biol. Ecol. 240: 37-52. [ Links ]
Phillips, R.C. 1992. The seagrass ecosystem and resources in Latin America, p. 150-168 In V. Seeliger (ed.). Coastal plant communities of Latin America. Academic, Nueva York, Nueva York, EEUU. [ Links ]
Phillips, R.C. & P.C. McRoy. 1990. Seagrass Research Methods. UNESCO, París, Francia. 210 p. [ Links ]
Pielou, E.C. 1984. The interpretation of Ecological Data. A primer on Classification and Ordination. Wiley, Nueva York, Nueva York, EEUU. 263 p. [ Links ]
Rojas-Galaviz, J.L., A. Yánez-Arancibia, J.W. Day & F.R. Vera-Herrera. 1992. Praderas Marinas en la Laguna de Términos. p. 89-105 In V. Seeliger (ed.). Coastal plant communities of Latin America. Wiley, Nueva York, Nueva York, EEUU. [ Links ]
Scott-Denton, E. 1999. Utilization of submerged aquatic vegetation habitats by fishes and decapods in the Galveston Bay ecosystem, Texas. Gulf Res. Rep. 10: 81. [ Links ]
Stoner, A.W. 1980. The role of seagrass biomass in the organization of benthic macrofaunal assemblages. Bull. Mar. Sci. 30: 537-551. [ Links ]
Stoner, A.W. 1983. Distributional ecology of amphipods and tanaidaceans associated with three seagrass species. J. Crust. Biol. 3: 499-511. [ Links ]
Stoner, A.W. & C. Acevedo. 1990. The macroinfaunal community of tropical estuarine lagoon. Estuaries 13: 174-181. [ Links ]
Stoner, A.W., H.S. Greening, J.D. Ryan & R.J. Livingston. 1983. Comparison of macrobentos collected with cores and suction sampler in vegetated and unvegetated marine habitats. Estuaries 6:76-82. [ Links ]
Verhoeven, J.T. 1979. The ecology of Ruppia-dominated communities in western Europe I. Distribution of Ruppia representatives in relation to their autoecology. Aquat. Bot. 6: 197-268. [ Links ]
Vicente, V.P. 1992. A summary of ecological information on the seagrass beds of Puerto Rico, p. 98-124. In V. Seeliger (ed.). Coastal plant communities of Latin America. Wiley, Nueva York, Nueva York, EEUU. [ Links ]
Winfield, I., E. Escobar-Briones & F. Álvarez. 2001. Crustáceos peracáridos asociados a praderas de Ruppia maritima (Ruppiaceae) en la laguna de Alvarado, México. An. Inst. Biol. Ser. Zool. Univ. Nac. Autón. Méx. 72: 29-41. [ Links ]
Apéndice
Taxocenosis de los crustáceos peracáridos asociados a Ruppia maritima.
Taxocoenosis of peracarids crustacean associated to Ruppia maritima.
Hourstonius laguna (McKinney, 1978) Cerapus benthophilus Thomas & Heard, 1979 Apocorophium louisianum (Shoemaker, 1934) Grandidierella bonnieroides Stephensen, 1948 Leptocheirus rhizophorae Ortiz & Lalana, 1980 Gammarus mucronatus Say, 1818 Haustorius sp. Melita longisetosa Sheridan, 1980 Cassidinidea ovalis (Say, 1818) Discapseudes holthuisi Bâcescu & Gütu, 1975 Leptochelia savignyi (Krøyer, 1842)














