Revista de Biología Tropical
versión On-line ISSN 0034-7744versión impresa ISSN 0034-7744
Rev. biol. trop vol.54 supl.3 San José dic. 2006
Actividades biológicas del extracto acuoso de la esponja Aplysina lacunosa (Porifera: Aplysinidae)
Arda Kazanjian & Milagros Fariñas
Departamento de Bioanálisis, Escuela de Ciencias, Universidad de Oriente, Núcleo de Sucre, Cumaná, Venezuela; arusiak@hotmail.com
Recibido 02-VI-2006. Corrected 02-X-2006. Accepted 13-X-2006.
Abstract: Biological activity of an aqueons extract of the sponge Aplysina lacunosa (Porifera: Aplysinidae). The aqueous extract and protein precipitate of Aplysina lacunosa (Pallas, 1776) were studied to assess their hemagglutinating, hemolysing, antibacterial, and antifungal activities. Specimens of the marine sponge were collected in El Morro de Tigüitigüe, Santa Fe, Sucre state, Venezuela. The active protein was separated by molecular exclusion chromatography and its molar mass estimated by SDS-PAGE electrophoresis. The sponge A. lacunosa has a protein with a molar mass of about 43 000 Daltons which is capable of agglutinating human erythrocytes of the blood groups A, B, and O in a strong and unspecific mode. The assayed samples did not evidence any hemolysing activity. As for the antibacterial assay, only the aqueous extract was able to inhibit the growth of Enterococcus faecalis, Bacillus cereus, Escherichia coli, and Salmonella enteritidis, with inhibition halos of 24, 20, 24, and 22 mm, respectively. None of the samples exhibited antifungal activity. The chemical analysis of the aqueous extract revealed the presence of several secondary metabolites. It is presumed that its hemagglutinating activity is mediated by agglutinative proteins. The antibacterial activity could be attributed to the presence of saponins, alkaloids, tannins, and polyphenols, which are highly antimicrobial compounds. Poriferans are a rich source of bioactive compounds that can be used in the development of new drugs potentially useful in medicine. Rev. Biol. Trop. 54 (Suppl. 3): 189-200. Epub 2007 Jan. 15.
Key words: Marine sponge, Aplysina lacunosa, agglutinins, secondary metabolites, antibacterial activity, aqueous extract.
Los invertebrados marinos constituyen un grupo de organismos en los que se ha encontrado una fuente muy importante de sustancias bioactivas, las cuales en muchos casos producen como mecanismos de defensa, y cuyas propiedades biológicas van desde la antibacteriana, antifúngica, antiviral, antiinflamatoria y anticoagulante, hasta su utilización como pinturas que eviten el establecimiento de organismos marinos sobre estructuras sumergidas (Piñeiro 2000). Actualmente, diversos compuestos químicos secundarios, tales como depsipéptidos, sesquiterpenos, ergosteroles, alcaloides, compuestos halogenados, entre otros, han sido aislados de holoturias, esponjas, octocorales y tunicados (Hatakeyama et al. 1999,Clark 2000, El-Gamal et al. 2004, Wang et al. 2004).
Otros de los compuestos bioactivos con propiedades farmacológicas potenciales son las lectinas. Estas sustancias constituyen un grupo de proteínas y/o glicoproteínas naturales de origen no inmune que comparten la propiedad de enlazarse de forma específica y reversible a carbohidratos, ya sean libres o que formen parte de estructuras más complejas, con la capacidad de aglutinar células y/o precipitar glicoconjugados (Frane 1982). Algunas lectinas se han utilizado como anticancerígenos, en el estudio de membranas celulares para detectar alteraciones relacionadas con malignidad (Schumacher et al. 1995, Opric et al. 1996); en estudios citogenéticos para la detección de anormalidades cromosómicas, así como también en ensayos histoquímicos y enzimáticos. En el área de la inmunohematología, asociadas con transfusiones de sangre, se han usado en la caracterización e identificación de grupos sanguíneos por la identidad que ellas presentan ante azúcares específicos presentes en la membrana de los eritrocitos, y en un futuro, podrían utilizarse como vacunas por su capacidad para inhibir el crecimiento de diversos microorganismos patógenos (Hernández et al. 1999).
Las esponjas marinas son los animales sésiles y pluricelulares más primitivos y se encuentran expuestas con frecuencia a depredadores y/o a microorganismos que infectan su tejido fino (Newbold et al. 1999, Faulkner et al. 2000). Protegidos por un sistema inmune altamente complejo, han existido durante millones de años; período de tiempo en el cual, las bacterias asociadas a las esponjas, adquirieron en común un metabolismo complejo, por lo que algunos de los compuestos bioactivos son producidos por enzimas provenientes de la esponja y/o de sus microorganismos asociados (Muller et al. 2004)..
En estos invertebrados se han detectado diversos compuestos químicos con propiedades inhibitorias, citotóxicas y otras, farmacológicamente activas. Compuestos como alcaloides, lectinas, saponinas, macrólidos y terpenoides con actividad antibacteriana, anticancerígena, antimicótica, antiviral, antiparasitaria, hemaglutinante y hemolizante han sido aislados de las esponjas Tethya sp. (Indap y Pathare 1998); Aplysina fistularis (Fariñas et al. 2000); Erylus nobilis (Shin et al. 2001); Plakortis simples (Fattorusso et al. 2002); Polymastia janeirensis (Monks et al. 2002); Jaspis wondoensis (Park et al. 2003) y Neamphius huxleyi (Oku et al. 2004).
Las esponjas del género Aplysina contienen altas concentraciones de metabolitos bromados (hasta el 13% del peso seco) con actividad antimicrobiana, actividad citotóxica contra las líneas celulares humanas del cáncer de mama y con características antidepredadoras (Sharma y Burkholder 1967, Kreuter et al. 1990, Weiss et al. 1996, citados por Hentschel et al . 2001). Por ello, se consideró importante evaluar algunas actividades biológicas del extracto acuoso y precipitado de proteínas de la esponja marina A. lacunosa como posible fuente de proteínas activas, y de esta manera poder contribuir a la investigación de nuevas sustancias de interés para la medicina, ampliando los conocimientos sobre compuestos bioactivos, en especial sobre el área de productos naturales de origen marino.
Materiales y métodos
Colecta: Los especimenes frescos de A. lacunosa (Fig.1) fueron colectados en el Morro de Tigüitigüe, Santa Fe, estado Sucre, Venezuela (10º19N, 64º28W); aproximadamente a 3 m de profundidad, empleando un equipo de buceo autónomo. Luego, se colocaron en cavas con hielo seco para su transporte hasta el laboratorio de Bioactivos Marinos del Instituto Oceanográfico de Venezuela en la Universidad de Oriente, donde fue identificada taxonómicamente, hasta la categoría de especie. Ejemplares de esta esponja se encuentran depositados en el Museo del Instituto de Investigaciones Marinas (INVEMAR), Urabá, Colombia, bajo el número INV-Por 0062 1s: octubre 1977 (Zea 1987).
Preparación de la muestra: La esponja en estudio fue dividida en pequeños fragmentos con ayuda de un bisturí, para eliminar la fauna endobiótica visible que podía habitar en estos organismos. Posteriormente, los fragmentos fueron liofilizados en un liofilizador TELSTAR modelo CRYODOS-50 y pulverizados en un mortero para ser conservados hasta el momento de la realización de los bioensayos. Las pruebas para ensayar actividad biológica se verificaron realizando tres réplicas de cada una de ellas.
La especie fue procesada siguiendo las técnicas descritas por Bollag y Edelstein (1992) para la preparación del extracto acuoso, la precipitación y concentración de proteínas. Los compuestos solubles en el medio acuoso se extrajeron en buffer fosfato salino (PBS) de pH 7.4. Las proteínas presentes fueron precipitadas por sobresaturación con sulfato de amonio a un 99% de pureza y fueron concentradas por diálisis utilizando bolsas de celulosa, cuya porosidad excluía moléculas menores a 12 kDa.
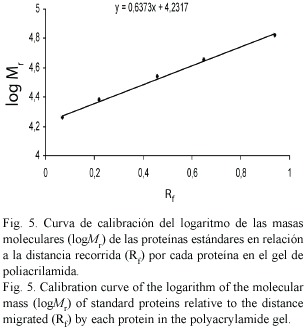
Separación de proteínas por cromatografía de exclusión molecular: Para separar las proteínas según su masa molar, se aplicó el método de Lloyd (1970, citado por Hughes 1976) utilizando una columna empacada con Sephadex G-50. Antes de aplicar la muestra preparada a una concentración de 2 mg/ml, la columna fue calibrada con patrones de masa molecular conocida con la finalidad de realizar una curva de calibración para calcular la masa molar de la proteína activa. Las proteínas empleadas como estándares fueron: albúmina de suero de bovino (66000 Da), anhidrasa carbónica (29000 Da), citocromo C (1.400 Da) y aprotinina (.400 Da). El volumen muerto de la columna (Vo) fue determinado con azul de dextrano. Con los datos obtenidos se realizó el cromatograma, y las fracciones pertenecientes al pico activo fueron reunidas para proceder a calcular la masa molar de la proteína en estudio.
Electroforesis: Para determinar la masa molar de la proteína de interés se aplicó la técnica descrita por Laemmli (1970), la cual se fundamenta en realizar corridas electroforéticas en gel de poliacrilamida (acrilamida/Bis acrilamida) en presencia del detergente sulfato dodecilsódico (SDS) para desnaturalizar la proteína y separarla de acuerdo a su masa molar. Una vez culminada la corrida se procedió a la coloración del gel siguiendo el método de Ausubel et al. (1999), utilizando una solución de nitrato de plata al 19.4% para teñir las bandas.
Actividad hemaglutinante y hemolizante: Se utilizaron muestras de sangre humana clasificadas como grupos sanguíneos A, B y O, siguiendo la técnica descrita por Landsteiner (1947, citado por Rogers y Fish 1991). Los resultados fueron reportados de acuerdo a la simbología normalmente utilizada (cruces) cuando se produce la hemaglutinación, la cual fue determinada con base en la formación de botones y/o grumos de glóbulos rojos, 4+ botón único con sobrenadante limpio, 3+ botón con pequeños grumos y sobrenadante limpio, 2+ pequeños grumos con sobrenadante limpio, 1+ pequeños grumos con sobrenadante turbio, comparados con dos controles (control positivo: fracción proteíca contentiva de aglutininas de Aplysina fistularis (Fariñas 2002); control negativo: suspensión normal de glóbulos rojos).
La hemólisis fue determinada cualitativamente con base en las transformaciones físicas (viscosidad y color) de cada suspensión sanguínea sometida al extracto acuoso y al precipitado de proteínas, comparando los resultados con el extracto acuoso de la esponja marina Amphimedon viridis, cuya actividad hemolítica es ampliamente conocida (Berlinck et al. 1996). Todo esto para asegurar que la hemólisis observada sea efecto del extracto y/o precipitado de proteínas de la esponja y no del mismo proceso. Cuando ocurre la hemólisis, la solución sanguínea de viscosidad relativamente elevada y de color rojo claro, cambia a una solución menos viscosa y de color rojo intenso.
Actividad antibacteriana y antimicótica: La propiedad antibacteriana se determinó por el método de difusión en placas, basados en la metodología de Bauer et al. (1966, citado por Finegold y Martín 1983) sobre cepas bacterianas certificadas; Grampositivas como Enterococcus faecalis (CVCM 924), Bacillus cereus (CVCM 461), Bacillus subtilis (CVCM 438) y Staphylococcus aureus (CVCM 48), cepas bacterianas Gramnegativas como Escherichia coli (CVCM 39), Salmonella enteritidis (CVCM 497) y una cepa silvestre de Listeria monocitogenes. Para evaluar la actividad antimicótica, se emplearon hongos silvestres, tales como Penicillum sp., Candida albicans, Fusarium sp., Rhizopus sp.y Aspergillus sp., siguiendo la técnica descrita por Madubunyi (1995). El extracto y/o precipitado de proteínas con propiedades antimicrobianas forma un halo de inhibición del crecimiento del microorganismo alrededor del disco, cuyo diámetro fue medido utilizando un vernier.
Pruebas químicas: En el extracto acuoso se determinó la presencia de familias de compuestos químicos, tales como alcaloides, saponinas, taninos y polifenoles, mediante las técnicas cualitativas descritas por Marcano y Hasegawa (2002)
Resultados
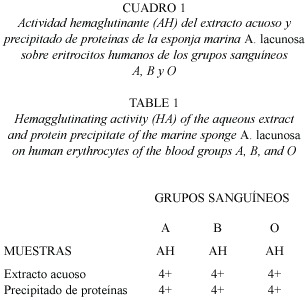
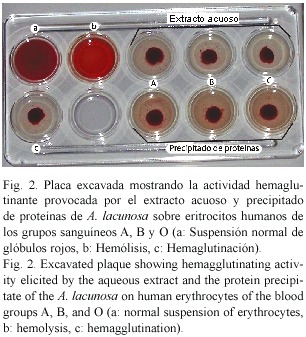
El extracto acuoso y el precipitado de proteínas de la esponja marina A. lacunosa provocaron la hemaglutinación con igual intensidad de los glóbulos rojos humanos de los grupos sanguíneos A, B y O probados (Cuadro 1, Fig.2).
El liofilizado del precipitado de proteínas de la esponja A. lacunosa fue evaluado en cuanto a su pureza en relación a otras proteínas contaminantes y a otros factores no proteicos mediante la cromatografía de exclusión molecular.
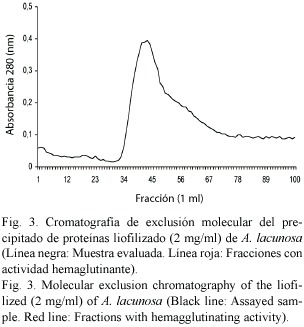
El perfil cromatográfico del precipitado de proteínas estudiado, mostró la presencia de un sólo pico, el cual contuvo un total de 30 fracciones (desde la 42 hasta la 71) con actividad hemaglutinante sobre los diferentes grupos sanguíneos probados (Fig.3), lo que indicó la presencia de la proteína en dichas fracciones. Además, la ausencia de otros picos activos en el cromatograma,sugiere la existencia de una sola proteína activa. Cabe mencionar que la masa molecular nativa de la proteína evaluada a través de este método cromatográfico, no pudo ser calculada debido a la gran cantidad de fracciones que resultaron ser activas. Por lo que se procedió aplicar electroforesis a todas estas fracciones, y al observar que todas mostraban una sola banda en la misma posición, fueron reunidas en una sola muestra, la cual se corrió junto al patrón de proteínas para así finalmente poder estimar la masa molar de la proteína activa.
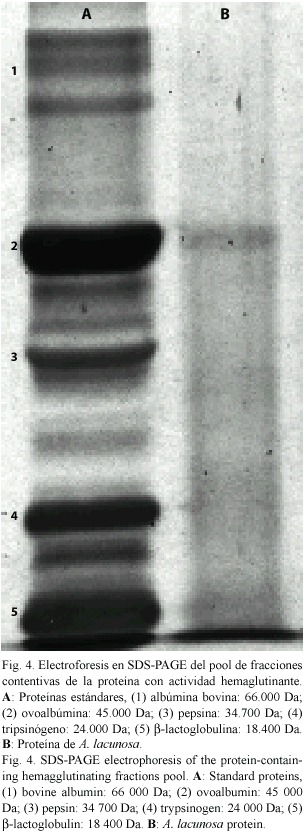
La electroforesis de fracciones contentivas de la proteína de A. lacunosa, arrojó la presencia de una banda (Fig. 4), cuya masa molar estimada por extrapolación mediante la ecuación de la recta obtenida de la curva de calibración fue de aproximadamente 43 000 Da (Fig. 5).
El extracto acuoso y el precipitado de proteínas de la esponja en estudio, no fueron capaces de provocar la lisis de los glóbulos rojos humanos ni de inhibir in vitro el crecimiento de las cepas de hongos probadas.
El extracto acuoso de A. lacunosa fue capaz de inhibir in vitro el crecimiento de Enterococcus faecalis (24 mm), Bacillus cereus (20 mm), Escherichia coli (24 mm) y Salmonella enteritidis (22 mm); sin embargo, el precipitado de proteínas no mantuvo dicha actividad (Cuadro 2) por lo que no se consideró necesario someterlo al fraccionamiento.
El análisis químico del extracto acuoso reveló la presencia de saponinas, alcaloides, taninos y polifenoles.
Discusión
El hecho de que la hemaglutinación observada en el extracto acuoso se mantenga en el precipitado de proteínas (Cuadro 1, Fig. 2) permite suponer que el compuesto responsable de la actividad sea de naturaleza proteica. En este sentido, Bennington (1993) define a las proteínas aglutinantes como anticuerpos que provocan la aglutinación de células y que el término aglutinina actualmente es usado como un sinónimo de lectina, debido a que éste se refiere a la capacidad que tienen las proteínas de unirse a los carbohidratos de membrana para aglutinar eritrocitos u otras células (Peumans y Van Damme 1995). Por lo tanto, se puede inferir que la sustancia capaz de producir la hemaglutinación en las muestras empleadas sea una proteína aglutinante posiblemente del tipo lectina.
Cabe resaltar que los tres grupos sanguíneos fueron aglutinados con la misma intensidad, lo cual permite inferir que la aglutinina presente está reconociendo algún factor común expresado en la membrana de estos glóbulos rojos. En este sentido, Wendell (1983) señala que los determinantes antigénicos del sistema ABO(H) presentes en la membrana de los eritrocitos, se expresan a través de la sustancia H, la cual consiste en la unión de cinco azúcares, cuya secuencia es glucosa, galactosa, N-acetil-glucosamina, galactosa y, fucosa. Esta sustancia H, es común para todas las membranas de los glóbulos rojos, diferenciándose en la presencia de azúcares adicionales a la galactosa terminal; la unión de N-acetilgalactosamina identifica al grupo A, la unión de galactosa identifica al grupo B, mientras que los eritrocitos del grupo O no presentan adición de azúcares en la sustancia H. Por otro lado, Müller de Soyano (1995) describe la membrana del eritrocito humano normal, célula utilizada en este estudio, y señala la presencia de tres glicoforinas, la A, B y C. La glicoforina A contiene muchos residuos de ácido siálico, lo que confiere cargas negativas al exterior de la membrana, impidiendo la aglutinación in vivo de los eritrocitos y, se le han detectado receptores para hema- glutininas. De acuerdo a lo señalado, quizás la proteína aglutinante de A. lacunosa podría estar reconociendo a cualquiera de los azúcares expresados en la sustancia H o al ácido siálico de la glicoforina A presente en la membrana de los eritrocitos humanos.
Algunas lectinas son específicas en sus reacciones con los grupos sanguíneos ABO, por esto han sido utilizadas en la determinación del tipo de sangre. Las lectinas que aglutinan los eritrocitos de todos los grupos sanguíneos son denominadas lectinas no específicas (Sharon y Lis 1989). En este caso, la proteína presente en A. lacunosa es inespecífica, puesto que aglutinó indistintamente y sin diferencia de intensidad a los eritrocitos de los grupos sanguíneos probados. Estos resultados coinciden con los reportados por Sepcic et al. (1997), Miarons y Fresno (2000) quienes describen en sus estudios que los extractos acuosos de Petrosia ficiformis, Spongia nitens, Aplysina aerophoba, A. archeri y A. cauliformes, Oscarella lobularis y Spirastrella cunctatrix exhibieron con igual intensidad una fuerte aglutinación contra todos los glóbulos rojos humanos empleados.
Al observar una banda única en la corrida electroforética (Fig. 4), se confirma la presencia de proteínas activas en A.lacunosa. En este sentido, Miarons y Fresno (2000) señalaron para la especie A. lacunosa colectada en el Parque Nacional Los Roques, la presencia de una lectina con una masa molar nativa aproximada de 63 000 Da, mientras que por SDS-PAGE observaron una sola banda de 16 000 Da, lo que permitió sugerir que sea una molécula con estructura homotetramérica. Entonces, según lo reportado por estos autores,se puede pensar que la proteína evaluada en el presente trabajo posiblemente tenga varias subunidades con masas molares próximas.La masa molar estimada se encuentra en el intervalo reportado para las lectinas de origen marino, las cuales varían entre 8.5 kDa a 400 kDa (Grubhoffer et al.1997).
La presencia de esta clase de proteínas se han reportado en diversas esponjas marinas. Fariñas (2002) determinó la presencia en Ircinia felix y Aplysina fistularis de aglutininas con masa molar de 50 y 49 kDa, respectivamente. La proteína de I. felix fue capaz de aglutinar los glóbulos rojos del grupo sanguíneo A y por ende de reconocer el azúcar N-acetilgalactosamina. Mientras que la proteína de A. fistularis fue capaz de aglutinar los eritrocitos de todos los grupos sanguíneos probados y de reconocer al ácido siálico.
Ninguna de las muestras evaluadas fue capaz de exhibir actividad hemolítica, lo que permite inferir que en esta especie no existen sustancias capaces de lisar glóbulos rojos. Estos resultados son similares a los reportados por Sepcic et al. (1997), quienes evaluaron los extractos acuosos de 14 esponjas marinas, encontrando en todos, ausencia de hemólisis. En los invertebrados marinos, la actividad citolítica puede ser atribuida a dos agentes, las hemolisinas, las cuales han sido definidas por Bennington (1993) como proteínas líticas capaces de liberar la hemoglobina de los eritrocitos, interrumpiendo su integridad estructural, y las saponinas, que actúan como toxinas (Stabili et al. 1992) y que han sido definidas por Marcano y Hasegawa (2002) como miembros de un grupo de diversos triterpenos o glucósidos esteroidales capaces de lisar glóbulos rojos; sin embargo, a pesar de detectarse la presencia de saponinas en el extracto acuoso de la especie en estudio, no se observó actividad hemolítica, lo cual puede atribuirse a varios factores, tales como la localidad, la época del año y el estado reproductivo del organismo, los cuales influyen en la bioactividad de los compuestos (Betancourt-Lozano et al. 1998), y quizás por estas razones, las saponinas de A. lacunosa no poseen esta propiedad.
Sólo el extracto acuoso de A. lacunosa fue capaz de inhibir in vitro el crecimiento de E. faecalis , B. cereus, E. coli y S. enteritidis (Cuadro 2). En este sentido, cabe señalar que los metabolitos secundarios detectados en dicha muestra, son reconocidos por diversos autores como potentes antimicrobianos. Desde el punto de vista antimicrobiano se sabe que las saponinas son activas para S. aureus y E. coli. También, aunque en menor grado, tienen actividad antiviral (Anderson 1986). Estos compuestos poseen una importante actividad antibacteriana, debido a que reducen la tensión superficial y actúan sobre los lípidos de la membrana provocando alteraciones de las mismas, lo que conlleva a la muerte celular; para ello se sugiere la formación de complejos con el colesterol presente en la membrana. Los taninos son compuestos fenólicos que pueden ser utilizados como protección contra infecciones, debido a que provocan desnaturalización de las proteínas (Marcano y Hasegawa 2002). Mientras que el efecto antimicrobiano de los alcaloides puede estar relacionado con la capacidad que presentan para inhibir la biosíntesis de ácidos nucleicos (McCarthy et al. 1992).
Diversos son los trabajos que reportan las propiedades antibacterianas de los compuestos antes mencionados. De la esponja Arenosclera brasiliensis fueron aislados cuatro alcaloides (Arenosclerins A-C y Haliclonacyclamine E) capaces de exhibir actividad inhibitoria contra S. aureus y Pseudomona aeruginosa (Torres et al. 2002). De Leucetta sp. se aislaron varios alcaloides (calcaridine A, spirocalacaridines A y B, spiroleucettadine) capaces de inhibir el crecimiento de Enterococcus durans (Ralifo y Crews 2004). El origen de estos alcaloides potencialmente bioactivos sugiere que estos compuestos sean las toxinas que la esponja utiliza para proteger su tejido fino contra las infecciones microbianas y/o evitar ser consumidos por sus depredadores.Todo esto confirma la potencialidad de los metabolitos secundarios presentes en la esponja de estudio. Por lo tanto, la actividad antibacteriana exhibida por el extracto acuoso de A. lacunosa permite inferir que esta especie sintetiza sustancias químicas que cumplen una función de defensa contra microorganismos invasores. Reinkevich (1994) ha señalado que las sustancias biológicamente activas de los organismos marinos están fundamentalmente asociadas a los mecanismos que los mismos desarrollan para su alimentación y defensa química contra depredadores u otras especies que comparten el hábitat, así como la presencia de agentes naturales antibióticos, antivirales, inmunomoduladores o anticancerígenos que protegen a las especies contra diferentes infecciones.
Por otra parte, en las esponjas del género Aplysina, se ha determinado la presencia de grandes cantidades de bacterias que ocupan hasta el 40% de su biomasa (Friedrich et al. 1999) las cuales pueden estar involucradas en la producción de compuestos antimicrobianos. Los invertebrados marinos son una fuente potencial de nuevas sustancias bioactivas; sin embargo, Siebert et al. (2004) sugieren que en muchos casos son las bacterias asociadas a éstos organismos las que realmente producen dichas sustancias. Mientras que Richelle-Maurer et al. (2003) señalan que las células del tejido fino de las esponjas son las que producen los compuestos bioactivos cuando están asociadas a ellas grandes poblaciones de bacterias, lo que indicaría que éstos compuestos son sintetizados para su defensa contra depredadores y/o invasores. A este respecto, existen diversos estudios en los cuales se demuestra la implicación de microorganismos marinos en la producción y/o acumulación de metabolitos secundarios activos. Bultel-Ponce et al. (2000) encontraron que la bacteria Micrococcus luteus aislada de Xestospongia sp.es capaz de producir un compuesto bromado con potente actividad antimicrobiana, similar al metabolito bioactivo, Verongiaquinol, de Aplysina cavernicola. Hentschel et al. (2001) aislaron de A. cavernicola y A. aerophoba diversas bacterias con actividad antibacteriana; asimismo, sugirieron que las esponjas pueden ser una fuente rica de microorganismos con sustancias farmacológicamente activas. Karpushova et al. (2004) indicaron en su estudio que el microorganismo Bacillus sp. asociado a la esponja A. aerophoba produce ésteres con actividad inhibitoria contra E. coli.
Por lo anteriormente señalado se puede inferir que la actividad antibacteriana observada en el extracto acuoso evaluado puede atribuirse a la presencia de metabolitos secundarios activos sintetizados por la esponja o por la flora bacteriana que pueden habitar en estos organismos.
Según Stainer et al. (1984) muchos antibióticos son más efectivos contra las bacterias grampositivas debido a la complejidad de la envoltura celular de las gramnegativas, lo cual dificulta el paso de ciertas sustancias al interior de las células, incluyendo los antibióticos. Sin embargo, en este estudio ambos grupos de bacterias resultaron ser inhibidas por el extracto acuoso empleado, lo cual corrobora los hallazgos de Sepcic et al. (1997) quienes encontraron que el extracto acuoso de A.aerophoba fue capaz de inhibir tanto bacterias Grampositivas como Gramnegativas. El hecho de que Bacillus subtilis, Staphylococcus aureus y Listeria monocytogenes no hayan resultado ser inhibidas por el extracto acuoso evaluado, probablemente se relacione con la estructura de sus paredes celulares.
A pesar de que el precipitado de proteínas evaluado fue capaz de exhibir una fuerte aglutinación de los eritrocitos humanos no provocó la inhibición del crecimiento bacteriano, por lo que dicha ausencia podría ser atribuida a la mala difusión del mismo en el medio de cultivo, a la incapacidad de la proteína posiblemente de tipo lectina para reconocer a los azúcares presentes en la superficie de las bacterias utilizadas, o a la concentración de proteínas presentes en la muestra, la cual pudo no ser lo suficientemente elevada como para inhibir el crecimiento de las cepas bacterianas. Sin embargo, existen investigaciones donde se demuestra la actividad antibacteriana producida por proteínas extraídas de esponjas marinas. A este respecto, se puede citar el trabajo de Schröder et al. (2003) quienes lograron purificar de la esponja Suberites domuncula, una lectina antibacteriana, con una masa molar de 27 kDa, la cual exhibió una fuerte actividad contra E. coli y en menor grado contra S. aureus.
Por otra parte, la ausencia de actividad antimicótica quizás se deba a los posibles mecanismos de resistencia que hayan desarrollado las cepas de hongos frente a las muestras ensayadas, los cuales no pudieron ser contrarrestados por ninguno de los compuestos presentes en A. lacunosa. Según Mitchell (1995) Cándida albicans presenta una superficie celular hidrofóbica, lo que le confiere mayor virulencia y resistencia a ser destruida por compuestos antimicóticos. También ésta carencia podría atribuirse a la baja concentración de compuestos antifúngicos en las muestras, ya que según Specic et al. (1997) los extractos acuosos de esponjas marinas, contienen un número menor de compuestos bioactivos, en comparación, con los extractos obtenidos con solventes orgánicos.
El extracto acuoso evaluado contiene varios compuestos químicos, los cuales pueden ser utilizados por la esponja para cumplir diversas funciones; entre ellas, defenderse de agentes patógenos como bacterias, parásitos, hongos y virus, evitar ser dañados por sus depredadores y/o protegerse contra las radiaciones ultravioletas (Waddell y Pawlik 2000). Son diversos los investigadores que han aislado un gran número de compuestos secundarios de diferentes especies de esponjas del género Aplysina, entre los cuales se puede citar el trabajo de Acosta y Rodríguez (1992) quienes reportaron la presencia del compuesto 11-oxoaerothionin, un alcaloide citotóxico derivado de la bromotirosina aislada de la esponja A. lacunosa, el cual ha demostrado una potente actividad antitumoral selectiva hacia la línea celular humana del colon (HCT 116). Ciminiello et al. (1999) identificaron ocho nuevos compuestos derivados de la bromotirosina aislada de A. cauliformis con capacidad de inhibir la síntesis de proteínas y la proliferación celular. Thoms et al. (2004) aislaron de las esponjas mediterráneas A. cavernicola y A. aerophoba diversos alcaloides bromados con actividad antibacteriana. Al igual que éstos, existen otros estudios que indican la importancia farmacológica que tienen las especies del género Aplysina.
Considerando todas las propiedades biológicas exhibidas por el extracto acuoso y precipitado de proteínas evaluados, se confirma la existencia de recursos marinos explotables y valiosos, representando A. lacunosa una fuente potencial de metabolitos secundarios biológicamente activos, los cuales deben ser purificados y evaluados para uso futuro como producto natural útil al área clínica.
Agradecimientos
Al Consejo de Investigación de la Universidad de Oriente por haber financiado esta investigación a través del proyecto Nº CI- 5-1005-0963/00. A María Elena Amaro por su valiosa colaboración en la identificación de la esponja marina. A Luz Bettina Villalobos por suministrar las cepas bacterianas certificadas. A Mairin Lemus por facilitar la infraestructura y la metodología aplicada para la separación de proteínas y determinación de su masa molar. Al personal del Laboratorio de Micología por facilitar las cepas de hongos silvestres.
Resumen
Evaluamos el extracto acuoso y precipitado de proteínas de Aplysina lacunosa, en relación con su actividad hemaglutinante, hemolizante, antibacteriana y antimicótica. Los ejemplares de la esponja marina fueron recolectados en el Morro de Tigüitigüe, Santa Fe, Estado Sucre, Venezuela. La proteína activa fue separada por cromatografía de exclusión molecular; y su masa molar fue estimada por electroforesis SDS-PAGE. La esponja A. lacunosa posee una proteína con masa molar aproximada de 4.000 Daltons capaz de aglutinar fuertemente y de manera inespecífica los eritrocitos humanos de los grupos sanguíneos A, B y O. No se observó actividad hemolizante por parte de las muestras ensayadas. Únicamente el extracto acuoso fue capaz de inhibir el crecimiento de Enterococcus faecalis, Bacillus cereus, Escherichia coli y Salmonella enteritidis con halos de inhibición de 24, 20, 24, 22 mm, respectivamente; ninguna de las muestras exhibió actividad antifúngica. El análisis químico del extracto acuoso reveló la presencia de diversos metabolitos secundarios. Se presume que la actividad hemaglutinante se deba a la presencia de proteínas aglutinantes. La actividad antibacteriana podría atribuirse a la presencia de saponinas, alcaloides, taninos y polifenoles, compuestos altamente antimicrobianos. Los poríferos constituyen una fuente rica de compuestos bioactivos que pueden ser utilizados para el desarrollo de nuevos fármacos.
Palabras clave: esponja marina, Aplysina lacunosa, aglutininas, metabolitos secundarios, actividad antibacterial, extracto acuoso.
Referencias
Acosta, A. L. & A. D. Rodríguez. 1992. 11-Oxoaerothionin: a cytotoxic antitumor bromotyrosine derived alkaloid from the caribbean marine sponge Aplysina lacunosa. J. Nat. Prod. 55: 1007-1012. [ Links ]
Amaro, M. E. 2003. Demospongiae (Porifera) de la Bahía de Mochima, Estado Sucre, Venezuela. Trabajo de Postgrado, Univ. Oriente, Cumaná, Venezuela.103 p. [ Links ]
Anderson, P. K. 1986. Dugongs of Shark Bay, Australia - Seasonal migration, water temperature, and forage. Natl. Georgr. Head. 2: 473-490. [ Links ]
Ausubel, F. M., R. Brent, R. E. Kingston, D. D. Moore, J. G. Seidman, J. A. Smith & K. Struhl (eds.). 1999. Short Protocols in Molecular Biology. Wiley. Nueva York, Nueva York, EEUU. 1044 p. [ Links ]
Bennington, D. M. 1993. Diccionario enciclopédico del laboratorio clínico. Médica Panamericana, Buenos Aires, Argentina. 1535 p. [ Links ]
Berlinck, R., C. Ogawa, A. Almeida, M. Sanchez, E. Malpezzi, L. Costa, E. Hajdu & J. Freitas. 1996. Chemical and pharmacological characterization of halitoxin from Amphimedon viridis (Porifera) from the southeastern Brazilian coast. Comp. Biochem. Physiol. 115C: 155-163. [ Links ]
Betancourt-Lozano, M., F. González-Farias, B. González-Acosta, A. García-Gasca & J. Bastida-Zavala. 1998. Variation of antimicrobial activity of the sponge Aplysina fistularis (Pallas, 1766) and its relation to associated fauna. J. Exp. Mar. Biol. Ecol. 223: 1-18. [ Links ]
Bollag, D. M. & S. J. Edelstein. 1992. Protein Methods. Wiley-Liss, Nueva York, Nueva York, EEUU. 230 p. [ Links ]
Bultel-Ponce, V., C. Debitus & M. Guyot. 2000. Metabolites from marine bacteria. Proc. Sympos. Brest. 27: 193- 203. [ Links ]
Ciminiello, P., C. Dell Aversano, E. Fattorusso, S. Magno & M. Pansini. 1999. Chemistry of Verongida sponges. Secondary metabolite composition of the Caribbean sponge Aplysina cauliformis. J. Nat. Prod. 62: 590-593. [ Links ]
Clark, R. J. 2000. The chemistry and chemical ecology of marine sponges. PhD Diss., Univ. Queensland, Queensland, Australia. 112 p. [ Links ]
El-Gamal, A. A., S. K. Wang, C. F. Dai & C. Y. Duh. 2004. New nardosinanes and 19-oxygenated ergosterols from the soft coral Nephthea armata collected in Taiwan. J. Nat. Prod. 67: 1455-1458. [ Links ]
Fariñas, M. 2002. Aislamiento, caracterización parcial y actividad biológica de lectinas de esponjas marinas. Tesis de Postgrado, Univ. Oriente, Cumaná, Venezuela. 88 p. [ Links ]
Fariñas, M., O. Crescente, P.D Jabayan & I. Liñero. 2000. Aislamiento y caracterización parcial de lectinas de la esponja marina Aplysina fistularis. Act. Cient. Venez. 51: 260. [ Links ]
Fattorusso, E., S. Parapini, C. Campagnuolo, N. Basilico, O. Taglialatela-Scafati. & D. Taramelli. 2002. Activity against Plasmodium falciparum of cycloperoxide compounds obtained from the sponge Plakortis simplex. J. Antimicrob. Chemother.50: 883-888. [ Links ]
Faulkner, D.J., M.K. Harper, M.G. Haygood, C.E. Salomon & E.W. Schmidt. 2000. Symbiotic bacteria in sponges: sources of bioactive substances, p. 107-119. In N. Fusetani (ed.). Drugs from the Sea. Karger, Basel, Suiza. [ Links ]
Finegold, S. & W. Martin. 1983. Diagnóstico microbiológico. Biley-Scott. Panamericana, Buenos Aires. 670 p. [ Links ]
Frane, H. 1982. Lectins definition and classification. Act. Histochem. 71: 19-21. [ Links ]
Friedrich, A., H. Merkert, T. Fendert, J. Hacker, P. Proksch & U. Hentschel. 1999. Microbial diversity in the marine sponge Aplysina cavernicola (formerly Verongia cavernicola) analyzed by fluorescence in situ hybridization (FISH). Mar. Biol. 134: 461-470. [ Links ]
Grubhoffer, L., V. Hypsa & P. Volf. 1997. Lectins (Hemagglutinins) in the gut of the important disease vectors. Parasite 4: 203-216. [ Links ]
Hatakeyama, T., T. Sato, E. Taira, H. Kuwahara, T. Niidome & H. Aoyagi. 1999. Characterization of the interaction of hemolytic lectin CEL-III from the marine invertebrate, Cucumaria echinata, with artificial lipid membranes: involvement of neutral sphingoglycolipids in the pore forming process. J. Biochem. 125: 277-284. [ Links ]
Hentschel, U., M. Schmid, M. Wagner, L. Fieseler, C. Gernert & J. Hacker. 2001. Isolation and phylogenetic analysis of bacteria with antimicrobial activities from the Mediterranean sponges Aplysina aerophoba and Aplysina cavernicola. FEMS Microbiol. Ecol. 35: 305-312. [ Links ]
Hernández, P., O. González, Y. Rodríguez & F. Ganem. 1999. Aplicaciones de las Lectinas. Rev. Cub. Hematol. Inmunol. Hemoter. 15: 91-95. [ Links ]
Hughes, R. 1976. Membrane Glycoproteins. Butter Worths. Londres. 357 p. [ Links ]
Indap, M. M. & S. P. Pathare. 1998. Cytotoxicity and bioactivity of some marine animals. Indian. J. Mar. Sci. 27: 433-437. [ Links ]
Karpushova, A., F. Brummer, S. Barth, S. Langes & R. D. Schmid. 2004. Cloning, recombinant expression and biochemical characterization of novel esterases from Bacillus sp. associated with the marine sponge Aplysina aerophoba. Appl. Microbiol. Biotechnol. 52: 4132-4135. [ Links ]
Laemmli, U. 1970. Cleavage of structural proteins during the assembly of the head of bacteriophage T4. Nature 227: 680-685. [ Links ]
Madubunyi, I. 1995. Antimicrobial activities of the constituents of Garcinia kola seeds. Int. J. Pharm. 33: 232-237. [ Links ]
Marcano, D. & M. Hasegawa. 2002. Fitoquímica Orgánica. Consejo Científico, Univ. Central Venezuela, Caracas. 451 p. [ Links ]
McCarthy, P. J., T. P Pitts, G. P. Gunawardana, M. K. Borges & S. A.Pomponi. 1992. Antifungal activity of Meridine, a natural product from the marine sponge Corticium sp. J. Nat. Prod. 55: 1664-1668. [ Links ]
Miarons, P. & M. Fresno. 2000. Lectins from tropical sponges. Purification and characterization of lectins from genus Aplysina. J. Biol. Chem. 275: 29283- 29289. [ Links ]
Mitchell, T. G. 1995. Micosis oportunistas, p.1510- 1558. In H. Zinsser (ed.). Microbiología. Médica Panamericana, Buenos Aires, Argentina. [ Links ]
Monks, N. R., C. Lerner, A. T. Henriques, F. M. Farias, E. S. Schapoval, E. S. Suyenaga, A. B. Rocha, G. Schwartsmann & B. Mothes. 2002. Anticancer, antichemotactic and antimicrobial activities of marine sponges collected off the coast of Santa Catarina, southern Brazil. J. Exp. Mar. Biol. Ecol. 281: 1-12. [ Links ]
Müller de Soyano, A. 1995. Anemias hemolíticas por anormalidades de la membrana Eritrocítica, p. 181-202. In J. L. Pérez Requejo (ed.). Hematología. Tomo I. Disinlimed, C. A., Caracas. [ Links ]
Muller, W., V. Grebenjuk, G. Le Pennee, H. Schröder, F. Brummer, U. Hentschel, I. Muller & H. Breter. 2004. Sustainable production of bioactive compounds by sponges-cell culture and gene cluster approach: a review. Mar. Biotechnol. 12: 219-221. [ Links ]
Newbold, R. W., P. R. Jensen, W. Fenical & J. R. Pawlik. 1999. Antimicrobial activity of Caribbean sponge extracts. Aquat. Microb. Ecol. 19: 279-284. [ Links ]
Oku, N., K. Gustafson, L. Cartner, J. Wilson, N. Shigematsu, S. Hess, L. Pannell, M. Boyd & J. McMahon. 2004. Neamphamide A, a new HIV-inhibitory depsi-peptide from the Papua New Guinea marine sponge Neamphius huxleyi. J. Nat. Prod. 67: 1407-1411. [ Links ]
Opric, M., S. Poznanovic & Z. Kljajic. 1996. Labelling of breast carcinoma, thyroid carcinoma and melanoma with manno-and galacto-specific lectins from marine invertebrates. Eur. J. Histochem. 40: 211-218. [ Links ]
Park, Y., Y. Liu, J. Hong, C. O. Lee, H. Cho, D. K. Kim, K. S. Im & J.H. Jung. 2003. New bromotyrosine derivatives from an association of two sponges, Jaspis wondoensis and Poecillastra wondoensis. J. Nat. Prod. 66: 1495-1498. [ Links ]
Peumans, W. & E. Van Damme. 1995. Lectins as plant defense proteins. Plant. Physiol. 109: 347-352. [ Links ]
Piñeiro, C. 2000. Los medicamentos del mar. Mar y Pesca, 1 de Agosto 2000: 14. [ Links ]
Ralifo, P. & P. Crews. 2004. A new structural theme in the imidazole containing alkaloids from a calcareous Leucetta sponge. J. Org. Chem. 69: 9025-9029. [ Links ]
Reinkevich, B. 1994. Inmunocompetence of marine invertebrates as a tool for monitoring aquatic pollution, p. 265-273. In W. E. G. Müller (ed.). Use of Aquatic Invertebrates as Tool for Monitoring of Enviromental Hazards. Gustav Fischer, Stuttgart. [ Links ]
Richelle-Maurer, E., M. De Kluijver, S. Feio, S. Gaudêncio, H. Gaspar, R. Gomez, R. Tavares, G. Van de Vyver & R. W. Van Soest. 2003. Localization and ecological significance of oroidin and sceptrin in the Caribbean sponge Agelas conifera. Biochem. System. Ecol. 31: 1073-1091. [ Links ]
Rogers, D. & B. Fish. 1991. Marine algal lectins, p. 129- 142. In: D. C. Kilpatrick, E. Van Driessche & T. C. Bog-Hansen (eds.). Lectin Reviews. Sigma Chemical Company, St. Louis, Missouri, Missouri, EEUU. [ Links ]
Schröder, H., H. Ushijima, A. Krasko, V. Gamulin, N. Thakur, B. Diehl-Seifert, I. Müller & W. Müller. 2003. Emergence and disappearance of an immune molecule, an antimicrobial lectin, in basal Metazoa. A Tachylectin-rrelated protein in the sponge Suberites domuncula. J. Biol. Chem. 278: 32810-32817. [ Links ]
Schumacher, U., E. Adam, S.A. Brooks & A.J. Leathem. 1995.Lectin-binding properties of human breast cancer cell lines and human milk with particular reference to Helix pomatia agglutinin. J. Histochem. Cytochem. 43: 275-281. [ Links ]
Sepcic, K., U. Batista, J. Vacelet, P. Macek & T. Turk. 1997. Biological activities of aqueous extracts from marine sponges and cytotoxic effects of 3-Alkylpyridinium polymers from Reniera sarai. Comp. Biochem. Physiol. 117C: 47-53. [ Links ]
Sharon, N. & H. Lis. 1989. Lectins. Chapman and Hall, Nueva York, Nueva York, EEUU. 259 p. [ Links ]
Shin, J., H., S. Lee, L. Woo, J. R. Rho, Y. Seo, K. W. Cho & C. J. Sim. 2001. New triterpenoid saponins from the sponge Erylus nobilis. J. Nat. Prod. 64: 767-771. [ Links ]
Siebert, K., M. Busl, I. Asmus, J. Freund, A. Muscholl-Silberhorn & R. Wirth. 2004. Evaluation of methods for storage of marine macroorganisms with optimal recovery of bacteria. Appl. Environ. Microbiol. 70: 5912-5915. [ Links ]
Stabili, L., P. Pagliari, M. Metrangolo & C. Canicatti. 1992. Comparative aspects of echinoidea cytolysins: The cytolytic activity of Spherechinus granularis (Echinoidea) coelomic fluid. Comp. Biochem. Physiol. 101A: 553-556. [ Links ]
Stainer, R., J. Ingrahan & E. Adelberg. 1984. Microbiología. Reverte, Barcelona, España. 836 p. [ Links ]
Thoms, C., M. Wolff, K. Padmakumar, R. Ebel & P. Proksch. 2004. Chemical defense of Mediterranean sponges Aplysina cavernicola and Aplysina aerophoba. Z. Naturforsch. 59: 113-122. [ Links ]
Torres, Y. R., R. G. Berlinck, G. Nascimento, S. C. Fortier, C. Pessoa & M. O. De Moraes. 2002. Antibacterial activity against resistant bacteria and cytotoxicity of four alkaloid toxins isolated from the marine sponge Arenosclera brasiliensis. Toxicon 40: 885-891. [ Links ]
Waddell, B. & J. R. Pawlik. 2000. Defenses of Caribbean sponges against invertebrate predators. I. Assays with hermit crabs. Mar. Ecol. Prog. Ser. 195: 125-132. [ Links ]
Wang, Y., Z. Z. Liu, S.Z. Chen & X.T. Liang. 2004. Progress in the studies on antitumor natural product ecteinascidin-743. Zhonggus. 26: 474-478. [ Links ]
Wendell, F. 1983. Inmunohematología, p. 504-524. In Anónimo (Ed.). Microbiología. Médica Panamericana, Buenos Aires. [ Links ]
Zea, S. 1987. Esponjas del Caribe Colombiano. Catálogo Científico, Bogotá, Colombia. 283 p. [ Links ]












 uBio
uBio 


