Services on Demand
Journal
Article
Indicators
-
 Cited by SciELO
Cited by SciELO -
 Access statistics
Access statistics
Related links
-
 Similars in
SciELO
Similars in
SciELO  uBio
uBio
Share
Revista de Biología Tropical
On-line version ISSN 0034-7744Print version ISSN 0034-7744
Rev. biol. trop vol.54 suppl.3 San José Dec. 2006
Estructura de la comunidad de moluscos y relaciones tróficas en el litoral rocoso del estado Sucre, Venezuela
Johanna Fernández1 & Mayré Jiménez P.2
1 Escuela de Ciencias, Departamento de Biología.
2 Instituto Oceanográfico de Venezuela, Departamento de Biología Marina, Núcleo de Sucre, Universidad de Oriente; johnannafer@yahoo.com.ar
Recibido 02-VI-2006. Corrected 02-X-2006. Accepted 13-X-2006.
Abstract: Mollusc community structure and trophic relations in the rochy littoral zone in Sucre State, Venezuela. We analyzed the structure of a mollusc community and its component trophic relations at six localities within a rocky littoral zone, in Sucre State, Venezuela, including areas that are both exposed to, and protected from, wave energy. Sampling was carried out from March 2003 to Febreuary 2004 period, in an area subdivided in to supralittoral, littoral and sublittoral zones. Samples were collected using hand-held spoons within 0.25 m2 quadrats along transects sited perpendicular to the coast line transects. Collected organisms were preserved in 10% formalin for subsequent taxonomic classification. Specific richness and constance were determined, and the four trophic categories of herbivore, suspendivore, carnivore and herbivore-suspendivore were established. Overall 14 581 individual specimens were collected that represented 68 species, 31 families and 9 orders, in the classes Gasteropoda (n=39), Bivalvia (n=23) and Polyplacophora (nn=6). Suspension feeders were the dominant trophic category (49%), followed by carnivores (337%), herbivores (13%) and herbivores-suspension feeders (11%). Herbivores and suspension feeders were dominant in the protected area, while carnivores and suspension feeders were dominant in the exposed area. Data indicate that mollusc distribution and intergroupal trophic relations are controlled by both morphological features and substrate composition. Rev. Biol. Trop. 54 (Suppl. 3): 121-130. Epub 2007 Jan. 15.
Key words: mollusc, rocky littoral, trophic relations, Sucre State, Venezuela.
El litoral rocoso presenta poca homogeneidad en las características del substrato, y una amplia diversidad de factores incidentes, tales como factores físico-químicos (exposición del oleaje, temperatura, desecación, salinidad, oxígeno, luz y superficie de fijación), biológicos (competencia, depredación y reclutamiento) y la interacción de las mareas. La variación espacial y temporal de estos factores determinan las características, distribución y comportamiento de las poblaciones existentes (Doty 1957, Denley y Underwood 1979, Garrity y Levings 1981).
Algunos factores que ocasionan la distribución de los organismos en los sustratos rocosos intermareales parecen seguir el modelo clásico de Connell (1961), en el cual el límite superior esta determinado por las variables físicas (temperatura y desecación) y el inferior por las interacciones biológicas como competencia y depredación. Otros autores, Stephenson y Stephenson (1949) y Lewis (1972) señalan que los diferentes grados de exposición al oleaje, diferentes regímenes de temperatura y diferentes tipos de sustratos rocosos influyen en la estructura trófica de estos ambientes. A este respecto, Olabarría et al. (2001) indican que los factores que controlan la distribución de los grupos tróficos determinan la estructura de la comunidad; a la vez que la distribución y abundancia de los grupos funcionales se correlacionan con los factores físicos del ambiente.
En esta zona rocosa la fauna malacológica constituye una comunidad muy estable debido a la conformación del substrato. La colonización y la forma en que se disponen los moluscos en este hábitat esta condicionada por adaptaciones morfológicas que les permite resistir las condiciones del ambiente (Mille et al. 1993, Wiliams 1994, Margalef 1995). Odum (1984) indica que el conocimiento de los grupos funcionales de las asociaciones bentónicas marinas nos da una idea de cómo y hasta que punto la energía dominante en el ecosistema es utilizada por los moluscos y nos aporta información indirecta de las características físicas del medio ambiente.
La costa rocosa es parte de un ecosistema con cadenas tróficas más o menos estructuradas, basadas principalmente en individuos raspadores y ramoneadores, debido a que la naturaleza erosiva de la costa casi no permite la acumulación de detritus. Sin embargo, para los moluscos que habitan en la zona rocosa, las cadenas tróficas están conformadas fundamentalmente por organismos sésiles, dominados en su mayoría por los bivalvos filtradores, y los de escaso movimiento como gasterópodos herbívoros y carnívoros. La alimentación es un aspecto primordial en el uso del hábitat por los moluscos y constituye un punto importante de su actividad diaria.
A pesar de las muchas investigaciones realizadas sobre moluscos,son pocas las realizadas sobre sus relaciones tróficas.Existen algunos estudios sobre la importancia del rol de la depredación en costas rocosas y su estructura trófica (Paine 1974, 1976, Menge et al. 1985, 1986, Ojeda y Dearborn 1991, Williams 1994). En la zona del Caribe son pocas las investigaciones sobre estos aspectos, encontrándose las investigaciones realizadas por Olabarría et al. (2001) quienes estudiaron la estructura trófica de asociaciones de moluscos del intermareal rocoso en la Bahía de Mazatlán,México. Ellos observaron una clara distribución espacial de los moluscos, indicando que el mayor porcentaje de la comunidad estaba formada por los filtradores, seguido de los carnívoros,herbívoros y un mínimo porcentaje de organismos parásitos.
En Venezuela existen estudios sobre los moluscos del litoral rocoso, entre los cuales se encuentran los trabajos de Rehder (1962) y Work (1969) y en el Archipiélago Los Roques; de Flores (1973) sobre la distribución de aguas costeras en la zona nororiental, y de Marval (1986) sobre la diversidad de moluscos en dos playas rocosas de la isla de Margarita.En el Estado Sucre, Venezuela se han realizado pocos estudios sobre moluscos del litoral rocoso, encontrándose los realizados por León (1997), quién analizó la fauna malacológica de los islotes Caribe y Los Lobos, y de Jiménez et al. (2004), quienes estudiaron los moluscos del litoral rocoso en cuatro localidades del Estado Sucre.
Sobre las relaciones tróficas de las comunidades de moluscos del litoral rocoso, existe poca información, y en la región oriental no se han realizado investigaciones sobre este tema, por lo que el objetivo de éste trabajo fue conocer la estructura de la comunidad de moluscos y sus relaciones tróficas en una zona expuesta y otra protegida del oleaje en el litoral rocoso del Estado Sucre, Venezuela.
Materiales y métodos
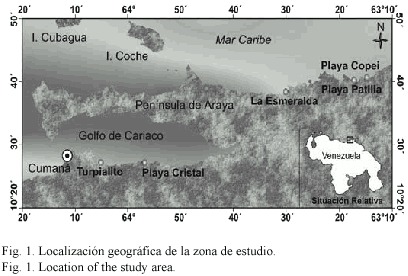
Sitio de muestreo: El estudio fue realizado en el Estado Sucre, localizado en la región Nororiental de Venezuela en donde se establecieron seis localidades de naturaleza rocosa. Tres de ellas se encontraban en un área protegida del oleaje en la costa sur del Golfo de Cariaco; la localidad 1 (Perimetral-Cumaná) ubicada a 10º2910 N y 63º1627 O, la localidad 2 (Ensenada de Turpialito) a 10º2840 N y 64 º210 O y la localidad 3: (Playa Cristal) a 10º2910 N y 63º5710 O. Tres localidades adicionales se ubicaron en la costa norte del Estado Sucre en áreas expuestas al oleaje; la localidad 4 (Playa La Esmeralda) ubicada a 10º3850 N y 63º5710 O, la localidad 5 (Playa Patilla) a 10º3930 N y 63º2445 N y la localidad 6 (Playa Copei) a 10º3930 N y 63º1627 O (Fig. 1).
Método de estudio: Los muestreos fueron realizados mensualmente en horas de la mañana, durante el período de un año que comprendió de marzo 2003 a febrero 2004. Se establecieron transeptos perpendiculares a lo largo de la línea de la costa, de 5 m de longitud, siguiendo la metodología propuesta por Jones (1980), citado por Contreras et al. (1991), tomando como puntos de partida y final la posición de organismos indicadores del ambiente. A lo largo del transepto se fijaron un total de seis estaciones, ubicando las estaciones 1 y 2 en la zona supralitoral, las estaciones 3 y 4 en la zona mediolitoral, y las estaciones 5 y 6 en la zona infralitoral o totalmente sumergida.
Las muestras fueron tomadas, dentro de una cuadrícula metálica de 0.25 m2, según la metodología de Weinberg (1978) y Damianidis y Chintiroglou (2000), raspando toda la superficie de las rocas con una espátula y colectando el material presente encima y por debajo de éstas de forma manual. Los organismos recolectados luego fueron preservados en formalina al 10% e identificados con ayuda de claves taxonómicas (Warmke y Abbot 1962, Abbott 1974, Humfrey 1975, Abbott 1994, Díaz y Puyana 1994, Abbott & Morris 1995, Pointier y Lamy 1998) hasta el renglón taxonómico posible. Se calcularon los parámetros ecológicos siguientes:
- Abundancia; contando el número de organismos encontrados en cada cuadrícula analizada para las zonas (supra, medio e infralitoral) en cada una de las localidades (Margalef 1995).
- Biomasa; peso de cada una de las especies, expresado en gramos.
- Constancia específica; mediante la fórmula definida por Balogh (1958, citado por Krebs 1989).
Con los datos de abundancia (log10 N+1) se realizaron análisis de varianza simple (Sokal & Rohlf 1981) entre las localidades, meses de estudio y zonas para observar si existen diferencias significativas en la abundancia de los organismos. Se le asignó a cada especie una categoría trófica, clasificándolos en herbívoros, filtradores, carnívoros y herbívoros –filtradores, según las descripciones realizadas por Hughes (1986), Greenway (1995), Pontier & Lamy (1998) y Olabarría et al. (2001).
Resultados
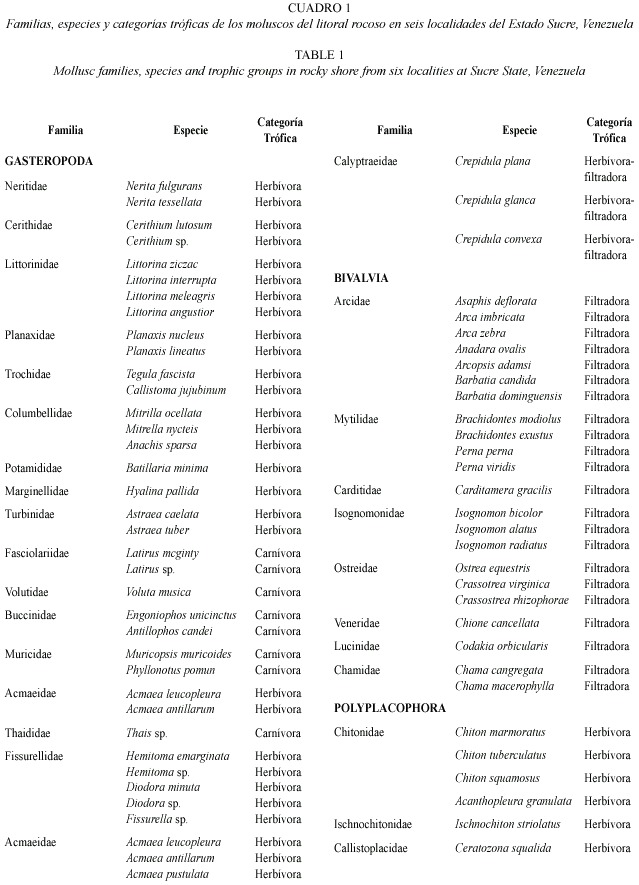
Estructura de la comunidad: Se obtuvo un total de 14 581organismos con una biomasa húmeda de 6 397.94 g, representadas por 68 especies, de las cuales 39 pertenecen a la clase Gasteropoda, 23 a Bivalvia y seis a Polyplacophora, contenidas en nueve órdenes y 31 familias.
La clase más abundante fue la clase Gasteropoda, con un total de 12 639 individuos, distribuidos en dos subclases, Prosobranchia y Opisthobranchia; cuatro órdenes: 18 familias; 24 géneros, contenidos en 41 especies. La segunda clase más abundante fue Bivalvia, con un total de 1 838 individuos, distribuidos en dos subclases, Pteriomorpha y Heterodonta; cuatro órdenes: 10 familias; 15 géneros y 24 especies, y por último la clase Polyplacophora, con un total de 69 individuos, contenidos en un órden: Neoloricata, tres familias: Ischnochitonidae, Chitonidae y Callistoplacidae, cuatro géneros y seis especies (Cuadro 1).
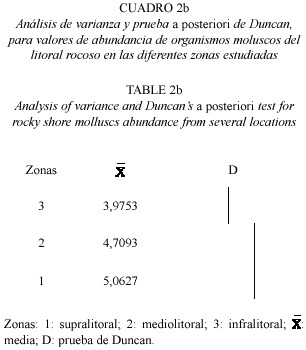
Los resultados del análisis de varianza mostraron que existen diferencias significativas en la abundancia (p < 0.001; Fs = 6.75 ***); y en la biomasa (p < 0.001; Fs = 6.87***) de los moluscos entre las localidades, en estudio. También se presentaron diferencias significativas entre las zonas (p < 0.01; Fs = 3.46 *), mientras que no se observaron diferencias significativas en la abundancia con respecto a las zonas (Cuadro 2a y b; Cuadro 3)
En lo que respecta a las estaciones, el máximo número de individuos se observó en las localidades protegidas: Playa Cristal (77 235) y Ensenada de Turpialito (2 070), seguidas por las localidades expuestas al oleaje: Playa la Esmeralda (1 731) y Playa Copei (1 518). En todas las localidades, en la zona supralitoral se encontró el mayor número con 2 399 organismos, seguida de la infralitoral con una abundancia de 2 213 individuos y la mediolitoral con 1 787 individuos.
En cuanto a los valores de la biomasa húmeda, los más elevados fueron observados en Playa Cristal con 1 957.67 g, seguida de Playa la Esmeralda con 1 559.49 g; Playa Copei con 1 222.32 g, Ensenada de Turpialito con 816.68 g, Playa Patilla con 698.25 g y por último Cumaná-Perimetral con una biomasa de 142.91 g.
De las 68 especies reportadas, 16 fueron constantes, 20 accesorias y 30 accidentales.
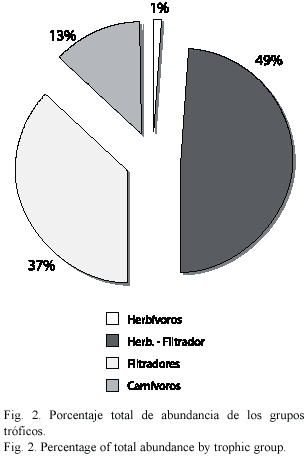
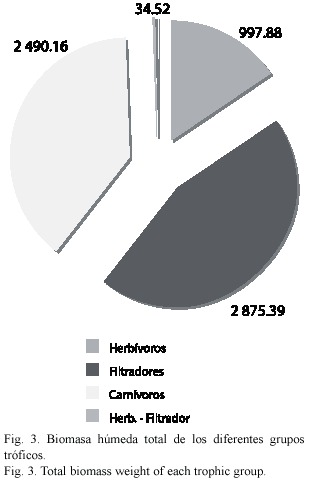
Categorías tróficas: En cuanto a la composición de las categorías tróficas para toda la comunidad, los herbívoros fueron la categoría dominante con 33 especies, se presentaron 23 filtradores, nueve carnívoros y tres especies fueron ubicadas en la categoría de herbívora –filtradora (Fig. 2). Los valores de biomasa húmeda mostraron un patrón diferente, donde los filtradores fueron los que presentaron la mayor biomasa con 2 875.39 g representados en su mayoría por los mytílidos, seguidos por los carnívoros (2 490.16 g) y por último los herbívoros (997.88 g). Las especies ubicadas como herbívoras-filtradoras presentaron bajos valores de biomasa (34.52 g) (Fig. 3).
Para la clase Gasteropoda, dominaron las especies herbívoras Nerita fulgurans, Planaxis nucleus, Littorina interrupta, L. meleagris, Cerithium lutosum, Astraea caelata, Crepidula convexa y Acmaea antillarum, mientras que las especies Perna perna, P. viridis, Brachidontes modiolus, Isognomon bicolor e I. alatus fueron los filtradores más abundantes para la clase Bivalvia. Dentro de la clase Polyplacophora dominaron los herbívoros Chiton tuberculatus y C. squamosus.
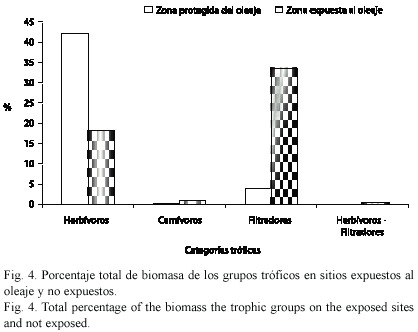
Con respecto al grado de exposición al oleaje, en las localidades protegidas se observó una gran cantidad de algas de los géneros Ulva sp. y Laurencia sp., y mayor número de individuos herbívoros, representados en su mayoría por los géneros Littorina, Planaxis, Nerita, Tegula, Mitrella, Acmaea, Astraea, y Cerithium, mientras que en las áreas de alta energía (fuerte oleaje) fueron más abundantes los filtradores de los géneros Brachidontes, Perna, Isognomon, Ostrea, Carditamera, y los carnívoros Thays, Muricopsis, Engoniophus y Antillophus (Fig. 4).
Discusión
El número de 68 especies de moluscos reportadas aquí, puede considerarse alto con respecto a otras investigaciones realizadas en el Caribe, tal es el caso de Contreras et al. (1991) quienes señalan 55 especies de moluscos en el intermareal rocoso de la Bahía de Chamela, México. En Venezuela, Almeida (1974) indica un total de 48 especies para el litoral rocoso de la región centro-occidental del país. Resultados similares fueron señalados por Vera (1978), Sant y De Grado (1997) y Jiménez et al. (2004), quienes obtuvieron un total de 56,50 y 57 especies de moluscos, respectivamente, al estudiar las costas rocosas del Estado Sucre. Estos autores también indican que la clase Gastropoda fue la más abundante, lo cual concuerda con los resultados de esta investigación. En cuanto a las diferencias del número de organismos y especies, ésta podría deberse a una mayor extensión del área de muestreo, un período de estudio más largo y metodologías diferentes para la toma de muestras.
Con respecto a la abundancia de los organismos, se observó que los valores más altos se obtuvieron en las localidades más protegidas al oleaje (1, 2 y 3), y los menores en las localidades más expuestas al oleaje (4, 5 y 6). Estas observaciones nos indican, que las características del sustrato, constituido por pequeñas rocas,cantos rodados y gravas; el escaso oleaje influenciado por el viento incidente, y la reducida amplitud de marea en esas aguas someras y tranquilas, hace posible el establecimiento de una gran cantidad de especies y organismos que se han adaptado a estos ambientes litorales; influyendo de forma positiva sobre estos índices, a diferencia de las localidades expuestas donde incide el fuerte oleaje y el sustrato formado de grandes rocas rugosas, con grietas y pendientes abruptas, no permitió una mayor abundancia de especies, sino sólo la presencia de las especies más resistentes a éstas localidades expuestas.
El estudio evidencia que la estructura trófica de la comunidad de moluscos parece definirse con base en las características físicas ambientales de cada localidad. En este caso, los filtradores compuestos en su mayoría por mytílidos, que presentan estructuras fuertes como el biso que les permite adherirse fuertemente a las rocas, dominaron las áreas expuestas al oleaje y fuertes vientos incidentes, con lo cual hace posible que en esta área el evento de surgencia sea más notorio y en consecuencia, exista un enriquecimiento de las masas de aguas, que permite un mayor aporte de materia orgánica y mayor abundancia de fitoplancton (Fukuoka 1966, Rueda 2000). Esta condición es utilizada directamente por los organismos filtradores e indirectamente por otros organismos como el caso de los carnívoros que fue el segundo grupo más abundante de estas zonas, a través de las redes tróficas. Estos resultados son similares a los reportados por León (1997) y Villafranca y Jiménez (2004) en la región oriental de Venezuela, quienes señalan que el ambiente intermareal rocoso de zonas expuestas al oleaje estuvo dominado por los moluscos filtradores. Por el contrario, en las áreas protegidas dominaron los herbívoros debido posiblemente a las condiciones ambientales menos severas y la gran cantidad de algas presentes en estas localidades, concordando con los resultados observados por Olabarría et al. (2001) quienes observaron en el litoral rocoso del Pácifico tropical oriental, que en las localidades protegidas del oleaje dominaron los herbívoros y las algas, indicando que la estructura de las comunidades de sustratos rocosos se determina por interacciones complejas entre los factores bióticos y abióticos.
Dayton (1975) y Menge y Sutherland (1976) indican que los efectos bióticos pueden ser complejos variando desde efectos pastoreo, interacciones carnívoro/presa y competencia por el espacio. La distribución de los moluscos y los diferentes grupos tróficos, pueden estar controlados por adaptaciones morfológicas, así como el nivel de exposición al oleaje y composición del sustrato (Dayton 1975, Jiménez et al. 2004).
Las diferencias existentes en la abundancia y biomasa de organismos y especies entre las localidades protegidas como expuestas al oleaje, en los meses, se debe muy probablemente a que gracias a los factores (físico-químicos y biológicos) incidentes, sumado a los cambios climáticos poco cambiantes, nos permite predecir que la disposición de los organismos se mantuvo constante durante todo el año de muestreo, observándose que en cada localidad y zona, los organismos conforman entidades ecológicamente diferentes.
La complejidad de los grupos tróficos fue mayor en los sitios expuestos al oleaje, donde dominaron los filtradores y carnívoros, disminuyendo en los sitios más protegidos, donde fueron más abundantes los herbívoros. La complejidad está asociada con el incremento de los grupos tróficos donde juegan un papel importante los carnívoros y suspensívoros (Bianchi y Morri 1985, Gambi y Giaangrande 1985). Olabarría et al. (2000) indican que la complejidad trófica y la heterogeneidad espacial de las asociaciones dependen de la historia de vida de cada especie en particular.
Los resultados obtenidos indican que el número de especies observadas son similares a otros estudios de la región oriental de Venezuela. Con respecto a la estructura trófica de la comunidad, parece estar definida por los grados de exposición al oleaje,sin embargo la ausencia de estudios similares dificulta realizar comparaciones cualitativas y cuantitativas más precisas.
Agradecimientos
Agradecemos a Thays Allen sus valiosas críticas al manuscrito.
Resumen
Se analizó la estructura de la comunidad de moluscos y sus relaciones tróficas en seis localidades del litoral rocoso con diferentes grados de exposición al oleaje (área expuesta y área protegida), en el Estado Sucre, Venezuela. El muestreo se llevó a cabo durante el período de marzo 2003 a febrero 2004. La recolección del material biológico se realizó de forma manual con ayuda de una espátula, dentro de una cuadrícula de 0.25 m2, estableciéndose tres zonas: supra, medio e infralitoral. Los organismos fueron preservados en frascos con formalina al 10% para su posterior análisis. En el laboratorio fueron identificados, contados, y pesados en una balanza de 0.001g de precisión. Se determinó la abundancia total de especies, biomasa, constancia específica y por medio de una revisión bibliográfica se le asignó a cada especie su categoría trófica, clasificándolos en: herbívoros, filtradores, carnívoros y herbívoros –filtradores. Se obtuvo un total de 14 581 individuos (6 397.945 g) representado por 68 especies correspondientes a las clases Gastropoda (39), Bivalvia (23) y Polyplacophora (6); contenidas en nueve órdenes y 31 familias. Los herbívoros fueron el grupo dominante (49%), seguido por filtradores (37%), carnívoros (13 %) y herbívoros-filtradores (1%). Las especies herbívoras y herbívoras-filtradoras dominaron en el área protegida, mientras que en el área expuesta, fueron las carnívoras y filtradoras. Las especies constantes en las seis localidades durante el período de estudio fueron Planaxis nucleus, Mitrella ocellata, M. nycteis, Littorina interrupta, Tegula fasciata, Acmaea leucopleura, Ostrea equestris y Chiton squamosus. La distribución de los moluscos y los diferentes grupos tróficos, pueden estar controlados por adaptaciones morfológicas, así como el nivel de exposición al oleaje y composición del sustrato.
Palabras clave: moluscos, litoral rocoso, relaciones tróficas, Estado de Sucre, Venezuela.
Referencias
Abbott, R. 1974. American Seashells. 2nd ed. Van Nostrand Reinhold, Nueva York, EEUU. 663 p. [ Links ]
Abbott, R. 1994. Conchas marinas del Mundo. Trillas, Guías del Saber, México. 173 p. [ Links ]
Abbott, R. & P. Morris. 1995. Shells of the Atlantic & Gulf Coast & The West Indies. Peterson Field Guides. Houghton Mifflin, Boston, Massachussetts, EEUU. 350 p. [ Links ]
Almeida, P. 1974. Distribución de los moluscos en las costas centro-occidental (Patanemo-Pta. Tucacas) de Venezuela. Comparación de hábitats litorales. Mem. Soc. Cienc. Nat. La Salle. 34: 24-32. [ Links ]
Bianchi, C. N. & C. Morri. 1985. I policheti come descrittori della struttura trofica degli ecosistemi marini. Oebalia 11: 203-214. [ Links ]
Connell, J. B. 1961. The influence of interspecific competition and other factors on the distribution of the barnacle Chatamalus stellatus. Ecology 42: 710-723. [ Links ]
Contreras, R., F. Cruz & A. Ibáñez. 1991. Ecological observations of the molluscs of the rocky intermedital zone at Chamela Bay, Jalisco, México. An. Inst. Biol. Univ. Nac. Auton. Mex. Zool. 64: 17-32. [ Links ]
Damianidis, P. & C. Chintiroglou. 2000. Structure and functions of Polychaetofauna living in Mytilus galloprovincialis assemblages in Thermaikos Gulf (north Aegean sea). Ocean. Act. 23: 110-118. [ Links ]
Denley, E. A. Underwood. 1979. Experiments on factors influencing the settlement survival and growth of two species of barnacles in New South Wales. J. Exp. Mar. Biol. Ecol. 13: 111-158. [ Links ]
Díaz, J. & Puyana, M. 1994. Moluscos del Caribe Colombiano. Un catálogo ilustrado. COLCIENCIAS, Fundación Natura e INVEMAR, Bogotá, Colombia. 367 p. [ Links ]
Doty, S. 1957. Rocky intertidal surfaces. E. W. Hedgth (ed). Treatise on Marine Ecology and Paleocology. Geol. Soc. Amer. Mem. 67: 535-545. [ Links ]
Fukuoka, J. 1966. Coastal upwelling near Venezuela (II): Anual periodicities of hydrographical conditions. Bol. Inst. Oceanogr. Venezuela, Univ. Oriente 5: 84-95. [ Links ]
Garrity, S. & H. Levings. 1981. A predator-prey interaction between two physically and biologically constrained tropical rocky shore gastropods: direct and comunity effects. Ecol. Monogr. 51: 267-286. [ Links ]
Greenway, M. 1995. Trophic relationships of macrofauna within a Jamaica seagrass meadow and the role of the echinoid Lythechinus variegatus (Lamarck). Bull. Mar. Sci. 56: 719-736. [ Links ]
Hughes, R. N. 1986. A Functional Biology of Marine Gastropods. Johns Hopkins Univ. Press, Baltimore, Maryland, EEUU. 245 p. [ Links ]
Humfrey, M. 1975. Sea Shell of the West Indies. William Collins Sons, Glasgow, Escocia, Reino Unido. 351 p. [ Links ]
Jiménez, M., B. Márquez & O. Díaz. 2004. Moluscos del litoral rocoso en cuatro localidades del Estado Sucre, Venezuela. Saber, Univ. de Oriente 16: 8-17. [ Links ]
Krebs, C. 1989. Ecological Methodological. Harper & Row, Nueva York, EEUU 654 p. [ Links ]
Lewis R. J. 1972. The ecology of rocky shores. A biological or physical entity. Oikos 12: 280-301. [ Links ]
Margalef, R. 1995. Ecología. Editorial Omega, Barcelona, España. 951 p. [ Links ]
Marval, J. 1986. Diversidad de moluscos en dos playas rocosas de la Isla de Margarita, Venezuela. Tesis Pregrado, Dept. Biología, Univ. Oriente, Cumaná, Venezuela. 127 p. [ Links ]
Menge, B. A. & J. P. Sutherland. 1976. Species diversity gradients: synthesis of the roles of predation, competition, and temporal heterogeneity. Am. Nat. 110: 351-369. [ Links ]
Menge, B. A., J. Lubchenco & L. R. Ashkenas. 1985. Diversity, heterogeneity, and consumer pressure in a tropical rocky intertidal community. Oecologia 65: 394-405. [ Links ]
Menge, B. A., J. Lubchenco, L. R. Ashkenas & F. Ramsey. 1986. Experimental separation of effects of consumers on sessile prey in the zone of a rocky shore in the Bay of Panama: direct and indirect consequences of food web complexity. J. Exp. Mar. Biol. Ecol. 100: 225-269. [ Links ]
Mille, S., M. Parra & A. Pérez. 1993. Guía para la identificación de invertebrados. Edit. Trillas, México, D. F. 465 p. [ Links ]
Ojeda, F. P. & J. H. Dearborn. 1991. Feeding ecology of benthic mobile predators: experimental analyses of their influence in rocky subtidal communities of the Gulf of Maine. J. Exp. Mar. Biol. Ecol. 149: 13-44. [ Links ]
Olabarría, C., J. Caraballo & C. Vega. 2001. Cambios espacio-temporales en la estructura trófica de asociaciones de moluscos del intermareal rocoso en un sustrato tropical. Cienc. Mar. 27: 235-254. [ Links ]
Odum, P. 1984. Ecología. 6ta ed. Edit. Continental, México, D. F. 295 p. [ Links ]
Paine, R. T. 1974. Intertidal community structure: experimental studies on the relationship between a dominant competidor and its principal predator. Oecologia 15: 93-120. [ Links ]
Paine, R. T. 1976. Food web complexity and species diversity. Am. Nat. 100: 65-75. [ Links ]
Pointier, J. & D. Lamy. 1998. Guía de moluscos y caracolas de mar del Caribe. M y G, Barcelona, España. 225 p. [ Links ]
Rueda, D. 2000. Variabilidad temporal de la distribución vertical de la biomasa fitoplanctónica en la depresión oriental de la cuenca de Cariaco y sus relaciones con los aspectos hidrográficos al estrato superficial (1996-1998). Tesis MSc, Univ. Oriente, Cumaná, Venezuela. 95 p. [ Links ]
Sant, S. & A. De Grado. 1997. Zonación de un litoral rocoso en la costa sur del Golfo de Cariaco (Quetepe), Estado Sucre, Venezuela. Saber Univ. Oriente 9: 69-75. [ Links ]
Sthephenson, T. & A. Sthephenson. 1949. The universal features of zonation between tide on rocky coast. Ecology 37: 289-305. [ Links ]
Sokal, R. & F. J. Rohlf. 1981. Biometry. Freeman, Nueva York, EEUU 859 p. [ Links ]
Vera, B. 1978. Introducción al conocimiento taxoecológico de la comunidad Talabais en aguas costeras de la región nor-oriental del Estado Sucre. Tesis Pregrado, Dept. Biol., Univ. Oriente, Cumaná. 101 p. [ Links ]
Villafranca, S. & M. Jiménez. 2004. Abundancia y diversidad de moluscos asociados al mejillón verde Perna viridis (Bivalvia: Mytilidae) en Guayacán, Edo. Sucre, Venezuela. Bol. Inst. Oceanogr. Venezuela, Univ. Oriente 43: 65-76. [ Links ]
Warmke, G. & Abbott, T. 1962. Caribbean Seashells. Dover Publications. Nueva York, EEUU 348 p. [ Links ]
Weinberg, S. 1978. The minimal area problem in invertebrate communities of mediterranean rocky substratc. Mar. Biol. 49: 33-40. [ Links ]
Williams G. 1994. The relations lup between shade and molluscan grazing in structuring communities on a moderately-exposed tropical rocky shore. J. Exp. Mar. Biol. Ecol. 178: 79-95. [ Links ]
Work, R. 1969. Systematic ecology and distribution of the mollusc of Los Roques, Venezuela. Bull. Mar. Sci. 19: 614-711. [ Links ]