Services on Demand
Journal
Article
Indicators
-
 Cited by SciELO
Cited by SciELO -
 Access statistics
Access statistics
Related links
-
 Similars in
SciELO
Similars in
SciELO  uBio
uBio
Share
Revista de Biología Tropical
On-line version ISSN 0034-7744Print version ISSN 0034-7744
Rev. biol. trop vol.54 n.1 San José Mar. 2006
Caraterización citogenética del pez tropical de agua dulce Parachromis managuensis (Pisces:Cichlidae)
Lenin Arias-Rodriguez1, Salomón Páramo-Delgadillo1 & Alicia de la Luz Durán-González2
1 Laboratorio de Acuacultura,División Académica de Ciencias Biológicas,UJAT.Apdo.Postal 967. Villahermosa, Tabasco.C.P.86101,México.FAX:52 (9933)54 43 08.Leninariasrodriguez@hotmail.com
2 Instituto de Ciencias del Mar y Limnología,UNAM.Apdo.Postal 70-305, México, D. F. C. P. 04510, México.
Recibido 12-VI-2002. Corregido 11-V-2005. Aceptado 09-XII-2005.
Abstract: Citogenetic characterization of the tropical freshwater fish Parachromis managuensis (Pisces: Cichlidae). To describe the cytogenetics of the jaguar cichlid fish Parachromis managuensis, we collected eight males and 13 females in Villahermosa, Tabasco, México. The specimens were processed with standard cytogenetic techniques (slightly modified), and high quality fields of chromosomes in mitosis and meiosis were obtained; 14 of these fields were analyzed by meristics and statistics methods. The specimens presented a diploid modal number of 2n=48 chromosomes, which is similar to the number reported for others Central American cichlids; five pairs were submetacentric-metacentrics(biarmed)and 19 were subtelocentric-telocentric (uni-armed), giving a fundamental number (NF)of 58.The haploid number was confirmed by counting meiotic fields in metaphase I. There was not evidence of heteromorphism: sexual chromosomes were not identifiable. Rev. Biol. Trop. 54 (1): 35-42. Epub 2006 Mar 31.
Key words: Parachromis managuensis, cytogenetics, chromosomes, mojarra, cichlid.
Debido a la creciente necesidad de desarrollar sistemas de producción que permitan un uso racional y sostenido de las especies de peces, en años recientes se han establecido numerosos programas para desarrollar la acuicultura en el sureste de México y particularmente en Tabasco (Mendoza et al. 1995, Jiménez y Nepita 2000, Gómez-Márquez et al. 2003, Jiménez-Badillo 2005, Pérez-Sánchez et al. 2005), lo que ha conducido a la búsqueda de especies nativas que presenten características adecuadas para su cultivo y que puedan ser empleadas como alternativa a la introducción de especies exóticas (Mendoza et al. 1992, 1995). Entre las especies nativas los cíclidos constituyen el grupo más diversificado y numeroso (Miller 1992).
La "mojarra pinta" P. managuensis Günther, 1867 es una especie muy prometedora para ser usada como controlador de crías de Oreochromis sp. en cultivo (Dunseth y Bayne 1978) y en cuerpos de agua abiertos (Carrillo 1991).
Los individuos de esta especie muestran coloración atractiva, por lo que son una buena alternativa como ornato. En los últimos años, dicha especie ha ocupado el primer lugar de captura entre las especies nativas de agua dulce siendo solo superada por mojarras del género Oreochromis sp.(SEMARNAP 2003).
La información relativa a la citotaxonomía de los ciclidos neotropicales es escasa, destacando la recopilación realizada por Gyldenholm y Scheel (1971) y los trabajos de Thompson (1979), Salas y Boza (1991) y Uribe-Alcocer et al. (1992 y 1999). En dichos estudios se encontró con mayor frecuencia un número diploide de 2n=48 cromosomas, manifestándose variaciones en la morfología cromosómica por tratarse de diferentes especies.
Por lo que este documento tuvo como propósito realizar el cariotipo de la población de P. managuensis presente en Tabasco, México.
Materiales y métodos
Se capturaron 21 organismos, ocho machos y trece hembras utilizando una red atarraya de 2.5 cm de luz de malla y 2.5 m de altura, en los estanques y canales artificiales del Jardín Botánico J. Narciso Rovirosa de la División Académica de Ciencias Biológicas de la Universidad Juárez Autónoma de Tabasco (17°59´15 "N-92 °58´30"W) en Villahermosa, Tabasco,México.
El procedimiento citogenético empleado se basó en las metodologías compiladas por Denton (1973), así como las estrategias recomendadas por Kligerman y Bloom (1977). Las cuales fueron adoptadas para obtener los campos mitóticos y meióticos a partir del epitelio de branquias y gónadas respectivamente.
La determinación sexual se realizó con el procedimiento "in vivo" recomendado por Parámo-Delgadillo (1985) para los cíclidos nativos y cuando se dificultó por imperfecciones en la papila genital se utilizó el método de prensado y tinción con aceto-carmín sugerido por Guerrero y Shelton (1974), después de que los organismos fueron sacrificados. Luego los peces se fijaron en formol al 10% durante el lapso de 24 a 48 horas, inmediatamente fueron conservados en alcohol al 70% a fin de corroborar las características merísticas y morfométricas para la determinación taxonómica de los especímenes.
Las laminillas con tejido fueron tratadas por la técnica de secado a la flama y teñidas con giemsa al 10 % preparada en buffer de fosfatos 0.1 M a pH 7.0, durante 10 min. Fueron obtenidas 3482 metafases mitóticas, de las que se seleccionaron 380 para realizar el conteo cromosómico bajo el microscopio óptico. Se empleó el objetivo 100x para determinar el número cromosómico modal. Se escogieron las metafases menos contraídas para ser fotografiadas. De las ampliaciones efectuadas, 14 campos cromosómicos (mitóticos,seis de hembras y ocho de machos) de alta calidad y número de dispersiones que corresponde al promedio utilizado en estudios citogenéticos en peces (Denton 1973, Thompson 1979 y 1981) permitieron analizar y determinar el cariotipo de la especie.
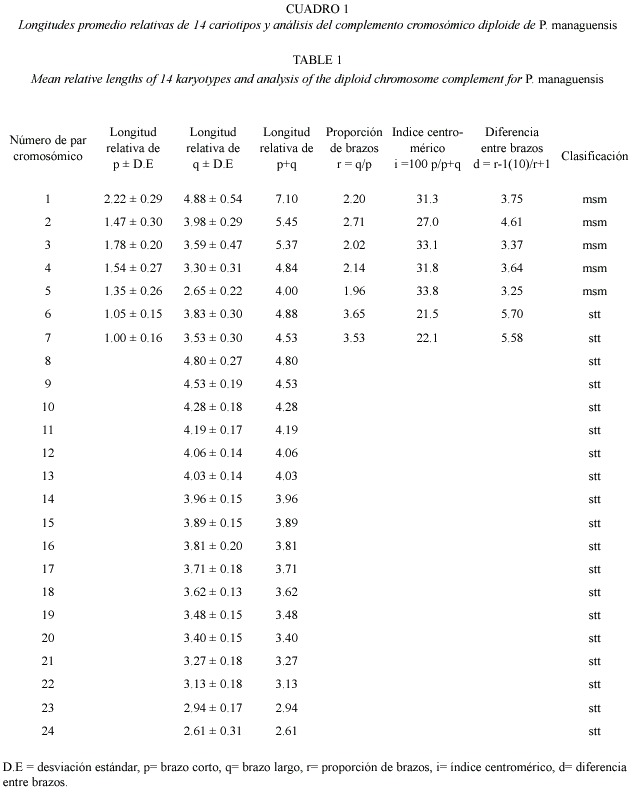
El análisis de los cariotipos se realizó dé acuerdo con el criterio de Levan et al.(1964), cuando los cromosomas tuvieron una proporción de brazos (r) menor a tres (r <3) fueron clasificados como metacéntricos-submetacéntricos (msm)y cuando el valor fue mayor a tres (r >3) se clasificaron como subtelocéntricos-telocéntricos (stt). Esto permitió comparar la información que se ha generado en estudios citogenéticos realizados para la especie.
También, se atendió la problemática de localización del centrómero señalada por Uyeno y Miller (1973), Thompson (1979 y 1981), Korth y Fitzsimons (1987), Salas y Boza (1991) y Uribe-Alcocer et al.(1992).
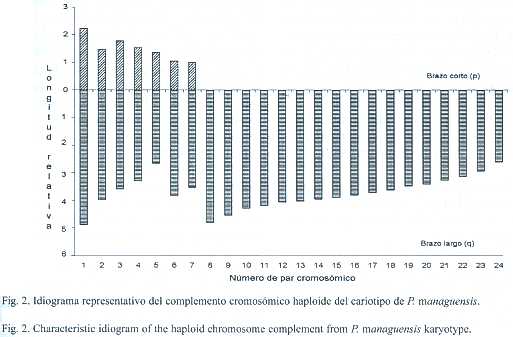
El ideograma se elaboró de acuerdo con la posición del centrómero (Denton 1973), tomando como referencia las longitudes relativas del brazo corto (p) y el brazo largo (q), así como el valor p+q de cada par cromosómico.
Los organismos fueron identificados empleando la descripción de Günther (1867) y la redescripción de Kullander y Hartel (1997). El nombre empleado para el taxón corresponde al propuesto por Kullander y Hartel (1997), cuatro del total de ejemplares fueron depositados en la colección Nacional de Peces de la Universidad Nacional Autónoma de México, con número de catalogo:IBUNAM 8886.
Resultados
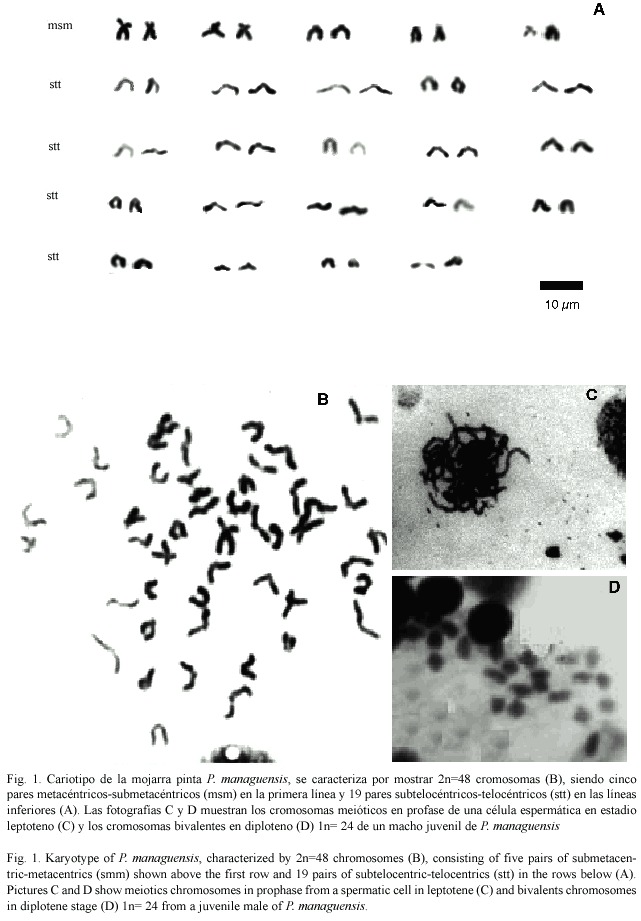
Se obtuvo un número cromosómico modal diploide de 2n=48 (Fig.1 A y B), similar al reportado para otros cíclidos neotropicales. Del complemento cromosómico se encontró que cinco pares fueron metacéntricos-submetacéntricos (birrámeos) y 19 pares correspondieron a cromosomas subtelocéntricos-telocéntricos (monorrámeos) (Fig.1A,2 y Cuadro 1).
No se presentaron evidencias heteromórficas que permitieran identificar cromosomas sexuales en ninguno de los sexos analizados. El número haploide de cromosomas se ratificó por el conteo de campos meióticos univalentes en metafase I, los cuales mostraron un número n=24 cromosomas en la mayoría de los campos contados.
Discusión
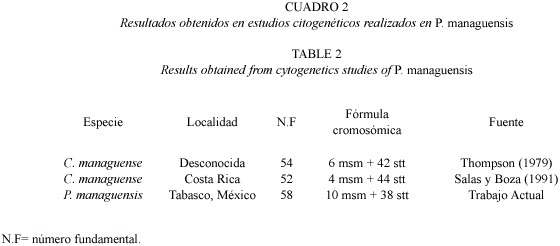
El cariotipo encontrado (Fig.1) difiere en el número de cromosomas birrámeos presentado en estudios realizados para la misma especie por Thompson (1979) y Salas y Boza (1991). Entre las diferencias, se puede mencionar que Thompson (1979) encontró tres pares de cromosomas metacéntricos-submetacéntricos y 21 pares de cromosomas subtelocéntricos-telocéntricos. Por su parte Salas y Boza (1991) identificaron cuatro pares de cromosomas metacéntricos-submetacéntricos y 20 pares de cromosomas subtelocéntricos-telocéntricos (Cuadro 2).
De acuerdo con la opinión de varios autores, los caracteres cromosómicos como el número de cromosomas,la estructura y tamaño de los mismos,son estables y específicos en cada especie. Siendo ello coherente con el número cromosómico diploide 2n=48 del cariotipo de P.managuensis y de los resultados presentados en estudios citogenéticos previos en la especie (Cuadro 2) y en los ciclidos del continente americano.Sin embargo,se identificaron diferencias en el número de cromosomas birrámeos presentado en las poblaciones estudiadas por Thompson (1979) y Salas y Boza (1991). Las diferencias encontradas sugieren que la designación de categorías a los pares cromosómicos fue diferente y posiblemente se deba a las siguientes causas:
1. Razones fortuitas que fueron asociadas a la dispersión de los cromosomas (Uribe-Alcocer y Arreguín-Espinoza 1989).
2. La constricción producida por la colchicina (Thompson 1979, 1981, Crosetti et al. 1988, Uribe-Alcocer y Arreguin-Espinoza 1989).
3. La consecuencia de la acción de los fijadores sobre los cromosomas, principalmente del reactivo ácido acético (Kligerman y Bloom 1977).
4. El tamaño de los cromosomas puede variar de acuerdo con la talla que tenían al momento de ser fijados (se pueden presentar diversas tallas por el grado de avancé de la metafase), factor que puede afectar las comparaciones.
5. Los criterios de cada autor para medir, clasificar y determinar la posición del centrómero en cada cromosoma.
A pesar de dichas consideraciones, la fórmula cromosómica para los organismos de la mojarra pinta P.managuensis colectados en Tabasco, fue la siguiente:
10 msm + 38 stt
Siendo 58 el número fundamental o número total de brazos cromosómicos del complemento diploide, representado por 10 (msm) cromosomas birrámeos y 38 (stt) cromosomas monorrámeos. Con número cromosómico modal diploide de 2n=48 cromosomas, igual al reportado para la mayoría de los cíclidos centroamericanos estudiados por Thompson (1979), Salas y Boza (1991) y Uribe-Alcocer et al. (1992,1999). Dicho número se considera ancestral para los cíclidos centroamericanos, los peces perciformes y la mayoría de los peces teleósteos.El número haploide para la especie de 1n=24 cromosomas estuvo congruente con los conteos reportados en este documento para las dispersiones mitóticas diploides (2n=48).
Siguiendo el criterio de Thompson (1979), podemos considerar el cariotipo de esta especie como primitivo o de tipo "A ",por estar formado de 38 cromosomas subtelocéntricos- telocéntricos y 10 cromosomas metacéntricos- submetacéntricos.
De acuerdo con Thompson (1979) y Uribe-Alcocer et al. (1989 y 1999), los resultados de la morfología cromosómica con o sin bandeo diferencial en los cariotipos de algunas especies de cíclidos no han dado pautas suficientes para establecer una separación entre los organismos de la misma especie, hecho que fue particularmente evidente en este reporte. Sin embargo, con la metodología desarrollada y con los resultados reportados se conducirán nuevas investigaciones para dar seguimiento a relaciones de tipo genético y evolutivo en las especies de ciclidos nativos del sureste de México considerando dentro de ello las características básicas de estructura y número cromosómico del cariotipo clásico (Denton 1973, Gold 1979). Así como también,la de sustentar estudios tendientes al manejo genético de la especie con fines de conservación y de mejora genética en acuicultura (Taniguchi et al.1993, Halvorson y Quezada 1999).En la producción de peces con juegos extra de cromosomas como los triploides y tetraploides, la evaluación del número de cromosomas se ha vuelto una herramienta indispensable para determinar el nivel de ploidía de los organismos manipulados (Lozano et al .1987,Thorgaard y Disney, 1990, Arias-Rodríguez 2001),por lo que el procedimiento citológico desarrollado en esta especie será de considerable utilidad.
Agradecimientos
Se agradece a Ulises Hernández Vidal por su contribución durante el trabajo de laboratorio, así como a las autoridades de la División Académica de Ciencias Biológicas de la Universidad Juárez Autónoma de Tabasco y del Instituto de Ciencias del Mar y Limnología de la Universidad Nacional Autónoma de México.
Resumen
Para contribuir con el ordenamiento de las especies de la familia Cichlidae, se realizó el estudio citogenético de la mojarra pinta Parachromis managuensis. Fueron utilizados veintiún organismos, ocho machos y trece hembras,colectados en Villahermosa, Tabasco, México. Los especímenes se procesaron por técnicas citogenéticas convencionales (con ligeras modificaciones). Se obtuvieron campos mitóticos y meióticos de buena calidad, de los que fueron seleccionados catorce cariotipos para ser analizados merística y estadísticamente. Los especímenes presentaron número modal diploide de 2n=48 cromosomas, similar al reportado para otros cíclidos neotropicales. Cinco pares fueron cromosomas metacéntricos-submetacéntricos (birrámeos) y 19 pares cromosomas subtelocéntricos-telocéntricos (monorrámeos),con número fundamental (NF) de 58 brazos.El número haploide se ratificó por conteo de campos meióticos en metafase I. Los campos mitóticos observados y los cariotipos de machos y hembras no presentaron evidencias heteromórficas para identificar cromosomas sexuales.
Palabras clave: Parachromis managuensis, citogenética, cromosomas, mojarra, cíclido.
Referencias
Arias-Rodríguez, L. 2001. Inactivación genética de esperma e inducción de ginogénesis y de triploidía en el botete diana Sphoeroides annulatus (Jenyns,1842). Tesis de maestría, Centro de Investigación en Alimentación y Desarrollo, Mazatlán, Sinaloa, México. 202 p. [ Links ]
Carrillo, M. C. E. 1991. Análisis de la pesca ribereña de 3 especies de cíclidos nativos: Cichlasoma synspilum, Cichlasoma urophthalmus y Cichlasoma motaguense de importancia comercial en el municipio de Jonuta,Tabasco,México.Tesis de Lic.en Biología. Universidad Juárez Autónoma de Tabasco,División Académica de Ciencias Biológicas,Tabasco, México.44 p. [ Links ]
Crosetti,D.,L.Sola.,P.Brunner &S.Cataudella.1988. Cytogenetical characterization of Oreochromis niloticus, O. mossambicus and their hybrid, p.143-151.In R.S.V.Pullin,T.Bhukaswan,K.Thonguthai &J.L. Maclean (eds.).The Second Symposium on Tilapia in Aquaculture.ICLARM.Department of Fisheries, Bangkok, Thailand and International Center for Living Aquatic Resources Management, Manila, Filipinas. [ Links ]
Denton,T.E.1973.Fish chromosome methodology.Charles C.Thomas,Chicago,Illinois,EEUU.166 p. [ Links ]
Dunseth,D.R.&D.R.Bayne.1978.Recruitment control and production of Tilapia aurea (Steindachner) with the predator Cichlasoma managuense (Günther). Aquaculture 14:383-390. [ Links ]
Gold, J. R. 1979. Cytogenetics,p.353-405.In W.S.Hoar, D.J.Rahdall &J.R.Brett (eds.).Fish physiology.Vol. VIII. Academic, Nueva York, EEUU [ Links ]
Gómez-Márquez,J.L.,B.Peña-Mendoza,I.H.Salgado- Ugarte &M.Guzmán-Arroyo.2003.Reproductive aspects of Oreochromis niloticus (Perciformes: Cichlidae) at Coatetelco lake,Morelos,Mexico.Rev. Biol. Trop. 51:221-228. [ Links ]
Guerrero,R.D.&W.L.Shelton.1974.An aceto-carmine squash method for sexing juvenile fishes. Prog. Fish. Cult.36:56. [ Links ]
Günther, A. 1867. On the fishes of the states of Central America, founded upon specimens collected in fresh and marine waters of various parts of that country by Messrs.Salvin and Godman and Capt. J. M. Dow. Proc. Zool. Soc. Lond. 600-604 p. [ Links ]
Gyldenholm, A. O. & J. J, Scheel. 1971. Chromosome numbers of fishes.I.J.Fish.Biol.3:479-486. [ Links ]
Halvorson,H.O.&F.Quezada.1999.Increasing public involvement in enriching our fish stocks through genetic enhancement.Gen.Anal.Biomol.Eng.15:75-84. [ Links ]
Jiménez,B.L.&R.Nepita.2000.Espectro trófico de la tilapia Oreochromis aureus (Perciformes, Cichlidae) en la presa Infiernillo, Mich.-Gro.México.Rev.Biol. Trop.48:487-494. [ Links ]
Jiménez-Badillo, L. 2005. Age-growth models for tilapia Oreochromis aureus (Perciformes,Cichlidae)of the Infiernillo reservoir, Mexico and reproductive behaviour. Rev. Biol. Trop. 54:in press. [ Links ]
Kligerman, A. D.& Bloom. S. E.1977. Rapid Chromosome preparations from solid tissues of fishes. J. Fish. Res. Board Can. 34: 266-269. [ Links ]
Korth, J. W. & J. M. Fitzsimons. 1987. Karyology of three species of eastern north American Atherinid fishes. Copeia 2:505-509. [ Links ]
Kullander, S. O. & Hartel K. E. 1997. The systematic status of cichlid genera described by Louis Agassiz in 1859: Amphilophus ,Baiodon ,Hypsophrys and Parachromis (Teleostei: Cichlidae). Ichthyol. Explor. Freshwaters.7:193-202. [ Links ]
Levan, A., K. Fredga & A. A. Sandberg. 1964. Nomenclature for centromeric position on chromosomes. Hereditas 52:201-220. [ Links ]
Lozano, R., C. R. Rejon & M. Ruiz Rejon. 1987. Manipulación cromosómica en organismos acuáticos. 215-246 p.In Espinosa de los Monteros y U. Labarta (eds.).Genética en Acuicultura.Mundi-Prensa, Madrid, España. [ Links ]
Mendoza, A., S. Páramo., J. A. Oseguera, C. A. Vázquez, J. Macias & G. Bravo. 1992. Efecto de la densidad de carga y el nivel de proteína sobre el crecimiento de Cichlasoma syspilum (Pisces: Cichlidae) bajo cultivo experimental en sistema cerrado.Universidad Ciencia 9:53-63. [ Links ]
Mendoza, E. A., A. Mendoza., A. Galmiche & R. Mesenguer. 1995. La acuicultura de peces nativos en México:Retos y perspectivas,p.131-141.In E.A.Mendoza,A.Galmiche &R.Mesenguer (eds.).Memorias del II Seminario sobre peces nativos con uso potencial en acuicultura 23-26 de mayo de 1994. H. Cárdenas. Tabasco.Colegio de postgraduados en ciencias agrícolas,Cárdenas, Tabasco,México. [ Links ]
Miller,R.R.1992.Pisces,p.486-501.In S.H.Hurlbert &A.Villalobos-Figueroa (eds.).Aquatic biota of México, Central America and the West Indies.San Diego,California,EEUU. [ Links ]
Páramo-Delgadillo,S.1985.Determinación del sexo en algunos cíclidos de Tabasco,Méx.Universidad y Ciencia 2:61-64. [ Links ]
Pérez-Sánchez, E., J. F. Muir & L. G. Ross. 2005. Livelihood options for the coastal zone of Tabasco, Mexico. Aquatic Resourc. Cult. Develop. 1:91-108. [ Links ]
Salas,E.& J. Boza. 1991. Citotaxonomía comparativa de tres especies de Cichlasoma (Pisces: Cichlidae) nativas de Costa Rica. Rev. Biol. Trop. 39:219-224. [ Links ]
SEMARNAP.2003.Archivos de Pesquerías,Departamento de Pesca,Delegación Centro, Tabasco, México. [ Links ]
Taniguchi,N.,H.S.Han &A.Tsujimura.1993.Use of chromosome manipulation fish in aquaculture and related problems of conservation of wild stock,p. 68-81.In K.L.Main &E.Reynolds (eds.).Selective breeding of fishes in Asia and U.S.A.Proceedings of a workshop in Honolulu,Hawaii.The Oceanic Institute, Honolulu, Hawaii,EEUU. [ Links ]
Thompson, K. W. 1979. Cytotaxonomy of 41 species of neotropical cichlidae.Copeia 4:679-691. [ Links ]
Thompson, K. W. 1981. Kariotypes of six species of African Cichlidae (pisces:Perciformes).Experientia 37:351-352. [ Links ]
Thorgaard,G.H.&J.E.Disney.1990.Chromosome preparation and analysis,p.171-190.In C.B Schreck & P. B. Moyle (eds.).Methods for fish biology. American Fisheries Society,Maryland,EEUU. [ Links ]
Uribe-Alcocer,M.&J.Arreguin-Espinoza.1989.Los cromosomas de los peces Oreochromis urolepis hornorum y Oreochromis mossambicus (Pisces:Cichlidae). An.Inst.Cienc.del Mar. Limnol. Univ. Nal. Autón. México,16:189-198. [ Links ]
Uribe-Alcocer,M.,Blanca L.Náder-Garcia &N.Valdés- Morales.1992.Karyotypes of two Cichlid fishes from México,Cichlasoma ellioti and Cichlasoma trimaculatum .Jap.J.Ichthyol.39:174-177. [ Links ]
Uribe-Alcocer,M.,C.Téllez-Vargas & P.Díaz-Jaimes.1999. Chromosomes of C ichlasoma istlanum (Perciformes: Cichlidae)and karyotype comparison of two presumed subspecies. Rev. Biol. Trop. 47: 1051-1059. [ Links ]
Uyeno,T.&R.R.Miller.1973.Chromosomes and the evolution of the plagopterin fishes (Cyprinidae)of the Colorado river system.Copeia 4:776-782. [ Links ]