Revista de Biología Tropical
versión On-line ISSN 0034-7744versión impresa ISSN 0034-7744
Rev. biol. trop vol.52 no.1 San José mar. 2004
Hábitos alimentarios del pargo mancha Lutjanus guttatus (Pisces: Lutjanidae)
en Los Cóbanos y Puerto La Libertad, El Salvador
José Rodrigo Rojas M.1 , Erick Maravilla2 & Francisco Chicas B.2
1 Apartado Postal 20-4200, Naranjo, Alajuela, Costa Rica. Para correspondencia: rrojasm@ice.go.cr
2 Escuela de Biología, Facultad de Ciencias Naturales y Matemáticas, Universidad de El Salvador.
Recibido 05-VIII-2003. Corregido 11-XII-2003. Aceptado 16-II-2004.
Abstract
A total of 175 spotted snapper Lutjanus guttatus were collected monthly in the Los Cobanos and Puerto La Libertad, El Salvador, from January to December 2000 to determine its feeding habits. The fishes studied ranged 9.8 - 58.0 cm in total length. Were collected using pushnet and hook and line. This snapper is a bentonic opportunistic carnivorous predator. The total biomass of the stomach contents was 260.5 g. Crustaceans (Squillidae, Portunidae, Dynomenidae, Penaeidae, Sicyoniidae, Callianassidae), were the most abundant group; they accounted for 50.4% of the total biomass. Numerically, Portunus asper was the most abundant prey. Ontogenic differences were observed in the diet. In juveniles (16 cm TL), at any time of the year, the most frequent and abundant components were crustaceans and in adults were crustaceans, fishes and mollusks. The relative importance of different components of the diet was assessed with two indexes that combine, in different ways, percentage frequency of occurrence, percentage number and percentage weight of prey categories. The commercial use this resource and the absence of management strategies are discussed.
Key words: Lutjanus guttatus, Lutjanidae, stomach content analysis, diet composition, El Salvador.
Los estudios sobre la dinámica trófica íctica forman parte de las investigaciones que se requieren para establecer la estructura y funcionamiento de los ecosistemas acuáticos (Saucedo 2000, Ayala-Pérez et al. 2003, Díaz-Ruiz et al. 2004). También representan la línea base de información para establecer planes de manejo y administración de los recursos, que ahí se encuentren. Parte de esta dinámica la conforman el estudio de los hábitos alimentarios, sobre todo de especies de peces que por su importancia económica, son sujetas de extracción (Rojas 1997 a, b). Este es el caso de los pargos (Pisces: Lutjanidae), peces que se distribuyen en las regiones tropicales del mundo (Yañez-Arancibia 1978, Allen 1985, Sánchez 1994 y Rojas 1997 a, b, Ayala-Pérez et al. 2003, Santamaría-Miranda et al. 2003 a, b, Chiapa-Carrara et al. 2004, Rojas-Herrera et al. 2004) y en forma especial del pargo mancha (Lutjanus guttatus Steindachner, 1869).
L. guttatus se distribuye desde el Golfo de California hasta Perú (Allen 1985), y de acuerdo con Maravilla (2001) es la especie más importante en la pesquería artesanal salvadoreña. Esta situación coincide con lo señalado para Costa Rica (Rojas 1997a, Andrade 1998, Vargas 1999, Olivares y Boza 1999, Valverde y Boza 1999), y para Guatemala (Saucedo 2000) y para México (Chiappa-Carrara et al. 2004, Rojas-Herrera et al. 2004).
Aunque en El Salvador el interés comercial por los pargos supera los 20 años, con excepción de Funes y Matal (1989), existen muy pocos antecedentes sobre estos Perciformes. Ante la falta de información sobre las preferencias alimentarias de adultos y cambios en la dieta relacionados con diferentes estados ontogénicos, se pretende en este estudio determinar los hábitos alimentarios del pargo mancha, L. guttatus, en Los Cóbanos y Puerto La Libertad, El Salvador.
Material y métodos
Entre enero y diciembre del 2000 especimenes de L. guttatus fueron recolectados mensualmente en los Cóbanos (13º3126" N; 89º4823" W) y el puerto de La Libertad (13º2918"N; 89º1924"W). Estos fueron capturados durante el atardecer y la madrugada, utilizando líneas con anzuelos (5-12) y trasmallo (4-5). La profundidad de captura fue entre 8 y 50 m. La designación de ejemplares juveniles y adultos sigue lo propuesto por Rojas (1997b). Acada pez se le determinó la longitud total (± 0.1 cm) y peso total (± 0.01 g). El eviscerado, extracción y preservación de los estómagos se llevó a cabo según Rojas (1997b). Para su posterior análisis cada muestra fue transportada al Laboratorio Húmedo de la Escuela
de Ciencias Biológicas de la Universidad Nacional, Costa Rica. Mediante eversión del estómago se extrajo el contenido, se colocó en una cápsula de vidrio y bajo estereoscopio se separó y se identificó cada ítem hasta el taxón más bajo posible. Mediante observación directa de cada estómago se registró la presencia o ausencia de contenido estomacal. La ictiofauna ingerida se identificó mediante características osteológicas y anatómicas externas (Allen y Robertson 1994). Los crustáceos fueron identificados mediante la clave de Pérez-Farfante (1971). Para la identificación de los moluscos se utilizó la guía propuesta por Cruz y Jiménez (1994). Algunos contenidos estomacales fueron clasificados como restos debido al avanzado estado de digestión.
Para el análisis del contenido estomacal se aplicaron tres métodos: A) el numérico (Hyslop 1980), con el cuál se determina el número y porcentaje de cada ítem, B) la frecuencia de ocurrencia (Starck & Schroeder 1970) el cuál expresa el porcentaje de estómagos que contienen una determinada presa con respecto a todos los estómagos, C) el método gravimétrico con el cuál se calcula el peso de cada ítem y se expresa como un porcentaje del peso total de todos los ítem encontrados (Hyslop 1980). A pesar de que estos métodos son comúnmente utilizados estos presentan algunas desventajas: dificultad de individualizar y contar especimenes digeridos y pérdida de material debido a la manipulación y pesado. Para evitarlas se han desarrollado varios índices que combinan estos tres métodos y caracterizan los componentes alimentarios, con la ventaja de que permiten hacer comparaciones entre clases de tamaño y desarrollo ontogénico. En la presente investigación se utilizarán dos índices: 1) Índice importancia relativa (IRI) (Pinkas et al 1971): IRI= Número (%) + Peso (%) x Ocurrencia (%). 2) Coeficiente de Alimentación Q, (Hureau 1970), Q= Número (%) x Peso (%).
Resultados
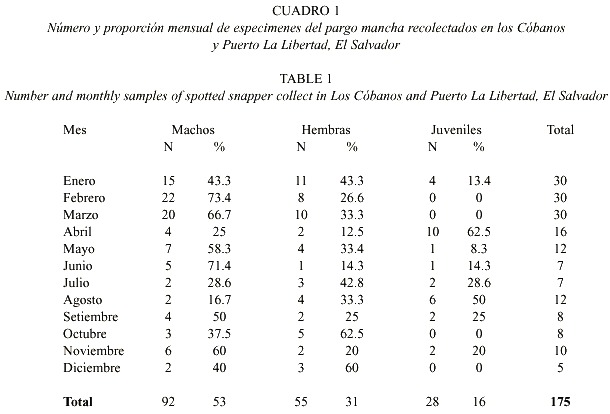
Doce meses de recolectas sistemáticas en los Cóbanos y Puerto La Libertad produjeron 175 ejemplares de L. guttatus. Enero y Marzo son los meses de mayor captura y Diciembre el mes de menor número de ejemplares disponibles (Cuadro 1). En este mismo cuadro se presenta la distribución mensual del número de ejemplares recolectados por intervalo de talla, cuyo espectro varió entre 9.8 y 58 cm LT. El 51.4% (n = 90) eran machos, 57 hembras (32.6%) y 28 juveniles (16%). La proporción de sexos fue 1.5 machos por cada hembra. El 11.4% (n = 20) de las muestras, todos ejemplares juveniles, provienen de las capturas con redes. El 78.9% de los ejemplares provienen del Puerto de La Libertad y el resto de Los Cóbanos. El análisis de varianza (ANDEVA) demostró que los contenidos estomacales de estos lugares no presentaron diferencias estadísticamente significativas (p = a 0.05).
L. guttatus presenta un amplio espectro alimentario, con preferencia hacia el consumo de crustáceos (seis familias, 11 especies), en menor grado peces (dos familias, dos géneros y dos especies) y ocasionalmente moluscos (Cefalopoda y Bivalvia) (Cuadro 2). La biomasa total fue de 260.5g, y en donde el 50.4% se encontró en seis familias de crustáceos (Squillidae, Portunidae, Dynomenidae, Penaeidae, Sicyoniidae, Callianassidae). Las jaibas (Portunidae) presentaron la mayor frecuencia numérica (19 especimenes), ocurrencia (20.43%) y biomasa (33.82 g). De igual forma el IRI, así como el índice Q fueron los más altos para este grupo (517.8 y 343.22 respectivamente). Por la biomasa y frecuencia numérica, Portunus asper representa la especie de cangrejo que más frecuentemente consume el pargo mancha. En segundo y tercer lugar la jaiba gigante (Callinectes toxotes) y la galera panameña (Squilla panamensis), estas especies aportan 18.85, 11.23 y 8.33 g de biomasa respectivamente (Cuadro 2). Otras especies de crustáceos que se reconocieron fueron los camarones blancos (Trachypenaeus sp.) y el camarón aquilado (Sycionia disdorsalis).
CUADRO 2
Espectro alimentario del pargo mancha (L. guttatus) en Los Cóbanos y
Puerto La Libertad, El Salvador
TABLE 2
Diet composition of spotted snapper (L. guttatus) in Los Cóbanos and
Puerto La Libertad, El Salvador
| Item | Nombre común | Presencia en estómagos N | Especímenes | Biomasa | Ocurrencia (%) | I R I | Q | ||
| Crustacea | Crustáceos | 36 | 42 | 45.16 | 131.4 | 50.4 | 31.30 | 2991 | 2276.1 |
| Stomatopoda | Estomatópodos | ||||||||
| Squilloidea | Esquílidos | ||||||||
| Squillidae | Esquílidos | 8 | 8 | 8.6 | 13.92 | 6.87 | 6.95 | 107.5 | 59.08 |
| Squilla panamensis | Galera panameña | 5 | 5 | 5.37 | 8.33 | 4.11 | 4.34 | 41.1 | 22.1 |
| Squilla parva | Galera langostina | 2 | 2 | 2.15 | 3 | 1.48 | 1.74 | 6.31 | 3.18 |
| Squilla sp. | Galeras | 1 | 1 | 1.07 | 2.59 | 1.28 | 0.87 | 2.04 | 1.37 |
| Restos estomatópodos | 4 | 1.785 | 0.88 | 3.48 | |||||
| Brachyura | Cangrejos | ||||||||
| Brachyrhyncha | Cangrejos | ||||||||
| Portunidae | Jaibas | 16 | 19 | 20.43 | 33.82 | 16.8 | 13.91 | 517.8 | 343.22 |
| Callinectes toxotes | Jaiba gigante | 4 | 5 | 5.37 | 11.23 | 5.54 | 3.48 | 37.96 | 29.75 |
| Portunus asper | Jaiba áspera | 9 | 10 | 10.75 | 18.85 | 9.29 | 7.82 | 156.71 | 99.86 |
| Portunus xantusii | Jaiba xantus | 1 | 2 | 2.15 | 2.82 | 1.34 | 0.87 | 3.04 | 2.88 |
| Cronius ruber | Jaiba pecosa | 1 | 1 | 1.07 | 0.65 | 0.32 | 0.87 | 1.21 | 0.34 |
| Callinectes sp. | Jaibas | 1 | 1 | 1.07 | 0.37 | 0.18 | 0.87 | 1.1 | 0.19 |
| Restos de cangrejos | 4 | 1.785 | 0.88 | 3.48 | |||||
| Dromiacea | |||||||||
| No determinados | 1 | 1 | 1.07 | 0.92 | 0.45 | 0.87 | 1.32 | 0.48 | |
| Dendrobranchiata | Camarones | ||||||||
| Penaeoidea | Camarones peneidos | ||||||||
| Penaeidae | 2 | 2 | 2.15 | 5.79 | 2.9 | 1.74 | 8.78 | 6.235 | |
| Trachypenaeus byrdi | Camarón carabalí | 1 | 1 | 1.07 | 3.23 | 1.6 | 0.87 | 2.32 | 1.71 |
| Penaeus occidentalis | Camarón blanco | 1 | 1 | 1.07 | 2.56 | 1.3 | 0.87 | 2.06 | 1.79 |
| Sicyoniidae | Camarones de piedra | ||||||||
| Sicyonia disdorsalis | Camarón aquilado | 5 | 9 | 9.68 | 17.45 | 8.6 | 4.31 | 78.78 | 83.24 |
| Restos de camarón | 16 | 24.025 | 11.84 | 13.8 | |||||
| Callianassidae | Calianasas | ||||||||
| Neotrypaea sp. | Calianasas | 2 | 3 | 3.23 | 8.75 | 4.3 | 1.72 | 12.95 | 13.88 |
| No determinados | 2 | 4 | 4.30 | 8.67 | 4.3 | 1.72 | 14.79 | 18.49 | |
| Pisces | 9 | 49 | 52.7 | 27.74 | 13.76 | 7.83 | 520.38 | 725.15 | |
| Ophichthidae | Tiesos | ||||||||
| Myrophis vafer | Gusano | 3 | 3 | 3.23 | 11.64 | 5.78 | 2.61 | 23.51 | 18.66 |
| Bregmacerotidae | Bregmacero | ||||||||
| Bregmaceros sp. | Bregmacero | 6 | 46 | 49.5 | 16.1 | 7.98 | 5.22 | 300 | 395 |
| Restos de peces | 9 | 27.76 | 13.68 | 7.76 | |||||
| Moluscos | 2 | 2 | 2.15 | 4.14 | 2.05 | 1.74 | 7.30 | 4.41 | |
| Cefalópodos | Calamares | 1 | 1 | 1.07 | 3.09 | 1.53 | 0.87 | 2.26 | 1.64 |
| Bivalvos | Bivalvos, conchas | 1 | 1 | 1.07 | 1.05 | 0.52 | 0.87 | 1.38 | 0.556 |
| Restos | |||||||||
| Restos no identificados | 69 | Indet. | 0 | 47.8 | 23.56 | 59.5 | 0 | ||
Se identificaron dos familias de peces (Ophichthyidae y Bregmacerotidae). Bregmaceros sp. fue numéricamente el ítem más abundante (46 especimenes) y el que más biomasa aportó (7.98%). Se encontraron tres ejemplares de la anguila Mirophis vafer, una de ellas de 22 cm longitud total y 8.96 g de peso total. Los moluscos tienen una baja frecuencia numérica (49) y de ocurrencia (7.83%).
Especimenes menores de 16 cm LT consumen preferentemente crustáceos (principalmente portúnidos). Después de los 24 cm y hasta los 44 cm el espectro se ve diversificado con la inclusión de peces, grupo que llega a significar, en ejemplares de grandes tallas (39.5-45 cm LT), el 52.2 % ,de la biomasa consumida. Después de los 45 cm la dieta incluye moluscos (Cefalópodos). El 59.5% de los estómagos contenían solo restos con una biomasa de 47.8 g. Los restos incluyen escamas, fragmentos de camarones (exoesqueletos, rostros y una matriz carnosa en estado avanzado de digestión).
Discusión
Durante el desarrollo de investigaciones sobre ecología trófica, es fundamental el uso de diferentes artes de pesca, ello facilita el muestreo en bocas de estuarios o zonas de manglar (caso de Los Cóbanos) donde usualmente ocurren pargos juveniles o adultos jóvenes (Rojas 1997a). Por ejemplo, el uso de la red es un método de captura que evita la eversión de estómagos por cambios batimétricos abruptos y con ello la pérdida de contenidos estomacales. Mientras que la línea con anzuelos permite la recolecta de ejemplares adultos a mayores profundidades (caso de Puerto La Libertad). El uso combinado de redes y líneas facilita la recolección de ejemplares de distintos ambientes (fondos lodosos, rocosos, arenosos), con una amplia gama de tallas y variada distribución batimétrica. Tal combinación robustece las investigaciones sobre hábitos alimentarios, ya que incorpora al análisis diferentes estados ontogénicos y se amplia la oferta alimentaria al considerar el ecosistema estuarino y la plataforma costera. La combinación de esta artes ha demostrado ser eficaz en estudios que incluyen otras especies del género Lutjanus (Stark 1971, Claro 1981, Funes y Matal, 1989, Suárez y Rubio 1993, Rojas 1997 a,b y Andrade 1998, entre otros).
Espectro alimentario: L. guttatus, de los Cóbanos y Puerto de La Libertad, es un depredador oportunista bentónico carnívoro y polífago, que consume crustáceos (animales de movimiento rápido) durante todo el año. Alterna su alimentación con peces y algunos moluscos. Esta situación diverge de lo encontrado para L. synagris en la plataforma cubana (Randall 1967), para L. kasmira en Hawai (Oda y Parrish 1981) y L. guttatus en el Golfo de Nicoya, Costa Rica (Rojas 1997a b), donde se determinó preferencia por el consumo de peces, tanto en ejemplares adultos como en juveniles.
La preferencia por el consumo de crustáceos coincide con los resultados obtenidos por Claro (1981), ya que del análisis de 905 ejemplares de la biajaiba (L. synagris), concluyó que este ítem se encontraban en el 60.9% de los estómagos. De igual forma Mizenko (1984) estudió los hábitos alimentarios de L. Kasmira y L. rufolineatus, en los arrecifes del oeste de Samoa, estableciendo una frecuencia de ocurrencia de crustáceos de 80% y 90% respectivamente. Al igual que en El Salvador, en Costa Rica, los crustáceos constituyeron la mayor biomasa (79.3%), los peces el (7.8%), mientras que los anélidos, equinodermos y moluscos representaron el 3.7% (Rojas 1997a). Situación similar es reportada por Saucedo (2000) para especimenes juveniles.
L. guttatus de El Salvador no consume frecuentemente camarón (Penaeus sp.), como lo hace esta especie en Costa Rica (Rojas 1997a). No obstante el carácter carnívoro-polífago observado en Los Cóbanos y Puerto La Libertad coincide con lo reportado en algunos países centroamericanos, como por ejemplo en Costa Rica (Rojas 1997a, b), Guatemala (Andrade 1998), México (Saucedo 2000, Rojas-Herrera y Chiappa-Carrera com. per.) y otras latitudes, como en Colombia (Suárez y Rubio 1993).
La baja ingestión de moluscos, tanto en juveniles como en adultos, puede ser explicada más como consumo casual que como objeto de preferencia alimentaria. Tal como lo señala Rojas (1997a,b) quizás su bajo consumo obedezca a las limitaciones de las anatomía bucal de esta especie, ya que L. guttatus al igual que L. colorado presentan caninos finos, delgados en hileras y bandas cortas de dientes palatinos y vomerinos.
Variación del espectro alimentario durante la ontogenia: Son notables los cambios ontogénicos en la alimentación de L guttatus. Los juveniles (15.8-22.0 cm) consumen casi exclusivamente crustáceos. Con el crecimiento incrementa la proporción de peces en su dieta, llegando los adultos a ser ictiófagos exclusivos. El aporte numérico y biomásico de ejemplares adultos mayores que 40 cm LT, se sustenta en la presencia de Bregmaceros sp y Myrophis vafer, peces típicamente bentónicos de sustratos rocosos. A partir de los 44 cm se suma un grupo más, los moluscos (Cefalópodos). Cambios similares en las preferencias alimentarias han sido reportadas por Rojas (1997a). Con la diferencia de que la ictiofagia se da después de los 20 cm con el consumo de peces como M. vafer, engráulidos y moluscos.
Tal como lo han demostrado Randall (1967), Mizenko (1984), Rojas (1997a), Andrade (1998) y Saucedo (2000), los cambios en los patrones alimentarios son el resultado de: a) cambios ontogénicos, b) abundancia del recurso presa, c) oferta alimentaria disponible, d) migraciones espaciales (desde el manglar hacia el pélagos) y e) desplazamientos batimétricos. Ante este escenario y aunque no existen antecedentes que señalen los balances energéticos comprometidos en la búsqueda de alimento, se hipotetiza que la estrategia del pargo mancha es compensar con peces y moluscos la energía que fácilmente conseguía consumiendo crustáceos.
Hacia el manejo del recurso pargo: Considerando los antecedentes publicados por Rojas (1997a,b), Andrade (1998), Chiappa-Carrara et al. (2004), Rojas-Herrera et al. (2004) y la presente investigación, L. guttatus es uno de los recursos de mayor importancia comercial en Centroamérica, tanto por su creciente consumo (debido a la alta calidad de su carne) como por la demanda regional e internacional. No obstante aunque, desde el punto de vista socioeconómico, pareciera una situación ventajosa, no pasa lo mismo cuando se examinan los siguientes aspectos:
En ningún país de la región centroamericana se han determinado medidas de manejo, lo que indica que posiblemente se esté extrayendo el recurso indiscriminadamente.
Como muchas especies de importancia comercial, durante sus primeros estados de vida el pargo mancha, en Centroamérica, ocupa diferentes hábitats esenciales, es decir aguas poco profundas de estuarios, manglares y playas de fondos rocosos en el Golfo de Panamá, Golfo Dulce, estuario y manglares del Golfo de Nicoya, manglares de Nicaragua, Bahía de Jiquilisco y Golfo de Fonseca. La dependencia por este tipo de hábitat se ve comprometida si consideramos las diferentes presiones antrópicas a las que están siendo sujetos estos ecosistemas, sobre todo por la explosión demográfica (demanda de proteína), el crecimiento de la frontera industrial, turística y de servicios en zonas costeras, la contaminación, la sobrepesca y la muerte incidental de juveniles por pesca de camarones, entre otros. La sinergia de este conjunto de impactos puede alterar el ciclo natural de esta especie, en lo que se refiere a sobrevivencia, migración de juveniles a zonas más profundas y tasas de reclutamiento.
La dependencia alimentaria del pargo por grupos que también son de consumo humano (ej. camarones, jaibas, esquilas etc.), compromete su conservación, ya que el consumo de crustáceos es esencial para juveniles y adultos jóvenes. La falta de alimento podría causar migraciones espacio-temporales, lo que a posteriori conllevaría a la extinción de poblaciones locales, situación que a todas luces afectaría la trofia del ecosistema.
La determinación de los hábitos alimentarios del pargo mancha deben ser la línea base de estudios que conduzcan al desarrollo e implementación de un plan de manejo y conservación regional. De seguir con el actual ritmo de explotación el pargo mancha puede tener la misma suerte que ha corrido en Centro América el tiburón toro (Carcharhinus leucas), el pez sierra (Pristis pristis) (Thorson 1982) y la calva (Centropomus parallelus) (M. Mug, com.per. 2001).
Agradecimientos
A Mario Argueta sin su ayuda esta investigación no hubiese sido posible. A Jorge Cabrera, por el acceso al Laboratorio Húmedo de la Universidad Nacional, Costa Rica y por sus acertadas observaciones y consejos. Al personal del Centro de Investigación en Ciencias del Mar y Limnología CIMAR, Universidad de Costa Rica, en especial a José Vargas, por las facilidades brindadas. A Moisés Mug por su apoyo y observaciones. A Guillermo, Oscar; Ethel, Maribelle, Cesar Laurito y Enrique Frer, por su colaboración en la Unidad de Microscopía Electrónica, Universidad de Costa Rica. A todos los pescadores artesanales de El Salvador. El primer autor desea agradecer el apoyo recibido del DAAD (Deutscher Akademischer Austauschdienst).
Resumen
Se determinaron los hábitos alimentarios del pargo mancha Lutjanus guttatus a partir de 175 ejemplares (9.8 y 58.0 cm LT), recolectados entre enero y diciembre del 2000 en Los Cóbanos y Puerto La Libertad, El Salvador. L. guttatus es un depredador carnívoro oportunista bentónico. La biomasa total fue de 260.5g. Los crustáceos, representados por seis familias (Squillidae, Portunidae, Dynomenidae, Penaeidae, Sicyoniidae, Callianassidae), constituyeron el 50.4% de la biomasa total. Numéricamente, la especie que más consumió el pargo mancha fue Portunus asper. Especimenes menores de 16 cm LT consumen preferentemente crustáceos. Después de los 24 cm y hasta los 44 cm el espectro alimenticio se ve diversificado con la inclusión de peces y moluscos. El 59.5% de los estómagos contenían restos (escamas, exoesqueletos y rostros de camarones) con una biomasa de 47.8 g. Se discute sobre la importancia comercial de este recurso y de la ausencia de una estrategia de manejo.
Referencias
Allen, G. 1985. Snappers of the world. An annotated and illustrated catalogue of Lutjanid species known to date. FAO Fish. Synop., Roma. 208 p. [ Links ]
Allen, G. & R. Robertson. 1994. Fishes of the Tropical Eastern Pacific. Univ. of Hawaii. Honolulu. 332 p. [ Links ]
Andrade, R. 1998. Contribución al estudio de la biología y pesquería del pargo de la mancha Lutjanus guttatus capturado por la pesca artesanal en el pacífico de Guatemala. Tesis de Licenciatura. Universidad San Carlos de Guatemala, San Carlos. 27 p. [ Links ]
Ayala-Pérez, L.A., J. Ramos Miranda & D. Flores Hernández. 2003. La comunidad de peces de la Laguna de Términos: estructura actual comparada. Rev. Biol. Trop. 51: 783-794. [ Links ]
Chiappa-Carrara, X. 2004. Coexistencia de Lutjanus peru y Lutjanus guttatus (Pisces: Lutjanidae) en la costa de Guerrero, México: relación con la variación temporal en el reclutamiento. Rev. Biol. Trop. 52: en prensa. [ Links ]
Claro, R. 1981. Ecología y ciclo de vida de la biajaiba Lutjanus synagris (Linnaeus) en la plataforma cubana. II Biología Pesquera. Acad. Cienc. Cuba. Inf. Cien. Tec. 177: 1-53. [ Links ]
Cruz, R. & J. Jiménez. 1994. Moluscos asociados a las áreas de manglar de la costa Pacífica de América Central. Fundación UNA. Costa Rica. 128 p. [ Links ]
Díaz-Ruiz, S., E. Cano-Quiroga, A. Aguirre-León & R. Ortega-Bernal. 2004. Diversidad, abundancia y conjuntos ictiofaunísticos del sistema lagunar-estuarino Chantuto-Panzacola, Chiapas, México. Rev. Biol. Trop. 52: en prensa. [ Links ]
Funes, M & M. Matal. 1989. Estudio sobre la reproducción y alimentación de la "Pargueta" Lutjanus argentiventris (Lutjanidae) en Los Cobanos, Depto. de Sonsonate, El Salvador, Centro América. Tesis de Licenciatura. Universidad de El Salvador, San Salvador. 65 p. [ Links ]
Hureau, J. 1970. Biologie comparée de quelques poissons antarctiques (Nototheniidae). Bull. Inst. Océanogr. Monaco 68: 1-250. [ Links ]
Hyslop, E. 1980. Stomach contents analysis- a review of methods and their application. J. Fish. Biol. 17: 411-429. [ Links ]Maravilla, E. 2001. Determinación de la época reproductiva, hábitos alimentarios, edad y crecimiento de Lutjanus guttatus (Steindachner, 1889) (Pisces: Lutjanidae) utilizando incrementos diarios en sus otolitos sagitales. Tesis de Licenciatura. Universidad de El Salvador, El Salvador. 89 p. [ Links ]
Mizenko, 1984 The biology of the Western Samoan reef-slope snapper populations of: Lutjanus rufolineatus , Pristipomoides multidens and Lutjanus kasmira Msc. Thesis. University of Rhode Island, Rhode Island. 200 p. [ Links ]
Oda, D. & J. Parrish. 1981. Ecology of commercial snappers and groupers introduced to Hawaiian reefs. Proceedings of the. Fourth International Coral Reef Symposium, Manila, Phillipines . 70 p. [ Links ]
Olivares, O. & J. Boza (1999). Crecimiento de juveniles de pargo mancha (Lutjanus guttatus) utilizando alimento granulado en condiciones de laboratorio. UNICIENCIA 15-16: 45-48. [ Links ]
Pérez-Farfante, I. 1971. A key to the American Pacific shrimps of the genus Trachypenaeus (Decapoda: Penaeidae), with description of a new species. Fish. Bull. 69: 635-646. [ Links ]
Pinkas, L., M. Oliphant & Y. Iverson. 1971. Foods habits of albacore, bluefin tuna and bonito in California waters. Calif. Fish & Game 152: 1-105. [ Links ]
Randall, J. 1967. Food habits of reef fishes of West Indies. Stud. Trop. Oceanogr. 5:1-847. [ Links ]
Rojas J.R. 1997a. Hábitos alimentarios del pargo mancha Lutjanus guttatus (Pisces: Lutjanidae) en el Golfo de Nicoya, Costa Rica. Rev. Biol. Trop. 44 (3)/45 (1): 471-476. [ Links ]
Rojas J.R. 1997b. Fecundidad y épocas de reproducción del pargo mancha Lutjanus guttatus (Pises:Lutjanidae) en el Golfo de Nicoya, Costa Rica. Rev. Biol. Trop. 44 (3)/45 (1): 477-487. [ Links ]
Rojas–Herrera, A.A., M. Mascaró & X. Chiappa-Carrara. 2004. Hábitos alimentarios del huachinango (Lutjanus peru) y del flamenco (Lutjanus guttatus) (Pisces: Lutjanidae) en la costa de Guerrero, México. Rev. Biol. Trop. 52: en prensa. [ Links ]
Sánchez, A. 1994. Feeding habits of Lutjanus apodus (Osteichthyes: Lutjanidae) in Laguna de Terminos, Southwest Gulf of Mexico. Rev. Invest. Mar. 15: 125-134. [ Links ]
Santamaría-Miranda, A., J.F. Elorduy-Garay, M. Villalejo-Fuerte & A.A. Rojas-Herrera. 2003a. Desarrollo gonadal y ciclo reproductivo de Lutjanus peru (Pisces: Lutjanidae) en Guerrero, México. Rev. Biol. Trop. 51: 489-502. [ Links ]
Santamaría-Miranda, A., J.F. Elorduy-Garay & A.A. Rojas Herrera. 2003b. Hábitos alimentarios de Lutjanus peru (Pisces: Lutjanidae) en las costas de Guerrero, México. Rev. Biol. Trop. 51: 503-518. [ Links ]
Saucedo, M. 2000. Alimentación natural de juveniles de Lutjanus peru (Nichols & Murphy, 1922) y Lutjanus guttatus (Steindachner, 1869) (Lutjanidae: Perciformes) en la costa de Jalisco y Colima, México. Tesis de Licenciatura. Universidad de Colima. 120 p. [ Links ]
Starck, W. & R. Schroeder. 1970. Investigation on the grey snapper Lutjanus griseus. Stud. Trop. Oceanogr. 101: 210-224. [ Links ]
Starck, W. 1971. Biology of the gray snapper, Lutjanus griseus (Linnaeus) in the Florida Keys. Stud. Trop. Oceanogr. 10: 12-150. [ Links ]
Suárez, A. & F. Rubio. 1993. Aspectos sobre el crecimiento y ciclo sexual de Lutjanus guttatus (Pisces:Lutjanidae) en la Bahía de Málaga, Pacífico de Colombia. Congreso Centroamericano y del Caribe en Ciencias del Mar Universidad del Valle. Colombia. 152 p. [ Links ]
Thorson, T. 1982. The impact of commercial exploitation of sawfish and shark populations in Lake Nicaragua. Fisheries 7: 2-19. [ Links ]
Valverde, S. & J. Boza (1999). Inducción al desove en hembras del pargo mancha, Lutjanus guttatus (Steindachner, 1869). UNICIENCIA 15-16: 65-69. [ Links ]
Vargas, M. 1999. Estimación de parámetros biológico-pesqueros para el pargo mancha Lutjanus gutatus en el Golfo de Nicoya, Costa Rica. UNICIENCIA 15-16: 79-84. [ Links ]
Yánez-Arancibia, A. 1978. Taxonomía, ecología y estructura de las comunidades de peces en lagunas costeras y bocas efímeras del Pacífico de México. Centro Cienc. del Mar y Limnol. Univ. Nal. Autón. México, Publ. Esp. 2: 1-306. [ Links ]












 uBio
uBio