Revista de Biología Tropical
versión On-line ISSN 0034-7744versión impresa ISSN 0034-7744
Rev. biol. trop vol.51 no.2 San José jun. 2003
Dieta del capibara Hydrochaeris hydrochaeris (Rodentia: Hydrochaeridae) en Caño Limón, Arauca, Colombia
Jimena Forero-Montaña 1, Julio Betancur 2 & Jaime Cavelier 3
Recibido 08-VIII-2000. Corregido 16-V-2001. Aceptado 16-IX-2002.
Abstract
We studied the composition and seasonal variation of the diet of the capybara (Hydrochaeris hydrochaeris) in the flooded savannas of Caño Limón, Colombia. This was achieved by direct observation of the consumption patterns of these animals. The capybaras only consumed plants, and their diet included 89 species of 22 families. Sixty three percent of these plant species had not been reported before. The most commonly consumed plants (94% of the diet), belonged to the Poaceae, Cyperaceae, Leguminosae and Pontederiaceae. Only seven species represented 60% of the total diet: the grasses Hymenachne amplexicaulis (16.9%), Digitaria bicornis (4.5%) and Panicum maximum (4.4%) and the Cyperaceae Rynchospora corymbosa (4.4%). There was seasonal variation in the diet composition of capybaras.
Key words: Arauca, capybara, chigüiro, diet, Hydrochaeris.
El "chigüiro" o "capibara" (Hydrochaeris hydrochaeris) es el roedor viviente más grande del mundo. Tiene una distribución amplia, desde Panamá hasta el norte de Argentina, con preferencia por las regiones bajas (Ojasti 1973, Emmons 1997). Es un animal gregario y semi acuático que realiza la mayor parte de sus actividades cerca a los cuerpos de agua (Ojasti 1973, Escobar y González-Jiménez 1976, Jogerson 1986, Emmons 1997, Quintana et al. 1998a, 1998b).
El chigüiro tiene adaptaciones anatómicas y fisiológicas especiales que le permiten tener una dieta herbívora, con alta eficiencia digestiva, comparable a la de los rumiantes (Ojasti 1973, Alho y Cleber 1986). Es considerado un herbívoro selectivo que se alimenta de plantas con alto contenido de nitrógeno, principalmente gramíneas, ciperáceas y, en menor proporción, de otras hierbas y plantas acuáticas (Ojasti 1973, Escobar y González-Jiménez 1976). La composición de su dieta y preferencias alimentarias cambian estacionalmente como respuesta a los cambios temporales del clima, la calidad y la abundancia de los forrajes (Quintana et al. 1994, 1998a, 1998b, Barreto y Herrera 1998).
En las áreas donde hay alta densidad de chigüiros pueden competir con el ganado por los forrajes, invadir y destruir los cultivos, así como deteriorar la calidad del agua de los abreaderos.
Por lo anterior, en algunos sitios de Sur América los campesinos y ganaderos los consideran un animal dañino que debe exterminarse (Ojasti 1973, Escobar y González-Jiménez 1976, Quintana et al. 1998a). Sin embargo, es un recurso biológico con alto interés económico e intensamente explotado por la calidad de su carne y cuero (Alho y Clever 1986). En Colombia se explota ilegalmente a través de la cacería furtiva para exportar su carne seca a Venezuela (Ojasti 1973).
Conocer los hábitos alimentarios de los organismos es de especial importancia para establecer planes de manejo y conservación, mucho más si se tiene en cuenta que en Colombia se han realizado pocos estudios sobre la dieta de las poblaciones silvestres de chigüiros. En este trabajo estudiamos la composición florística de la dieta de los chigüiros de Caño Limón, teniendo en cuenta las proporciones de consumo de cada planta y su variación estacional.
Materiales y métodos
Área de estudio: Este trabajo se realizó en el Campo Petrolero de Caño Limón, localizado entre los municipios de Arauca y Arauquita, departamento de Arauca, Colombia. La zona se encuentra entre 6º56- 7º07N y 70º57- 71º10O, a 140 m de altitud, está ubicada sobre la llanura aluvial de desborde del río Arauca y forma parte de las sabanas inundables y mal drenadas de la Orinoquía Colombiana (Llanos Orientales).
La temperatura no varía significativamente durante el año, con un promedio diario de 26.5ºC. Por el contrario, la precipitación es marcadamente estacional siendo el promedio anual en las estaciones pluviométricas de Arauca y Arauquita de 1 900 y 2 069 mm, respectivamente. La época lluviosa se presenta entre abril y noviembre, con un período de transición entre las épocas seca y lluviosa, de un mes aproximadamente. Durante el muestreo, el período de transición ocurrió entre noviembre y diciembre, el clima en general fue más lluvioso de lo esperado y no hubo una época seca típica, en la que normalmente se presentan incendios, reducción marcada de los cuerpos de agua y escasez de pastos.
El campo petrolero tiene un área aproximada de 6 000 ha y cuenta con un sistema de 160 plataformas y 66 km de carreteras que las comunican entre sí. Las plataformas y carreteras son terraplenes que están por encima del nivel de las aguas, aún durante la época de lluvias. Los principales tipos fisonómicos de la vegetación en Caño Limón son los esteros, los cuerpos de agua, las sabanas graminoides y los bosques. Los esteros son áreas que pueden estar inundadas durante todo el año, o secarse durante la época seca, y los hay de diferentes tipos según sea la planta semi-acuática dominante. Los cuerpos de agua son naturales o artificiales (creados para el tratamiento de las aguas producidas durante la extracción del petróleo). Los bosques son heterogéneos y se localizan generalmente en el borde de ríos, caños y esteros (Betancur 1997).
Caño Limón es un sitio propicio para estudiar el comportamiento del chigüiro por razones logísticas. Primero, en el área del campo petrolero no se realiza ningún otro tipo de actividad económica diferente a la de extracción del crudo, como si ocurre en los alrededores (ganadería, agricultura y cacería extensivas). Así, el campo petrolero se ha convertido en un refugio para los chigüiros. Segundo, dentro del campo petrolero los chigüiros se han acostumbrado a la presencia del hombre y a la circulación de maquinaria y automóviles, lo que hace fácil observarlos desde las plataformas y carreteras sin alterar su comportamiento.
Muestreos: Se realizaron cuatro muestreos (dos durante la época de lluvias, uno en la época de transición y uno en la época seca), entre mayo de 1998 y abril de 1999, para un total de 63 días de observación (nueve días en el primer muestreo de la época de lluvias y 18 días en cada una de los otros). En cada muestreo se realizaron observaciones entre las 6:00- 10:00 y las 15:00-18:00 horas, para un total de 441 horas de observación.
Se observó directamente, desde las plataformas y las carreteras, utilizando un automóvil a una velocidad aproximada de 15 km/h. Cada día de observación se efectuaba un recorrido diferente en busca de chigüiros que se estuvieran alimentando, empleando nueve días en recorrer completamente el área de estudio. Las observaciones se realizaron exclusivamente en los esteros y espejos de agua y, ocasionalmente, en las plataformas y las carreteras que las conectan. Se hizo una caracterización cualitativa de los diferentes tipos fisonómicos de la vegetación frecuentada por los chigüiros y de la composición florística de los mismos.
Composición de la dieta: Al observar un chigüiro o un grupo de ellos alimentándose, nos deteníamos, identificábamos la planta consumida por cada individuo y, posteriormente, la colectábamos. Para identificar la planta consumida se utilizaron binoculares 10 x 50 que nos permitían tener un alcance de hasta 50 m de distancia. Cada registro de observación estuvo compuesto por el número de la observación, la fecha, la especie consumida, el número de colección del espécimen botánico y el hábitat. El tiempo de duración de cada observación estuvo determinado por la reacción de los chigüiros ante nuestra presencia y por la visibilidad del lugar donde se encontraban, con un promedio de aproximadamante cinco minutos.
El material botánico colectado se procesó, determinó y depositó en el Herbario Nacional Colombiano (COL), del Instituto de Ciencias Naturales, Universidad Nacional de Colombia, bajo la numeración de J. Forero y J. Betancur. Duplicados de estos especimenes se distribuyeron al Herbario Amazónico Colombiano (COAH) y al del Missouri Botanical Garden (MO). Para todos los casos asignamos las familias de acuerdo al sistema de clasificación propuesto por Cronquist (1981), excepto para las leguminosas (Caesalpinaceae, Fabaceae y Mimosaceae) que las designamos como Leguminosae s.l.
Se calcularon las frecuencias relativas de las familias y las especies que fueron consumidas por los chigüiros, para cada uno de los cuatro muestreos y para el total de la investigación. Para comparar la dieta de los chigüiros en los cuatro muestreos tuvimos en cuenta las frecuencias relativas de consumo de cada especie, con las que se calculó la distancia euclidiana utilizando el programa PCORD para Windows (McCune y Mefford 1997).
Resultados
Tipos de hábitats utilizados por el chigüiro: Se encontraron diferentes tipos de esteros frecuentados por los chigüiros, caracterizados por la dominancia de una sola especie vegetal o por la codominancia de varias. Entre los del primer tipo están los dominados por Canna glauca, Ipomoea batatas, Montrichardia arborescens, Paspalum fasciculatum, Thalia geniculata o Typha angustifolia. Entre los codominados por varías especies están: 1) los de Acrostichum aureum y Andropogon bicornis; 2) los de leguminosas, con la presencia de Aeschynomene hispidula, Chamaechrista nictitans, Mimosa pellita, M. pudica, Senna aculeata, S. reticulata y Sesbania exasperata; 3) los de gramíneas y ciperáceas, con la presencia de Andropogon bicornis, Eleocharis intersticta, Hymenachne amplexicaulis, Panicum maximun, Paspalum fasciculatum, Rhynchospora corymbosa, Torulinium odoratum, Urochloa arrecta y U. decumbens.
Las orillas de los cuerpos de agua están ocupadas por vegetación semi acuática, donde predominan plantas como las mencionadas para los esteros y otras como Caperonia palustris, Cyperus digitatus, C. luzulae, Echinodorus paniculatus, Limnocharis flava, Neptunia natans y Polygonum acuminatum, entre otras. Sobre el espejo de agua crecen macrófitas flotantes, especialmente Eichhornia azurea, E. crassipes, Hetheranthera limosa, Hydrocleys nymphoides, Lemna minor, Marsilea polycarpa, Pistia stratiotes y Salvinia minima.
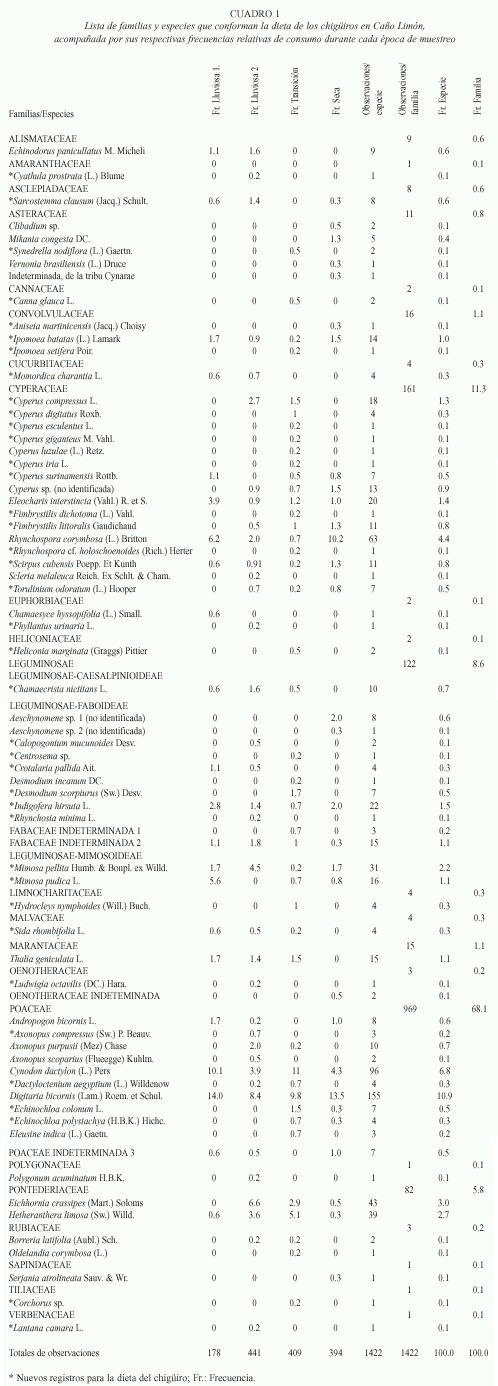
Dieta: Se realizaron 1 422 observaciones en total, 178 en el primer muestreo, 441 en el segundo, 409 en el tercero y 394 en el cuarto. Los chigüiros se alimentaron exclusivamente de plantas y su dieta estuvo compuesta por 89 especies de angiospermas, correspondientes a 22 familias, 55 de las cuales (63%) son nuevos registros para la dieta del chigüiro. La mayoría de estos nuevos registros corresponden a especies con una proporción de consumo muy baja (Cuadro 1).
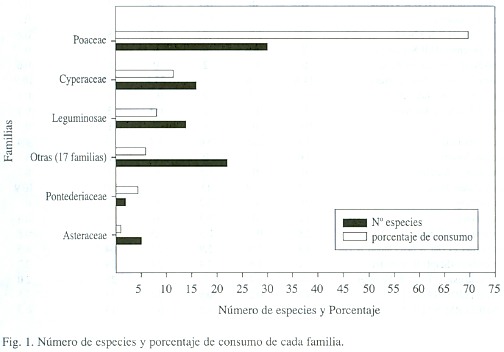
Las familias con mayor número de especies consumidas fueron Poaceae (30), Cyperaceae (16), Leguminosae (14) y Asteraceae (5), mientras que las restantes estuvieron representadas por solo una a tres especies (Cuadro 1, Fig. 1). Solo cuatro familias representaron el 94% del total de la dieta, así: Poaceae (68.1%), Cyperaceae (11.3%), Leguminosae (8.6%) y Pontederiaceae (5.8%). Cada una de las restantes 18 familias representaron menos del 1.1% del total (Cuadro 1, Fig. 1).
Sólo siete especies representaron casi el 60% de la dieta del chigüiro. Las especies más consumidas fueron los pastos Hymenachne amplexicaulis (16.9%), Digitaria bicornis (10.9%), Paspalum fasciculatum (10.9%), Cynodon dactylon (6.8%), Urochloa arrecta (4.5%) y Panicum maximum (4.4%), y la ciperácea Rhynchospora corymbosa (4.4%). Las especies restantes fueron consumidas con una frecuencia muy baja, representando cada una menos del 3% del total de la dieta (Cuadro 1).
Variación estacional: El número total de especies consumidas por los chigüiros fue diferente en los cuatro muestreos (entre 34 y 54 por muestreo). Aproximadamente el 50% de las especies fueron consumidas solamente durante uno de los cuatro muestreos (tres fueron exclusivas del primer muestreo, 12 del segundo, 22 del tercero y nueve del cuarto). Sin embargo, la mayoría de estas especies exclusivas tuvieron una frecuencia muy baja de consumo (entre una y diez observaciones). Por otra parte, solo el 20 % de las especies fueron consumidas en los cuatro muestreos (Cuadro 1).
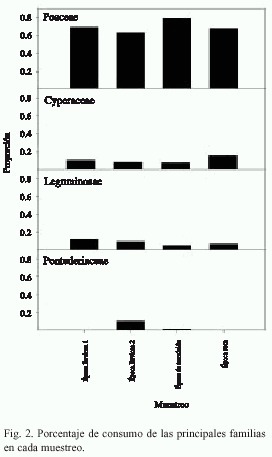
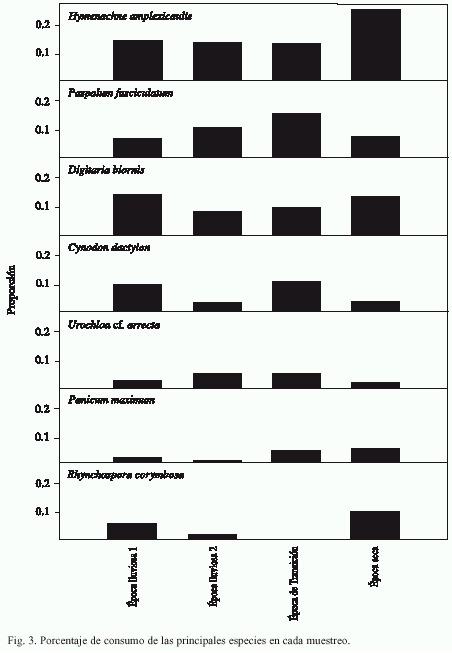
Durante los cuatro muestreos los chigüiros consumieron con alta frecuencia especies de las familias Poaceae, Cyperaceae, Leguminosae y Pontederiaceae, siendo Poaceae la mas consumida (Fig. 2). Por otra parte, las especies mas consumidas durante los cuatro muestreos fueron, en su orden, Hymenachne amplexicaulis, Paspalum fasciculatum, Digitaria bicornis, Cynodon dactylon,y Urocholoa arrecta (Fig. 3, Cuadro 1).
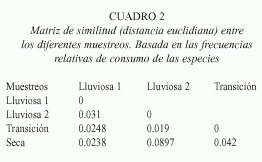
Hubo mayor similitud en la composición de la dieta entre los muestreos realizados durante la segunda época lluviosa y la de transición (0.019); se formó un segundo grupo entre las dietas de la primera época lluviosa y la seca (0.024) (Cuadro 2).
Discusión
El alto número de nuevos registros encontrados para la dieta del chigüiro se puede deber a la metodología empleada, la cual permite detectar especies consumidas en muy baja proporción, a diferencia de estudios basados en análisis bromo- histológicos. Existen diferentes argumentos que tratan de explicar las ventajas de una dieta constituida por muchas especies y que se pueden aplicar al caso de los chigüiros. Primero, una dieta mixta permite obtener una mezcla de nutrientes apropiada y, así, algunos de los nutrientes que son necesarios en pequeñas cantidades se pueden encontrar en plantas que son consumidas esporádicamente. Segundo, algunas especies vegetales pueden contener químicos tóxicos y una dieta mixta brinda concentraciones tolerables de los mismos. Tercero, los animales pueden comer algunas especies simplemente porque las encuentran en sus recorridos y ganan más energía consumiéndolas que ignorándolas. Cuarto, debido a que la disponibilidad y calidad de los forrajes varían estacionalmente y de forma impredecible, una dieta amplia permite adaptarse a estos cambios (Begon et al. 1990).
Sin embargo, los chigüiros tienen una alta eficiencia digestiva por su buena capacidad de masticación y absorción, lo que les permite poder cubrir sus necesidades nutricionales consumiendo pocas especies (Ojasti 1973, Quintana et al. 1998a, 1998b). La alta proporción de consumo de unas pocas especies de gramíneas en Caño Limón también ha sido registrada en estudios realizados en los Llanos venezolanos (Escobar y González-Jiménez 1976, Barreto y Herrera 1998) y en el área no insular del delta bajo del río Paraná en Argentina (Quintana et al. 1998 b). Contrariamente, en el área insular del delta bajo del río Paraná los chigüiros se alimentan principalmente de ciperáceas (Quintana et al. 1994).
En Caño Limón, al igual que en los Llanos venezolanos (Barreto y Herrera 1998) y en el pantanal de Mato Grosso en Brasil (Rodiney y Pott 1996), la especie más consumida por los chigüiros fue Hymenachne amplexicaulis. Esta misma gramínea también ha sido registrada como especie importante en la dieta del roedor en estudios realizados en otros lugares (Ojasti 1973, Milán 1977, Usma 1991, Rodiney y Pott 1996). Además, los chigüiros en cautiverio también muestran preferencia por Hymenachne amplexicaulis (Alho y Cleber 1986). Al parecer el alto consumo de esta gramínea se debe a que tiene poca fibra y altos contenidos calóricos y protéicos, características que la hacen palatable (Barreto y Herrera 1997).
Para los chigüiros de Caño Limón, al igual que para los de las sabanas del Bajo Apure venezolano (Ojasti 1973) y para los de localidades colombianas en el Meta y Arauca (Milán 1977), el pasto Paspalum fasciculatum ("gramalote chigüirero"), es una especie importante en su dieta. Se atribuye la importancia de esta especie más por su abundancia que por su calidad, excepto cuando son consumidos los retoños que salen después de las quemas (Ojasti 1973). Por otra parte, el alto consumo de Cynodon dactylon y Digitaria bicornis puede deberse a que son tiernas y abundantes en las plataformas y carreteras. Cynodon dactylon también es una especie importante en la dieta de los chigüiros en el delta del río Paraná y en la Provincia de Entre Ríos, Argentina (Quintana et al. 1994, 1998a, 1998b). Así mismo, Digitaria es un género que ha sido registrado para la dieta de los chigüiros en Urugüay (Quintana et al. 1994), el Bajo Apure venezolano (Ojasti 1973) y Brasil (Alho y Cleber 1986).
Las ciperáceas, como segunda familia de plantas en importancia para la dieta en Caño Limón (11% del total) ha sido registrada como constituyente del 16% de la dieta en los Llanos venezolanos (Escobar y González-Jiménez 1976).
En Caño Limón los buchones (familia Pontederiaceae) constituyen el 5% de la dieta, resultado similar al registrado para los Llanos venezolanos donde constituyen entre el 2% y el 3% del total de la dieta (Escobar y González- Jiménez 1976). Mientras que en Venezuela son un recurso importante durante la época seca, en Caño Limón fueron consumidos exclusivamente durante las épocas de lluvias y de transición. En Caño Limón, durante la época seca los buchones se marchitaron en los esteros donde se hicieron las observaciones. Las diferencias en la composición de la dieta durante los cuatro muestreos pueden deberse a la existencia de cambios temporales en la cantidad y la calidad de los forrajes. Así mismo, las variaciones en la dieta de los herbívoros están correlacionadas con las variaciones temporales de clima y vegetación y se ha observado que los chigüiros se adaptan a estos cambios modificando su patrón de forrajeo (Quintana et al. 1998a, 1998b).
Durante todo el tiempo de estudio los chigüiros no realizaron coprofagia. Este comportamiento ha sido observado en los Llanos venezolanos, principalmente en las primeras horas del día (Lord 1991) y durante la época seca (Barreto y Herrera 1998). La ausencia de este comportamiento en Caño Limón pudo deberse a que durante el periodo de muestreo el "verano" fue atípico, no se presentó una reducción marcada de los cuerpos de agua y los forrajes fueron abundantes durante todo el año.
Por otra parte, varias veces observamos a los chigüiros comer tierra, comportamiento que no ha sido registrado en la literatura disponible, como tampoco la visita a "salados". Es posible que en la tierra se encuentren minerales que le permiten a los animales complementar su dieta, neutralizar y ayudar en la excreción de las toxinas que contienen algunas de las plantas que consumen, o también modificar el pH intestinal y favorecer el crecimiento de bacterias simbióticas (Mahaney 1993). Además, a los chigüiros en cautiverio se les debe suministrar suplementos polivitamínicos y sales minerales (Alho y Cléber 1986).
Consideración final: Los resultados obtenidos en este estudio contribuyen a conocer de una forma más amplia los hábitos alimentarios de los chigüiros silvestres. Utilizando esta metodología, suministramos nuevos datos sobre su dieta y comportamiento que pueden ser empleados para su manejo en cautiverio y posible explotación comercial. Por otra parte, para comprender mejor los cambios estacionales en la composición de la dieta de los chigüiros sería de gran utilidad complementar este tipo de observaciones con el análisis del contenido químico de las plantas, así como estimar su calidad y disponibilidad estacional.
Agradecimientos
A la Occidental de Colombia, Inc. (OXY) por la financiación y las facilidades proporcionadas para realizar este trabajo. A las universidades de Los Andes y Nacional de Colombia por facilitar el desarrollo del mismo. A Juanita Aldana, Alicia Medina y Juan Carlos Mejía por su ayuda en el trabajo de campo. A Jaime Uribe por su asesoría en el tratamiento de los datos. A los curadores del Herbario Nacional Colombiano (COL) por determinar y/o confirmar parte del material vegetal, así: Cesar Barbosa (Leguminosae), Santiago Díaz (Asteraceae), José C. Murillo (Euphorbiaceae), Polidoro Pinto (Poaceae), José L. Fernández (varios grupos) y Stella Suárez (Marantaceae).
Resumen
Estudiamos la composición y variación estacional de la dieta del chigüiro (Hydrochaeris hydrochaeris) en los esteros de Caño Limón, por medio de observaciones directas del consumo de las plantas. Los chigüiros se alimentaron exclusivamente de plantas y su dieta estuvo compuesta por 89 especies, pertenecientes a 22 familias. El 63 % de las especies son nuevos registros para la dieta del chigüiro. Las cuatro familias mas consumidas fueron Poaceae, Cyperaceae, Leguminosae y Pontederiaceae, las cuales representaron el 94% del total de la dieta. Solo siete especies representaron el 60% del total de la dieta, así: los pastos Hymenachne amplexicaulis (16.9%), Digitaria bicornis (10.9%), Paspalum fasciculatum (10.9%), Cynodon dactylon (6.8%), Urochloa arrecta (4.5%) y Panicum maximum (4.4%) y la ciperácea Rynchospora corymbosa (4.4%). Se presentó variación en la composición de la dieta de los chigüiros durante las épocas de muestreo.
Referencias
Alho, R & J. Cleber. 1986. Criaçao e manejo de capivaras em pequenas propiedades rurais. EMBRAPA. Brasilia, D.F., Brasil. [ Links ]
Barreto, G. & A. Herrera. 1998. Foraring patterns of capybara in seasonally flooded lands of Venezuela. J. Tr. Ecol. 14: 87-98. [ Links ]
Begon, M., J.L. Harper & C.R. Townsend. 1990. Ecology, Individuals, populations and communities. Blackwell Sc., Boston, E.E.U.U. 947 p. [ Links ]
Betancur, J. 1997. Flora del Llano, Naturaleza de la Orinoquia. Cristina Uribe Ed., Santafé de Bogotá, Colombia. 112 p. [ Links ]
Cronquist, A. 1981. An integrated system of classification of flowering plants. Columbia University, Nueva York, U.S.A. 1262 p. [ Links ]
Emmons, H.L. 1997. Neotropical Rainforest Mammals. A Field Guide. University of Chicago, Chicago, U.S.A. 307 p. [ Links ]
Escobar, A. & E. Gónzalez-Jiménez. 1976. Estudio de la competencia alimenticia de los herbívoros mayores del Llano inundable con referencia especial al chigüiro (Hydrochaerys hydrochaeris). Agron. Trop. 26: 215-227. [ Links ]
Jogerson, J. 1986. Notes on the ecology and behavior of capybaras in northeastern Colombia. Vida Silvestre Neotropical 1: 31-40. [ Links ]
Lord R. 1991. Twenty-four hour activity and coprophagy by capybaras (Hydrochaeris hydrochaeris). Studies on Neotropical Fauna and Environment 26: 113-120. [ Links ]
Mahaney, W. 1993. Geochemistry and clay mineralogy of solids eaten by japanese macaques. Primates 34: 85-91. [ Links ]
Milan, M. 1977. Hábitos nutricionales del chigüiro. Tesis de Maestría. Universidad Nacional de Colombia, Santafé de Bogotá, Colombia. 76 p. [ Links ]
Ojasti, J. 1973. Estudio biológico del chigüiro o capibara. Fondo Nacional de Investigaciones Agropecuarias, Caracas, Venezuela. 277 p. [ Links ]
Quintana, R., S. Monge & A. Malvárez. 1994. Feeding habits of capybara (Hydrochaeris hydrochaeris) in afforestation areas of the Lower Delta of the Parana River, Argentina. Mammalia 58: 569-580. [ Links ]
Quintana, R., S. Monge & A. Malvárez. 1998a. Composición y diversidad de las dietas del capibara (Hydrochaeris hydrochaeris) y del ganado doméstico en un agroecosistema de la región central de Entre Ríos, Argentina. Ecotropicos 11: 33-44. [ Links ]
Quintana, R., S. Monge & A. Malvárez. 1998b. Feeding patterns of capybara Hydrochaeris hydrochaeris (Rodentia, Hydrochaeridae) and cattle in noninsular area of the Lower delta of the Parana River, Argentina. Mammalia 62: 37-52. [ Links ]
Rodiney, M. & A. Pott. 1996. Dieta de capibara (Hydrochaeris hydrochaeris) basada en análisis microhistológico de las heces. Vida Silvestre Neotropical 5: 151-153. [ Links ]
Usma, J. 1991. Aspectos ecológicos del chigüiro (Hydrochaeris hydrochaeris) en la Reserva Natural de la Laguna de Sonso. Tesis de Pregrado en Biología. Universidad del Valle, Cali, Colombia. 65 p. [ Links ]
1 Departamento de Biología, Facultad de Ciencias Biológicas, Universidad de Los Andes, Bogotá, Colombia. jimefore@yahoo.com
2 Instituto de Ciencias Naturales, Universidad Nacional de Colombia, apartado 7495, Bogotá, Colombia. Fax (571) 3165365. jbetanc@ciencias.ciencias.unal.edu.co
3 Departamento de Biología, Facultad de Ciencias Biológicas, Universidad de Los Andes, Bogotá, Colombia. Dirección actual: WWF, 2828 Connecticut Avenue, NW, # 608, Washington D.C. 20008, USA. Fax 009-1-202-2650499. jaime.cavelier@wwfus.org











 uBio
uBio