Revista de Biología Tropical
versão On-line ISSN 0034-7744versão impressa ISSN 0034-7744
Rev. biol. trop vol.51 no.2 San José Jun. 2003
Irma Reyes Jaramillo 1, Blanca Pérez-García 1 & Aniceto Mendoza Ruiz 1
Recibido 15-V-2001. Corregido 26-VI-2002. Aceptado 25-VII-2002.
Abstract
The development and morphology of the gametophytes of seven species of ferns from genus Pleopeltis are described and compared. The spore germination is Vittaria-type in P. astrolepis, P. crassinervata, P. macrocarpa, P. polylepis and P. revoluta. For P. angusta and P. mexicana it was proposed a new germination pattern is Pleopeltis-type. The prothallial development is Drynaria-type in P. astrolepis, P. crassinervata, P. macrocarpa, P. polylepis and P. revoluta and Ceratopteris-type for P. angusta and P. mexicana. The gametangia are typical of the leptosporangiate ferns, sporophytes after six and a half months in culture did not appeared.
Key words: epiphytic, gametophyte, fern, morphogenesis, Pleopeltis, Polypodiaceae.
Polypodiaceae es una familia grande y diversa que no puede ser definida por una sola característica. Sin embargo, varios rasgos están muy relacionados; por ejemplo, numerosas especies de la familia tienden a presentar rizomas rastreros escamosos, dorsiventrales, con hojas dispuestas en dos series en la superficie dorsal. Las hojas están articuladas a filopodios cortos y caen en la madurez sin dejar rastro (la zona de articulación se evidencia por un cambio brusco de color entre el pecíolo y los filopodios). Los soros son a menudo amplios y redondeados con esporas amarillas (Tryon y Tryon 1982, Moran 1995).
Mickel y Beitel (1988) y Mickel (1992) incluyen dentro de las Polypodiaceae a dos subfamilias, las Polypodioideae con los géneros Campyloneurum, Niphidium, Pecluma, Phlebodium y Polypodium y las Pleopeltoideae con los táxones Pleopeltis, Pleopodium y Microgramma. Smith (1981) considera todos estos a nivel genérico, mientras que Stolze (1981) estima a Polypodium con seis subgéneros anteriormente citados.
En este trabajo abordaremos al género Pleopeltis, que comprende helechos epífitos, con hojas simples o pinnatífidas. Es esencialmente un género americano, la mayoría de las especies se encuentran en México, por lo que podría pensarse que ha sido un centro de diversificación importante.
En los antecedentes sobre morfogénesis de la fase sexual de este grupo de helechos destacan unos cuantos géneros: Lepisorus (J. Smith) Ching, Phlebodium (R. Brown) J. Smith, Pleopeltis Humb. et Bonpl. ex Willd., Weatherbya Copel., Belvisia Mirbel y Drynariopsis (Copel.) C. Chr. (Heilbronn 1932, Nayar 1961, 1962, 1964, Nayar y Raza 1970, Nayar y Kaur 1971, Chandra 1979, Bhatta-charyya y Sen 1992) del viejo mundo. La morfología de los gametofitos segregados dentro del grupo Polypodium - Pleopeltis de la India fue estudiada por Nayar (1962). Nayar y Kaur (1971) describieron la morfología de los gametofitos de especies indias afines como Belvisia spicata Mirbell, Lepisorus excavatus (Bory) Ching, L. normalis (J. Sm.) Ching y Phlebodium aureum J. Sm. Para el Nuevo Mundo se conoce el desarrollo del gametofito para tres especies de Phlebodium, Microgramma nitida y Niphidium crassifolium (L.) Lellinger y Polypodiaceae respectivamente (Atkinson y Stokey 1964, Reyes et al. 1996, Liang-Chiou y Farrar 1997a, 1997b, Pérez-García et al. 1998, Ramírez y Pérez-García 1998).
En el presente trabajo se describe la morfogénesis de la fase gametofítica de siete especies de Pleopeltis que habitan en México.
Materiales y métodos
Para este estudio se recolectaron plantas fértiles de las especies: P. angusta, P. astrolepis, P. crassinervata, P. macrocarpa, P. mexicana y P. polylepis, en diversas localidades y tipos de vegetación citadas en el Cuadro 1, los ejemplares de respaldo se depositaron en el Herbario Metropolitano, UAMIZ. Las esporas se obtuvieron de segmentos fértiles con esporangios maduros y cerrados que fueron guardados en sobres de papel, dejándolas secar a temperatura ambiente para propiciar su apertura por desecación en forma natural; el material así obtenido se tamizó a través de una malla con poros de 0.74 mm de diámetro para eliminar fragmentos de esporangios y restos de hojas.
Se sembraron las esporas de cada especie con una densidad de 150-200 por cm2 en medio de Thompson con agar (Klekowski 1969, Pérez-García 1989) en 15 cajas de Petri por cada especie (tres repeticiones), una de las cuales se cubrió con papel estaño para probar fotoblastismo. Los cultivos se mantuvieron en un régimen lumínico de 12 hr luz/12 hr obscuridad, a una temperatura de 20-25ºC. Las cajas se mantuvieron dentro de bolsas de polietileno transparente durante todo el proceso, abriéndose solamente cada 8-10 días durante las revisiones periódicas para definir la germinación. En cada revisión se humedeció el medio con unas cuantas gotas de agua destilada previamente esterilizada, con objeto de evitar la desecación y propiciar el desplazamiento de los anterozoides, cuando los gametofitos alcanzaron la madurez sexual; las cajas mantenidas en la obscuridad se abrieron hasta los 100 días después de la siembra.
Los dibujos se hicieron con una cámara clara AO y las fotomicrografías se tomaron con un fotomicroscopio Zeiss y película Plus-X de 35 mm.

Resultados
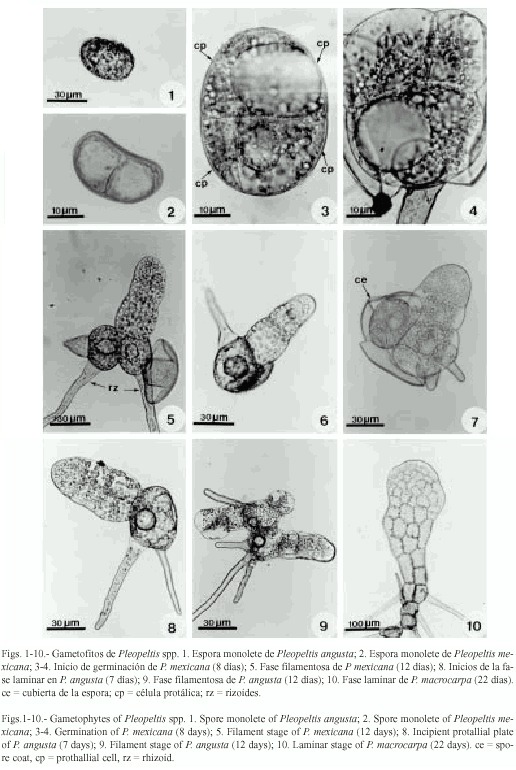
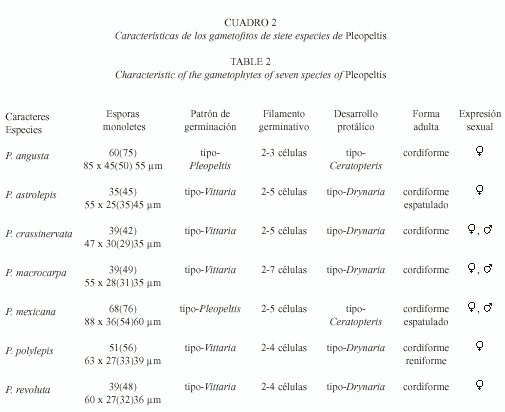
Esporas: las esporas de las siete especies son monoletes, elipsoidales, de color amarillo, de contornos superficiales lisos a ligeramente tuberculados (Tryon y Lugardon 1991). Las esporas de menor tamaño fueron las de Pleopeltis astrolepis (35(45)55 µm x 25(35)45 µm y las más grandes las de P. mexicana con 68(76)88 µm x 36(54)60 µm (Figs. 1 y 2, Cuadro 2).
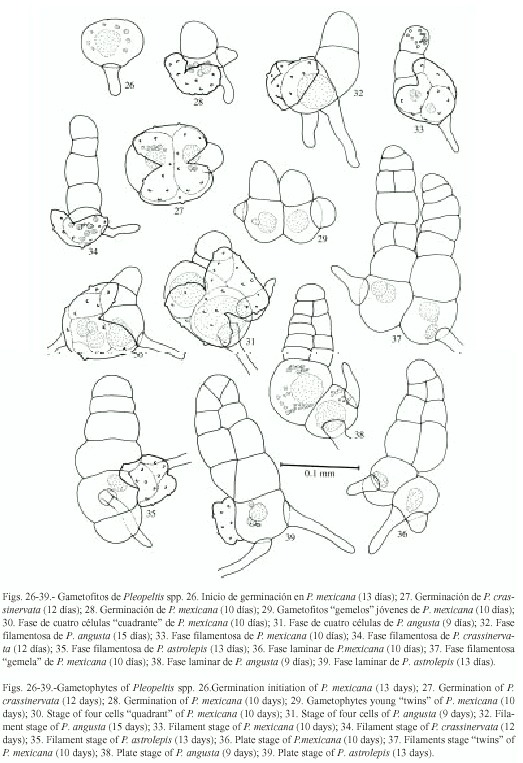
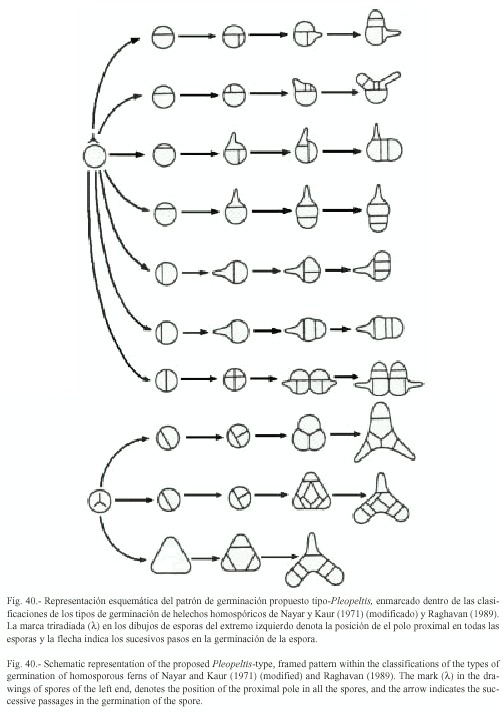
Germinación: se inicia entre los 7-12 días después de sembradas las esporas (Figs.2, 3, 26). El filamento germinativo en las siete especies es corto, formado de 2-7 células de largo, siendo los más precoces P. mexicana y P. revoluta (7-10 días) y los más tardíos en P.macrocarpa (13-24 días), presentan grandes glóbulos de grasa de color amarillo brillante en las dos células protálicas iniciales, los rizoides son cortos, de color hialino a pardo claro (Figs. 5-7, 28, 31-35). La germinación corresponde al tipo Vittaria, con excepción de P. angusta y P. mexicana para las cuales proponemos el patrón de germinación tipo Pleopeltis.
Descripción del tipo-Pleopeltis: en este patrón de germinación, la primera división es paralela al eje polar de la espora, resultando en la formación de dos células protálicas de igual tamaño (Fig. 2), posteriormente la segunda división es perpendicular a la primera dando lugar a cuatro células protálicas dos pequeñas y dos más grandes (Fig. 3). Los rizoides se forman a partir de la tercera división que es paralela a la primera (Figs. 4, 29, 30). Los filamentos uniseriados resultan de divisiones consecutivas paralelas al eje ecuatorial (Figs. 40, 5, 37).
El desarrollo de la lámina en P. angusta y P. mexicana puede darse de la siguiente manera:
i) en algunos gametofitos como resultado de las divisiones paralelas a la segunda división de las células protálicas, se forman dos filamentos germinativos unidos en la base, dando la apariencia de gametofitos "gemelos". Finalmente sólo un gametofito prospera formando su lámina protálica normalmente (Figs. 9, 29, 30).
ii) se forman dos filamentos germinativos, con la diferencia de que uno de ellos cesa su crecimiento en la fase filamentosa y el segundo sigue su desarrollo normal hasta formar la lámina protálica (Fig. 37).
iii) en este caso sólo una de las células protálicas iniciales desarrolla el filamento y la otra permanece sin actividad mitótica (Figs. 5, 30, 36).
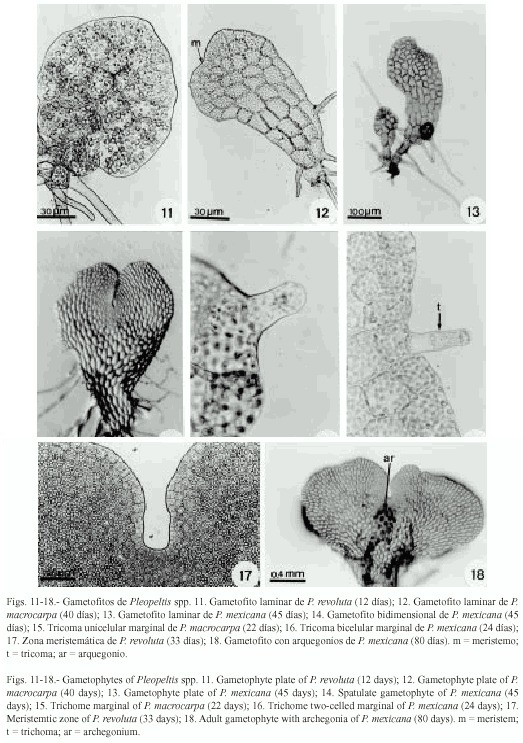
Fase laminar: la diferenciación de esta fase se inicia de los 12 a 45 días alcanzando su forma laminar espatulada-cordiforme alrededor de los 60 días (Figs. 8, 10-12, 14, 38, 39). Cinco de las siete especies presentan un desarrollo protálico tipo Drynaria con excepción de P. angusta y P. mexicana que desarrollan alas anisodiamétricas semejante al desarrollo tipo Ceratopteris (Fig. 13).
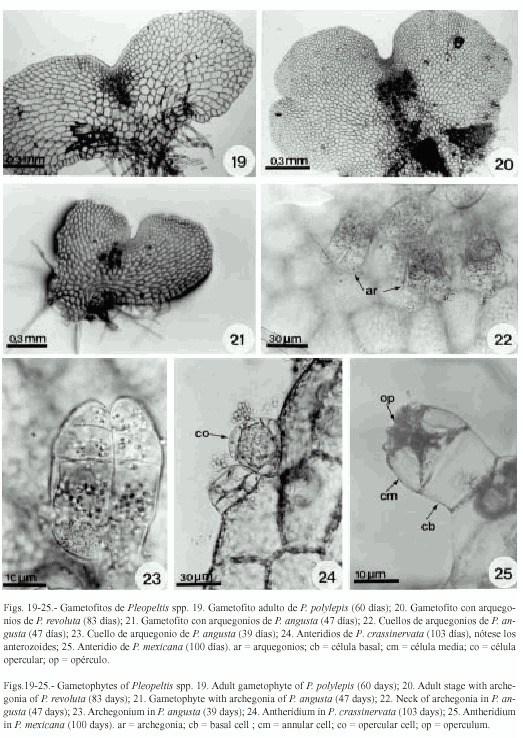
Fase adulta: los gametofitos son cordiforme-espatulados a cordiforme-reniformes con amplias alas isodiamétricas, la zona meristemática está bien definida (Figs. 17-20 y 21). En las siete especies se inicia la formación de los gametangios alrededor de los 40 días.
Los arquegonios se formaron en todas las especies en un período de 40 a 130 días, son del tipo común de los helechos leptosporangiados, localizados en la región del cojinete con los cuellos dirigidos hacia la base del gametofito (Figs. 18, 20-23).
Los anteridios se formaron solamente en los cultivos de P. crassinervata, P. mexicana y P.macrocarpa y están formados por una célula basal, una media y una tercera opercular (Figs.24, 25), éstos se desarrollaron alrededor de los 50-130 días, se forman posteriormente a los arquegonios. Los gametofitos son unisexuados (Cuadro 2).
Los tricomas se forman en fases adultas, son unicelulares y bicelulares, de posición marginal y escasos (Figs. 15 y 16).
Esporofitos: no se formaron esporofitos en las especies estudiadas al término de 200 días de cultivo in vitro.
Discusión
La morfogénesis de la fase sexual de las siete especies descritas de Pleopeltis tienen mucha similitud entre ellas, se caracterizan por presentar un ciclo de vida relativamente corto, ya que sus protalos pueden alcanzar la madurez poco después de los 40 días.
Después de iniciado el proceso de germinación de la espora es notoria la presencia de grandes glóbulos de grasa de color amarillo, que normalmente se localizan en las dos primeras células protálicas y que seguramente participan en el metabolismo del crecimiento y división celular, que una vez iniciado no se detiene hasta formar la lámina protálica. La concentración de estos aceites en las células protálicas iniciales es frecuente encontrarla en diferentes especies de Polypodiaceae, entre ellas P. percusa (Bhattacharyya y Sen 1992), Polypodium lepidotrichum (Reyes y Pérez-García 1994), Niphidium crassifolium (Reyes et al. 1996) y en Phlebodium araneosum, P. pseudoaureum y P. decumanum (Pérez-García et al. 1998).
En relación con el patrón de germinación en P. astrolepis, P. crassinervata, P. macrocarpa, P.polylepis y P. revoluta se clasificó del tipo-Vittaria, el cual de acuerdo con Nayar y Kaur (1971) y Raghavan (1989) es un tipo de germinación polar, donde la primer división de la espora es por una pared paralela al plano ecuatorial de ésta y el crecimiento del rizoide primario y de la célula protálica inicial son paralelos al eje polar de la espora. Las células que resultan de la primer división son desiguales, de la más pequeña que está en posición polar, se forma el rizoide primario y por una segunda división perpendicular al eje polar se originan dos células protálicas, las cuales por divisiones paralelas sucesivas forman el filamento germinativo.
En P. angusta y P. mexicana el patrón de germinación es diferente a los descritos por Nayar y Kaur (1971) y por Raghavan (1989) para los helechos homospóricos, en este caso es evidente la formación de una pared celular paralela al eje polar que divide a la espora en dos células protálicas iguales, la segunda división es perpendicular a la primera, dando como resultado dos células protálicas chicas y dos más grandes, los rizoides se forman después de la tercer división que es paralela a la primera.
En P. angusta y en P. mexicana los gametofitos jóvenes dan la impresión de ser "gemelos" unidos por la base, en algunos de ellos, desde las primeras células del filamento germinativo hay inhibición del crecimiento de alguno de los dos gametofitos, el cual deja de crecer; en otros puede seguir creciendo y formar la lámina solamente que de menor tamaño con relación a su "gemelo".
La frecuencia de este tipo de germinación en las poblaciones de gametofitos de P. angusta y P. mexicana nos llevó a proponer un nuevo patrón de germinación, que designamos como tipo-Pleopeltis. Lo anterior se relaciona de igual forma con el desarrollo protálico de estas dos especies, que son también la excepción, con un patrón de germinación tipo-Ceratopteris y no Drynaria como lo presentan las cinco especies restantes del estudio.
Con respecto a los gametangios a pesar de que P. crassinervata, P. macrocarpa y P. mexicana formaron anteridios y arquegonios, no hubo la formación de esporofitos, lo cual hace pensar en lo que escribió Bhattacharyya y Sen (1992) al referirse también a Pleopeltis, donde tampoco observaron esporofitos y señalan que puede deberse a la formación de gametangios abortivos, no funcionales. Por otra parte Hooper y Haufler (1997) también hacen referencia a la dificultad de formar esporofitos en condiciones de laboratorio y de campo, en las especies de Pleopeltis que forman principalmente gametofitos unisexuales.
En los helechos homospóricos epífitos como las especies de Pleopeltis, su tasa de reproducción sexual debe ser muy baja, por lo observado in vitro; siendo para estas especies la propagación vegetativa la más exitosa.
Agradecimientos
A Jorge Lodigiani por su apoyo fotográfico.
Resumen
Se describe y compara la morfología y el desarrollo de la fase sexual de siete especies mexicanas del género Pleopeltis. P. astrolepis, P. crassinervata, P. macrocarpa, P. polylepis y P. revoluta todas ellas presentan germinación de tipo-Vittaria. Para P. angusta y P. mexicana se propone un nuevo patrón de germinación tipo-Pleopeltis. El desarrollo protálico de P. astrolepis, P. crassinervata, P. macrocarpa, P. polylepis y P. r evoluta es tipo-Drynaria. P. angusta y P. mexicana son tipo-Ceratopteris. Los gametangios son del tipo común de los helechos leptosporangiados; después de seis y medio meses de cultivo no se formaron esporofitos.
Referencias
Atkinson, L.R. & A.G. Stokey. 1964. Comparative morphology of the gametophyte of homosporous ferns. Phytomorphology 14: 51-70. [ Links ]
Bhattacharyya, A.K. & T. Sen. 1992. Structure and ontogenia of gametophytes of Lepisorus (J. Sm.) Ching and Pleopeltis Willdenow. Indian Fern J. 9: 66-75. [ Links ]
Chandra, P. 1979. Gametophytes morphology of the fern genus Drynariopsis (Polypodiaceae). Amer. Fern J. 69: 111-118. [ Links ]
Hooper, A.E. & C.H. Haufler. 1997. Genetic diversity and breeding system in a group of neotropical epiphytic ferns (Pleopeltis; Polypodiaceae). Amer. J. Bot. 84:1664-1674. [ Links ]
Liang-Chiou, W. & D.R. Farrar. 1997a. Comparative gametophyte morphology of selected species of the family Polypodiaceae. Amer. Fern J. 87: 77-86. [ Links ]
Liang-Chiou, W. & D.R. Farrar. 1997b. Antheridiogen production and response in Polypodiaceae species. Amer. J. Bot. 84: 633-640. [ Links ]
Heilbronn, A. 1932. Diploid prothallia from spores of te-traploid Polypodium aureum. Ber. Deut. Bot. Ges. 50: 289-299. [ Links ]
Klekowski, E.J. Jr. 1969. Reproductive biology of the Pteridophyta. III. A study of the Blechnaceae. J. Linn. Soc. 62: 347-359. [ Links ]
Mickel, J.T. 1992. Pteridophytes, pp. 120-431. In R. Mc-Vaugh. (ed.). Flora Novo-Galiciana. A descriptive account of the vascular plants of Western Mexico vol.17. The University of Michigan Herbarium.USA. [ Links ]
Mickel, J.T. & J.M. Beitel. 1988. Pteridophyte: Flora of Oaxaca, México. Mem. New York Bot. Gard. 46: 284-289. [ Links ]
Moran, R.C. 1995. Polypodiaceae, pp. 333-366. In R.C. Moran & R. Riba (eds.). Flora Mesoamericana, Psi-lotaceae a Salviniaceae, vol. 1. Universidad Nacional Autónoma de México, Intituto de Biología, Cd. Uni-versitaria, México. [ Links ]
Nayar, B.K. 1961. Studies in Polypodiaceae - VIII: Morphology of Lepisorus excavatus (Bory) Ching. Sci. & Cul. 27: 345-347. [ Links ]
Nayar, B.K. 1962. Morphology of spores and prothalli of some species of Polypodiaceae. Bot. Gaz. 123: 223-232. [ Links ]
Nayar, B.K. 1964. Ferns of India. XVI: Lemmaphyllum. Bull. Natl. Bot. Gards. 106: 1-15. [ Links ]
Nayar, B.K. & S. Kaur. 1971. Gametophytes of Homosporous ferns. Bot. Rev. 37: 295-396. [ Links ]
Nayar, B.K. & F. Raza. 1970. Morphology of the prothalli of some species of the Polypodiaceae II: Lepisorus lo-riformis, L. thunbergianus, Polypodium vulgare and Weatherbya accedens. J. Indian Bot. Soc. 49: 81-86. [ Links ]
Pérez-García, B. 1989. Morfogénesis de gametofitos de Cyatheaceae (Pterophyta: Filicales). Tesis de Doctorado, Facultad de Ciencias, Universidad Nacional Autónoma de México, México. 224 p. [ Links ]
Pérez-García, B., R. Riba, A. Mendoza & I. Reyes. 1998. Compared gametophytic development of three species of Phlebodium (Polypodiaceae, s.str.). Rev. Biol. Trop. 46: 1059-1067. [ Links ]
Raghavan, V. 1989. Developmental Biology of fern gametophytes. Cambridge University, Nueva York. 361p. [ Links ]
Ramírez, M. del R. & B. Pérez-García. 1998. Fase gametofítica del helecho Microgramma nitida (Polypodiaceae). Rev. Biol. Trop. 46: 587-593. [ Links ]
Reyes J.I. & B. Pérez-García. 1994. Morfología y estrategias reproductivas del gametofito de Polypodium lepidotrichum (Fée) Maxon (Polypodiaceae). Acta Bot. Mex. 28: 71-78. [ Links ]
Reyes J.I., B. Pérez-García & A. Mendoza. 1996. Desarrollo del gametofito y del esporofito joven de Niphidium crassifolium (Filicales: Polypodiaceae s.str.). Rev. Biol. Trop. 44: 485-490. [ Links ]
Smith, A.R. 1981. Flora of Chiapas, part 2, Pteridophytes. The California Academy of Sciences, San Francisco, California. pp. 173-176. [ Links ]
Stolze, R.G. 1981. Ferns and fern allies of Guatemala, part II Polypodiaceae. Fieldiana Botany, New Series 6: 377-387. [ Links ]
Tryon, A.F. & B. Lugardon. 1991. Spores of the pteridophyta: surfaces, wall structures and diversity based on electron microscope studies. Springer, Nueva York. 648 p. [ Links ]
Tryon, R.M. & A.F. Tryon. 1982. Ferns and allies plants with special reference to tropical America. Springer, Nueva York. pp. 702-708. [ Links ]
1 Departamento de Biología, Área de Botánica Estructural y Sistemática. Universidad Autónoma Metropolitana, Iztapalapa.
Apartado Postal 55-535, 09340 México, D. F. Fax: (92) 58-04-46-88; irj@xanum.uam.mx












 uBio
uBio