Services on Demand
Journal
Article
Indicators
-
 Cited by SciELO
Cited by SciELO -
 Access statistics
Access statistics
Related links
-
 Similars in
SciELO
Similars in
SciELO  uBio
uBio
Share
Revista de Biología Tropical
On-line version ISSN 0034-7744Print version ISSN 0034-7744
Rev. biol. trop vol.50 n.3-4 San José Dec. 2002
Abstract
Previous studies indicated the presence of high concentrations of nickel in the "El truchón" ponds (in México), so it was necessary to find a possible correlation between sediment physicochemical properties of this water body and the damage that could be produced on the rainbow trout which culture is done in a rustic reservoir. The study was initiated with the determination of the physicochemical properties of the trout farm sediments, which are; granular composition, total nitrogen percentage, organic matter content, pH, redox potential, cationic interchange capacity, and Ni concentration. LC50 of Ni at 96 h was determined on Onchorynchus mykiss in the sytem water-sediment from the trout farm at equilibrium time. In the same system the sublethal toxicity of Ni was evaluated by the determination of metallotioneine (MT) levels, o-demethylase activity (OD) and protein concentration. The results showed a significant increment in the three-biochemical parameters. A linear relation was observed between Ni concentration and MT, OD and protein concentration, so these damage biomarkers are recommended in order to evaluate Ni toxicity. Probably these effects were due to the physicochemical characteristics of the sediments, which may give a high capacity to store metal in it. According to the obtained results it was suggested not to use rustic ponds in the fish culture, and use concrete ponds to avoid the accumulation of toxic compounds or make periodic sediments remotion.
Key words
Nickel, Oncorhynchus mykiss, metalothionein, o-demetilasa, sediments.
El cultivo de truchas es una actividad que se ha desarrollado y expandido en las aguas frías de todo el mundo como consecuencia de su introducción en Europa, Oriente y países latinoamericanos. La selección de este pez para su cultivo está en función de su alto nivel nutricional, biotecnología de cultivo, fácil manejo del recurso, gran adaptabilidad a diversas condiciones ambientales, tolerancia al alimento artificial, crecimiento eficiente bajo condiciones controladas, aceptación comercial por su sabor y textura, así como por la viabilidad de obtener alta producción a bajos costos (Huet 1983 ).
En México, para el cultivo de la trucha arcoiris se utilizan dos tipos de estanques: rústicos y de concreto (de corriente rápida). Los primeros tienen la ventaja de disminuir los costos de construcción, pero no pueden limpiarse frecuentemente para minimizar enfermedades y eliminar la excreta de los peces; además, pueden ser grandes reservorios de diversos contaminantes como plaguicidas, detergentes y metales pesados entre otros, pues son hoyos en el suelo en los cuales se coloca el agua y los organismos, y el sedimento puede absorber dichos xenobióticos. Estos depósitos son muy comunes en las granjas trutícolas de México, ya que los campesinos aseguran que se producen truchas de sabor más agradable, aunque reportan diversos problemas relacionados con el cultivo de los peces sobretodo en cuanto a la viabilidad del huevo y el tiempo de engorda.
La adsorción y deserción de contaminantes no es exclusivo de los sedimentos presentes en el fondo de un reservorio acuático, ya que este tipo de sustrato puede ser removido por el movimiento del agua y organismos, causando que los xenobióticos estén suspendidos en la columna de agua. Este proceso permitirá que fitoplancton, zooplancton y peces estén en contacto con los contaminantes y por lo tanto dañar el ecosistema (Margalef 1983 ).
En un estudio llevado a cabo por Martínez-Tabche et al. (1999) en tres diferentes granjas trutícolas del Estado de México, encontraron Ni en los sedimentos y el agua de los estanques rústicos. Los niveles de Ni en estos reservorios están dentro de los límites permisibles tanto para agua (10 g/l) (Scott-Fordsmand 1997 ) como para sedimentos (18 mg/l) (Smith et al. 1997 ), sin embargo, éstos producen toxicidad sobre el oligoqueto Limnodrilus hoffmeisteri, ya que la concentración de su hemoglobina disminuyó hasta un 38.18%, después de 72 horas de exposición a estos sustratos (Martínez-Tabche et al. 1999 ).
En ríos, el Ni es principalmente transportado como un precipitado asociado con partículas de materia orgánica; en lagos en cambio, se combina también a éstas pero en forma iónica. Este metal puede ser absorbido por partículas de arcilla de los sedimentos y ser ingerido por la biota ( Anónimo 1991 ).
Diversos estudios demuestran que el Ni en plantas acuáticas presenta factores de bioconcentración muy altos. En peces, la concentración de este metal alcanza valores de 0.02 a 2 mg/kg, incrementándose hasta diez veces en lugares muy contaminados (Anónimo 1991 ). La tolerancia que presentan los diferentes organismos a altas concentraciones de metales, probablemente se deba a la inducción de metalotioneina (MT), la cual es un buen indicador de la biodisponibilidad de estos xenobióticos y por tanto de su toxicidad (Yau y Menear 1977 ).
El objetivo de este trabajo fue evaluar la toxicidad del Ni en sedimentos de la granja trutícola "El Truchón", sobre la trucha arcoiris (Oncorhynchus mykiss).
Materiales y métodos
Trabajo de campo: Este estudio se llevó a cabo en la granja trutícola "El Truchón", que se construyó a 33 km del Este de Toluca, Estado de México. Las coordenadas geográficas son 19º17'58" N y 99º21'10" W. Alrededor de esta granja se cosechan principalmente maíz, papas y forraje. Además, existen restaurantes y se realiza pesca recreativa. El clima es frío húmedo, en verano llueve intensamente (julio, agosto y septiembre). Los meses más cálidos son mayo y junio, la temperatura promedio anual es 7.5 ºC. Esta granja recibe agua de los manantiales Pajaritos y Agua Azul aproximadamente 50 I/s y se construyó sobre un terreno ligeramente inclinando para que el agua circule desde un depósito a otro por gravedad.
El muestreo se efectuó entre enero y marzo de 1999 empleando una draga cónica. Los sedimentos se tomaron de los estanques rústicos cuya densidad de trucha juvenil es alta (500 peces de 3.6-4.6 g de peso). La profundidad promedio del reservorio fue 1.0 m con un área de superficie de 23.8 cm2 . Las muestras se colocaron en frascos de polietileno sobre hielo y transportadas al laboratorio para su análisis fisicoquímico y toxicológico.
Propiedades fisicoquímicas del sedimento: Los sedimentos de la granja se secaron a 21 ºC y se tamizaron a través de una malla de acero inoxidable de tamaño 0.84 mm. A estas muestras se les determinó: humedad, pH (potenciómetro), textura, tamaño de partícula predominante, contenido de materia orgánica, carbono orgánico, nitrógeno total, capacidad de intercambio canónico, y potencial de oxido-reducción ( Bohn et al. 1993 ).
Tiempo al equilibrio del Ni en los sedimentos: Se formaron diez lotes de 5 g de sedimento de la granja (seco y tamizado), los cuales se reconstituyeron con 1000 ml de agua y se mezclaron con las soluciones de prueba de Ni. La concentración nominal de las soluciones fue: 18 (límite permisible en sedimentos, Smith et al. 1997), 23, 29, 36, 45, 50, 62.8, 79.06, 99.54 y 125 mg/kg (concentraciones que se emplearán en la toxicidad aguda). Los sedimentos sembrados se agitaron mecánicamente. Después de 30, 45, 60, 120, 180, 240 y 300 min, todas las muestras se centrifugaron a 3 500 rpm durante 15 min, la concentración de Ni fue determinada en el agua y en estos sustratos por absorción atómica. El Ni rápidamente alcanzó el equilibrio (4 hr).
Mantenimiento de los organismos de prueba: La trucha arcoiris (O. mykiss) aproximadamente de 3.6-4.6 g de peso se obtuvo de la piscifactoría "El Zarco" ubicada a 33 km deToluca. En el laboratorio, los peces se mantuvieron en un acuario con agua reconstituida (dureza como CaCO3= 150 mg/l; alcalinidad como CaCO3 = 13 mg/l; oxígeno disuelto = 12 mg/1 y pH = 8.2) a 9 ± 1ºC, aireación constante, ciclos de luz-oscuridad de 16-8 hr.
Determinación de la toxicidad aguda en sedimentos: Seis lotes de diez organismos se expusieron al sistema constituido por 15 1 de agua reconstituida y 75 g de sedimentos del estanque rústico sembrado con diferentes concentraciones de Ni al equilibrio (23.13, 29.12, 36.66, 46.15 y 58.10 mg/kg) así como un grupo control, en el cual el sedimento fue sustituido por uno artificial (arena, caolinita y materia orgánica en una proporción de 70:25:5; sin metal). La duración de exposición fue de 96 hr. El comportamiento y la supervivencia se observaron y compararon con los del control. La determinación de la CL50 para el Ni, se efectuó a través del método Probit con un programa de software (DL50C S.B.I.-IRCT, Montepellier 1987). El estudio de toxicidad aguda fue realizado para la posterior selección de la concentración de Ni a utilizar en el estudio de toxicidad subletal.
Toxicidad subletal: Seis lotes de diez organismos cada uno se expusieron al sistema de 15 l de agua reconstituida y 75 g de sedimentos del estanque rústico sembrado con diferentes concentraciones de Ni al equilibrio (14.85, 15.58, 16.04, 16.25, y 16.64 mg/kg) (niveles no letales del metal y están dentro de los límites permisibles), así como un grupo control (sedimento artificial; sin metal). Cabe hacer mención que en ambas pruebas se consideró el contenido de Ni en el sustrato (13.83 mg/kg).
Después de 110 hr, las branquias se extrajeron y homogeneizaron con amortiguador de fosfatos (0.05 M) y NACI (0.375 M). El homogenizado se centrifugó a 14 000 rpm durante 20 min a 14ºC. En el sobrenadante se determinó la concentración de MT, la actividad de la OD y la concentración de proteína.
Determinación de Metaloproteína en branquias: La determinación de MT se realizó por el método de saturación con plata (Ag) ( Sheuhammer y Cherian 1986 ). Preparado del hemolizado de mamífero: 10 mi de sangre de mamífero (mujer de 21 años) se le adicionaron 20 mi de KCI al 1.5%, la mezcla se disolvió en 200 mi de agua desionizada y se le añadió 1.0 mi de heparina. El hemolizado se sometió a centrifugación durante 5 min a 3 000 rpm. El sobrenadante se desechó, y al precipitado se le adicionó 3 2 mi de KCI al 1. 15 %, se agitó y se centrifugó nuevamente a 3 000 rpm durante 5 min. A la pastilla se le adicionó 24 ml de TRIS HCI 30 mM a pH 8 y se centrífugo a 10 000 rpm durante 10 min a 10 ºC.
Determinación del efecto del Ni sobre niveles de MT en branquias de trucha arcoiris: a 400 l del sobrenadante de branquias se le adicionaron 400
l de solución amortiguadora de glicina 0.5 M, pH 8.5 y 250
l de solución estándar de Ag (1000 mg/l), se agitó suavemente y se dejó reposar a temperatura ambiente. Después de 5 min, se le adicionaron 100
l de hemolizado (obtenido como arriba se mencionó). La mezcla se calentó a 75 ºC durante 25 min y se centrifugó a 10 000 rpm por 5 min. Este procedimiento se realizo 3 veces en el sobrenadante, el cual se resuspendió en ácido nítrico al 3 % en una proporción 1: 1 0 v/v y se le determinó la concentración de Ag por espectrofotometría de absorción atómica. El contenido de MT fue obtenido utilizando la ecuación:
Determinación de la actividad de la odesmetilasa (McMahon et al. 1963 ) en branquias: La actividad de esta enzima fue evaluada a través de la biotransformación de para-nitroanizol (PNA) a para-nitrofenol (PNF). A 1.5 ml del sobrenadante de branquias (control e intoxicado con Ni) se le adicionaron 1.2 pmoles de PNA y se incubó a 37 ºC. Después de 60 min, la reacción se detuvo con 1.0 ml de ácido tricloroacético al 30%. Las mezclas fueron centrifugadas a 14 000 rpm durante 10 min a 14 ºC. El sobrenadante se mezcló con 2.0 ml de NAOH 2 N. La absorbancia del PNF fue leída a 400 nm en un espectrofotómetro Varian modelo DMS-90. Posteriormente la absorbancia fue interpolada en la curva tipo de PNF.
Determinación de Proteínas en Branquias (Bradford 1976 ): A 100 l del sobrenadante de branquias se le adicionaron 5 ml de reactivo de Bradford (100 mg de azul de Coomassie, se disolvieron en 50 ml de etanol al 95%, adicionando 100 ml de ácido fosfórico y llevando a un volumen de 1 000 ml con agua desionizada). Después de 5 min se midió la absorbancia a 400 nm en un espectrofotómetro Varian modelo DMS-90. Posteriormente la absorbancia fue interpolada en una curva tipo de albúmina bovina.
Determinación de Ni en sedimento: Para la determinación de Ni en sedimentos se empleó la técnica establecida en APHA, AWWA y WPCF, (1995). Posteriormente 10 g de sedimento se sometieron a digestión ácida con ácido nítrico concentrado (1:10) durante 1 hr en autoclave (15 lbs de presión y 121ºC). La concentración de Ni fue determinada por absorción atómica en un espectrofotómetro Varian Modelo AA- 1475.
Análisis estadístico: Los resultados obtenidos fueron sometidos a un análisis de varianza de una sola vía con el fin de detectar diferencias significativas mediante el paquete de Microsta. Posteriormente se efectuó la prueba de Dunnet (procedimiento de comparación múltiple desarrollado para probar la hipótesis nula de igualdad de los diferentes tratamientos comparados con el testigo). El límite de significancia estadística establecida para esta prueba fue p<0.05 (Glantz 1992 ).
Resultados
Propiedades fisicoquímicas: Los sedimentos de la granja trutícola retienen una gran cantidad de agua, ya que su porcentaje de humedad fue de 40.6%, además son ligeramente ácidos. Los resultados de textura muestran que predominan las partículas arenosas (75.4%), en tanto que los valores de limo y arcilla son bajos. El contenido de materia orgánica fue alto, por lo que se pueden catalogar como extremadamente ricos en materia orgánica, según la clasificación del manual de técnicas agrícolas (Nava y Prado 1996 ). Su contenido de carbón orgánico, nitrógeno total (inorgánico y orgánico), y su capacidad de intercambio canónico también fueron elevados (Cuadro 1 ). El valor de potencial redox fue de 198 mv, característica que determina su capacidad oxidante (Bohn et al. 1993).
Concentración de Ni en sedimentos: La concentración de Ni en sedimentos (Cuadro 1 ) fue mayor que en el agua (85.17%) (Martínez-Tabche et al., en prep .).

Efecto del Ni sobre la producción de MT: Los organismos expuestos únicamente al sedimento de la granja presentaron 6.31 g/g de branquia (tejido húmedo) de MT, a diferencia de los peces control (agua reconstituida) cuyo valor fue de 5.51
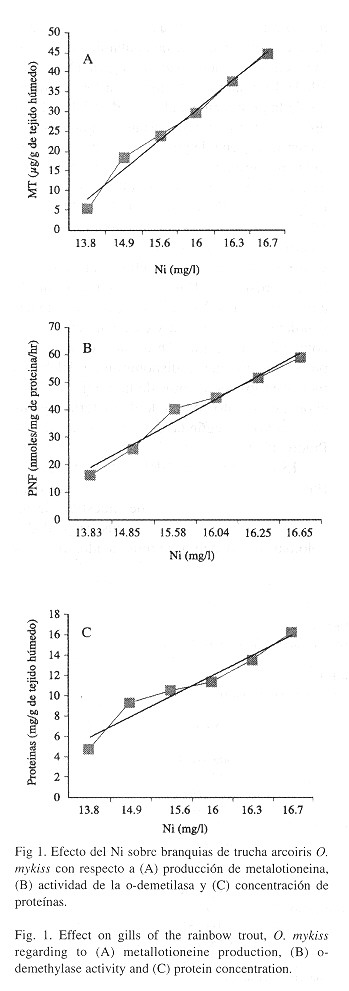
g/g de tejido. Con respecto a las branquias de la trucha arcoiris expuestas a diferentes concentraciones de Ni, los niveles de MT se incrementaron conforme aumentaban los del metal en el sistema agua-sedimento con Ni al equilibrio hasta 8.5 veces con respecto al control (Dunnet, p<0.05) ( Fig. 1A ).
Efecto del Ni sobre la actividad de la odesmetilasa: La cantidad de PNF formado en los peces expuestos a 13.83 (cantidad presente de Ni en los sedimentos de la granja), 14.85, 15.58, 16.04, 16.25, y 16.64 mg/kg de Ni se incrementó en 1.6, 2.5, 2.7, 3.2 y 3.5 veces respectivamente con respecto al control (Dunnet, p<0.05) (Fig. 1B ).
Efecto del Ni sobre la concentración de proteínas: La concentración de proteínas totales en branquias de los peces expuestos a sedimentos con 14.85, 15.58, 16.04, 16.25, y 16.64 mg/kg de Ni al equilibrio, se incremento en 2, 2.2, 2.4, 2.9 y 3.4 veces respectivamente con respecto al control (Dunnet, p<0.05) (Fig 1C ).
Discusión
Los sedimentos de un ecosistema acuático representan la acumulación de materiales arrastrados, o bien producidos en el mismo cuerpo de agua. La velocidad con que se acumulan éstos, expresa la actividad de un cuerpo de agua como receptor de contaminantes y como centro de actividad biológica (Margalef 1983 ). El contenido de arcilla en los sedimentos de la granja en estudio fue de 12.4% (Cuadro 1 ). Estas partículas están compuestas por minerales, lo cual le permite que su área superficial por gramo (67 m 2/g de sedimento) sea casi 850 veces mayor que el de la arena (8 m 2 /g) (Scott-Fursmand 1997 y Margalef 1983 ). Esto permitirá que la disponibilidad del Ni alrededor de la columna de agua sea menor y su retención mayor. Estudios realizados por Scott-Fordsmand (1997) , determinaron que la concentración de Ni en suelos es altamente dependiente de su textura y especialmente de su contenido en arcilla. Otra característica que puede sugerir que la disponibilidad del Ni es menor en los sedimentos de la granja "El Truchón", es su alto contenido de materia orgánica (Cuadro 1 ), según la clasificación de Nava y Prado (1996) .
Este componente del sedimento puede fluctuar en los diferentes cuerpos de agua, e inclusive en diversos sitios de muestreo de un mismo lugar. La mayoría de sus propiedades coloidales se deben al humus (ácidos fúlvicos y húmicos), cuya área superficial puede ser hasta de 900 x 103 m2 /kg y por tanto su capacidad de adsorción es mayor que el de las arcillas ( Nriagu y Coker 1980 ).
Calmano (1996) encuentra que al decrecer los valores de pH se incremento el potencial redox de los sedimentos. Los resultados obtenidos en este estudio concuerdan con este investigador, ya que los valores de pH del sedimento de la granja son ligeramente ácidos con un potencial redox elevado (198 mv) ( Cuadro 1 ), lo cual le confiere propiedades oxidantes. Esta propiedad le permitirá que se lleven a cabo reacciones de oxido-reducción del Ni con el carbono, nitrógeno, azufre y oxígeno (presentes en el sedimento), formando complejos insolubles, efecto que depende del pH. En aguas naturales, en un intervalo de pH 5-9, el ión divalente Ni2+, predomina como (Ni(H2O)6 2+ ) ( Snodgrass 1980 ). En el caso de los sedimentos de la granja con un pH de 6.3 ( Cuadro 1 ), es probable que esta forma sea la más importante. Además, en este intervalo de pH el Ni puede ser adsorbido sobre óxidos de Fe y Mn, formando complejos con ligandos orgánicos con ácidos húmicos y fúlvicos, así como los inorgánicos con CI- , S04 2-, y OH- ( Snodgrass 1980 ).
La concentración de Ni en sedimentos de la granja "El Truchón " fue de 13.83 mg/kg ( Cuadro 1 ), valor que está dentro de los límites considerados como seguros para ecosistemas canadienses (18 mg/kg) (Smith et al. 1997 ), pero no para los de Dinamarca (8.8 mg/kg) ( Scot-Fordsmand 1997 ). Así mismo, los niveles de este metal en el agua de este reservorio (2.05 mg/l) (Martínez-Tabche et al. in prep .) no exceden a los establecidos como seguros. Ambos resultados demuestran que el Ni presenta una baja disponibilidad, ya que únicamente el 14.82% del contenido total de este metal en sedimento es liberado al agua. El análisis de estas propiedades fisicoquímicas indica que la disponibilidad del Ni es muy baja, sin embargo los resultados obtenidos en el contenido de arena (75.4%), sugieren que ésta debe ser mayor, ya que los espacios entre estas partículas facilitan el movimiento del agua y aire en este sustrato, de tal forma que el Ni contenido en estos estanques puede ser transportado horizontal y verticalmente (Bohn et al. 1993 ).
Diferentes pruebas de toxicidad pueden servir como herramienta para evaluar la toxicidad de un xenobiótico o sus mezclas, también otorgan información sobre su disponibilidad. La CL 50 a 96 hr de suspensión de sedimentos de la granja sembrado con Ni en trucha arcoiris fue casi igual (28.13 mg/l) al obtenido con agua (29.1 mg/kg) (Martínez-Tabche et al. en prep .), lo cual demuestra que la disponibilidad del Ni es muy alta, probablemente porque este sustrato está constituido principalmente por arena, y que sus otros componentes no están determinando la disponibilidad del metal, o quizás, como se mencionó anteriormente puede formar otro tipo de compuestos derivados del Ni quizás más tóxicos que la sal de sulfatos. Otra posibilidad sería que los sedimentos de la granja contengan otro tipo de sustancias que estén potenciando el efecto de este metal.
Por testimonios de los campesinos de la granja "El Truchón" (Anónimo 1982 ), se menciona que la producción de la trucha disminuye sobre todo cuando los organismos jóvenes se cultivan en los estanques rústicos, ya que éstos presentan en las branquias un moco, efecto que desencadena la asfixia de los animales. Así mismo, estudios realizados por Reid y McDonald (1991) demostraron que la superficie bronquial de la trucha arcoiris está cubierta por con una capa de moco protector (restricción de agua y alimento, así como al estrés químico), consistente de glicoproteinas, mucopolisacáridos (compuestos de peso molecular bajo) y agua. Por lo que en este estudio se determinó los niveles de MT en homogeneizado de branquias de peces obtenidos de la granja trutícola, cuyas condiciones de cultivo son óptimas. El nivel de esta biomolécula en peces control fue 5.14 g/g de tejido húmedo, lo cual representa el 0.11% de las proteínas totales de este órgano. Estos resultados concuerdan con los obtenidos por Hamilton et al. (1987) , quienes observaron que la trucha brook previa exposición al cadmio, presentaba niveles de MT similares a los encontrados en este estudio. Probablemente la MT que se secretó en las branquias de los peces de la granja fue a causa del estrés por ausencia de alimento, ya que éste se les retiró durante 110 hr.
Son diferentes los metales (Zn, Cu, y Cd) que pueden producir MT en diferentes órganos de peces, probablemente como mecanismo de defensa (Brown et al. 1984 , Hogstrand y Haux 1990 y Handy 1992 ). En este estudio al exponer a los peces al agua con suspensión de sedimentos sembrados con Ni, esta biomolécula se incremento conforme aumentó la concentración del metal (Fig. 1 ). Este mismo comportamiento fue observado en el intestino de peces escorpión intoxicados con 25 y 50 mg/l de Cd (Brown et al. 1984 ). Estos estudios consideran que la producción de la MT en los peces es un mecanismo de defensa que se desencadena al estar en contacto con el metal. Probablemente es lo que está sucediendo en los sedimentos de la granja, sin embargo, este efecto puede contribuir a que este órgano se cubra de moco y por lo tanto sus funciones se dañen y el pez muera asfixiado, debido a que el intercambio de oxígeno por el bióxido de carbono no puede llevarse a cabo.
Con los resultados obtenidos en la producción de MT en las branquias de los peces se observó que existe una correlación muy elevada entre los niveles de Ni presente en los sedimentos y la producción de esta proteína (r=0.915) (Fig. 1 ). En situaciones en donde la concentración de Ni es baja, se puede considerar que la producción de MT se desencadena como un mecanismo de defensa, sin embargo cuando el metal se encuentra a niveles altos, como es el caso de la granja "El Truchón", este proceso se podría interpretar como una respuesta tóxica. Diversos estudios informan un comportamiento similar al encontrado en este trabajo. Hamilton et al. (1987) al exponer la trucha café a Cd, observó que la MT en hígado, riñón y branquias se incremento hasta un 50% al aumentar la cantidad del metal. Así mismo estudios realizados por Hogstrand y Haux (1990) confirman nuevamente lo anterior, ya que al exponer al pez azul rayado la MT hepática se incremento en forma proporcional al aumentar los niveles de Cd (0.27 hasta 22 mg/l).
El complejo enzimático Función Mixta Oxidasa (FMO) ha sido identificado como un sistema de detoxificación importante en diversos organismos. La presencia de FMO ha sido identificada en algunas bacterias como Escherichia coli y moscas a través de la oxidación de p-nitroanisol a p-nitrofenol, la cual se lleva a cabo específicamente por o-desmetilasas (Lee y Scott 1989 , Edelson y McMulien 1977 ). Este complejo enzimático presente en muchos organismos participa de forma importante en la autolimpieza que se lleva a cabo en los cuerpos de agua contaminados con diferentes xenobióticos, ya que al ser biotransformados en compuestos más hidrosolubles, se atenúa su toxicidad y permanencia en los mismos.
En diferentes estudios se informa que los metales inhiben al complejo enzimático FMO. Alvares et al. (1972) demostraron que los metales divalentes (Hg y Pb) reaccionan con el NADPH (coenzima de la FMO) en tejidos de ratas, de tal forma que puede detener el proceso de biotransformación de diversos xenobióticos. En el presente estudio contrario a lo esperado, se observó un incremento en la producción de p-nitrofenol en el homogeneizado de branquias de los peces expuestos a los sistemas sedimento-agua-Ni. La actividad de la enzima o-desmetilasa aumentó conforme se incrementó la concentración del metal en el sistema. Se ha informado que la inducción de la glutatión peroxidasa, gama-glutamil cisteína sintetasa y glutatión disulfuro reductasa por selenio, así como la homooxigenasa (enzima que forma parte del sistema FMO) se induce por metales divalentes entre los que se menciona al Ni (Repetto 1995 ).
Maines y Kappas (1976) en un estudio realizado con Co encontraron en hígado de ratas tratadas con este metal, una estimulación en la actividad de la hemooxigenasa microsomal. Estos investigadores mencionan que el Co se une con las fracciones tiol de la hemooxigenaza, formando un complejo tritiol-Co, el cual la estimula en forma importante. Considerando que esta enzima participó en la o-desmetilación del p-nitroanisol, es probable, que el Ni también forme un complejo, el cual pueda inducir la enzima de novo y por lo tanto incrementarse la producción de p-nitrofenol en el homogeneizado de branquias de trucha expuesta a Ni.
Nascimiento et al. (1996) , informan que un parámetro indicador del estado de salud de un cuerpo de agua pueden ser las proteínas totales, ya que su síntesis puede ser inducida por el estrés consecuencia de inanición, temperatura y xenobióticos. En un estudio realizado por estos investigadores con la almeja asiática Corbicula fluminea expuestas a diferentes temperaturas, identificaron a dos proteínas estresantes y las denominaron Hsp 60 y Hsp 10.
En este estudio se observó en los peces expuestos al sistema agua-sedimento-Ni, un incremento importante en la concentración de proteínas hasta 3.41 veces con respecto al control, siendo este efecto dependiente de la concentración del metal (Fig. 3 ). Este resultado puede ser explicado debido a que el Ni estimula la síntesis de proteínas, entre las que se sugiere están las metaloprotínas (Hamer 1986 ). Otra explicación a esta respuesta sería la que proponen Kacew y Singhal (1980) , quienes mencionan que los metales pueden producir alteraciones en las funciones enzimáticas, y provocar un incremento en las proteínas (directa o indirecta) como una respuesta compensatoria del organismo a posibles daños estructurales y funcionales.
Para determinar si la producción de MT era por el efecto directo del Ni o estaba ligada con la producción de proteínas, se calculó la proporción MT/proteína. Como puede observarse esta relación siempre sobrepasa el valor de uno (Fig. 1 ), lo que sugiere que la inducción de esta biomolécula se lleva a cabo como un efecto neto por la presencia del metal, posiblemente como un mecanismo homeostático para evitar los efectos tóxicos del Ni.
Resumen
Estudios previos indicaron la presencia de elevadas concentraciones de níquel (Ni) en los estanques de la granja "El Truchón", por tal motivo fue necesario establecer correlaciones entre las propiedades fisicoquímicas de los sedimentos de este embalse y el daño que puede producirse sobre la trucha arcoiris cuyo cultivo se lleva a cabo en un reservorio denominado rústico. El estudio se inició con la determinación de las propiedades fisicoquímicas de los sedimentos de la granja, las cuales incluyeron: composición granular, porcentaje de nitrógeno total, contenido de materia orgánica, pH, potencial redox, capacidad de intercambio canónico y la concentración de Ni. Se determinó la CLSO del Ni-96 H sobre Oncorhynchus mykiss en el sistema agua-sedimentos de la granja-metal al equilibrio. En este mismo sistema se evaluó la toxicidad subletal del Ni, mediante la determinación de niveles de metalotioneina (MT), la actividad de la o-desmetilasa (OD) y la concentración de proteínas. Los resultados muestran un incremento significativo en los tres parámetros bioquímicos, observándose una relación linear entre efecto y concentración del Ni, por lo que estos biomarcadores de daño se teconúendan para evaluar la toxicidad del Ni. Probablemente estos efectos se deban a las propiedades fisicoquímicas del sedimento que le confiere alta capacidad de absorber el metal. De acuerdo a los resultados obtenidos en este estudio se sugiere al truticultor no emplear estanques rústicos, sino aquellos revestidos de concreto, para evitar la acumulación de sustancias tóxicas o bien realizar remociones periódicas de su sedimento.
Referencias
Alvares, A.R, S. Leigh & Cohn, J. 1972. Lead and methyl mercury: effects of acute exposure on cytochrome P450 and the mixed function oxidase system in the liver. J. Exper. Med. 135: 1406-1409. [ Links ]
Anónimo. 1982. Secretaría de Pesca. Manual Técnico para el Cultivo de Trucha Arcoiris. Dirección General de Acuacultura. Dirección General de Planeación México. 140 p. [ Links ],
Anónimo. 1991. Enviromental health criteria 108: Nickel. International Programme on Chemical Safety (IPCS). Word Health Organization (WHO). Genova. [ Links ]
Bohn, H.l., B.L. McNeal & G.A. O'Connor. 1993. Química del Suelo. Limusa, México pp. 34-56. [ Links ]
Bradford, M.M. 1976. A rapid and sensitive method for the quantitation of microgram quantities of protein utilizing the principles of protin-dye binding. Anal. Biochem. 27: 248-254. [ Links ]
Brown, D.A., S.M. Bay, J.F. Alfafara, G.P. Hershelman & K.D. Rosenthal. 1984. Detoxification/toxification of cadmium in scorpionfish (Scorpaena guttata). Aquatic Toxicol. 5: 93-107. [ Links ]
Calmano, W. 1996. Metals in sediments: Remobilization and environmental hazards. pp. 1-14. In M. Munawar & G. Dave, (eds.). Development and progress in sediments quality assessment. Rationale, challenges, techniques & strategies. [ Links ]
Eaton, D.A., L.S. Clesceri. & A.E. Greenberg (eds.). 1995. Standard methods for the examination of water and wastewater. 19th edition. American Public Health Association. Washington D.C. 1268 p. [ Links ]
Edelson, J. & J.R McMulien 1977. O-demethylation of pnitroanisole by Escherichia coli stimulation by phenobarbital. Amer. Soc. Pharmacol. Exper. Ther. 5: 185-190. [ Links ]
Glantz, S.A. 1992. Primer of Biostatistics. 3rd Edition. Mc Graw Hill. Nueva York. 358 p. [ Links ]
Hamer, D.H. 1986. Metallothionein. Ann. Rev. Biochem. 55: 913-951. [ Links ]
Hamilton, S.J., P. Mehrle & J.R. Jones. 1987. Evaluation of metallothionein measurement as a biological indicator of stress from cadniium in brook trout. Trans Am. Fish. Soc. 11 6: 551-560. [ Links ]
Handy, R.D. 1992. The assessment of episodic metal pollution I. Uses and imitations of tissue contaminant analysis in rainbow trout (Oncorhynchus mykiss) after short waterborne exposure to cadmium or copper. Arch. Environ. Contam. Toxicol. 22: 74-81. [ Links ]
Hogstrand, C. & C. Haux. 1990. Metallodúoncin as an indicator of heavy-metal exposure in two subtropical fish species. J. Exp. Mar. Biol. Ecol. 138: 69-84. [ Links ]
Huet, M. 1983. Tratado de Piscicultura. 3' edición. Ediciones Mundiprensa. España. pp. 94-154. [ Links ]
Kacew, S. & R.L. Singhal. 1980. Aspects of molecular mechanisms underlying biochemical toxicology of lead. pp. 43-78. In R.L. Singhal & J. A. Thomas, (eds.). Lead Toxicology. Urban & Schwarzenberg. Baltimore. [ Links ]
Lee, S.S. & J.G. Scott. 1989. Microsomal cytocrome P45. monooxigenases in the house fly (Musca domestica L): Biochemical changes associated with pyrethroid resistance and Phenobarbital induction. Pestic. Biochem. Physiol. 35: 1-10. [ Links ]
Maines, M.D. & A. Kappas. 1976. Studies on die mechanisin of induction of haem oxygenase by cobalt and other metal ions. Biochem. J. 154: 125-131. [ Links ]
Margalef, R. 1983. Limnología. Ediciones Omega. Barcelona. 1010 p. [ Links ]
Martínez-Tabche, L., M.B. Ramírez, O.L. Gómez, EC. Germán & O.M. Grajeda. 1999. Toxic effect of nickel on hemoglobin concentration of Limnodrilus hoffmeisteri in spiked sediments of trout farms. Ecotoxicol. Environ. Saf. 42: 143-149. [ Links ]
McMahon, R.E., H.W. Culp, J. Milis, & R. Marshall. 1963. Microsomal p-nitroanisole O-demethylase. J. Med. Chem. 6: 343-349. [ Links ]
Nascimiento, A.I., K.L. Dickson, & E.G. Zimmerman. 1996. Heat shock protein response to termal stress in the Asiatic clain, Corbicula fluminea. J. Aquatie Ecosystem Health. 5: 231-238. [ Links ]
Nava, D.J. & M.L. Prado. 1996. Prácticas de Laboratorio del Curso de Análisis Especiales Il (Química Agrícola). Esc. Nac. Ciene. Biol., 1.P.N., México. pp. 2-44. [ Links ]
Nriagu, J.O. & R.D. Coker. 1980. Trace metals in humic and fulvic acids from Lake Ontario sediments. 14: 443-446. [ Links ]
Reid, S.D. & D.G. McDonald. 1991. Metal binding activity of the gills of rainbow trout (Oncorhynchus mykiss). Can. J. Fish. Aquat. Sci. 48: 1061-1068. [ Links ]
Repetto, M. 1995. Toxicología avanzada. Díaz de Santos, S.A. Madrid. 278 p. [ Links ]
Scott-Fordsmand, J. 1997. Toxicity oí nickel to soils organism in Denmark. Rev. Environ. Contam. Toxicol. 148: 1-147 [ Links ]
Sheuhammer, A.M. & G. Cherian. 1986. Quantification of metallothionein by silver-saturation method. Toxicol. Appl. Pharmacol. 82: 417-425. [ Links ]
Smith, S.L., D.D MacDonald, K.A. Keenleyside & C.L. Gaudet. 1997. The development and implementation of canadian sediment quality guidelines. pp. 232-249. In M. Munawar & G. Dave (eds). Development and progress in sediments quality assessment. Rationale, challenges, techniques & strategies. Amsterdam. [ Links ]
Snodgrass, W.J. 1980. Distribution and behaviour of nickel in the aquatic environment. pp. 203-268. In J.O. Nriagu, (ed.). Nickel in the environment. Wiley Interscience Publication. [ Links ]
Yau, T.E. & H.J. Menear. 1977. Pancreatic metallothionein: protection against cadmium-induced inhibition of insulin secretory activity. Toxicol. Appl. Pharmacol. 39: 515-520. [ Links ]
1 . Laboratorio de Toxicología Acuática, Programa de Ciencias Químico Biológicas-Depto de Toxicología, Escuela Nacional de Ciencias Biológicas, Instituto Politécnico Nacional. Plan de Ayala y Carpio s/n. Delegación Miguel Hidalgo, México. D.F.
2 . Laboratorio de Limnología, Programa de Ciencias Químico Biológicas-Depto de Ecología, Escuela Nacional de Ciencias Biológicas, Instituto Politécnico Nacional, Plan de Ayala y Carpio s/n. Delegación Miguel Hidalgo, México. D.F.
* Correspondencia: Dra. Laura Martínez Tabche, Laboratorio de Toxicología Acuática, Escuela Nacional de Ciencias Biológicas, 1.P.N., México, D.F. CP 11340. Fax: 525-3963503; Itabche@encb.ipn.mx














