Revista de Biología Tropical
versión On-line ISSN 0034-7744versión impresa ISSN 0034-7744
Rev. biol. trop vol.48 no.4 San José dic. 2000
Federico Escobar S123y Patricia Chacón de Ulloa1
Recibido: 6-IX-99 Corregido: 14-VI-00 Aceptado: 16-VI-00
Abstract
Dung beetles (Scarabaeinae y Aphodiinae) were used to evaluate the effects of human activities in the area surrounding La Planada Natural Reserve, southwestern Colombia. During 1993 we monitored three habitats: primary and secondary forest, and open fields used for cattle grazing. A total of 55 296 trap / hours, evenly distributed among the three habitat types, captured 9 115 individuals (18 species, 11 genera). There were differences in species richness between habitats (F 2,9 = 29.88; P < 0.001), an in number of individuals (F 2, 9 = 36.22; P < 0.001). Collecting sites differed within habitats. Cluster analyses show that species composition differs between habitats with and without tree cover. Open areas act as barriers for movements of forest species. Differences between habitats and collecting sites may reflect high environmental heterogeneity, land use history of the sites or the influence of nearby disturbance. Some of the species found in open fields come from lower elevations and are usually associated with intense human disturbance. The proportion of digging and rolling species is similar in both primary and secondary forest, nocturnal species are more abundant; in open areas rolling species are absent and the number of diurnal species increases. We found no relationship between rainfall and species richness (r2 = 0.26; P = 0.41), nor between rainfall and number of individuals collected throughout the year (r2 = 0.07; P = 0.84). For all species the number of individuals collected decreased during dry season and during the onset of the rainy season.
Key words
Scarabaeinae, Aphodiinae, succession gradient, spatial heterogeneity, diversity and conservation, Colombian Andes
Los bosques andinos se caracterizan por una alta concentración de especies endémicas y diversidad biológica, debido a su complejidad geológica, climática y fisiográfica (van der Hammen 1995). Además de mantener una alta diversidad, cumplen un importante papel en la conservación de los suelos y en la regulación del ciclo hídrico de tierras bajas (Cavalier 1991). En Colombia, es uno de los ecosistemas que ha recibido mayor impacto y presión de la actividad humana (Kattan y Alvarez 1996) y se considera que cerca del 85 % de su extensión original ha desaparecido a causa de la extracción de maderas finas y la adecuación de tierras para la agricultura y ganadería (Andrade 1992).
La modificación de los ecosistemas como consecuencia de las actividades humanas es reconocida como una de las principales causas directas de pérdida de la diversidad biológica. Si la transformación es total y abarca una extensa área una porción considerable de la biota puede desaparecer. Sin embargo, en la mayor parte de los casos esto no ocurre, pues la alteración de los ecosistemas naturales no siempre es total y con frecuencia el resultado es un mosaico compuesto por remanentes del hábitat original en medio de una matriz de ambientes antropogénicos (Forman 1995).
El proceso de fragmentación de los hábitats naturales incluye mucho más que cambios en el tamaño, forma y aislamiento de los parches de hábitat, contempla su reemplazo por otros ambientes, la alteración de los límites, la distribución y el contexto de los parches de hábitat (Saunders et al. 1991, Weins et al. 1993). Dichos cambios se manifiestan de manera distinta dependiendo de la escala espacial que se considere. En términos generales, la persistencia de las especies en los ambientes naturales depende en gran medida de la intensidad y la frecuencia de las perturbación y del arreglo espacial de los hábitats naturales y derivados de la actividad humana en el paisaje (Forman 1995).
Los coleópteros coprófagos pertenecientes a la familia Scarabaeidae, se consideran un grupo importante para la evaluación de los cambios producidos por la actividad del hombre en ecosistemas naturales y sistemas derivados, así como para el monitoreo de la biodiversidad en bosques tropicales (Halffter y Favila 1993, Escobar y Halffter 1999), debido a la facilidad para estandarizar métodos de recolecta, a su taxonomía manejable e historia natural bien conocida, así como por el papel que ellos cumplen en el funcionamiento de los ecosistemas y en especial por su estrecha dependencia del excremento de vertebrados, en particular de mamíferos para su alimentación y nidificación (Halffter y Matthews 1966).
Mediante el monitoreo de los escarabajos del estiércol (Scarabaeinae y Aphodiinae) a lo largo del año 1993, en un bosque de montaña localizado al sur occidente de Colombia, este trabajo pretende: 1. Cuantificar los cambios en la riqueza, abundancia y composición a través de un gradiente de sucesión, 2. Determinar el uso de los distintos ambientes por parte de los escarabajos, 3. Conocer la variación mensual en la abundancia de las especies y, 4. Conocer los ritmos de actividad diaria y sus preferencias alimenticias.
Materiales y Métodos
Area de estudio: Este estudio se realizó en el área de influencia de la Reserva Natural La Planada, localizada en la vertiente Pacífica de la cordillera Occidental, en el Municipio de Ricaurte, Departamento de Nariño - Colombia (1° 17 N, 78°15 W). La Reserva tiene un rango altitudinal que varía entre los 1 800 y los 2 000 m y un promedio de 4 900 mm de precipitación anual, con un marcada estación seca entre junio y agosto. Los suelos de la Reserva son de origen volcánico, de textura franco - arenosa y arcillosa, bien drenados. Por sus características climáticas y tipo de vegetación el área corresponde a la zona de vida bosque pluvial premontano (bp - PM) (Espinal 1977).
La mayor parte de las 3 200 hectáreas de la Reserva están cubiertas por bosque en buen estado de conservación. Al interior de la Reserva existen más de 150 ha que fueron destinadas a la ganadería y extracción de maderas finas hace aproximadamente 15 años. Las zonas aledañas están compuestas por un mosaico de hábitats compuesto por cultivos, áreas en regeneración natural, pastizales y puntos de asentamiento humano.
El bosque nativo se caracteriza por la presencia de especies arbóreas de las familias Lauraceae, Rubiaceae, Melastomataceae, Palmae, Bombacaceae, Euphorbiaceae y Cesalpinaceae, con un dosel cercano a los 30 m de altura con un gran cantidad de lianas y epífitas. Las zonas en regeneración se encuentran dominadas por helechos del género Cyathea, arbustos y arboles pioneros de los géneros Psychotria sp. (Rubiaceae), Tibuchina sp. (Melastomataceae) y Clusia sp. (Clusiaceae) y el dosel no supera los 15 m de altura. Los pastizales presentan gramineas para el forrajeo del ganado y algunos árboles aislados de gran tamaño.
Técnicas de captura y diseño de muestreo: Para la captura de los especímenes se utilizó trampas de caída modificadas (Escobar 1994). La trampa consiste en un vaso desechable de 500 ml enterrado a ras de suelo, al cual se le adaptó un embudo plástico en la boca del vaso. El embudo permite la entrada de los individuos a la trampa y reduce la probabilidad de su salida. Suspendido con un alambre sobre el vaso se colocó un recipiente desechable de 25 ml con el atrayente o cebo. La base del recipiente enterrado se encuentra finamente perforado para evitar que se inunde.
La principal ventaja de este método es que se reduce la mortalidad a causa del muestreo, al eliminar el alcohol y otros preservantes tradicionalmente utilizados para la captura y conservación de los especímenes, permitiendo su cuantificación, marcaje y posterior liberación. Otra ventaja de esta trampa es que puede permanecer durante largo tiempo en el campo sin el atrayente, el cual es intercambiado (vaso de 25 ml), según las necesidades del muestreo, además permite una medida estándar de la cantidad de atrayente.
La fase de campo se desarrolló entre enero y diciembre de 1993. Para el muestreo se escogieron tres tipos de hábitat (tratamientos): bosque primario (BP), bosque secundario (BS) y pastizal (PA). En cada hábitat se ubicaron cuatro sitios, en cada sitio se trazó un transecto compuesto por ocho trampas de caída separadas 50 m una de la otra, cubriendo una distancia de 350 m para un total de 96 trampas. La distancia entre sitios de muestreo varió entre un km como mínimo y los siete kms como distancia máxima. Los muestreos se realizaron cada mes con una duración aproximada de ocho días. Las trampas fueron cebadas con excremento humano entre las 06: 00 y las 08: 00 horas y evaluadas a los largo de dos días, con revisiones a las 24 y 48 horas, para un total de 18 432 horas / trampa en cada tipo de bosque. Durante los primeros cinco meses de muestreo se intensificó la visita a las trampas cada 12 horas, con el fin de diferenciar el período diario de actividad de las especies. Los individuos capturados se mantuvieron en cajas plásticas marcadas de acuerdo al sitio de captura y una vez finalizado el muestreo eran liberados en el mismo lugar.
Para establecer el número de recapturas mensuales y determinar el flujo de individuos entre sitios de muestreo, se marcaron los individuos de especies con un tamaño mayor a 10 mm. Este tamaño permite una fácil manipulación de los individuos en el campo y en el laboratorio. El marcaje fue realizado durante el muestreo correspondiente a los meses de febrero y junio, siguiendo la metodología de Favila (1988). Para diferenciar la procedencia de los individuos se asignó un color a cada hábitat, un código al transecto y al mes en el cual fueron marcados.
De forma adicional, se realizaron capturas en los distintos hábitats a través de la revisión manual de diferentes tipos de substratos en condiciones naturales, en especial en excremento de "oso de anteojos" (Tremarctos ornatus), "mono aullador" (Allouatta palliata) y de animales domésticos, en particular de ganado vacuno y caballos. Igualmente, se realizaron capturas en carroña y frutos en descomposición.
La fase de campo se desarrolló entre enero y diciembre de 1993.
Análisis estadístico: Se usó análisis de varianza anidados (ANOVA) de dos factores para evaluar el efecto del tipo de hábitat y de sitio de muestreo, con sitios anidados dentro de los hábitats, sobre la riqueza de especies y el número de capturas. Los cambios en la abundancia de cada especie a través del gradiente de sucesión se analizaron con el mismo diseño. Los datos fueron transformados teniendo en cuenta las recomendaciones de Elliot (1977) y de Sokal y Rohlf (1981) para datos obtenidos a través de conteos. Las diferencias entre tratamientos se probaron por comparaciones múltiples mediante la prueba de Tukey.
Se estableció la similitud entre sitios de muestreo teniendo en cuenta los valores de abundancia de las especies. El agrupamiento se hizo por medio del coeficiente de correlación de Pearson y los dendrogramas construidos por el método de la mínima varianza.
Se hizo análisis de regresión para establecer la relación entre la precipitación y la riqueza de especies y entre la precipitación y el número de capturas a lo largo del año, así como para relacionar la precipitación con el número de capturas de cada especie durante el período de muestreo.
Resultados
Riqueza, abundancia y distribución espacial en el gradiente de sucesión: Se capturó un total de 9 115 individuos pertenecientes a 17 especies y 10 géneros de la subfamilia Scarabaeinae y una especie de Aphodiinae. El 70 % del total de individuos capturados pertenecían a cuatro especies: Deltochilum spinipes, Sulcophanaeus velutinus, Uroxys brachialis y U. nebulinus. En cambio la captura de Bdelyrus laplanadae, Canthon aberrans, Deltochilum mexicanum, Eurysternus foedus y Oxysternon conspicillatum, no superan los diez individuos por especie y representando el 1.2 % total de capturas (Cuadro 1).
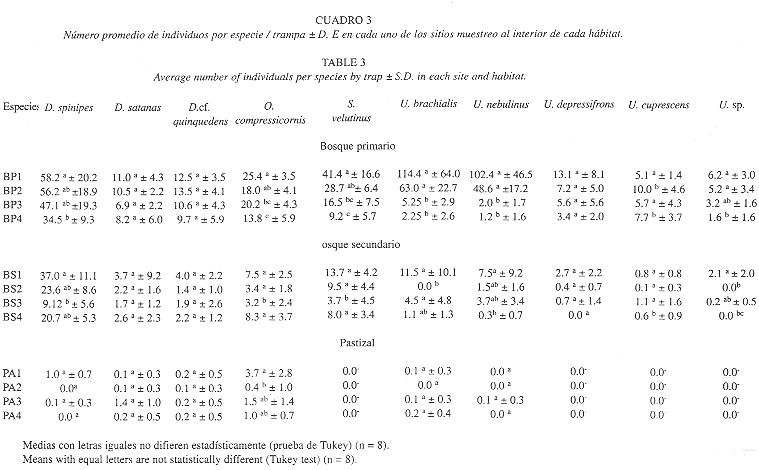
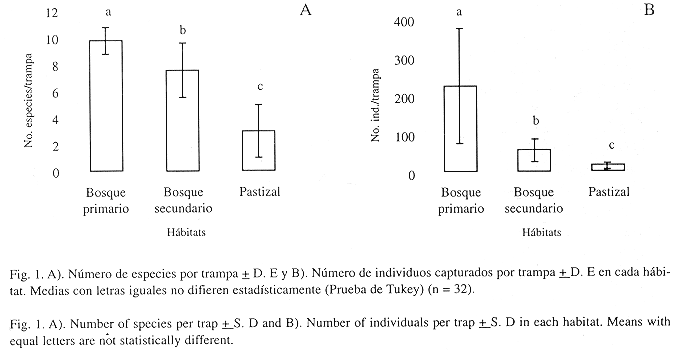
Se encontraron diferencias en la riqueza de especies (F 2, 9 = 29.8; P < 0.001) y en el número de individuos capturados (F 2, 9 = 36.2; P < 0.001) entre los hábitats. Cerca del 60 % de las especies de escarabajos estercoleros no se encontraron en pastizal (Fig.1A), y su abundancia decrece drásticamente en el bosque secundario y en zonas abiertas, en donde se capturó el 20.1 % del total de individuos (Fig. 1B). Igualmente, se encontró diferencias entre los sitios de muestreo en el interior de cada uno de los tipos hábitat tanto en el número de especies (F 9, 84 = 5.2; P < 0.001) como en el número de individuos capturados (F 9, 84 = 11.6; P < 0.001) (Cuadro 2).
Cuando se analizó separadamente cada una de las diez especies más abundantes de escarabajos (> 100 individuos), se encontró diferencias significativas entre los hábitats (Cuadro 3). De igual forma, se encontró que las especies son atrapadas de forma diferencial entre sitios de muestreo al interior de cada hábitat (Cuadro 3). Sin embargo, aunque la mayoría de las especies disminuyeron su abundancia en zonas de regeneración y pastizal, otras como: Canthon aberrans, Eurysternus marmoreus, Onthophagus acuminatus (Scarabaeinae) y Aphodius brasiliensis (Aphodiinae),tienden a incrementar en número en zonas pastizal y capturadas con frecuencia en excremento de ganado (Cuadro 1).
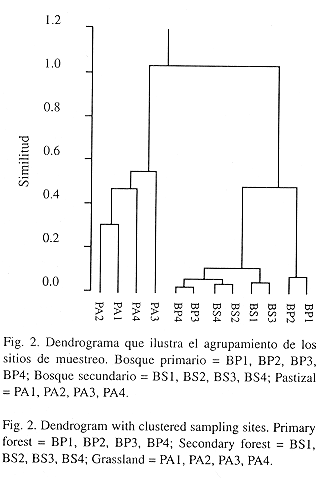
Los resultados del análisis de agrupamiento definen tres grupos correspondientes al estado de sucesión y las características propias de los sitios de muestreo. En el dendrograma, el primer grupo está formado por los sitios BP1 y BP2 de bosque primario, el segundo conformado por la mezcla de BP3 y BP4 con los sitios de bosque secundario y el tercero, agrupa todos los sitios de pastizal (Fig 2).
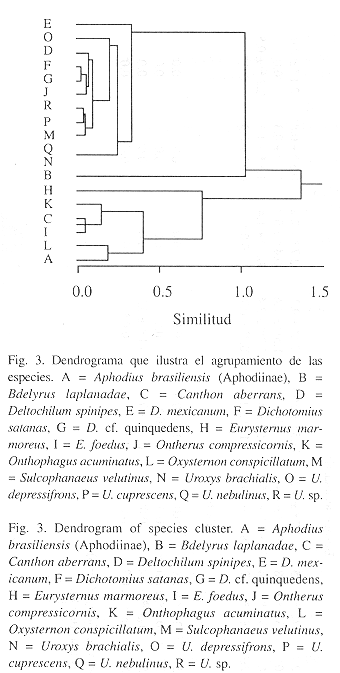
El dendrograma correspondiente al agrupamiento de las especies separa dos grandes grupos (Fig. 3), con especies típicas tanto de áreas con cobertura boscosa como de zonas abiertas y con diferentes límites de tolerancia a los cambios microambientales. El primer grupo, lo constituye las especies más abundantes y comunes en bosque primario y con muy poca capacidad de penetración en zonas de pastizal como: Uroxys brachialis, U. cuprescens, U. nebulinus y Sulcophanaeus velutinus. Así mismo incluye las especies que eventualmente penetran a zonas de pastizal como Deltochilum spinipes, Dichotomius satanas, D. cf. quinquedens y Ontherus compressicornis. El segundo grupo está conformado por las especies típicas de pastizal dentro de las que se incluyen: Onthophagus acuminatus, Eurysternus foedus, Oxysternon conspicillatum y Aphodius brasiliensis (Aphodiinae), provenientes de hábitats derivados de la actividad humana localizados a alturas más bajas (Escobar, obs. pers.).
Marcaje Recaptura: Durante el mes de febrero se marcaron 475 individuos de los cuales se recapturaron tres individuos al siguiente mes. Para el mes de junio fueron marcados 456 individuos y recapturados cinco en julio. Al finalizar el año, de los 931 individuos marcados, fueron recapturados 21 individuos (2. 25 %), de los cuales cuatro se encontraron en sitios diferentes al punto de marcaje (Cuadro 4). La máxima distancia de desplazamiento fue de aproximadamente dos km en un individuo de Sulcophanaeus velutinus después de un mes de ser liberado. Mientras que un individuo de Dichotomius cf. quinquedens capturado en bosque primario y marcado en febrero fue recapturado siete meses después en el mismo sitio.
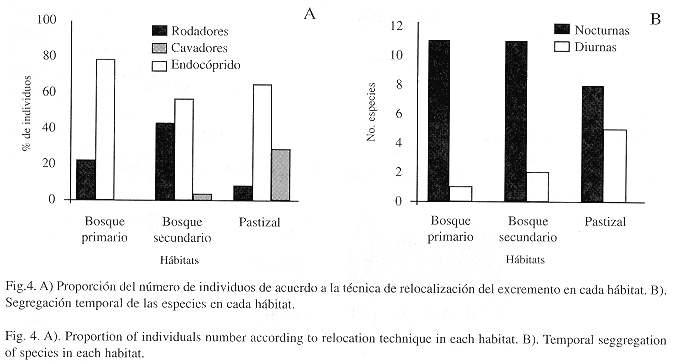
Formas de relocalización, ritmos de actividad y preferencias alimenticias de las especies: De las 18 especies capturadas 12 eran de hábitos cavadores, tres son rodadoras y tres de hábitos endocópridos. Aunque el número de especies de hábitos cavadores y rodadores no varía entre hábitats (Cuadro 1), en bosque primario y bosque secundario se observó una mayor proporción de rodadores respecto a las zonas de pastizal, en donde se observó una disminución en la abundancia de individuos de hábitos rodadores y la presencia exclusiva de dos especies de hábitos endocópridos (Fig. 4A, Cuadro 1).
A través de la visita cada 12 horas a las trampas y mediante la revisión de otros tipos de excremento a lo largo del día se pudo establecer que 12 especies son activas en horas de la noche y seis durante el día (Cuadro 1). En bosque primario y bosque secundario, la actividad se concentra en horas de la noche, mientras que en áreas de pastizal se observa una disminución de estas especies y una incremento de las especies de actividad diurna (Fig. 4B). Observaciones preliminares indicaron que las especies presentan períodos diferenciales de actividad durante el día. Sulcophanaeus velutinus es activa entre las 06: 00 y las 10: 00 horas, período en el cual realiza vuelos continuos a baja altura. En la noche Deltochilum spinipes se captura con mayor frecuencia entre las 18: 00 y las 21: 00 horas y en menor proporción entre las 04: 00 y las 06: 00 horas. Mientras que Ontherus compressicornis, U. brachialis y U. nebulinus son capturadas entre las 20: 00 y las 24: 00 horas. En términos generales, la actividad de las especies parece decrecer entre las 24: 00 y las 04: 00 horas.
Una 77 % de las especies fueron observadas en excremento de ganado vacuno (ver Cuadro 1). Al interior del bosque primario Sulcophanaeus velutinus fue la única especie que se capturó en excremento de mono (Alouatta palliata). Tres especies, Uroxys brachialis, U. nebulinus y Sulcophanaeus velutinus fueron observadas en excremento de oso de anteojos (Tremarctos ornatus). Por otro parte, Canthon aberrans se encontró manipulando cadáveres de insectos (Hymenoptera: Apidae) y depredando lombrices de tierra (Oligoqueta), mientras que cerca de 15 individuos de Bdelyrus laplanadae fueron capturados alimentándose de frutos en descomposición de Qoararibea sp. (Bombacaceae).
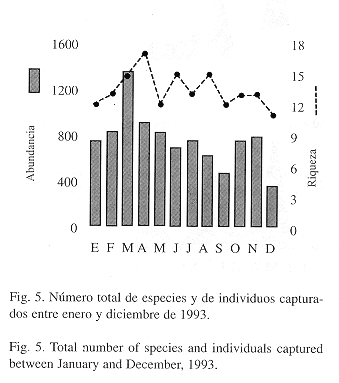
Cambios en la abundancia a lo largo del año: Los análisis de regresión indican que no existó una relación entre la precipitación y la riqueza de especies (r2 = 0.26; P = 0.41), ni entre la precipitación y el número de capturas a lo largo del año (r2 = 0.07; P = 0.84), Sin embargo, la fig. 5 muestra que la mayor riqueza, 17 especies, se obtuvo durante el mes de abril, mes en el cual se registró la mayor precipitación durante el año de 1993. Igualmente, se observó que el número de individuos capturados disminuyó durante los meses de agosto y septiembre, época que coincide con la transición entre el periodo más seco del año y el inicio de la lluvias (Fig. 5).
Al graficar el número de individuos capturados durante cada mes para aquellas especies más frecuentes (> 100 individuos), se observó picos de mayor de abundancia que varían de acuerdo a la estación y alternándose a lo largo del año (Fig. 6). Especies como Uroxys brachialis y U. nebulinus fueron más abundantes durante el primer semestre del año, en especial durante el mes de marzo. Esto es contrario a Sulcophanaeus velutinus y Dichotomius cf. quinquedens, las cuales incrementaron en número hacia el final del año. Mientras que Ontherus compressicornis y Dichotomius satanas, presentarón dos picos de abundancia, al comienzo y al final del año. Otras especies en cambio, presentan tres picos de abundancia, como Uroxys cuprescens y U. sp. Todas las especies disminuyeron en abundancia durante el final del período seco, pero en ninguno de los casos la precipitación explica los cambios en abundancia de las especies a lo largo del año.
Discusión
La sustitución de áreas de bosque de montaña por zonas dedicadas a la ganadería modifica diferentes atributos de la comunidad de coleópteros coprófagos. La zonas de regeneración natural y los pastizales evaluados en este estudio soportan comparativamente una menor riqueza de especies y abundancia de escarabajos con respecto al bosque nativo y para la mayoría de las especies típicas de interior del bosque las áreas abiertas constituyen una barrera para el movimiento de sus poblaciones.
Algunos estudios demuestran que los escarabajos coprófagos responden negativamente a disturbios como la fragmentación y transformación de los hábitats naturales (Klein 1989, Halffter et al. 1992, Amat et al.1997, Escobar 1997). La mayoría de las especies, en especial en bosques tropicales, son relativamente intolerantes a las condiciones imperantes en zonas deforestadas, debido a los cambios microclimáticos y de oferta de recursos (Klein 1987). Sin embargo, muy pocos documentan los patrones de distribución espacial de este grupo de insectos a través de gradientes de sucesión.
Varios factores influyen sobre el número de especies que pueden sobrevivir en ambientes fragmentados. El tamaño y el grado de aislamiento de los remanentes de hábitat son importantes, pero la frecuencia y la intensidad de los disturbios humanos, el tipo de vegetación circundante y los arreglos del paisaje, pueden ser determinantes en la persistencia de las especies (Weins et al. 1993). Este trabajo apoya la sugerencia de Klein (1989) y Stouffer y Bierregard (1995) en la Amazonía, respecto a la idea que el efecto de barrera impuesto por las zonas abiertas sobre la fauna de escarabajos del estiércol y de aves insectívoras, decrece con la presencia de áreas en crecimiento secundario. En la Reserva Natural La Planada, la mayoría de las especies típicas de bosque primario penetran a zonas de bosque secundario y algunos de los sitios estudiados en este hábitat, presentan poblaciones bien establecidas, como lo confirma el escaso movimiento de los individuos recapturados (Cuadro 4).
A la escala espacial de este estudio, los valores de variación expresados en términos de la desviación estándar para la riqueza y la abundancia de especies entre los hábitats, posiblemente reflejen el grado de heterogeneidad espacial y del efecto de la simplificación de estos ocasionado por la deforestación. En bosque primario, la variación en la riqueza de especies es menor con respecto al pastizal, mientras que para la abundancia, dicha variación se comporta de forma contraria y es comparativamente mucho mayor en bosque primario que en bosque secundario y pastizal (ver Fig.1A y 1B respectivamente).
Una explicación a lo anterior, es que aunque la mayoría de la especies típicas de bosque primario se encuentran presentes en todos los sitios seleccionados para el muestreo, varias especies presentan marcadas diferencias en el número de capturas al interior de este hábitat. Especies como: Sulcophanaeus velutinus, Uroxys brachialis, U. nebulinus y U. sp, presentan una distribución agregada, con una menor proporción de individuos de los sitios BP3 y BP4, sitios que limitan con zonas en regeneración y pastizal. De otro lado, estas especies nunca penetran a zonas abiertas (ver cuadro 3). Tales diferencias pueden estar relacionadas con la influencia de perturbaciones cercanas y los límites de tolerancia de las especies. En muchos casos las condiciones microclimáticas dominantes en áreas desmontadas penetran en los remanentes de bosque, modificando la distribución espacial de los escarabajos como recientemente se ha registrado para varias localidades en selvas tropicales (Halffter et al. 1992, Escobar 1997).
De otro lado, en bosque secundario y pastizal, la extrema reducción y la poca variación en los valores de abundancia de las especies entre sitios de muestreo, como consecuencia de la homogeneidad de estos ambientes en términos de la vegetación y oferta del recursos (excremento de ganado), conlleva a una captura errática de los escarabajos en estos ambientes y por lo tanto, un incremento en los valores de desviación estándar de la riqueza de especies. En zonas de pastizal, las diferencias entre sitios de muestreo, posiblemente se deban a factores como tamaño del potrero, así como al tiempo de apertura, intensidad y clases de pastoreo y su distancia a los remanentes de bosque, aspecto que merece ser investigado en detalle.
Además de la reducción en la riqueza y abundancia de las especies de escarabajos, se producen cambios en la composición de la comunidad cuando se comparan áreas de bosque y pastizal. Los nuevos componentes de la comunidad de escarabajos estercoleros en zonas abiertas están representados por una mezcla de especies con capacidad de explotar ambientes contrastantes (bosque / pastizal), y por especies provenientes de hábitats perturbados localizados a altura más bajas, adaptadas fisiológica y conductualmente a las condiciones creadas por el hombre (especies parantrópicas en los términos de Halffter et al. 1992), las cuales utilizan los corredores deforestados para invadir zonas a mayor altura (Escobar, datos sin publicar). Lo anterior tiene un implicación importante en términos de la conservación y manejo de los ecosistemas de montaña, ya que cierto grado de modificación de los paisajes puede incrementar el número de total de especies a nivel regional (Favila y Halffter 1997).
La respuesta de organismos a los cambios ambientales puede estar afectada por diferentes factores. En el caso de los coleópteros coprófagos, el grado de cobertura vegetal, en particular la estratificación vertical, la densidad de la vegetación y el tipo de suelo influyen en la distribución micro - espacial de las especies (Nealis 1977, Doube 1991, Escobar 2000). En las zonas en proceso de regeneración de la Reserva estudiada, se presentan un sotobosque espeso, compuesto por arbustos muy ramificados, lo cual puede dificultar el vuelo y la localización del excremento por parte de los escarabajos. Sin embargo, Doube 1991, sugiere que las preferencias de estos coleópteros por un determinado tipo de hábitat depende más de su respuesta a la intensidad de luz que penetra a través de la vegetación. Esto podría explicar los cambios encontrados este estudio en la segregación temporal entre áreas de bosque y pastizal, puesto que en este último se incrementa el número de especies heliófilas.
Así mismo, las diferencias detectadas en términos de la partición del recurso, indican la sensibilidad de las especies rodadoras a los cambios en la estructura del suelo, ocasionada por el apisonamiento que produce el ganado en zonas de pastoreo, compactándolo y modificando su capacidad de drenaje. Fincher (1973) y recientemente Sowig (1995, 1996), han demostrado las preferencias de varias especies de Scarabaeinae por determinados tipos de suelos y su contenido de humedad. Hay evidencias que en suelos pobremente drenados ocurre una alta mortalidad de adultos y larvas (Hanski y Cambefort 1991).
La estacionalidad de los insectos es generalmente controlada por tres factores: disponibilidad de recurso, temperatura y precipitación (Wolda 1988). Los resultados de este estudio muestran que la precipitación no es un factor importante para explicar los cambios en la abundancia de la fauna de escarabajos. Esto contrasta con lo encontrado en otras regiones tropicales en donde se registran marcados cambios en la riqueza, abundancia y composición de las comunidad de escarabajos coprófagos de acuerdo con los regímenes de lluvia (Janzen 1982, Breytenbanch y Breytenbanch 1986, Rougon y Rougon 1991, Escobar 1997).
Los picos de abundancia encontrados para las especies encontradas parecen alternarse a lo largo del año. Esta asincronía permite la coexistencia de las especies, disminuyendo la competencia (Hanski y Cambefort 1991). Aunque la disponibilidad de excremento no es estacional (Hanski 1989), para muchos mamíferos, los picos en la oferta de alimento, como frutos y otros invertebrados, pueden determinar variaciones en la composición y disponibilidad del excremento a lo largo del año (Estrada et al. 1993). Algunos trabajos sugieren cambios en las preferencias alimentarias y en los requerimientos nutricionales de las especies relacionados con la época reproductiva (Janzen 1982, Edwards 1991).
Los cambios en la fauna de mamíferos y sobre los recursos que componen su dieta, pueden tener implicaciones sobre la supervivencia y tamaño corporal de los escarabajos del estiércol, como lo indican Favila (1993) y Emlen (1997) para dos especies de Scarabaeinae en condiciones de laboratorio. Esto puede llegar a ser más importante, para aquellas especies que preferentemente explotan excretas de ciertos mamíferos, como es el caso de Sulcophanaeus velutinus que usa excremento de mono aullador y de varias de las especies de Uroxys encontradas en heces de oso de anteojo, dos de los mamíferos de tamaño grande más importantes en R. N. La Planada y su área de influencia.
Finalmente, los mecanismos y los procesos que explican las diferencias en la comunidad de coleópteros coprófagos en hábitats modificados no son necesariamente independientes, pueden ser aditivos y actuar de manera sinérgica (Hobbs y Huenneke 1992). Se requiere de investigaciones que estudien de manera integral el problema de la fragmentación de los paisajes y la reducción de los hábitats en bosque tropicales con el fin de entender los factores que modelan la diversidad.
Agradecimientos
A Cristián Samper y a Carla Restrepo por su apoyo y amenas discusiones en torno a los resultados de este trabajo. Agradecemos a Peter Feinsinger, Jorge Escobar y Fernando Zapata por su disposición a responder preguntas. A Gustavo Kattan, Gonzalo Halffter y Jorge Lobo por sus comentarios y sugerencias al manuscrito Para la identificación taxonómica de los especímenes se contó con la colaboración de Henry F. Howden. Este trabajo fue financiado por la R. N. La Planada, el programa de becas de Wildlife Conservation Society (WSC) y la Vicerrectoría de Investigaciones de la Universidad del Valle. La versión final de este trabajo se realizó gracias al apoyo del Subprograma XII. Diversidad Biológica del CYTED.
Resumen
Se realizó un monitoreo a lo largo de 1993 en tres tipos de hábitat en la zona de influencia de la Reserva Natural la Planada (Nariño - Colombia): bosque primario, bosque secundario y pastizal. Se capturó 9 115 individuos pertenecientes a 18 especies y a 11 géneros. Se capturó un mayor número de especies (F 2, 9 = 29.88; P < 0.001) e individuos (F 2, 9 = 36.22; P < 0.001) en bosque primario que en bosque secundario y pastizal. Igualmente, se encontraron diferencias en la riqueza y la abundancia de las especies entre sitios de muestreo en el interior de cada hábitat. Los análisis de agrupamiento muestran que la composición de especies varía entre los hábitats con cobertura boscosas y zonas abiertas. En el bosque primario y en el bosque secundario, la proporción de individuos de hábitos cavadores y rodadores fueron similares, con el predominio de especies de actividad nocturna, mientras que en pastizal, desaparecieron los rodadores y se incrementaron las especies con actividad diurna. No se encontró una relación entre la precipitación y la riqueza de especies (r2 = 0.26; P = 0.41), ni entre la precipitación y el número de individuos capturados a lo largo del año (r2 = 0.07; P = 0.84). Todas las especies disminuyen su abundancia durante el período más seco del año y el inicio de las lluvias.
Palabras clave: Scarabaeinae, Aphodiinae, gradiente de sucesión, heterogeneidad espacial, diversidad, conservación, Andes colombianos.
Referencias
Amat, G., A. Lopera & S. Amezquita. 1997. Patrones de distribución de escarabajos coprófagos (Coleoptera: Scarabaeidae) en un relicto del bosque altoandino, cordillera oriental de Colombia. Caldasia 19 (1-2): 191- 204. [ Links ]
Andrade, I. G. 1992. Biodiversidad y Conservación, p. 9 - 61. In G. I. Andrade, J. P. Ruíz & R. Goméz (eds.). Biodiversidad, conservación y uso de recursos naturales: Colombia en el contexto Internacional Cerec - Fescol, Editorial Presencia, Bogotá. [ Links ]
Breytenbach W. & G. J. Breytenbach. 1986. Seasonal patterns in dung feeding Scarabaeaidae in the southern Cape. J. Entomol. Soc. South Africa 49: 359 - 366. [ Links ]
Cavalier, J. 1991. El ciclo del agua en bosque montanos, p. 69 - 82. In C. H. Uribe (ed.). Bosques de niebla de Colombia. Editoral Cristina Uribe, Bogotá. 220 pp. [ Links ]
Doube, B. M. 1991. Dung beetles of southern Africa, p. 133 - 155. In I. Hanski & Y. Cambefort (eds.). Dung beetle ecology. Princeton University, New Jersey. [ Links ]
Edwards, P. B. 1991. Seasonal variation in the dung african grazing mammals and consecuences for coprophagous insects. Fun. Ecol. 5: 617 - 628. [ Links ]
Elliot, J. M. 1977. Some methods for the statistical analyses of samples of benthic invertebrates. Freshwater Biological Association. Scientific publication. 156 pp. [ Links ]
Emlen, D. 1997. Diet alters male horn allometry in the beetle Onthophagus acuminatus (Coleoptera: Scarabaeidae). Proc. R. Soc. Lond. B. 264: 567 - 574. [ Links ]
Escobar, F. 1994. Excremento, coprófagos y deforestación en bosques de montaña al sur occidente de Colombia. Tesis de Pregrado. Universidad del Valle, Cali, Colombia. [ Links ]
Escobar, F. 1997. Estudio de la comunidad de coleópteros coprófagos (Scarabaeidae) en un remanente de bosque seco al norte del Tolima, Colombia. Caldasia 19: 419 - 430. [ Links ]
Escobar, F. 2000. Diversidad de coleopteros coprófagos (Scarabaeidae: Scarabaeinae) en un mosaico de hábitats en la Reserva Natural Nukak, Guaviare, Colombia. Acta Zool. Mex. (n.s). 79: 103 - 121. [ Links ]
Escobar, F. & G. Halffter. 1999. Análisis de la biodiversidad a nivel de paisaje mediante el uso de grupos indicadores: el caso de los escarabajos del estiércol, p. 135 - 140. In Memorias da IV reunion Latino-Americana de Scarabaeoidologia. Vicosa - Brasil. 154 p. [ Links ]
Espinal, S. 1977. Zonas de vida y formaciones vegetales de Colombia. Instituto Geografico Augustin Codazzi, IGAC, Vol. XIII No. 11. Bogotá. 337 pp. [ Links ]
Estrada, A, G. Halffter, R. Coates - Estrada & D. A. Merrit Jr. 1993. Dung beetles attracted to mammalian herbivore (Allouatta palliata) and omnivore (Nasua narica) dung in the tropical rain forest of Los Tuxtlas, Mexico. J. Trop. Ecol. 9: 45 - 54. [ Links ]
Favila, M. E. 1988. Un método sencillo para marcar escarabajos. Fol. Entomol. Mex. 75: 117 - 118. [ Links ]
Favila, M. E. 1993. Some ecological factors affecting the life-style of Canthon cyanellus cyanellus (Coleoptera Scarabaeidae): an experimental approach. Ethol. Ecol. and Evol. 5: 319 - 328. [ Links ]
Favila, M. E. & G. Hallfter. 1997. The use of indicator groups for measuring biodiversity as related to community structure and function. Acta Zool. Méx. (n.s) 72: 1 -25. [ Links ]
Fincher, G. T. 1973. Nidification and reproduction of Phanaeus spp. in three textural classes of soil (Coleoptera: Scarabaeidae). Coleop. Bull. 27: 33- 37. [ Links ]
Forman, R. T.T. 1995. Land mosaics. Cambridge University, Cambridge. 632 pp. [ Links ]
Halffter, G. & E. G. Matthews. 1966. Natural history of dung beetles of the subfamily Scarabaeinae (Coleooptera: Scarabaeidae). Folia Entomol. Mex. 12 - 14: 1 - 132. [ Links ]
Halffter, G., M. E. Favila & V. Halffter. 1992. A comparative study of the structure of the scarab guild in Mexican tropicals rain forest and derived ecosystems. Fol. Entomol. Mex. 84: 131 - 156. [ Links ]
Halffter, G. & M. E. Favila. 1993. The Scarabaeinae (Insecta: Coleoptera) an animal group for analysing, inventorying and monitoring biodiversity in tropical rainforest and modified landscapes. Biol. Interna. No. 27. 21 pp. [ Links ]
Hanski, I. 1989. Dung beetles, p. 489 - 511. In H. Lieth & M. J. A. Werger. (eds.). Ecosystems of the World 14b - Tropical Rain Forest Ecosystems. Elsevier, Amsterdam. [ Links ]
Hanski, I. & Y. Cambefort. 1991. Resource partitioning. p. 331 - 349. In I. Hanski & Y. Cambefort (eds.). Dung beetles ecology. Princeton University, New Jersey. [ Links ]
Hobbs, R. J & L. F. Huenneke. 1992. Disturbance, diversity, and invasion: Implications for conservation. Cons. Biol. 6: 324 - 337. [ Links ]
Janzen, H. D. 1982. Seasonal changes in abundance of large nocturnal dung beetles (Scarabaeidae) in a Costa Rica deciduous forest and adjacent horse pastures. Oikos 33: 274 - 283. [ Links ]
Kattan, G. & H. Alvarez. 1996. Preservation and management of biodiversity in fragmented landscape in the colombian Andes, p. 3 - 18. In J. Schelhas & Greenberg (Eds.) Forest patches in tropical landscapes. Island Press. Washington D. C. 426 pp. [ Links ]
Klein, B. C. 1989. Effects of forest fragmentation on dung and carrion beetle communities in central Amazonia. Ecology 70: 1715 - 1725. [ Links ]
Lord, J. M. & D. A. Norton. 1990. Scale and the spacial concept of fragmentation. Cons. Biol. 4 (2): 197 - 202. [ Links ]
Nealis, V. G. 1977. Habitat associations and community analysis of south Texas dung beetles (Coleoptera: Scarabaeinae). Can. J. Zool. 5: 138 - 147. [ Links ]
Rougon D & C. Rougon. 1991. Dung beetles of the Sahel region, p. 230- 254. In I. Hanski & Y. Cambefort (eds.). Dung beetle ecology. Princeton University, New Jersey. [ Links ]
Saunders D. A., R. J. Hobbs & C. R. Margules. 1991. Biological consequences of ecosystem fragmentation: a review. Cons. Biol. 5: 18-32. [ Links ]
Sokal, R. R. & F. J. Rohlf. 1981. Biometry. Freeman, San Francisco, California. [ Links ]
Sowig, P. 1995. Habitat selection and offspring survival rate in three paracoprid dung beetles: influence of soil type and soil moisture. Ecography 18: 147-154. [ Links ]
Sowig, P. 1996. Brood care in the dung beetle Onthophagus vacca (Coleoptera: Scarabaeidae): the effect of soil moisture on time budget, nest structure, and reproductive success. Ecography 19: 254-258. [ Links ]
Stouffer, P. C & R. O. Bierregaard. 1995. Use of Amazonian forest fragments by understory insectivorous birds. Ecology 76: 2429-2445. [ Links ]
van der Hammen, T. 1995. Global change, biodiversity, and conservation of Neotropical montane forest, p. 603 - 607. In S. P.
Churchill et al. (eds). Biodiversity and conservation Neotropical montane forest. New York Botanical Garden. New York.
Weins A. J., N. Chr. Stenseth, B. van Horne y Ims. R. A. 1993. Ecological mechanisms and landscape ecology. Oikos 66: 369-380. [ Links ]
Wolda, H. 1988. Insect seasonality. Ann. Rev. Ecol. Syst. 19: 1-18. [ Links ]
Cuadro 1
Lista de especies de escarabajo del estiércol capturadas. R.N. La Planada, Nariño - Colombia
Table 1
Species of dung beetles collected. R. N. La Planada, Nariño - Colombia
| Especies | BP | BS | PA | Total | Act. | Tr. | Preferencias alimenticias |
| A.Scarabaeinae | |||||||
| Bdelyrus laplanadae | 1 | 1 | N | C | Ev,Fr, | ||
| Canthon aberrans | 6 | 6 | D | R | Ec,I**L*** | ||
| Deltochilum spinipes | 1591 | 724 | 9 | 2324 | N | R | Ev,Ec,Ca |
| D. mexicanum | 7 | 2 | 9 | N | R | Ca | |
| Dichotomius satanas | 371 | 77 | 7 | 455 | N | C | Ev,Ca |
| D.cf. quinquedens | 300 | 83 | 15 | 398 | N | C | Ev,Ca |
| Eurysternus marmoreus | 9 | 30 | 53 | 92 | N | E | Ev,Ec,Ca |
| E. foedus | 3 | 3 | D | E | Ev | ||
| Ontherus compressicornis | 619 | 180 | 54 | 853 | N | C | Ev,Ec,Ca |
| Onthophagus acuminatus | 5 | 24 | 29 | D | C | Ev | |
| Oxysternon conspicillatum | 3 | 3 | D | C | Ev,Ep | ||
| Sulcophanaeus velutinus | 767 | 278 | 1045 | D | C | Ev,Ec,Em,Eo,Ca | |
| Uroxys brachialis | 1720 | 143 | 4 | 1867 | N | C | Ev,Eo,Ca |
| U. depressifrons | 229 | 22 | 1 | 252 | N | C | Ev,Ca |
| U. cuprescens | 240 | 31 | 271 | N | C | ||
| U. nebulinus | 1234 | 105 | 2 | 1341 | N | C | Ev,Eo |
| U. sp. | 132 | 19 | 151 | N | C | ||
| B. Aphodiinae | |||||||
| Aphodius brasiliensis | 15 | 15 | D | E | Ev | ||
| Total | 7219 | 1700 | 196 | 9115 |
Cuadro 2
Número promedio de especies y de individuos capturados ± D. E en cada uno de los sitios seleccionados
para el muestreo en los tres tipos de hábitat
Table 2
Average number of species and individuals ± S. D. in each site and habitat
| Hábitat (sitio) | No. especies ± D.E | No. individuos ± D.E |
| Bosque primario | ||
| BP1 | 10.25a±0.20 | 421.75a±145.10 |
| BP2 | 10.50a±0.57 | 262.01b±54.40 |
| BP3 | 9.50ab±0.57 | 124.12c±33.01 |
| BP4 | 9.00b±1.43 | 92.50c±27.10 |
| Bosque secundario | ||
| BS1 | 10.00a±1.14 | 92.50a±24.80 |
| BS2 | 6.50b±1.14 | 44.25b±9.54 |
| BS3 | 6.90b±5.26 | 30.50b±19.25 |
| BS4 | 6.90b±0.70 | 45.37b±10.55 |
| Pastizal | ||
| PA1 | 4.00a±1.43 | 9.37a±1.92 |
| PA2 | 1.37b±1.70 | 2.62b±2.20 |
| PA3 | 3.25ab±3.36 | 5.75ab±4.33 |
| PA4 | 3.50ab±6.00 | 6.50ab±3.74 |
Average with equal letters are not statistically different (Tukey test) (n=8).
Cuadro 4
Número de individuos marcados durante los meses de febrero - junio de 1993 y su recaptura.
Table 4
Number of individuals marked between February and June of 1999, and recaptures
| Meses | |||||||||||
| F | M | A | M | J | J | A | S | O | N | D | |
| No. ind. marcados | 475 | 456 | |||||||||
| Tamaño muestra | --- | 528 | 479 | 480 | --- | 442 | 389 | 291 | 365 | 489 | 249 |
| Recaptura febrero1 | 3 | 2 | 1 | 1 | 1 | 2* | 2* | 0 | 0 | 0 | |
| Recaptura junio2 | 5 | 2 | 1 | 1 | 0 | 0 |
The marked individuals refer to species with size> 10 mm (Dichotomius satanas, Dichotomius cf. quinquedens, Sulcophanaeus velutinus, Ontherus compressicornis, Deltochilum spinipes, Deltochilum mexicanum y Eurysternus marmoreus).
1. Número de individuos recapturados a partir de los individuos marcados en febrero.
Number of individuals recaptured from marked individual on February.
2. Número de individuos recapturados a partir de los individuos marcados en junio.
Number of individuals recaptured from marked individual on June.
* Individuos capturados en sitios diferentes al sitio de marcaje.
*Individuals captured in different sites from marked place
1 Departamento de Biología, Universidad del Valle, Apartado Aéreo 25360 Cali, Valle-Colombia.
2. Programa de Inventarios de Biodiversidad. Instituto de Investigaciòn en Recursos Biológicos Alexander von Humboldt. Apartado Aéreo 8693 Bogotá, D.C.- Colombia.
3 Para correspondencia: Instituto de Ecología y Comportamiento Animal Km 2.5 antigua carretera a Coatepec. Apartado Postal 63 Xalapa 91000. Fax: 01(28)187809. Correo electrónico: escobarf@ecologia.edu.mx












 uBio
uBio