Services on Demand
Journal
Article
Indicators
-
 Cited by SciELO
Cited by SciELO -
 Access statistics
Access statistics
Related links
-
 Similars in
SciELO
Similars in
SciELO  uBio
uBio
Share
Revista de Biología Tropical
On-line version ISSN 0034-7744Print version ISSN 0034-7744
Rev. biol. trop vol.47 n.4 San José Dec. 1999
dominantes en el Delta del Río Magdalena, Colombia
Claudia Sánchez Ramírez and Mario Rueda1
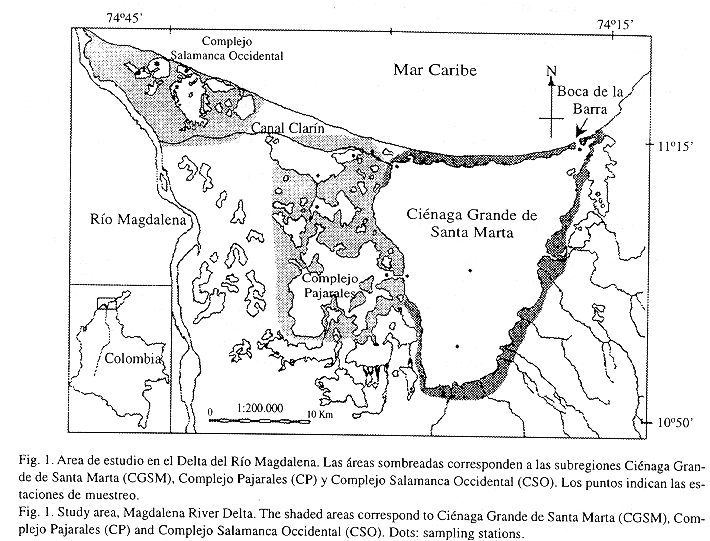
La CGSM (Fig. 1) es la laguna costera estuarina más grande de Colombia (450 km2). Está permanentemente comunicada con el Mar Caribe a través de la Boca de la Barra e indirectamente con el Río Magdalena a través de canales naturales y artificiales. Sus aguas poseen una profundidad promedio anual de 1.5 m y una temperatura de 30oC, en tanto la salinidad varía entre 9 y 33, de acuerdo con dos períodos climáticos mayores: uno seco durante el primer semestre del año y otro lluvioso en el segundo semestre, éstos están separados por dos períodos de transición. Es el área de mayor población e interés socioeconómico en el Delta, pues por décadas sus habitantes han dependido en forma directa de la pesca artesanal (Mancera y Botero 1993). Su grado de deterioro es medio, principalmente manifestado por la pérdida de cobertura de manglar vivo hacia adentro del bosque.
Materiales y Métodos
Mensualmente entre marzo de 1995 y febrero de 1996 se recolectaron peces en las tres subregiones de estudio CGSM, CP y CSO. En cada una de ellas se visitaron cinco estaciones (Fig. 1), en las cuales fue aplicado un esfuerzo estándar de 24 lances usando dos atarrayas de diferente tamaño de malla (3 cm y 6.3 cm) intentando reducir la selectividad del arte. En total se realizaron 120 lances por subregión/mes. Además, mensualmente se midió la salinidad del agua en cada estación para reconocer las épocas climáticas.
Los peces recolectados fueron identificados (Cervigón 1991, Cervigón et al. 1992, Cervigón 1993, 1994, Nelson 1994), contados, medidos y pesados. La abundancia fue calculada en términos absolutos y relativos, considerando el número total de individuos capturados y la captura por unidad de esfuerzo (g/lance) respectivamente. La diversidad se calculó con el índice (H´) de Shannon y Weaver (Clarke y Warwick 1994) el cual relaciona la riqueza y equitatividad.
Del total de especies recolectadas, se definieron aquellas dominantes de acuerdo con su abundancia numérica, amplia distribución y frecuencia de aparición (Yáñez-Arancibia et al. 1985). Las especies comunes en las tres subregiones fueron estudiadas para seguir su dinámica de aparición anual por medio del índice de abundancia estacional (Yáñez-Arancibia et al. 1988). Este índice se estimó obteniendo el promedio mensual de la abundancia por especie, dividido por la mayor abundancia mensual y multiplicando el cociente por cien.
Para las especies dominantes se determinó la relación longitud peso utilizando la relación:
P = aLb
donde P es el peso total (g), L es la longitud total (mm), el intercepto a es el factor de condición y la pendiente b es el coeficiente de alometría. Con el fin de determinar diferencias significativas entre las curvas de regresión de cada especie en las tres subregiones, se realizó una prueba de homogeneidad de pendientes. Para los casos en que hubo diferencias entre pendientes, fue aplicada la prueba de comparación múltiple de Tukey con el fin de determinar las pendientes diferentes entre sí (Zar 1996).
Resultados
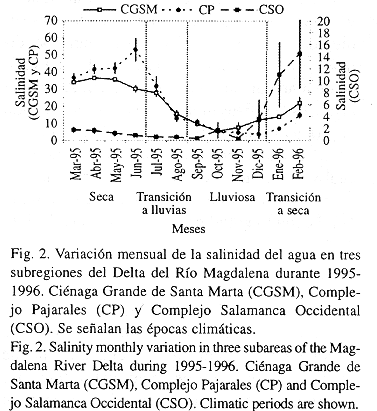
La variación mensual de la salinidad siguió un patrón de fluctuación similar en las tres subregiones de estudio (Fig. 2), este comportamiento fue más claro en CGSM y CP que en CSO donde ocurrió a menor escala debido a su permanente contacto con el Río Magdalena (Fig. 1). Durante la época seca (marzo a junio) las salinidades fueron altas debido al escaso régimen de lluvias y poco aporte de los ríos. A continuación el período de transición a lluvias (julio a agosto), fue definido cuando la variable empezó a descender producto de las primeras precipitaciones. La época lluviosa (septiembre a diciembre) se caracterizó por alcanzar los menores valores de salinidad, mientras en la temporada de transición al estiaje (enero a febrero) ésta volvió a subir y surgieron los vientos alisios.
Se recolectaron un total de 3 411 especímenes pertenecientes a 57 especies. Específicamente, en CGSM se colectaron 1 158 individuos (36 especies); en CP 1 410 individuos (24 especies) y en CSO 843 individuos (42 especies) (CUADRO 1). Solo 11 especies fueron comunes en las tres subregiones, cuatro entre CGSM y CP, 13 entre CGSM y CSO, y seis entre CP y CSO.
CUADRO 1
Especies ícticas recolectadas de 1995 a 1996 en el Delta del rí Magdalena, Colombia.
TABLE 1
Fish species collected from 1995 to 1996 in the Magdalena River Delta, Colombia
| CGSM | CP | CSO | CGSM | CP | CSO | CGSM | CP | CSO | CGSM | CP | CSO | |
| Anchovia clupeoides, E | | | | | | | | | | | | |
| Eugerres plumieri, E | | | | | | | | | | | | |
| Mugil incilis, E | | | | | | | | | | | | |
| Ariopsis bonillai, E | | | | | | | | | | | | |
| Elops saurus, CE | | | | | | | | | | | | |
| Sphoeroides testudineus, CE | | | | | | | | | | | | |
| Tarpon atlanticus, E | | | | | | | | | | | | |
| Poecillia cf. gilli, E | | | | | | | | | | | | |
| Triportheus magdalenae, D | | | | | | | | | | | | |
| Diapterus rombeus, CE | | | | | | | | | | | | |
| Pimelodus clarias, D | | | | | | | | | | | | |
| Cathorops, spixii, E | | | | | | | | | | | | |
| Achirus lineatus, E | | | | | | | | | | | | |
| Centropomus ensiferus, E | | | | | | | | | | | | |
| Oreochromis niloticus, D | | | | | | | | | | | | |
| Aequidens pulcher, D | | | | | | | | | | | | |
| Caquetaia kraussi, D | | | | | | | | | | | | |
| Citharychthys spilopterus, CE | | | | | | | | | | | | |
| Trinectes paulistanus, E | | | | | | | | | | | | |
| Prochilodus magdalenae, D | | | | | | | | | | | | |
| Oligoplites palometa, CE | | | | | | | | | | | | |
| Anchoa hepsetus, CE | | | | | | | | | | | | |
| Anchoa sp., CE | | | | | | | | | | | | |
| Centropomus undecimalis, E | | | | | | | | | | | | |
| Gerres cinereus, CE | | | | | | | | | | | | |
| Astyanax fasciatus, D | | | | | | | | | | | | |
| Roeboides dayi dayi, D | | | | | | | | | | | | |
| Ctenolucius hujeta, D | | | | | | | | | | | | |
| Micropogonias furnieri, CE | | | | | | | | | | | | |
| Arius proops, E | | | | | | | | | | | | |
| Bairdiella ronchus, CE | | | | | | | | | | | | |
| Opisthonema oglinum, CE | | | | | | | | | | | | |
| Leporinus muyscorum, D | | | | | | | | | | | | |
| Mugil curema, CE | | | | | | | | | | | | |
| Strongylura marina, E | | | | | | | | | | | | |
| Trichogaster pectoralis, D | | | | | | | | | | | | |
| Caranx hippos, CE | | | | | | | | | | | | |
| Curimata magdalenae, D | | | | | | | | | | | | |
| Diapterus auratus, CE | | | | | | | | | | | | |
| Eucinostomus melanopterus, CE | | | | | | | | | | | | |
| E. gula, CE | | | | | | | | | | | | |
| Gobiosoma spes, E | | | | | | | | | | | | |
| Lutjanus jocu, CE | | | | | | | | | | | | |
| Oligoplites saurus, E | | | | | | | | | | | | |
| Trachycorystes insignis, D | | | | | | | | | | | | |
| Anchoa parva, E | | | | | | | | | | | | |
| A. trinitatis, CE | | | | | | | | | | | | |
| Caranx latus, CE | | | | | | | | | | | | |
| Lutjanus synagris, CE | | | | | | | | | | | | |
| Menticirrhus americanus, CE | | | | | | | | | | | | |
| Mugil sp, CE | | | | | | | | | | | | |
| Pomadasys corvinaeformis, CE | | | | | | | | | | | | |
| Engraulidae sp., E | | | | | | | | | | | | |
| Mugil liza, CE | | | | | | | | | | | | |
| Curimata mivarti, D | | | | | | | | | | | | |
| Pseudopimelodus raninus, D | | | | | | | | | | | | |
| Stellifer venezuelae, CE | | | | | | | | | | | | |
CPUE= captura-por-unidad de esfuerzo. CGSM= Ciénaga Grande de Santa Marta, CP= Complejo de Pajarales, CSO= Complejo Salamanca Occidental. Hábitats: CE= Costero estuarino, E= estuarino, D= Dulceacuícola. X= dominante, *= no dominante, - = no hubo dato.
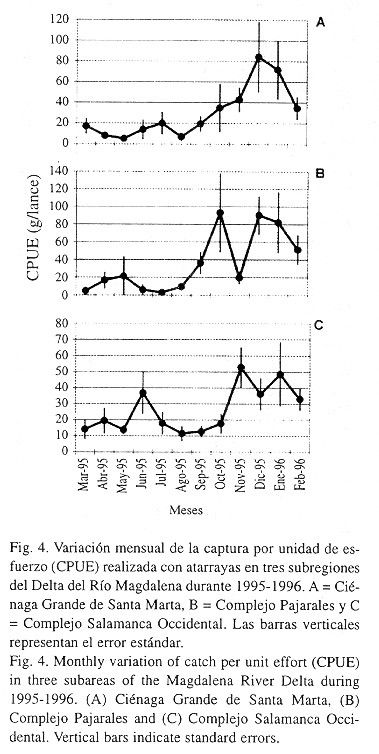
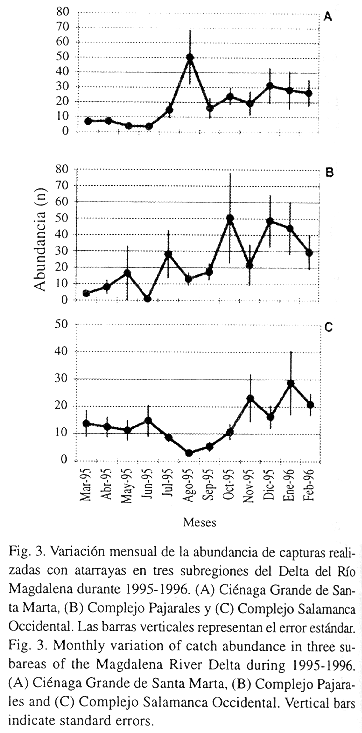
Considerando como índice de abundancia relativa la captura por unidad de esfuerzo (CPUE), se encontró que ésta aumentó uniformemente en la época lluviosa. Al comparar la captura mensual promedio entre las épocas seca y lluviosa, en CGSM ésta varió de 11 a 45 g/lance (Fig. 4A), en CP de 12 a 60 g/lance (Fig. 4B) y en CSO de 21 a 30 g/lance (Fig. 4C). De otra parte, durante meses como agosto en CGSM y julio en CP aunque la abundancia fue alta (Fig. 3A y 3B), la CPUE no lo fue (Fig. 4A y 4B).
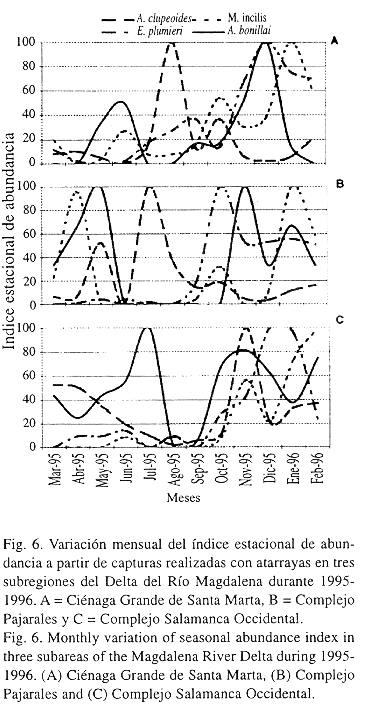
Se observó una variación mensual del índice estacional de abundancia en las especies dominantes (Fig. 6), estableciéndose patrones de distribución para cada especie en cada subregión. En todo el Delta, E. plumieri mostró a través del tiempo máximos de abundancia durante las épocas lluviosa y transición a seca. Así mismo, fue identificado un patrón espacial de desplazamiento del pico de abundancia entre CP y CGSM (Fig. 6B y 6A, respectivamente). M. incilis presentó varios máximos de abundancia a lo largo del año, sobresaliendo aquellos de la época transición a seca (Fig. 6). A. bonillai mostró un patrón bimodal en las tres subregiones (Fig. 6), el primero correspondiente a la época seca (mayo – junio, en CGSM y CP) y transición a lluvias (julio, en CSO), y el segundo a la época lluviosa (diciembre, en CGSM y noviembre, en CP y CSO). A. clupeoides presentó en CGSM y CP (Fig. 6A y 6B, respectivamente) un máximo de abundancia en la época de transición a lluvias (julio-agosto), mientras en CSO se observó en la época lluviosa (noviembre) (Fig. 6C).
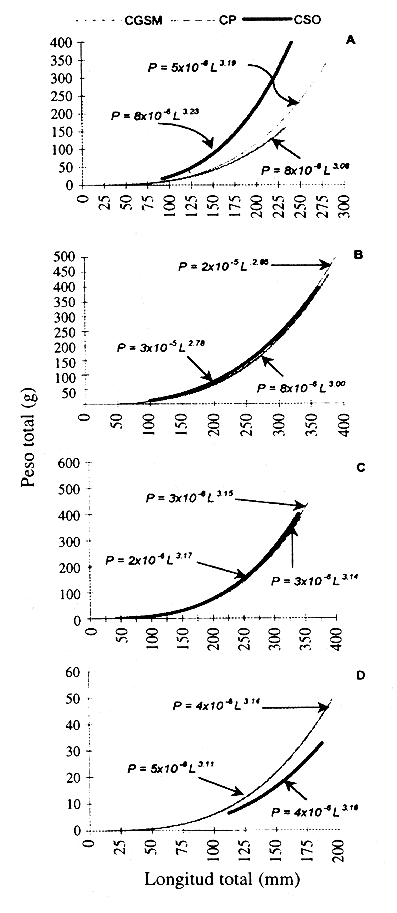
La Fig. 7 muestra las curvas de la relación longitud peso y sus expresiones explícitas para cada especie dominante en las diferentes subregiones de estudio. De acuerdo con la prueba de homogeneidad de pendientes, se determinó que para E. plumieri (Fig. 7A) los patrones de la relación longitud peso fueron diferentes entre subregiones (p<0.05); así mismo la prueba de Tukey definió que el mejor crecimiento en talla y peso ocurre en CSO (p<0.05). La Fig. 7B y 7C muestran que M. incilis y A. bonillai, no presentaron diferencias en la relación para las tres subregiones (p>0.05). Para A. clupeoides (Fig. 7D), se establecieron diferencias estadísticamente significativas entre las curvas (p<0.05), mientras la prueba de Tukey (p<0.05) permitió definir el menor estado de condición de la especie en CSO.
Fig 7. Lenght-weight relationship for four dominants fish species in three subareas of the Magdalena River Delta during 1995-1996. Ciénaga Grande de Santa Marta (CGSM), Complejo Pajarales (CP) and Complejo Salamanca Occidental (CSO). A = Eugerres plumieri = Mugil Incilis, C = Ariopsis bonillai y D = Anchovia clupeoides.
Discussion
Las variaciones anuales en la salinidad del Delta del Río Magdalena dependen del régimen de lluvias y la dinámica hidrológica de la región (Anónimo 1984). Estas favorecen los cambios en las agrupaciones de peces, apareciendo en forma alternada las especies mejor adaptadas a cada una de las condiciones dadas. Es conocido que en ambientes lagunares estuarinos, la salinidad es una de las variables que más afecta la distribución tanto espacial como temporal de las comunidades ícticas debido a las exigencias fisiológicas que establece para que pueda ser tolerada (Margalef 1983, Balogun 1987, Amadi 1990), y por ésto las agrupaciones de peces en el Delta tienen un patrón de variación anual.
Los géneros de las especies recolectadas en este trabajo son fieles representantes de la composición ictifaunística de estuarios tropicales, los cuales han sido agrupados según la profundidad de la columna de agua y la similaridad entre ellos responde al tipo de hábitat (Vieira y Musick, 1994). De acuerdo con las categorías de estadía (Santos-Martínez 1989), la mayoría de las especies encontradas fueron ocasionales (76% en CGSM, 43% en CP y 60% en CSO), ingresando de manera esporádica al ecosistema para cumplir con alguna de sus funciones vitales. Las especies residentes, es decir aquellas que se encuentran de manera permanente dentro de las subregiones cumpliendo con todo o gran parte de su ciclo de vida (16% en CGSM, 9% en CP y 12% en CSO), fueron las mismas dominantes, las cuales se caracterizan por tener amplios intervalos de tolerancia ecológica.
La heterogeneidad de las subregiones de estudio condicionó la presencia de especies de origen marino, dulceacuícola y estuarino en diversa proporción según la influencia del Mar Caribe y el Río Magdalena. Diversos complejos estuarinos en América Latina presentan estas características (Yáñez Arancibia et al. 1985, Aguiaro y Pellegrini 1995). Por otro lado, es sabido que la mayor parte de peces capturados dentro de estos ecosistemas son juveniles (Yáñez-Arancibia et al. 1988, Santos-Martínez 1989, Ramírez 1994), lo cual fue corroborado en este estudio, pues la proporción de juveniles en las capturas fue de 72% en CGSM, 67% en CP y 60% en CSO.
La tendencia al aumento de abundancia en la época lluviosa (Fig. 3), se debe a la existencia de condiciones favorables como la mayor disponibilidad de alimento, dada por el aumento en las descargas de los ríos que traen consigo material alóctono (Yáñez Arancibia et al. 1988, Harrison y Withfield 1995). Diferentes estudios realizados en la CGSM, también han reportado mayores abundancias durante la época lluviosa (Barrios 1981, Santos-Martínez 1989).
Un gran componente de la variabilidad temporal y espacial de la abundancia (medida en las barras error estándar) en las tres subregiones, se debe a eventos como: el predominio en las capturas de alguna especie (generalmente A. clupeoides), al comportamiento migratorio de algunas especies (como Mugil incilis) y a un fenómeno de mortandad masiva de peces causada por florecimiento de microalgas, que ocurrió en junio, lo que provocó bajas capturas en CGSM y CP (Mancera y Vidal 1995). La mayor variabilidad mostrada en la época lluviosa está asociada a las diversas y mayores capturas obtenidas entre estaciones de cada subregión, dada la distribución agregada del recurso (Rueda y Santos-Martínez com. per.).
Como respuesta a la mayor abundancia en la época lluviosa, la actividad de la flota pesquera artesanal es mayor, lo cual asigna a esta parte del año una reconocida importancia por la producción pesquera. Recientes reportes estadísticos de la pesquería, han confirmado esta observación a través de la medida del esfuerzo de pesca (Santos-Martínez 1998).
El hecho de que durante meses como agosto en CGSM y julio en CP la abundancia fue alta pero la CPUE no, puede deberse al aumento en las capturas de una especie pequeña como A. clupeoides, la cual no aporta mayor biomasa y su naturaleza pelágica usualmente suele afectar la capturabilidad del arte de pesca (Richards y Schnute 1986).
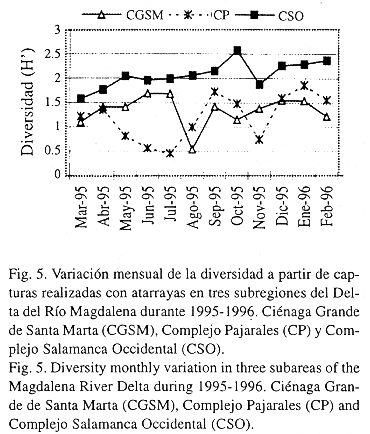
La mayor diversidad en CSO está asociada al contacto permanente de la subregión con el Río Magdalena y efímero con el mar. Además, el mejor estado de conservación del manglar y los cambios menos marcados de condiciones ambientales, hacen de este lugar un área propicia para la protección, crianza y alimentación de más especies de peces que en las otras subregiones, donde la presión ambiental, que genera mayor competencia y predación es mucho mayor. Aunque la diversidad no está directamente relacionada con la biomasa y la producción de peces (Haedrich & Hall 1976), se ha determinado que en lagunas costeras con bocas efímeras, la producción pesquera puede ser muy alta, en períodos cortos de tiempo (Yáñez-Arancibia et al. 1988).
A pesar de que en los sistemas lagunares estuarinos las agrupaciones de peces cambian de acuerdo a sus características (geomorfología, cobertura vegetal, comunicación con ambientes dulce y marinos, entre otros) y a los cambios temporales en las condiciones del hábitat, existen ciertas especies que permanecen y predominan en ellos durante todo o gran parte del ciclo de vida. En el presente estudio E. plumieri, M. incilis, A. bonillai y A. clupeoides identificadas como especies dominantes, controlaron la estructura de las comunidades influenciando cambios en la diversidad. Esto se debe a que poseen adaptaciones en su historia de vida (Blanco 1980, Galvis 1983, Santos-Martínez y Acero 1991, Arenas y Acero 1992, Caselles 1994), que les permiten optimizar sus ciclos dentro de éstos ecosistemas. Debido a la complejidad de estos ambientes una especie no puede considerarse dominante sólo por su preponderancia numérica, sino debe tenerse en cuenta además su abundancia en peso, distribución y frecuencia (Yáñez-Arancibia et al. 1988).
El comportamiento denominado programación estacional (Yáñez-Arancibia et al. 1988) se presenta debido a la utilización del medio por las especies de acuerdo a la disponibilidad de alimento, hábitats para reproducción, crianza y protección. Así las especies optimizan la utilización del medio ambiente estuarino.
El máximo de abundancia de E. plumieri en CGSM se presenta cuando esta especie encuentra condiciones ambientales favorables para su reclutamiento (Rueda y Santos-Martínez, en prep.) y su desplazamiento entre CP y CSO es debido al uso secuencial que hace del sistema estuarino.
Los cambios en la abundancia de M. incilis entre subregiones están relacionados con los patrones de migración de esta especie. De acuerdo con Blanco (1980) y Osorio (1988) en la época lluviosa M. incilis migra hacia el mar para desovar (octubre-noviembre) y regresa en época seca (enero-marzo), contribuyendo al máximo de reclutamiento hasta mayo, claramente observado en CP (Fig. 6B) y menos intenso y desplazado en CGSM y CSO (Fig. 6A y 6C, respectivamente).
El primer máximo de abundancia de A. bonillai en las tres subregiones está relacionado con el reclutamiento de la especie (Galvis 1983), el segundo máximo en época lluviosa corresponde a un mayor movimiento de la especie a áreas de alta salinidad en búsqueda de alimento (Callinectes spp.), haciéndola más vulnerable a la captura.
El máximo de abundancia de A. clupeoides en CGSM y CP estuvo conformado en su mayoría por individuos juveniles, lo que podría indicar un pico de reclutamiento. Este pulso prosigue a un periodo de maduración de marzo a mayo en las subregiones mencionadas (Caselles 1994). Por otro lado, en CSO el máximo de abundancia está desplazado hacia noviembre e igualmente parece corresponder a un período de reclutamiento; además durante esta época existe contacto directo con el mar por medio de bocas efímeras, lo que podría posibilitar la entrada de individuos de la especie a esta subregión.
En general, se puede establecer que las especies dominantes presentan un patrón temporal y espacial de dominancia alternado, lo que garantiza la disminución de la competencia interespecífica por espacio y alimento, garantizando de esta forma una mayor eficiencia en la utilización y transformación de materia y energía en estos ambientes. No obstante, se presentaron casos en que dos especies coincidieron en sus máximos de abundancia (A. bonillai y E. plumieri) (Fig. 6A), y A. clupeoides y A. bonillai (Fig. 6C), esto se debe a que las especies ocupan nichos tróficos diferentes y por tanto no llegan a competir. Mientras A. clupeoides es planctófaga (Caselles 1994) y ocupa los niveles superiores de la columna de agua, E. plumieri es omnívora y se encuentra de media agua hacia el fondo (Arenas y Acero 1992), así mismo A. bonillai es carnívora y se ubica en el bentos (Galvis 1983).
La relación longitud peso proporciona información sobre el estado fisiológico del pez y es un reflejo de las condiciones ecológicas del hábitat (Ricker 1975). Esta relación para E. plumieri demostró que a una talla determinada los individuos poseen mayor peso en CSO que en las otras dos subregiones. Esto expone la mejor condición alcanzada en CSO, consecuencia de las condiciones favorables del área y la eficiente utilización que hacen estas especies del hábitat. Por otra parte la menor condición obtenida en CP y CGSM puede ser resultado de perturbaciones tales como el deterioro ambiental y la mayor presión de pesca a que es sometida.
Las relaciones longitud peso de M. incilis y A. bonillai sugieren que en los tres ambientes existen los recursos específicos para cada una de ellas de acuerdo a la amplitud de su nicho, que favorecen tasas de crecimiento semejantes. En el caso de A. clupeoides la condición de esta especie es menor en CSO que en las otras dos subregiones, esto se debe a que la especie se encuentra mejor adaptada a salinidades altas como las encontradas en CGSM y CP (Caselles 1994).
De acuerdo con la geomorfología del Delta, los patrones de diversidad y abundancia encontrados, y la relación longitud peso determinada para las especies dominantes, se puede concluir que entre CGSM y CP existe movimiento libre de la población íctica realizando una similar utilización de los hábitats. Como CSO tiene comunicación limitada y sus características ambientales son menos similares, se establece que la movilización de las especies entre ésta y las otras dos subregiones es restringida y además se condiciona un uso diferente del hábitat.
Se concluye que a partir de las especies dominantes es posible conocer el tipo de relación existente entre una comunidad íctica multiespecífica y las caracteristicas del hábitat ocupado. En el Delta del Río Magdalena las especies Eugerres plumieri, Mugil incilis, Ariopsis bonillai y Anchovia clupeoides, han adaptado sus ciclos de vida a un patrón anual cambiante de salinidad para cumplir funciones de reproducción, crianza y alimentación. Los diferentes grados de deterioro ambiental entre subregiones corresponden a estados de la naturaleza de heterogeneidad espacial y perturbancia, los cuales estructuran la comunidad íctica y proporcionan una idea de la condición de estos sistemas. Esto constituye información trascendental para el manejo de sistemas estuarinos, en los cuales diversas investigaciones de este tipo han proporcionado un indicador de la salud del estuario (Whitfield 1996)
Agradecimientos
La comunidad íctica del Delta del Río Magdalena, Colombia fue estudiada con el fin de tener un conocimiento de su relación con los hábitats ocupados y generar así información complementaria para programas de evaluación y manejo de recursos pesqueros. Entre 1995 y 1996 se hicieron recolectas mensuales de peces usando atarrayas, en la Ciénaga Grande de Santa Marta (CGSM), el Complejo Pajarales (CP) y el Complejo Salamanca Occidental (CSO). 36 especies utilizan la CGSM, 24 el CP y 42 el CSO, siendo 11 especies comunes en las tres áreas. La abundancia y la captura por unidad de esfuerzo fueron mayores en época lluviosa, cuando la disponibilidad de alimento fue mayor. La diversidad varió a lo largo del período de estudio y fue mayor en CSO donde las condiciones ambientales fueron mejores. La geomorfología del Delta y las condiciones ambientales generan que las especies utilicen los hábitats en forma diferente. Se determinó que las especies dominantes han adaptado su ciclo de vida a un patrón anual de salinidad cambiante para cumplir funciones de reproducción, crianza y alimentación.
Botero, L. 1990. Massive mangrove mortality on the Caribbean coast of Colombia. Vid. Silv. Neotrop. 2: 77-78. [ Links ]
Botero, L. & M. Marshall. 1994. Biodiversity within the living, dying and dead mangrove forests of the Ciénaga Grande de Santa Marta. Mote Marine Laboratory Technical Report Number 366. [ Links ]
Botero, L. & J. E. Mancera. 1996. Síntesis de los cambios de origen antrópico ocurridos en los últimos 40 años en la Ciénaga Grande de Santa Marta (Colombia). Rev. Acad. Colomb. Cienc. 78: 465-474. [ Links ]
Campos, N.H. 1992. Descarga de metales pesados en la Ciénaga Grande de Santa Marta, Caribe colombiano, con el material suspendido. Rev. Cont. Amb. 23: 11-31. [ Links ]
Caselles, A.O. 1994. Aspectos biológicos de algunas especies de Engraulididae (Pisces: Clupeiformes) existentes en la Ciénaga Grande de Santa Marta y Ciénaga de Pajaral, Caribe colombiano. Tesis de Maestría, Universidad Nacional de Colombia, Bogotá, Colombia. [ Links ]
Cervigón, F. 1991. Los peces marinos de Venezuela. Volumen 1. Fund. Cient. Los Roques, Caracas. 425p. [ Links ]
Cervigón, F. 1993. Los peces marinos de Venezuela. Volumen 2. Fund. Cient. Los Roques, Caracas. 497p. [ Links ]
Cervigón, F. 1994. Los peces marinos de Venezuela. Volumen 3. Fund. Cient. Los Roques, Caracas. 295p. [ Links ]
Cervigón, F., R. Cipriani, W. Fischer, L. Garibaldi, M. Hendrickx, A.J. Lemus, R. Márquez, J.M. Poutiers, G. Robaina & B. Rodríguez., 1992. Fichas FAO de identificación de especies para los fines de la pesca. Guía de campo de las especies comerciales marinas y de aguas salobres de la costa septentrional de Sur América. Roma, FAO. 513p. [ Links ]
Clarke, K.R. & R.M. Warwick. 1994. Change in marine communities: An approach to statistical analysis and interpretation. Plymouth Marine Laboratory, UK. 144p. [ Links ]
Christensen, J.D., M.E. Monaco & T.A. Lowery. 1997. An index to assess the sensitivity of Gulf of Mexico species to changes in estuarine salinity regimes. Gulf. Res. Rep. 9:219-229. [ Links ]
Espinosa, L.F., G. Ramírez & N.H. Campos. 1995. Análisis de residuos organoclorados en los sedimentos de zonas de manglar en la Ciénaga Grande de Santa Marta y la Bahía de Chengue, Caribe colombiano. An. Inst. Inv. Mar. Punta de Betín 24: 79-94. [ Links ]
Galvis, O.C. 1983. Los áridos de la Ciénaga Grande de Santa Marta. Tesis de Maestría, Universidad Nacional de Colombia, Santafé de Bogotá, Colombia. [ Links ]
Haedrich, R.L. & C.A. Hall. 1976. Fishes and estuaries. Oceanus 19:55-63. [ Links ]
Harrison, T. & A. Whitfield. 1995. Fish community structure in three temporarily open/closed estuaries on the Natal coast. Ichthyol. Bull. J. L. B. Smith Institute of Ichthyology. Grahamstown, South Africa. 80p. [ Links ]
Mancera, J.E. & L. Botero. 1993 (eds). Estudio ecológico de la Ciénaga Grande de Santa Marta, Delta exterior del Río Magdalena. Informe de Proyecto Tercera Etapa. INVEMAR, Santa Marta, Colombia. 128p. [ Links ]
Mancera, J.E. & L.A. Vidal. 1994. Florecimiento de microalgas relacionado con mortandad masiva de peces en el complejo lagunar Ciénaga Grande de Santa Marta, Caribe colombiano. An. Inst. Inv. Mar. Punta de Betín 23: 103-117. [ Links ]
Mancera, J.E. & L.A. Vidal. 1995. Informe sobre fenómenos recurrentes de mortandades de peces en el complejo lagunar Ciénaga Grande de Santa Marta. INVEMAR, Santa Marta, Colombia. 15p. [ Links ]
Margalef, R. 1983. Limnología. Ed. Omega S. A., Barcelona. 1010p. [ Links ]
Nelson, J.S. 1994. Fishes of the World. Nueva York. 600p. [ Links ]
Osorio, D. 1988. Ecología trófica de Mugil curema, M. incilis y M. liza (Pisces: Mugilidae) en la Ciénaga Grande de Santa Marta, Caribe colombiano. An. Inst. Inv. Mar. Punta de Betín 18: 113-126. [ Links ]
Plata, J., N.H. Campos & G. Ramírez. 1993. Flujo de compuestos organoclorados en las cadenas tróficas de la Ciénaga Grande de Santa Marta. Caldasia 17: 199-204. [ Links ]
Ramírez, P. 1994. Estructura de las comunidades de peces de la Laguna de raya, Isla de Margarita, Venezuela. Cienc. Mar. 20:1-16. [ Links ]
Reid, G. & R. Wood. 1976. Ecology of inland waters and estuaries. Van Nostrand, Nueva York. 485p. [ Links ]
Richards, L.& J. Schnute. 1986. An experimental and statistical approach to question: is CPUE an index of abundance? Can. J. Fish. Aquat. Sci. 43:1214-1227. [ Links ]
Ricker, W. E. 1975. Computation and interpretation of biological statistics of fish populations. Department of Environment Fisheries and Marine Service. Bull. Fish. Res. 191: 382p. [ Links ]
Sánchez, C. 1996. Variación espacial y temporal de la ictiofauna de Ciénaga Grande de Santa Marta, Complejo de Pajarales y ciénagas del costado occidental de la Isla de Salamanca, Caribe colombiano. Tesis de Biología. Universidad Nacional de Colombia, Santafé de Bogotá, Colombia. [ Links ]
Santos-Martínez, A. 1989. Estudio biológico y ecológico de la ictiofauna de la Ciénaga Grande de Santa Marta, Caribe colombiano. Tesis de Maestría, Universidad Nacional de Colombia, Santafé de Bogotá, Colombia. [ Links ]
Santos-Martínez, A. 1998. Informe Proyecto Evaluación de los Principales Recursos Pesqueros de la Ciénaga Grande de Santa Marta, Costa Caribe colombiana. INVEMAR-COLCIENCIAS, Santa Marta, Colombia. 250p. [ Links ]
Santos-Martínez, A. & A. Acero. 1991. Fish community of the Ciénaga Grande de Santa Marta (Colombia), composition and zoogeography. Icthyol. Explor. Freshwaters 2: 247-263. [ Links ]
Schluter, D. & R.E. Ricklefs. 1993. Species diversity in ecological communities: historical and geographical perspectives. University of Chicago, Chicago. 19p. [ Links ]
Vieira, J.P. & J.A. Musick. 1994. Fish faunal composition in warm-temperate and tropical estuaries of western Atlantic. Atlantica 16:31-53. [ Links ]
Whitfield, A. K. 1996. Fishes and the environmental status of South African estuaries. Fish. Manage. Ecol. 3:45-57. [ Links ]
Yáñez-Arancibia, A. 1986. Ecología de la zona costera. Análisis de siete tópicos. AGT, México. 189p. [ Links ]
Yáñez-Arancibia, A. & R. Nugent. 1977. El papel ecológico de los peces en estuarios y lagunas costeras. An. Centro Cien. Mar Limnol. Univ. Nal. Auton. México, 4: 107-117. [ Links ]
Yáñez-Arancibia, A., A. L. Lara-Dominguez, A. Aguirre-León, S. Díaz Ruiz, F. Amezcua-Linares, D. Florez-Hernández & P. Chavance. 1985. Ecología de poblaciones de peces dominantes en estuarios tropicales: factores ambientales que regulan las estrategias biológicas y la producción. p.311-366. In: A. Yáñez-Arancibia (ed.) Fish community ecology in estuaries and coastal lagoons: Towards an ecosystem integration. UNAM, Mexico, D.F. 654p. [ Links ]
Yáñez-Arancibia, A., A. L. Lara-Dominguez, J.L. Rojas-Galviz, P. Sánchez-Gil, J.W. Day & C.J. Madden. 1988. Seasonal biomass and diversity of estuarine fishes coupled with tropical habitat heterogenety (southern Gulf of Mexico). J. Fish Biol. 33: 191-200. [ Links ]
Yañez-Arancibia, A, A.L. Lara & D. Pauly. 1994. Coastal lagoons as fish habitats, p. 363-376. In B. Kjerfve (ed.). Coastal lagoons processes. Elsevier, Amsterdam, 577 p. [ Links ]
Zar, J.H. 1996. Biostatistical analysys. Prentice Hall. Nueva Jersey. 121 p.