Services on Demand
Journal
Article
Indicators
-
 Cited by SciELO
Cited by SciELO -
 Access statistics
Access statistics
Related links
-
 Similars in
SciELO
Similars in
SciELO  uBio
uBio
Share
Revista de Biología Tropical
On-line version ISSN 0034-7744Print version ISSN 0034-7744
Rev. biol. trop vol.47 n.4 San José Dec. 1999
Eugenia López- López y José Angel Serna-Hernández 1
Abstract
The plankton communities and environmental factors of the Ignacio Allende reservoir were surveyed from July 1990 to June 1991. A total of 57 phytoplankton species were identified. There was a blue green algae bloom in the summer, simultaneously with highest water levels, followed by the dominance of diatoms in the coldest months (February and March). Chlorophyceans became dominant in the spring, consonant with highest temperature records. Bacillariophyceans and cyanophyceans had the greater species richness, while dinophyceans and euglenophyceans had the lowest values. The summer bloom of Anabaena variabilis and the abundance of Ceratium hirundinella, Aulacosseira granulata and Fragilaria crotonensis are associated with tropical eutrophic waters. The zooplankton was composed by 39 species, from these, Diaphanosoma birgei, Bosmina longirostris, Daphnia parvula, Diaptomus (Mastigodiaptomus) montezumae, Acanthocyclops vernalis, Keratella cochlearis, Polyarthra vulgaris and Asplanchna priodonta occurred throughout the annual cycle. A canonical correspondence analysis showed a succesional pattern associated to several environmental processes. The lowest species richness occurred during the dry season, in the coldest months. In the wet season, species richness increased and population densities decreased, consonant with the blue-green algae bloom, the highest values of suspended solids and the highest water levels in the reservoir.
Key words
Seasonality, phytoplankton, zooplankton, reservoir, tropical, México.
México cuenta con un escaso número de lagos naturales, sin embargo, de acuerdo con los datos del Plan Nacional Hidráulico (Athié 1987), el país posee aproximadamente 1 264 embalses artificiales con una capacidad mayor a 5x105 m3. Al igual que los lagos naturales, éstos están sometidos a un progresivo enriquecimiento de nutrientes, que conduce a la eutroficación, a la proliferación de algas indeseables que confieren al agua propiedades organolépticas desagradables y en casos extremos, traen consigo toxicidad y mortandades masivas de peces (Haynes 1988, Margalef 1983).
En los embalses artificiales, la eutroficación y azolve se presentan con rapidez, por los multiples usos a que son sometidos y al manejo inadecuado, de manera que su tiempo de vida útil varía de 10 a 100 años. Por lo anterior, un primer nivel en el manejo adecuado de un embalse, es el diagnóstico de las condiciones de calidad del agua y sus comunidades.
Entre las comunidades acuáticas, los organismos del plancton se han utilizado como indicadores de las condiciones que prevalecen en los cuerpos de agua (Kalff y Knoechel 1978, Haynes 1988, Klemer y Konopka 1989, Rosas et al. 1992). Sin embargo, para emplearlos con certeza, en particular en nuestras latitudes, se deben conocer sus respuestas ante cambios estacionales. De esta forma será posible predecir en qué momentos y bajo qué condiciones el sistema se encuentra con mayor susceptibilidad de presentar una proliferación de especies no deseables; así se podrán reconocer las especies que solo se presentan estacionalmente y las que prevalecen resultado de su mayor tolerancia.
En latitudes tropicales, donde la luz y la temperatura son relativamente constantes, las variaciones estacionales del plancton dependen del efecto de las lluvias, la sequía e incluso de la mezcla. Las fluctuaciones de la biomasa planctónica suelen ser de amplitud mayor en lagos tropicales, que en los templados, el inicio de la temporada de lluvias define el máximo crecimiento, cuya significancia depende del aporte de nutrientes de la cuenca de drenaje (Harris 1980).
En su mayoría, los elementos del zooplancton dependen del fitoplancton para su alimentación, sin embargo, algunas especies se alimentan de materia coloidal, material suspendido y en menor grado de sustancias en solución. Además, en lagos muy turbios, la depredación de los peces sobre el zooplancton puede ser no selectiva, lo que permite la persistencia de especies de gran tamaño, así como la permanencia de las pequeñas (Geddes 1984).
En este estudio se analiza la variación estacional del zooplancton del embalse Ignacio Allende y de la calidad del agua del sistema. Se identifica la respuesta en composición y abundancia del zooplancton ante las fluctuaciones ambientales y su relación con la sucesión fitoplanctónica y los eventos de proliferación de algas.
Materiales y Métodos
El embalse Ignacio Allende se ubica en el Río de la Laja, en la Cuenca del Río Lerma, su represa se localiza a 1 834 msnm, a 12 km al suroeste de San Miguel de Allende (Fig. 1), su capacidad de almacenamiento es de 251 millones de metros cúbicos. Fue construido en 1968 para controlar las avenidas y en la actualidad tiene múltiples usos, como son: irrigación, consumo doméstico, pesquerías, acuacultura extensiva y recreación. La represa cuenta con dos compuertas de hizaje, una válvula de desazolve y vertederos de excedencias, que desfogan agua epilimnética durante la época de lluvias.
El embalse fue estudiado en su dinámica ambiental en el mismo ciclo anual que corresponde a nuestro estudio (julio de 1990 a junio de 1991) por López-López y Soto-Galera (1993), quienes mencionan que la cota de nivel de agua alcanzó 1 830 msnm durante las lluvias ydecayó a 1 822 msnm en la sequía. El embalse presentó estratificación térmica, de marzo a agosto, la circulación ocurrió de agosto a febrero. El oxígeno disuelto mostró un agotamiento hipolimnético en la estratificación, con anoxia hipolimnética en agosto. Los más altos valores de turbiedad y sólidos suspendidos ocurrieron de agosto a octubre, durante las lluvias, que coincidió con los menores valores de transparencia. Las mayores concentraciones de dureza por calcio (CaCO3), se presentaron en la época de menor nivel de agua en el embalse (febrero a julio) y en general, la concentración fue mayor en el fondo que en superficie. El pH fue menor en el fondo que en superficie y con la circulaciónaumentó gradualmente en ambos niveles. El nitrógeno fue el elemento limitante la mayor parte del año.
El clima del área es seco, semicálido extremoso con régimen de lluvias en verano, la mayor pluviosidad es de junio a septiembre (110 a 250 mm), la precipitación media anual es de 48 mm y la temperatura media anual es de 18 a 22°C. La vegetación aledaña al embalse consiste en matorral crasicaule con elementos arbustivos espinosos e inermes (Rzedowski 1978).
Se realizaron recolectas mensuales durante un ciclo anual, a partir de julio de 1990. Las muestras se tomaron en la superficie de tres sitios (Fig. 1), estación norte (E-N), estación centro (E-C) y estación sur (E-S), en los que se registró la temperatura, el oxígeno disuelto, el pH, la transparencia, la cota de nivel y se tomaron muestras de agua para la determinación de N-NO3, P-PO4, dureza, sulfatos, turbiedad y sólidos suspendidos, según las técnicas del espectrofotómetro Hach (Anónimo 1976).
En cada estación se realizaron arrastres superficiales durante tres minutos con una red de planctontipo Wisconsin, con luz de malla de 64 µm, equipada con un flujómetro de aletas de diseño General Oceanic. Los arrastres se fijaron con formaldehido al 4%. La identificación del fitoplancton se realizó siguiendo los criterios de Tiffany y Britton (1952) y Prescott (1962),para el zooplancton se consultaron a Pennak (1978), Dodson y Frey (1991), Wallace y Snell (1991) y Williamson (1991).
El fitoplancton se cuantificó de muestras de agua de 2 l, recolectadas del epilimnion de cada sitio de estudio, siguiendo las técnicas de Utermöhl (Lund et al. 1958). El zooplancton se cuantificó de los arrastres de cada sitio, se tomaron tres réplicas de 1 ml, la cuantificación se realizó en la cámara de Sedgwick-Rafter según la técnica descrita por Infante (1988) y Wetzel y Likens (1979).
Para jerarquizar la dominancia de las especies se construyó el diagrama de Olmstead-Tuckey (Sokal y Rohlf 1981) para la comunidad fitoplanctónica y para la zooplanctónica. Las especies dominantes, constantes, ocasionales y raras se determinaron a partir de la relación entre las densidades de los organismos y sus frecuencias de aparición. El criterio de discriminación se basa en la media de la frecuencia de aparición relativa para el eje de las "X" y de la media respectiva del logaritmo natural de la sumatoria de la densidad absoluta para el eje de las "Y", de tal forma que al trazar ambas se perfilan cuatro cuadrantes. Las especies dominantes, son aquellas que presentan la densidad y la frecuencia mayor a ambas medias. Las constantes presentan densidades menores a la media y la frecuencia mayor a la media. Las ocasionales son las que presentan densidad mayor a la media y frecuencia menor a la media. Las raras presentan densidades y frecuencias menores a ambas medias.
Los datos de densidad del zooplancton se resumieron en matrices de abundancia de especies por sitios. Así también, se elaboró una matriz de los factores ambientales por sitio de estudio, a la que se incluyó la densidad total del fitoplancton. Se aplicó el análisis canónico de correspondencias (ACC) con datos transformados, empleando el paquete ANACOM (De la Cruz 1991). El ACC es un método de ordenación directa que requiere de dos tipos de observaciones, por ejemplo datos de densidad poblacional por sitio y datos de factores ambientales por sitio (Pielou 1977). Este enfoque de usar datos de especies y variables ambientales en el proceso de ordenación es conocido como una forma de análisis canónico, de tal manera que el diagrama de ordenación resultante expresa no solamente patrones de variación en composición de especies, sino también muestra las relaciones principales entre las especies y cada una de las variables ambientales (Kent y Coker 1992).
Resultados
Características físico-químicas de los sitios de estudio: Los altos valores de turbiedad y sólidos suspendidos (Cuadro 1), característicos de aguas con gran opacidad, sugieren que el embalse posee gran cantidad de material, de tamaño coloidal y partículas mayores, que limitan la penetración de luz en la columna de agua. Estas condiciones se reflejan en la transparencia, con valores menores a 15 cm, por lo que la columna de agua cuenta con una capa trofogénica sumamente limitada.
De acuerdo con los valores de durezay por la naturaleza calcárea de la cuenca de captación, el embalse presenta aguas moderadamente duras, con un incremento en la concentración de carbonatos en el período de estratificación. Los valores de pH presentan una ligera acidificación al final de la estratificación e inicio de la circulación y valores tendientes a la alcalinidad en la estratificación. Los sulfatos muestran un incremento durante la estratificación y un decremento en la circulación. Los nitratos tienden a incrementarse durante la estación lluviosa y decaen hasta su agotamiento en la sequía. Los fosfatos presentan una dinámica con aporte durante las lluvias y el invierno y un agotamiento en la sequía.
Los valores de la temperatura superficial muestran que el periodo cálido corresponde al momento de la estratificación y las menores temperaturas al final de la circulación. El oxígeno disuelto muestra los valores más bajos al iniciar la circulación.
Valores promedio mensuales de las características físico-químicas registradas en el embalse Ignacio Allende, durante los periodos de circulación (agosto a febrero) y estratificación (marzo a julio)
TABLE 1
Monthly mean values of physical and chemical factors recorded in Ignacio Allende resevoir, during overturn (August through february) and stratification (March through July) periods
| Meses | Sólidos suspendidos (mg/l) | Turbiedad (UFT) | Transparencia (cm) | Dureza (mg/l) | PH | Sulfatos (mg/l) | Nitratos (mg/l) | Fosfatos (mg/l) | Temperatura | Oxígeno Disuelto (mg/l) |
| A | 259.5 | 352.3 | 13 | 64 | 6.5 | 0.6 | 1.7 | 0.6 | 18.9 | 5 |
| S | 133.3 | 202.5 | 13.3 | 55.3 | 6.6 | 0.7 | 8.8 | 0.7 | 20. | 5.7 |
| O | 122.5 | 203.8 | 6.1 | 59.3 | 6.7 | 0.3 | 23.7 | 0.3 | 18.6 | 5.3 |
| N | 35.6 | 144.5 | 8.0 | 63 | 7.1 | 0.7 | 4.6 | 0.7 | 15 | 6.2 |
| D | 32.1 | 158.3 | 6.7 | 61.1 | 7.06 | 0.4 | 0 | 0.4 | 11.7 | 7.2 |
| E | 12 | 125 | 8.0 | 59 | 7.2 | 0.9 | 0 | 0.9 | 14.6 | 11.9 |
| F | 81.3 | 138 | 12.6 | 70 | 7 | 0.7 | 0 | 0.7 | 13.8 | 7.3 |
| Promedio Circulación | 96.6 | 189.2 | 8.0 | 61.6 | 6.9 | 0.6 | 5.58 | 0.6 | 16.1 | 6.9 |
| M | 0.33 | 140 | 11.3 | 67.8 | 8.1 | 0.8 | 0 | 0.8 | 15.5 | 7.3 |
| A | 19 | 100.8 | 12.8 | 76.3 | 7.2 | 0.4 | 0 | 0.4 | 20.5 | 7.1 |
| My | 23.8 | 105 | 17.3 | 80 | 7.33 | 1.0 | 0.5 | 1.0 | 21.5 | 8.0 |
| Jn | 34.1 | 119.1 | 15.8 | 84.5 | 7.03 | 0.9 | 0 | 0.9 | 22 | 7.0 |
| J | 89.3 | 128 | 6.7 | 84.5 | 6.5 | 1.1 | 15.7 | 1.1 | 20.0 | 6.4 |
| Promedio Estratificación | 33.3 | 118.5 | 12.8 | 78.6 | 7.2 | 0.88 | 3.2 | 0.8 | 19.9 | 7.1 |
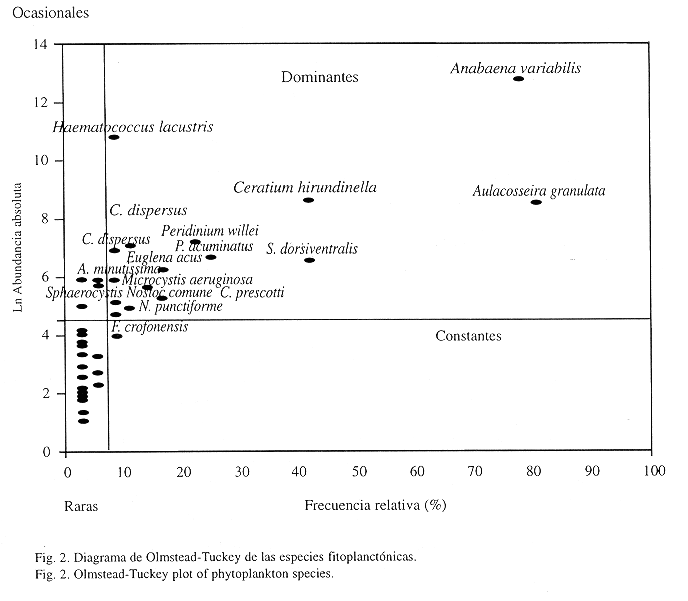
Comunidad fitoplanctónica:Se determinaron 56 especies, que incluyen 22 Bacillariophyceae, 10 Chlorophyceae, 19 Cyanophyceae, tres Euglenophyceae y dos Dinophyceae (Cuadro 2). El diagrama de Olmstead-Tukey (Fig. 2), muestra 15 especies que por su alta frecuencia y gran densidad son dominantes. En esta asociación se encuentran cinco cianofíceas, Anabaena variabilis, Microcystis aeruginosa, Nostoc comune, N. punctiforme y Chroococcus dispersus, las dos primeras se han registrado como especies con alto potencial de toxicidad (Haynes 1988). Se registran también cinco bacilariofíceas, Aulacosseira granulata destaca por su gran densidad. En el mismo grupo se encuentrandos dinoflagelados, de los que Ceratium hirundinella es el más abundante y frecuente, solo una clorofícea, Haematococcus lacustris y dos euglenofíceas Phacus acuminatus y Euglena acus.
Fragilaria crotonensis, una diatomea con alta frecuencia de aparición en las muestras pero con bajas densidades fue la única especie que se clasificó como constante. Las especies raras son 31, la mayoría de ellas diatomeas de los géneros Synedra y Navicula. El grupo de las especies ocasionales está compuesto por 10 especies, un gran número de ellas representantes de las diatomeas.
CUADRO 2
Elenco sistemático de la comunidad de fitoplancton en el embalse Ignacio Allende
TABLE 2
Composition of phytoplankton community in Ignacio Allende reservoir
| Bacillaryophyceae | Chlorophyceae | Nostoc comune D |
| Achnanthes exilis R | Botryococcus brauni R | Nostoc punctiforme D |
| Achnanthes lanceolata R | Coleochaete orbicularis O | Oscillatoria tenuissima O |
| Achanantes minutissima O | Haematococcus lacustris D | Spirulina princeps R |
| Aulacosseira granulata D | Microspora loefgreni R | Dynophyceae |
| Caloneis bacillum R | Mougeotia scalaris R | Ceratium hirundinella D |
| Caloneis silicula O | Pediastrum boryanum R | Peridinium willei D |
| Caloneis affinis R | Pediastrum integrum R | |
| Fragilaria capuccina R | Pediastrum simplex R | |
| Fragilaria crotonensis C | Staurastrum gracile R | |
| Gomphonema dichotomum R | Trentepohlia aurea O | |
| Gomphonema olivaceum R | Cyanophyceae | |
| Hantzchya amphyoxis R | Sphaerocystis schroeteri O | |
| Navicula dicephala R | Ulothrix subtilissima R | |
| Navicula radiosa R | Anabaena variabilis D | |
| Nitzchia dissipata R | Chroococcus dispersus D | |
| Nitzchia linearis R | Chroococcus limneticus D | |
| Nitzchia palea O | Chroococcus minutus R | |
| Opephora sp. R | Chroococcus prescotti D | |
| Synedra acus R | Coelosphaerium dubium R | |
| Synedra dorsiventralis D | Coelosphaerium pallidum R | |
| Synedra pulchella R | Cylindrospermum minimum O | |
| Synedra ulna R | Glaucocystis oocystiformis R | |
| Euglenophyceae | Gomphosphaeria aponina R | |
| Euglena acus D | Merismopedia glauca R | |
| Phacus acuminatus O | Merismopedia trolleri R | |
| Phacus spyrogyra O | Microcystis aeruginosa D |
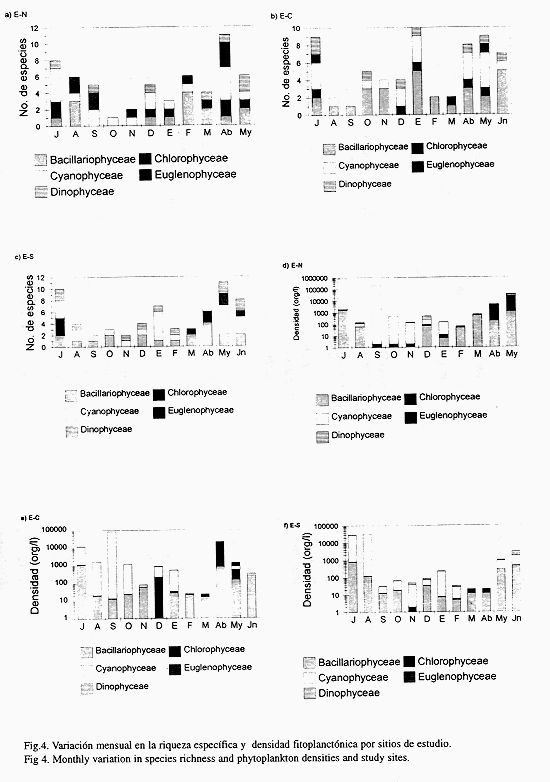
En los tres sitios de estudio las bacilariofíceas y las cianofíceas contribuyen con la mayor riqueza específica, mientras que las clorofíceas, dinofíceas y euglenofíceas adquieren importancia solo durante la primavera y el verano. En las tres estaciones existe un patrón con altos valores de riqueza específica durante el período cálido, de abril a julio, con otro pico en diciembre y/o enero y la menor riqueza específica entre ambos períodos (Figs. 3a, b y c).
Las densidades totales fluctuaron en forma drástica (Figs. 3d, e y f), se detectaron los más bajos valores de octubre a marzo (abril en la E-S),mientras que los máximos valores fueron de mayo a julio (septiembre en la E-C). Las euglenofíceas fueron las más escasas, las cianofíceas alcanzaron las mayores densidades en especial en septiembre en la E-N, con un valor máximo de hasta 200 810 org/l. Se presentó un largo período con proliferación de cianofíceas de julio a octubre, en la E-C, y de julio a noviembre en E-N y E-S. En la E-S las cianofíceas prevalecieron durante todo el año, con excepción de marzo y abril que fue cuando el fitoplancton alcanzó la más baja densidad.
Comunidad zooplanctónica:En el zooplancton, se encontraron 38 taxones, de ellos 13 especies fueron rotíferos, 14 cladóceros, ocho copépodos, un caoborido, un ostrácodo y larvas de peces del género Chirostoma (Cuadro 3).
Composición taxonómica de la comunidad zooplanctónica del embalse Ignacio Allende
TABLE 3
Taxonomic composition of zooplankton community from Ignacio Allende reservoir
| Protozoa | Moina macrocopa R |
| Difflugia sp. O | Bosmina longirostris D |
| Macrothrix laticornis R | |
| Rotatoria | Leydigia quadrangularis R |
| Ascomorpha saltans R | Alona guttata R |
| Asplanchna priodonta D | Alona costata R |
| Brachionus calyciflorus C | |
| Euchlanis incisa R | Copepoda |
| Filinia longiseta C | Diaptomus (Mastigodiaptomus) montezumae D |
| Hexarthra mira R | Acanthocyclops vernalis C |
| Keratella cochlearis D | Acanthocyclops capillatus R |
| Keratella valga D | Acanthocyclops exillis C |
| Kellicothia sp. R | Mycrocyclops varicans R |
| Polyarthra vulgaris C | Lernaea sp. R |
| Platyas quadricornis R | Paracyclops fimbriatus R |
| Tetramastix sp. R | Paracyclops affinis R |
| Trichocerca insulana R | |
| Insecta | |
| Cladocera | Chaoborus sp. R |
| Diaphanosoma birgei C | |
| Daphnia ambigua R | Larvas de pez |
| D. parvula C | Chirostoma sp. C |
| D. catawba R | |
| Ceriodaphnia reticulata R | Ostracoda |
| C. quadrangula R | Ostracodo R |
| Moinodaphnia macleayii C | |
| Moina micrura R |
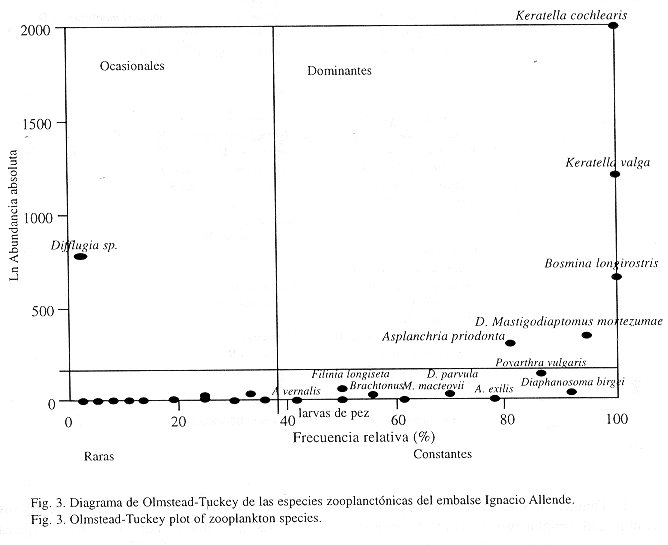
El Diagrama de Olmstead-Tukey para la comunidad zooplanctónica (Fig. 4), muestra cinco taxones, que son Keratella cochlearis, K. valga, Bosmina longirostris, Diaptomus (Mastigodiaptomus) montezumae y Asplanchna priodonta,alcanzaron altas frecuencias y valores superiores a la media del Ln de la abundancia absoluta, por lo que se consideran dominantes. Nueve taxones, Polyarthra vulgaris, Diaphanosoma birgei, Acanthocyclops exilis, A. vernalis, Moinodaphnia macleayi, Daphnia parvula, Filinia longiseta, Brachionus calyciflorus y larvas de pez, se encuentran en el grupo de las especies constantes. Solo una especie se considera ocasional, Difflugia sp., un protozoario que mostró altos valores de abundancia durante las lluvias pero fue poco frecuente. Las restantes 24 especies por su escasa abundancia y frecuencia, se consideran raras (Cuadro 3).
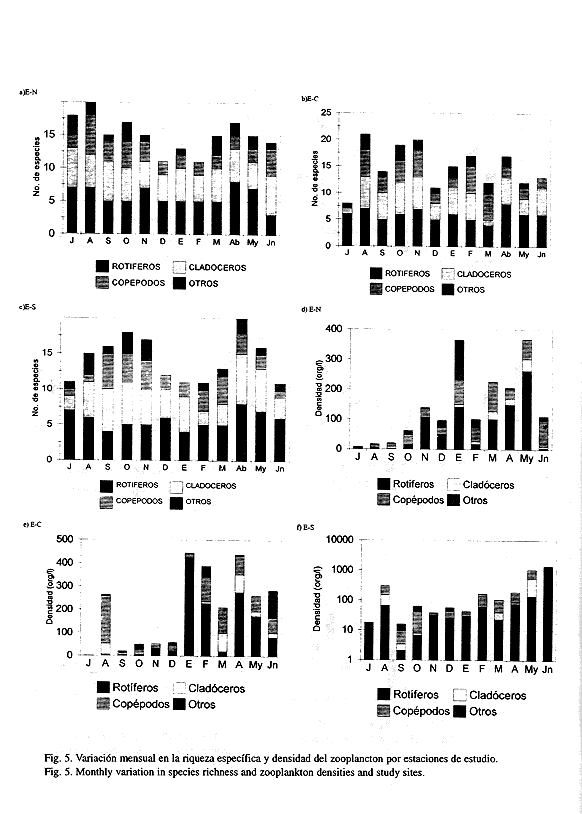
Se encontraron variaciones en riqueza específica por taxocenosis y sitios de estudio (Figs. 5a, b y c). En los tres sitios los rotíferos alcanzaron la mayor contribución en riqueza específica, le siguen los cladóceros y copépodos, en ese orden de importancia. Durante los meses fríos y en particular en diciembre se observó un abatimiento drástico en la riqueza específica que, en la E-N y E-S permaneció hasta los meses de febrero y marzo respectivamente; además, en la E-C y E-S se detectó que en julio existió otra caída en la riqueza específica.
Las densidades zooplanctónicas acusaron bajos valores durante julio a diciembre, a partir de enero (E-N y E-C) y en febrero para la E-S, se detectó una marcada recuperación (Fig. 5 d, e y f). Las mayores densidades se detectaron en los meses cálidos, es decir, mayo en la E-N, abril en la E-C y junio para la E-S; los más bajos valores se presentaron en julio en todos los sitios de estudio. Los rotíferos fueron el grupo dominante casi todo el ciclo de estudio, seguidos por copépodos y cladóceros en ese orden de importancia.
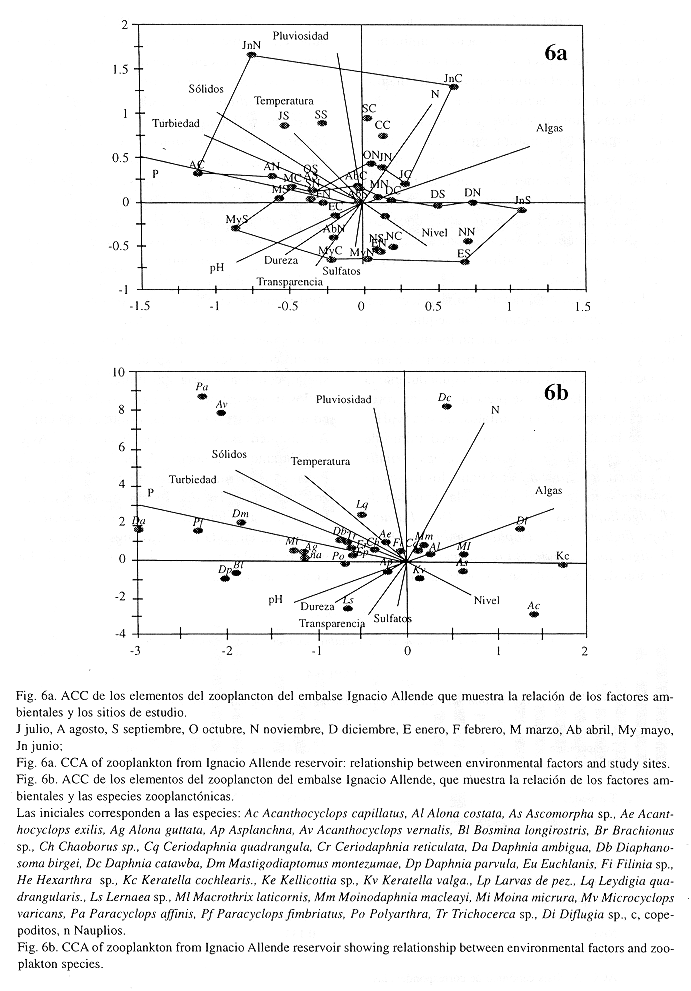
El diagrama del ACC muestra los meses de estudio y su relación con los factores ambientales así como las especies con relación a los factores (Fig. 6). En el extremo superior del diagrama (Fig. 6a), se encuentran los meses asociados a las lluvias, junio a octubre, en los que se presentó la mayor temperatura, turbiedad y sólidos suspendidos, el P se incrementó, en particular en agosto, y el N aumentó en junio; además, las densidades algales fueron máximas, en particular en junio y julio. De acuerdo con López-López y Soto-Galera (1993), estos meses corresponden al final de la estratificación térmica y el inicio de la circulación.
En la parte inferior del diagrama se localizan los meses que corresponden a la sequía. En el margen inferior derecho se ubican los meses más fríos y de mayor nivel de agua, noviembre a enero. De marzo a mayo, aun en la sequía durante la estratificación térmica, se presentan los mayores valores de transparencia, sulfatos, dureza y pH.
En las lluvias se detectó el predominio de Paracyclops affinis Pa, Acanthocyclops vernalis Av y Daphnia catawba Dc; durante los meses de agosto a octubre se incrementó la densidad de Mastigodiaptomus montezumae Dm, Paracyclops fimbriatus Pf, Daphnia ambigua Da, y Leydigia quadrangularis Lq; asociado a la proliferación de algas solo se encontró a Keratella cochlearis Kc y Difflugia sp. Di. Durante la sequía, en los meses fríos las especies comunes fueron Acanthocyclops capillatus Ac, Ascomorpha sp. As. y Macrothrix laticornis Ml, y durante el periodo cálido Lernaea sp. Ls, Bosmina longirostris Bl y Daphnia parvula Dp, los rotíferos Poliarthra Po, Brachionus Br y Filinia Fi, fueron comunes, mientras que Moina micrura Mi, Alona gutata Ag y los nauplios fueron comunes durante febrero y marzo (Fig. 6b).
De acuerdo con lo descrito se observa que la llegada del período de pluviosidad es acompañado de incremento en nutrientes N y P, turbidez y sólidos suspendidos, momentos que se asocian al predominio de copépodos ciclopoideos al iniciar las lluvias y al copépodo calanoideo al final de las mismas. En el estiaje se detectó incremento en sulfatos, dureza, transparencia y oxígeno disuelto, con una notoria substitución de especies, en los meses cálidos con dominio de rotíferos y en los meses fríos una escasa riqueza específica. Así también, es evidente en el diagrama del ACC que durante el momento de proliferación algal fue menor la riqueza específica y la densidad zooplanctónica.El ACC mostró que si bien existen pequeñas diferencias entre sitios de estudio, en general en cada mes los sitios responden de manera similar a la variación estacional de los factores ambientales.
Coeficientes de correlación de las variables ambientales y los ejes 1 y 2 del ACC
TABLE 4
Correlation coefficients of environmental factors on axes 1 and 2 of CCA
| Factor ambiental | ACC 1 | ACC 2 |
| Temperatura | -0.141 | 0.21 |
| Oxígeno | 0.0 | -0.29 |
| PH | -0.21 | -0.21 |
| Turbiedad | -0.25 | -0.20 |
| Sólidos suspendidos | -0.22 | 0.24 |
| Nitrógeno | 0.10 | 0.23 |
| Fósforo | -0.45 | 0.15 |
| Sulfatos | -0.012 | -0.115 |
| Dureza | -0.207 | -0.122 |
| Transparencia | -0.141 | -0.428 |
| Pluviosidad | -0.028 | 0.413 |
| Nivel | 0.133 | -0.133 |
| Algas | 0.251 | 0.127 |
Discusión
Las condiciones ambientales que prevalecen en el embalse, alta turbieadad y en particular la limitación por N (López-López y Soto-Galera 1993), pueden ser de los principales factores en favorecer la dominancia por cianofíceas (Fig. 3 d, e y f), elementos que constituyen casi el total de la densidad fitoplanctónica. La proliferación de cianofíceas en verano y la asociación de especies dominantes compuesta por Anabaena variabilis,Aulacosseira granulata y C. hirundinella, así como la alta frecuencia de F. crotonensis, se asocia a cuerpos de agua tropicales eutróficos (Hutchinson 1967, Harris 1986, Reynolds 1976, 1984 y 1986).
Algunas de las especies del zooplancton registradas en este estudio han sido consideradas como indicadoras de ciertas condiciones ambientales. La presencia de Chaoborus, señala que las aguas se encuentran poco oxigenadas (Wetzel 1981); la presencia y abundancia de B. longirostris, y el gran número de especies de rotíferos y sus altas densidades sugiere que se trata de un sistema eutrófico (Carvalho 1983).
Otro aspecto que resalta en las fluctuaciones de densidad planctónica, es la coincidencia del período de proliferación de cianofíceas con el de las densidades más bajas del zooplancton, en especial en septiembre para la E-N, julio para la E-C y julio y agosto para la E-S (Figs. 3 y 5), este evento también es coincidente con la época de lluvias y de ascenso en el nivel de agua en el embalse. Durante el invierno, la densidad total del zooplancton en las tres estaciones de estudio tendió a recuperarse y a finales de la sequía, marzo a agosto, cuando las clorofíceas fueron abundantes, el zooplancton acusó otra recuperación en sus densidades.
El abatimiento en las densidades zooplanctónicas ha sido detectado en varios embalses de la región intertropical, entre ellos en Sri Lanka, Duncan (1984) registró durante las lluvias un efecto de dilución y de lavado de los rotíferos zooplanctónicos en un reservorio de irrigación. Carvalho (1983) y Kirk (1991), sugieren que durante los periodos con mayor concentración de sólidos suspendidos en los cuerpos de agua lénticos con gran aporte de material terrígeno, existe la posibilidad de interferencia en los procesos de filtración del zooplancton. Así también, Infante y Riehl (1984) notaron, que las cianofíceas obstruyen los mecanismos de filtración de las especies zooplanctónicas en los momentos de proliferación de estas algas en el Lago Valencia, Venezuela. Por último, también se ha registrado un efecto de toxicidad de varias especies de Anabaena, sobre los organismos que las consumen voluntaria o accidentalmente (Haynes 1988).
En el embalse Ignacio Allende, es posible que estén operando de forma sinérgica los cuatro eventos, ya que el abatimiento de la densidad total del zooplancton coincidió con los mayores niveles de sólidos suspendidos en el embalse, y con la proliferación de cianofíceas, ambos eventos pueden contribuir a la obstrucción de los mecanismos de filtración del zooplancton. Aunado a lo anterior, se puede presentar toxicidad sobre el zooplancton provocado por la proliferación de A. variabilis. Las menores densidades zooplanctónicas también coincidieron con los momentos de mayor nivel de agua en el embalse, condiciones que pudieron provocar dilución y a su vez parte del zooplancton pudo haber sido arrastrado y eliminado a través de los vertederos de demasías.
Otros eventos que influyen en el abatimiento de la densidad zooplanctónica son las relaciones bióticas como la depredación y la competencia interespecífica, fenómenos que no han sido abordados en el embalse y que llegan a influir de distinta forma en la composición y abundancia de la comunidad planctónica.
Los resultados sugieren que el embalse Ignacio Allende es un sistema eutrófico, en el que existe una marcada estacionalidad en los factores ambientales asociada a los periodos de lluvias y estiaje, que le confieren rasgos distintivos. En conjunto, la composición fitoplanctónica y la dinámica impuesta por los períodos de lluvias y estiaje, determinaron un marcado efecto en el zooplancton, el cual también presentó un esquema de sucesión, con una caída en sus densidades durante la proliferación de cianoficeas. Dado que el zooplancton constituye el vínculo de enlace de productores primarios a niveles superiores de las pirámides tróficas, es conveniente abordar los efectos que tiene la caída de las densidades zooplanctónicas sobre otros niveles tróficos y en general en la estructura de la trama trófica, aspectos que requieren otro nivel de estudios y que contribuirán a lograr una mayor comprensión del funcionamiento global del sistema.
Agradecimientos
Agradecemos a Paúl Vallejo de Aquino y a Eduardo Soto Galera su valiosa colaboración en el trabajo de campo. El financiamiento para la realización de este trabajo fue otorgado por la DEPI-IPN.
Resumen
Se estudiaron las comunidades planctónicas y los factores ambientales del embalse Ignacio Allende de julio de 1990 a junio de 1991. Se presentó una proliferación de cianofíceas en el verano coincidente con el mayor nivel de agua, seguido por la dominacia de bacilariofíceas en los meses fríos, en primavera con el incremento en la temperatura las cloroficeas alcanzaron sus mayores densidades. Las dinofíceas y euglenofíceas presentaron la menor riqueza específica. La proliferación de Anabaena variabilis en el verano y la alta frecuencia de Ceratium hirundinella, Aulacosseira granulata y Fragilaria crotonensis se asocian con cuerpos de agua tropicales eutróficos. Se encontraron 39 taxones zooplanctónicos, de los cuales Diaphanosoma birgei, Bosmina longirostris, Daphnia parvula, Diaptomus (Mastigodiaptomus) montezumae, Acanthocyclops vernalis, Keratella cochlearis, Polyarthra vulgaris y Asplanchna priodonta, fueron persistentes en todo el ciclo. Un análisis de correspondencias canónicas mostró las relaciones que guardan los cambios en composición del zooplancton con las características físicas y químicas del embalse.
Referencias
Anónimo. 1976. DR-EL/2 Methods (Manual). Hach Europe, Ames, Iowa. 83 p. [ Links ]
Athié, M. 1987. Calidad y cantidad del agua en México. Fundación Universo Veintiuno, México, D. F. 152 p. [ Links ]
Carvalho, M. L. 1983. Effeitos da fluctacao do nivel da agua sobre a densidad e composicao do zooplancton em um Lago de Varzea da Amazonia, Brasil. Acta Amazonica. 13: 715-724. [ Links ]
De la Cruz, G. 1991. ANACOM. Sistema para el análisis de comunidades. Versión 3.0. Centro de Investigación y Estudios Avanzados, Instituto Politécnico Nacional. México, D.F. [ Links ]
Dodson, S. & D. G. Frey. 1991. Cladocera and other Branchiopoda, p. 723-787. In J. H. Thorp & A. P. Covich (eds.). Ecology and Classification of North American Freshwater Invertebrates. Academic, Londres. [ Links ]
Duncan, A. 1984. Assessment of factors influencing the composition, body size and turnover rate of zooplankton in Parakrauma Samudra, an irrigation reservoir in Sri Lanka. Hydrobiologia 113: 201-215. [ Links ]
Geddes, M. C. 1984. Seasonal studies on the zooplankton community of Lake Alexandrina, River Murray, South Australia and the role of turbidity in determining zooplankton community structure. Aus. J. Mar. Freshw. Res. 35: 417-426. [ Links ]
Harris, G. P. 1980. Temporal and spatial scales in phytoplankton ecology. Mechanisms, methods, models and management. Can. J. Aquat. Sci. 37: 877-900. [ Links ]
Harris, G. P. 1986. Phytoplankton Ecology. Structure, function and fluctuation. Chapman & Hall, Londres. 384 p. [ Links ]
Haynes, R. C. 1988. An Introduction to the Blue-Green Algae (Cyanobacteria) with an emphasis on nuisance species. North American Lake Management Society, Washington, D. C. 20 p. [ Links ]
Heaney, S. I. 1976. Temporal and spatial distribution of the dinoflagellate Ceratium hirundinella O. F. Müeller within a small productive lake. Freshwat. Biol. 6: 531-542. [ Links ]
Hutchinson, G. E. 1967. A treatise on Limnology. Vol. II. Wiley, Nueva York. 1155 p. [ Links ]
Infante, A. 1988. El plancton de las aguas continentales. Serie de Biología. Monografia No. 33. Secretaría General de la Organización de los Estados Americanos. Programa Regional de Desarrollo Científico y Tecnológico. Washington, D. C. 126 p. [ Links ]
Infante, A. & W. Riehl. 1984. The effect of Cyanophyta upon zooplankton in an eutrophic tropical lake (Lake Valencia), Venezuela, p. 293-298. In H. J. Dumont & J. G. Tundisi (eds.). Tropical Zooplankton, Junk. La Haya. [ Links ]
Kalff, J. & R. Knoechel. 1978. Phytoplankton and their dynamics in oligotrophic and eutrophic lakes. Annu. Rev. Ecol. Syst. 9: 475-495. [ Links ]
Kent, M. & P. Coker. 1992. Vegetation description and analysis. A practical approach. Belhaven, Londres. 363 p. [ Links ]
Kirk, K. L. 1991. Suspended clay reduces Daphnia feeding rate: Behavioural mechanisms. Freshwat. Biol. 25: 357-365. [ Links ]
Klemer, A. & A. E. Konopka. 1989. Causes and consequences of blue-green algal (Cyanobacterial) blooms. Lake and Reserv. Manage. 5: 9-19. [ Links ]
López-López, E. & E. Soto-Galera. 1993. Diagnóstico de eutroficación del embalse Ignacio Allende, Guanajuato, México. An. Inst. Cienc. del Mar y Limnol. Univ. Nal. Autón. de Méx. 20: 33-42. [ Links ]
Lund, J.W., G. C. Kipling & E. D. Le Cren. 1958. The inverted microscope method of estimating algal numbers and the statistical basis of estimations by counting. Hydrobiologia 11: 143-170. [ Links ]
Margalef, R. 1983. Limnología. Omega, Barcelona. 1101 p. [ Links ]
Pennak, R. W. 1978. Freshwater Invertebrates of the United States. Wiley, Nueva York. 803 p. [ Links ]
Pielou, E. C. 1977. Mathematical Ecology. Wiley, Nueva York. 385 p. [ Links ]
Prescott, G. W. 1962. Algae of the Western Great Lakes Area. WM. C. Brown, Dubuque, Iowa. 977 p. [ Links ]
Reynolds, C. S. 1976. Succesion and vertical distribution of phytoplankton in response to thermal stratification in a lowland mere, with special reference to nutrient availability. J. Ecol. 64: 529-551. [ Links ]
Reynolds, C. S. 1984. Phytoplankton periodicity: The Interactions of Form, Function and Environmental Variability. Freshwat. Biol. 14: 111-142. [ Links ]
Reynolds, C. S. 1986. The Ecology of Freshwater Phytoplankton. Cambridge University, Cambridge. 384 p. [ Links ]
Rosas, I.,A. Velasco, R. Belmont, A. Báez & A. Martínez. 1992. The algal community as indicator of the trophic status of Lake Pátzcuaro, México. Envir. Poll. 80: 255-264. [ Links ]
Rzedowski, J. 1978. Vegetación de México. Limusa, México, D.F. 432 p. [ Links ]
Serna-Hernández, J. & E. López-López. 1996. Una aproximación al fenómeno de sucesión fitoplanctónica del embalse Ignacio Allende, Guanajuato, por métodos multivariados. Zoología Informa. México, D.F. 32: 5-17. [ Links ]
Sokal,R. & F. J. Rohlf. 1981. Biometry. Freeman, San Franciso, California. 259 p. [ Links ]
Tiffany, L. H. &M. E. Britton. 1952. The Algae of Illinois. University of Chicago, Chicago, Ilinois. 407 p. [ Links ]
Wallace, R. & T. W. Snell. 1991. Rotifera: p. 187-240. In J. H. Thorp & A. P. Covich (eds.). Ecology and Classification of North American Freshwater Invertebrates. Academic, Londres. [ Links ]
Wetzel, R. 1981. Limnología. Omega, Barcelona. 679 p. [ Links ]
Wetzel, R. andG. E. Likens. 1979. Limnological Analyses. Saunders. Boston. 357 p. [ Links ]
Williamson, C. E. 1991. Copepoda, p. 787-812. In J. H. Thorp & A. P. Covich (eds.). Ecology and Classification of North American Freshwater Invertebrates. Academic, Londres. [ Links ]
1 Laboratorio de Ictiología y Limnología. Departamento de Zoología. E.N.C.B. IPN. Prol. Carpio y Plan de Ayala, Col. Sto. Tomás. México, D. F. 11340. Fax (5) 3 96 35 03 Correo electrónico: elopez@alquimia.encb.ipn.mx
Recibido 24-II-1999. Corregido 10-VI-1999. Aceptado 23-VI-1999.