Services on Demand
Journal
Article
Indicators
-
 Cited by SciELO
Cited by SciELO -
 Access statistics
Access statistics
Related links
-
 Similars in
SciELO
Similars in
SciELO  uBio
uBio
Share
Revista de Biología Tropical
On-line version ISSN 0034-7744Print version ISSN 0034-7744
Rev. biol. trop vol.47 n.3 San José Sep. 1999
en un agroecosistema cañero de Cuba
Marta M. Hidalgo-Gato Rosanna Rodríguez-León Nancy E. Ricardo Hermen Ferrás 1
Recibido 17-XI-1998. Corregido 14-III-1999. Aceptado 28-III-1999.
Abstract
Twenty three species of leafhoppers were found in a sugar cane crop in San Pedro, Havana province, Cuba. Balclutha rufofasciata (Merino) and Tylocygus geometricus (Signoret) were new records for the crop. The samples were collected monthly from 1991- 1994 with entomological net. The most abundant and frequent species was B. guajanae (De Long) (1 920 ind/ha) in the crop and Hortensia similis Walk (18 960 ind/ha) in the surrounding vegetation. Population dynamics was determined for each species. The surrounding vegetation was represented by Rottboellia cocninchinensis (Lourd. Clayton), Echinochloacolona (L.) Link, Chamaesyce hyssopifolia (L.) Small y Euphorbia heterophylla L. The sugar cane showed the highest spatial organization, diversity (0.61) and evennes (0.25). The surrounding vegetation had the highest species dominance.
Key words
Leafhoppers, sugar cane, ecological indexes, diversity, agroecosystems, population dynamics.
Cicadellidae reúne un gran número de especies que habitan preferentemente en gramíneas; algunas de ellas presentan especificidad por una determinada planta, aunque generalmente tienen más de un hospedante. Algunos de estos insectos pueden inocular virus y hongos a los cultivos, afectando el crecimiento y la forma de la planta (Hamilton 1985).
Diferentes autores dedicaron parte de sus investigaciones al análisis de los brotes o explosiones de homópteros auquenorrincos en el cultivo de la caña de azúcar y las posibles causas de su origen en Cuba (Hourse 1908, Van Dine 1926, Scaramuzza 1935, 1946, Bruner et al. 1945, Metcalf 1971, ORelly 1985); sin embargo se limitaron a dar listas de las especies que lo habitan.
Por la importancia económica que representa el principal cultivo para Cuba, y la escasa información existente sobre la dinámica de las poblaciones de cicadélidos, nos proponemos conocer las especies más abundantes y frecuentes, el comportamiento de sus poblaciones en las diferentes fases fenológicas del cultivo y su organización espacial en el agroecosistema cultivo - vegetación segetal.
Materiales y Methods
Se realizaron muestreos mensuales de los cicadélidos en cañaverales pertenecientes al central Martínez Prieto, en el lote 136 del distrito de Chirigota de San Pedro, Guatao, provincia de La Habana en las variedades Ja 60-5 y Cu 568-75 durante los años 1991 a 1994. Este agroecosistema se presenta en llanuras de suelos ferralíticos cársicos, con promedios anuales de precipitaciones de 1 355.7 mm y temperaturas de 23.9 °C (Ricardo 1994). La época de seca está comprendida entre los meses de diciembre a abril y la de lluvia de mayo hasta noviembre (Chong 1993).
La vegetación segetal (es aquella que se asocia a los cultivos) está integrada fundamentalmente por: Rottboellia cocninchinensis (Lourd. Clayton), Echinochloacolona (L.) Link, Chamaesyce hyssopifolia (L.) Small y Euphorbia heterophylla L.
Con el empleo de una red entomológica se recolectaron los insectos presentes en los plantones cañeros, a lo largo de cinco transeptos de 100 m de largo por 1 m de ancho, equidistantes entre sí, y cinco en la vegetación segetal que rodea al campo de caña, de 50 x 2 m, cada trancepto se consideró como una muestra.
La identificación de las especies se realizó a través de los genitales internos de los individuos machos según la técnica de Dlavola y Novoa (1976). Diez o más ejemplares fueron depositados en la colección de entomofauna de la caña de azúcar del Instituto de Ecología y Sistemática, CITMA.
La densidad poblacional se halló con las sumas promedios mensuales de las diferentes muestras tomadas del cultivo y la vegetación segetal expresados en ind/ha.
Se determinó la frecuencia de aparición según la fórmula: C=Ma/Mt, donde C es la frecuencia o constancia de especies; Ma número total de muestras con especies y Mt número total de muestras.
El teorema de la entropía total fue aplicado para determinar la organización de las comunidades estudiadas, según Pielou (1977) y Pineda et al. (1981). Acorde con este teorema la densidad total H(EP) es descrita en términos de entropía de especies H(E); calculada a través del índice de Shanon y Wiener (Magurran 1989), además puede ser descrita a través de la entropía de las parcelas H(P); entropía de las parcelas condicionadas a especies H(P/E) y entropía de las especies condicionada a las parcelas H(E/P). Se utilizó la fórmula de Pielou (1969) para calcular los valores máximos de la entropía con el fin de lograr la uniformidad y eliminar las diferencias entre las muestras y censos realizados.
La expresión H(E/P) se usó para describir la amplitud de hábitat ocupado por las especies y H(E/P) para medir el solapamiento de hábitat entre las especies. La dominancia de especies (D) se determinó según Simpson (1949) y la equitatividad (J') por Pielou (1975).
Se calculó el coeficiente de correlación de la abundancia con la temperatura y la humedad relativa y se confeccionó el gráfico de regresión abundancia y temperatura.
Resultds
Composición de la fauna de Cicadellidae: En las áreas cañeras de la localidad de San Pedro se recolectaron 23 especies de cicadélidos pertenecientes a las subfamilias: Agallinae, Cicadellinae, Deltocephalinae, Typhlocybinae y Xerophloeinae; de éstas, 16 están presentes en el cultivo y 22 en la vegetación segetal (Cuadro 1).
Composición taxonómica de los cicadélidos presentes en áreas cañeras de San Pedro y frecuencia de aparición.
Taxonomic composition of leafhoppers on sugar cane fields in San Pedro and occurrence frequency.
| Táxones | Frecuencia de aparición | ||
| Caña | Veg. segetal | ||
| Deltocephalinae | Balclutha guajanae (De Long) | 0.57 *** | 0.68 *** |
| B. rufofasciata (Merino) | 0.15 ** | 0.15 ** | |
| Planicephalus flavicosta (Stal) | 0.36 *** | 0.57 *** | |
| Chlorotettix viridius Van Duzze | 0.15 ** | 0.68 *** | |
| C. minimus Baker | 0.31 *** | 0.47 *** | |
| Exitianus exitiosus (Uhler) | 0.21 ** | 0.63 *** | |
| Graminella cognita Caldwell | - | 0.47 *** | |
| G. punctata Caldwell | - | 0.05 *** | |
| Unerus colonus (Uhler) | - | 0.05 *** | |
| Spangbergiella vulnerata (Uhler) | - | 0.05 *** | |
| Acinopterus sp. | - | 0.10 *** | |
| Scaphytopius sp. | 0.15 ** | 0.15 ** | |
| Haldorus sp. | 0.05 * | 0.10 ** | |
| Hecalus sp. | - | 0.05 * | |
| Cicadellinae | Hortensia similis (Walker) | 0.78 *** | 0.89 *** |
| Draeculacephala producta (Walker) | 0.10 ** | 0.52 *** | |
| D. bradleyi Van Duzee | 0.57 *** | 0.57 *** | |
| Xiphon flaviceps (Riley) | 0.31 *** | 0.31 *** | |
| Tylozygus geometricus (Signoret) | 0.05 * | 0.21 * | |
| Typhlocybinae | Protalebrella brasiliensis Backer | 0.05 * | 0.21 * |
| Empoasca kraemeri Ross y Moore | 0.42 *** | 0.57 *** | |
| Agallinae | Agallia sp. | - | 0.10 * |
| Xerophloeinae | Xerophloea viridis (Fabricius) | 0.05 * | - |
C e 0.30, Muy frecuente ***; 0.29 e c e 0.10, frecuente **; c < 0.10, poco frecuente *.
C e 0.30, Very frequent ***; 0.29 e c e 0.10, frequent **; c < 0.10, non frequent *.
Deltocephalinae se presenta con 11 géneros y 14 especies, es la subfamilia más representativa en el agroecosistema cañero; Cicadellinae se encontró con cuatro géneros y cinco especies. El resto de las subfamilias: Typhlocybinae, Agallinae y Xerophloeinae aparecen sólo con una o dos especies.
Las especies recolectadas coinciden en su gran mayoría con las encontradas en otras localidades cañeras del país (Cabañas, Bahía Honda, Jovellanos, Cienfuegos y Florida), donde alcanzan un 22 % en el cultivo de la caña y 93 % en la vegetación segetal, estos valores constituyen una alta representatividad con relación a otras familias de homópteros auquenorrincos (Hidalgo-Gato et al. 1998). Se dan a conocer como nuevos registros para la caña en San Pedro Balclutha rufofasciata (Merino) y Tylocygus geometricus (Signoret).
Se encontraron cinco especies que constituyen vectores de enfermedades a diferentes cultivos o que potencialmente pueden serlo: Chlorotettix viridius Van Duzze, Planicephalus flavicosta (Stal), Empoasca kraemeri Ross y Moore, Draeculacephala producta (Walker) y Xiphon flaviceps (Riley). En otras localidades cañeras de Cuba se registran otras especies (Hidalgo-Gato et al., en prep.) entre las que se encuentran las mencionadas para San Pedro.
Frecuencia de aparición: En el cultivo se encuentran siete especies muy frecuentes: D. bradleyi Van Duzze, Hortensia similis Walker, X. flaviceps, B. guajanae (De Long), C. minimus Baker, P. flavicosta y E. kraemeri. Además de estas, en la vegetación segetal, son muy frecuentes: D. producta, C. viridius, E. exitiosus (Uhler) y G. cognita Caldwell.
Como frecuentes en el cultivo aparecen D. producta, B. rufofasciata, C. viridius, E.exitiosus, Scaphytopius sp. y en la vegetación segetal se presentan B. rufofasciata, Haldorus sp. y Scaphytopius sp. Con una baja frecuencia de aparición o que no están presentes en uno de los dos ecotopos estudiados están Agallia sp., Tylocygus geometricus, Haldorus sp., Protalebrella brasiliensis Backer y Xerophloea viridis (Fabricius) (Cuadro 1).
En la vegetación segetal hay una mayor frecuencia de aparición de cicadélidos siendo 11 las especies más frecuentes, y superando los valores hallados para la caña de azúcar; lo que muestra la preferencia de estos insectos por la vegetación herbácea.
Densidad y dinámica poblacional de las especies más abundantes: Se presentan las estadísticas descriptivas como la media, desviación estándar (mínimos- máximos) en los cuadros del 2 al 5.
Evaluación de los muestreos mensuales en cañaverales de San Pedro durante 1991 y 1992: estadísticos descriptivos
del conteo de Balclutha guajanae (De Long) (n= 5).
Evaluation of the monthly samplings in sugar cane plantations of San Pedro during 1991 and 1992: descriptive
statistics of Balclutha guajanae (De Long) numbers (n = 5).
| Caña | Vegetación segetal | |||||||
| Meses | x | S | min | max | x | S | min | max |
| 1991 | ||||||||
| Abril | 0 | 0 | 0 | 0 | 0 | 0 | 0 | 0 |
| Mayo | 80 | 109.54 | 0 | 200 | 0 | 0 | 0 | 0 |
| Junio | 0 | 0 | 0 | 0 | 40 | 100 | 0 | 200 |
| Julio | 0 | 0 | 0 | 0 | 0 | 0 | 0 | 0 |
| Agosto | 40 | 0 | 0 | 0 | 60 | 191.49 | 0 | 400 |
| Septiembre | 0 | 0 | 0 | 0 | 60 | 109.54 | 0 | 200 |
| Octubre | 0 | 0 | 0 | 0 | 0 | 0 | 0 | 0 |
| Noviembre | 40 | 89.44 | 0 | 200 | 380 | 219.09 | 400 | 1000 |
| Diciembre | 560 | 517.69 | 0 | 1000 | 4000 | 6059.70 | 5000 | 18400 |
| | ||||||||
| Enero | 1920 | 2062.04 | 400 | 5400 | 10800 | 18933.25 | 3600 | 49400 |
| Febrero | 1640 | 1888.92 | 0 | 4400 | 5880 | 9539.81 | 0 | 23000 |
| Marzo | 680 | 178.89 | 0 | 400 | 140 | 521.54 | 0 | 1200 |
| Abril | 80 | 219.09 | 0 | 400 | 40 | 109.54 | 0 | 200 |
| Mayo | 120 | 178.89 | 0 | 400 | 60 | 109.54 | 0 | 200 |
| Junio | 0 | 0 | 0 | 0 | 100 | 346.41 | 0 | 800 |
| Septiembre | 0 | 0 | 0 | 0 | 80 | 219.09 | 0 | 400 |
| Octubre | 40 | 89.44 | 0 | 200 | 80 | 167.33 | 0 | 400 |
| Noviembre | 0 | 0 | 0 | 0 | 40 | 89.44 | 0 | 200 |
| Diciembre | 200 | 228.04 | 0 | 600 | 980 | 2080.38 | 0 | 4800 |
Las especies abundantes en el cultivo son: P. flavicosta, Chlorotettix minimus y Empoasca kraemeri mientras que en la vegetación segetal aparecen siete especies: P. flavicosta, C. viridius, C. minimus, Exitianus exitiosus, D. producta, D. bradleyi y E. kraemeri. Se destacan con los valores más altos en el agroecosistema B.guajanae (Deltocephalinae) y H. similis (Cicadellinae).
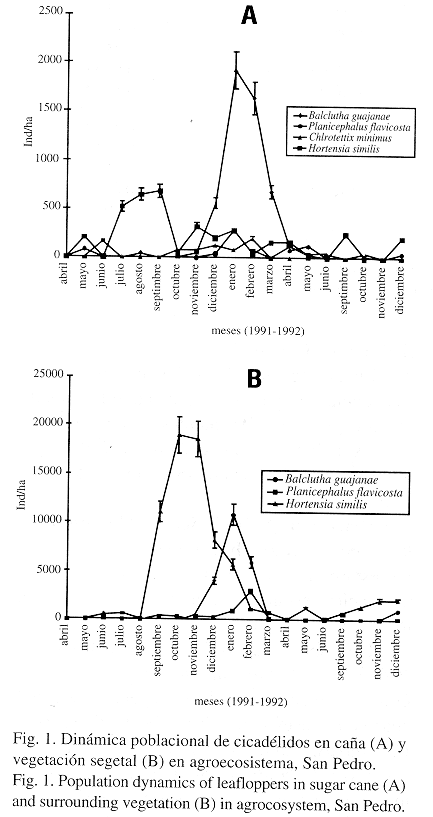
La dinámica poblacional durante las fases fenológicas del cultivo (Fig. 1A) muestra que B. guajanae se destaca con una mayor densidad poblacional del resto de las especies en los meses de enero y febrero (Cuadro 2). H. similis es la segunda especie con mayor abundancia en este ecotopo durante los meses de septiembre y octubre (Cuadro 3) (Fig.1A).
Evaluación de los muestreos mensuales en cañaverales de San Pedro durante 1991 y 1992: estadísticos descriptivos
del conteo de Hortensia similis (Walker) (n= 5).
Evaluation of the monthly samplings in sugar cane plantations of San Pedro during 1991 and 1992: descriptive
statistics of Hortensia similis (Walker) numbers (n = 5).
| Caña | Vegetación segetal | |||||||
| Meses | | | | | | | | |
| | ||||||||
| Abril | | | | | | | | |
| Mayo | | | | | | | | |
| Junio | | | | | | | | |
| Julio | | | | | | | | |
| Agosto | | | | | | | | |
| Septiembre | | | | | | | | |
| Octubre | | | | | | | | |
| Noviembre | | | | | | | | |
| Diciembre | | | | | | | | |
| | ||||||||
| Enero | | | | | | | | |
| Febrero | | | | | | | | |
| Marzo | | | | | | | | |
| Abril | | | | | | | | |
| Mayo | | | | | | | | |
| Junio | | | | | | | | |
| Septiembre | | | | | | | | |
| Octubre | | | | | | | | |
| Noviembre | | | | | | | | |
| Diciembre | | | | | | | | |
CUADRO 4
Evaluación de los muestreos mensuales en cañaverales de San Pedro durante 1991 y 1992: estadísticos descriptivos del
conteo de Planicephalus flavicosta (Stal) (n= 5).
Evaluation of the monthly samplings in sugar cane plantations of San Pedro during 1991 and 1992: descriptive statistics
of Planicephalus flavicosta (Stal) numbers (n = 5).
| | | | | | | |||
| | ||||||||
| Meses | | | | | | | | |
| Abril | | | | | | | | |
| Mayo | | | | | | | | |
| Junio | | | | | | | | |
| Julio | | | | | | | | |
| Agosto | | | | | | | | |
| Septiembre | | | | | | | | |
| Octubre | | | | | | | | |
| Noviembre | | | | | | | | |
| Diciembre | | | | | | | | |
| | ||||||||
| Enero | | | | | | | | |
| Febrero | | | | | | | | |
| Marzo | | | | | | | | |
| Abril | | | | | | | | |
| Mayo | | | | | | | | |
| Junio | | | | | | | | |
| Septiembre | | | | | | | | |
| Octubre | | | | | | | | |
| Noviembre | | | | | | | | |
| Diciembre | | | | | | | | |
CUADRO 5
Evaluación de los muestreos mensuales en cañaverales de San Pedro durante 1991 y 1992: estadísticos descriptivos
del conteo de Chlorotettix minimus Baker (n= 5).
Evaluation of the monthly samplings in sugar cane plantations of San Pedro during 1991 and 1992: descriptive statistics
of Chlorotettix minimus Baker numbers (n = 5).
| | | | | |
| Meses | | | | |
| | ||||
| Abril | | | | |
| Mayo | | | | |
| Junio | | | | |
| Julio | | | | |
| Agosto | | | | |
| Septiembre | | | | |
| Octubre | | | | |
| Noviembre | | | | |
| Diciembre | | | | |
| | ||||
| Enero | | | | |
| Febrero | | | | |
| Marzo | | | | |
| Abril | | | | |
| Mayo | | | | |
| Junio | | | | |
| Septiembre | | | | |
| Octubre | | | | |
| Noviembre | | | | |
| Diciembre | | | | |
En la vegetación segetal (Fig. 1B) H. similis incrementa nueve veces más su densidad en octubre (Cuadro 3) y B. guajanae ocupa el segundo lugar, sus poblaciones comienzan a aumentar a partir de noviembre, alcanzando un valor máximo en enero (Cuadro 2) (Fig. 1B). P. flavicosta y C. minimus incrementan sus poblaciones dos meses después de terminado el período de lluvia, con mayor discreción que las especies anteriores, coincidiendo con los meses más fríos (diciembre a febrero).
En abril y octubre del primer año de muestreo no se encontraron individuos de B. guajanae en ninguno de los dos ecotopos estudiados, de la misma forma ocurre con H. similis en mayo, además en septiembre y octubre de 1992 se observó una disminución de esta especie con relación a 1991.
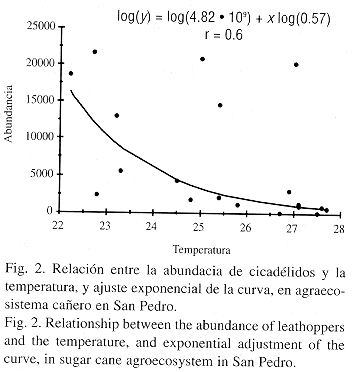
Relación entre densidad poblacional, temperatura y humedad relativa: Al correlacionar la densidad poblacional de los cicadélidos presentes en el cultivo con la temperatura se observa (Fig. 2) una relación inversamente proporcional, mientras que no hay correlación entre estos dos parámetros para la vegetación segetal. A medida que disminuye la temperatura aumentan los valores en la densidad poblacional de B. guajanae. Esto se debe a que el florecimiento de la caña depende de las bajas temperaturas, este cultivo florece en diciembre y enero; por tanto la población de esta especie es más abundante. Por otra parte se obtuvo que la densidad poblacional es independiente de la humedad relativa.
Diversidad de cicadélidos en el agroecosistema: La consideración de la diversidad, según el teorema de la entropía total, permite una interpretación más exacta de la organización espacial de las poblaciones de cicadélidos en caña de azúcar y vegetación segetal. Este análisis nos permite demostrar que al cultivo le corresponden los valores mayores de diversidad total H(EP) (Cuadro 6); lo que está condicionado por la mayor diversidad de especies H(E) que se presenta en éste, mientras que la diversidad condicionada a los censos o muestreos realizados H(P) no ofrecen grandes diferencias entre los subsistemas por lo que no influyen en la diversidad total.
Valores máximos de la entropía total, H(EP) de la fauna de Cicadellidae en el agroecosistema de San Pedro.
Maximum values of the total entropy, H(EP) of the Cicadellidae fauna in San Pedro agroecosystem.
| Hábitat | | | | | | | | |
| Caña | | | | | | | | |
| Vegetación Segetal | | | | | | | | |
H(E): Entropía de especies, H(P): Entropía de las parcelas, H(P/E): Entropía de las parcelas condicionadas a
especies, H(E/P): Entropía de las especies condicionadas a las parcelas, J: Equitatividad, D: Dominancia.
H(E): Species Entropy, H(P): Entropy of parcels, H(P/E): Entropy of parcels conditioned to species, H(E/P): Entropía
of the species conditioned to parcels, J': Equitability, D: Dominance.
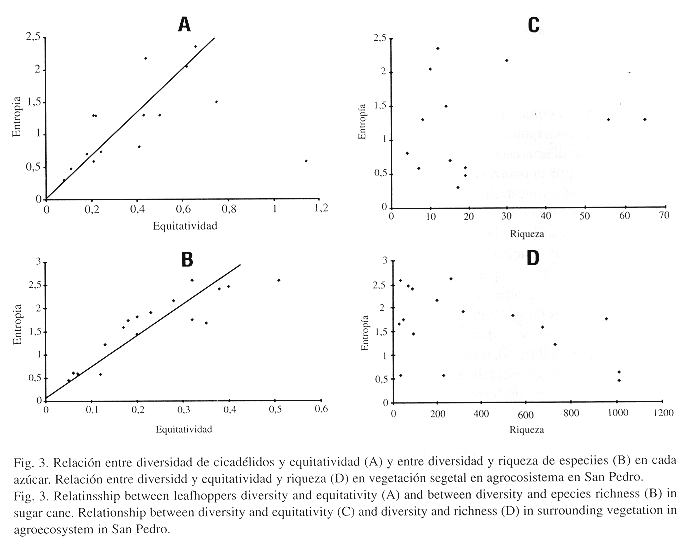
La mayor diversidad de cicadélidos que se presenta en el cultivo está determinada por los valores más altos de equitatividad (0.25) si lo comparamos con la vegetación segetal (0.16), las especies siguen una distribución más uniforme en el cultivo. La diversidad en este caso depende de la equitatividad (Fig.3A y B) y, en menor grado de la riqueza de especies (Fig. 3C y D). Se presenta una dominancia de especies mayor en la vegetación segetal con un valor de 4.84 y en caña con 1.44.
Discusón
La alta densidad poblacional de B.guajanae durante los meses de enero y febrero coincide con la etapa en que la caña es adulta y las temperaturas son más bajas (temperatura promedio baja 22,7ºC), lo que está estrechamente relacionado con el florecimiento de la planta (M. Guerra com. pers.); esta especie cría en la inflorescencia de la caña (Osborn 1926 a y b, Van Dine 1926) por lo que estas condiciones favorecen el aumento de sus poblaciones.
El aumento poblacional de H. similis que comienza en el mes de julio para la caña y agosto para la vegetación segetal se corresponde con la época de lluvia que está comprendida entre los meses de mayo a noviembre para la localidad de San Pedro. En Costa Rica se obtuvo que las mayores infestaciones de homópteros cicadélidos ocurren en la época lluviosa (Novoa y Badilla 1985); por lo que pudiéramos inferir que la alta humedad en el cañaveral debido a las precipitaciones contribuye a crear condiciones favorables para esta especie.
La ausencia total de especies de B.guajanae y H. similis en los meses de abril- octubre y mayo respectivamente durante el primer año de muestreo, así como la disminución de individuos de H. similis durante septiembre y octubre de 1992 pudieran estar determinadas entre otros factores por la ocurrencia de lluvias momentos antes del muestreo; esto provoca que los insectos se refugien y la recolecta se afecte, o por la aplicación de herbicidas.
En el agroecosistema cañero la densidad poblacional de algunas especies de cicadélidos responden a las precipitaciones (H. similis) y otras a las temperaturas(B. guajanae), estos resultados confirman lo expuesto por Ramos- Elorduy y Galindo (1979), quienes señalan que la abundancia y frecuencia de este grupo están relacionados con su preferencia estacional y por factores ambientales.
Las especies con una alta frecuencia de aparición tanto en el cultivo como en la vegetación segetal coinciden en general con las más abundantes, como por ejemplo: B. guajanae, H. similis, P. flavicosta, C. minimus, D. bradleyi, X. flaviceps y E. kraemeri; por lo que podemos inferir que se trata de especies que están relacionadas con el cultivo porque realizan determinadas funciones vitales en el mismo, como la reproducción y alimentación y además se caracterizan por migrar hacia otros hábitat, como la vegetación que rodea los cañaverales. La baja frecuencia o ausencia de otras, pudiera estar relacionada con la preferencia por otras plantas; como es el caso de Agallia sp. que ha sido recolectada en cultivos destinados al autoconsumo (vegetales y plantas ornamentales)
El análisis de los índices ecológicos demuestra que estamos en presencia de especies generalistas o polífagas que se caracterizan por una gran amplitud ecológica, habitan en diferentes plantas ya sean cultivadas o silvestres y migran de unas a otras sin presentar solapamiento entre sus hábitat. La distribución espacial de algunas especies de cicadélidos está determinada en mayor medida por factores ambientales (temperatura y humedad) que condicionan el aumento o disminución de sus poblaciones en determinadas épocas del año.
Resumen
Un agroecosistema cañero en San Pedro, Ciudad de La Habana, Cuba, arrojó una riqueza de cicadélidos de 23 especies, con dos nuevos registros para el cultivo: Balclutha rufofasciata (Merino) y Tylocygus geometricus (Signoret). Se realizaron recolectas mensuales durante los años 1991 a 1994, para lo cual se empleó una red entomológica. En el estudio de la dinámica poblacional de las especies más abundantes y frecuentes se destacaron B. guajanae (De Long) con una densidad de 1 920 ind/ha en el cultivo de la caña y Hortensia similis Walk con 18 960 ind/ha en la vegetación segetal. Esta última está integrada fundamentalmente por Rottboellia cocninchinensis (Lourd. Clayton), Echinochloa colona (L.) Link, Chamaesyce hyssopifolia (L.) Small y Euphorbia heterophylla L. El cultivo de la caña de azúcar presentó mayor organización espacial, diversidad (0.61) y equitatividad (0.25), mientras que la vegetación segetal presentó una mayor dominancia de especies (4.84).
Referencias
Bruner, S. C., L. C. Scaramuza & A. R. Otero. 1945. Catálogo de los insectos que atacan a las plantas económicas de Cuba. Academia de Ciencias de Cuba, La Habana. [ Links ]
Chong, E. R. 1993. La subfamilia Deltocephalinae (Homoptera: Cicadellidae) en un agroecosistema cañero. Tesis de diploma, Universidad de La Habana, La Habana. [ Links ]
Dlavola, J. & N. Novoa 1976. Dos nuevas especies del género Hadria Metcalf y Bruner, (1936) (Homoptera:Auchenorrhyncha) y revisión de otras especies cubanas. Poeyana 373: 1-19. [ Links ]
Hamilton, K.G.A. 1985. Leafhoppers of ornamental and fruit trees in Canada. Agric. Canada. Publ. 1779/E: 71 p. [ Links ]
Hidalgo-Gato, M. M., R. Rodríguez-León & N. Novoa 1998. Homópteros (Homoptera: Auchenorrhyncha) presentes en cañaverales de cinco localidades de Cuba. Poeyana 469: 1-4. [ Links ]
Hourse, J. S. 1908. Informe preliminar sobre las plagas de la caña de azúcar en Cuba. Estación Experimental Agronómica, La Habana. Circular 43: 24-29. [ Links ]
Magurran, A. E. 1989. Diversidad ecológica y su medición. Cap. 2, Vedra, Barcelona. p. 39. [ Links ]
Metcalf Z. P. 1971. Observaciones sobre la ecología de Saccharosydne sacharivora (West.) (Homoptera: Delphacidae) en cañaverales de Jamaica. Bull. Ent. Res. 60: 10 p. [ Links ]
Novoa, I. y F. Badilla 1985. Manejo integrado de plagas de la caña de azúcar en Costa Rica. Dirección de Investigación y Extensión de la caña de Azúcar, San José. 16 p. [ Links ]
O'Relly, J. L. 1985. Guía de las principales plagas de la caña de azúcar. Inst. Nac. de Invest. de la Caña de Azúcar, La Habana. 35 p. [ Links ]
Osborn, H. 1926 a. Notes on the economic status of certains Cuban Homoptera. Trop. Plant. Res. Forend. 1: 99-106. [ Links ]
Osborn, H. 1926 b. Faunistic and Ecologic notes on Cuban Homoptera. Trop. Plant. Res. Found. 2: 335-365. [ Links ]
Pielou, E. C. 1969. An introduction to Mathematical Ecology. Wiley, Nueva York. 250 p. [ Links ]
Pielou, E. C. 1975. Ecological diversity. Wiley, Nueva York. 165 p. [ Links ]
Pielou, E, C. 1977. Mathematical Ecology. Wiley, Londres. 385 p. [ Links ]
Pineda, F.D., J. P. Nicolás, B. Peco, M. Ruiz y F.G. Bernaldez. 1981. Succession, diversité et amplitude de niche dans les paturages du Centre de la Peninsule Iberique. Vegetatio. 47: 267-277. [ Links ]
Ramos- Elorduy, J.C. y N. Galindo. 1979. Estudio de la población de homópteros de la familia Cicadellidae, subfamilia Cicadellinae del Estado de Veracruz, México. An. Inst. Biol. Univ. Nal. Autón. México 50, Ser. Zool. (1): 347-362 [ Links ]
Ricardo, N. 1994. Malezas asociadas al cultivo de caña de azúcar (Saccharum spp.) en Cuba. Tesis en opción al grado de Doctor en Ciencias Agropecuarias, Inst. Nac. de Invest. de la Caña de Azúcar, La Habana, Cuba. [ Links ]
Scaramuzza, L. C. 1935. Algunos aspectos de la entomología de la caña de azúcar. Memoria 9a Conferencia Anual de la ATAC. La Habana p.: 27-28. [ Links ]
Scaramuzza, L. C. 1946. Insectos que atacan la caña y modo de combatirlos. Informes Técnicos. Bol. 425: 813-826. [ Links ]
Simpson, H. E. 1949. Measurement of diversity. Nature. 163: 688. [ Links ]
Van Dine, D. L. 1926. A list of the insects affecting sugar cane in Cuba. Trop. Plant Res. Fund. Bull. 3: 16 p. [ Links ]
1 Instituto de Ecología y Sistemática, Ministerio de Ciencia Tecnología y Medio Ambiente.
Carretera de Varona km 3 1/2, Capdevila, Boyeros, Apdo Postal 8029, C. P. 10800, Fax: (537) 578088, correo electrónico: ecologia@cidea.cu.unep.net