Revista de Biología Tropical
versión On-line ISSN 0034-7744versión impresa ISSN 0034-7744
Rev. biol. trop vol.47 no.3 San José sep. 1999
A total of 280 foliicolous lichens and 12 lichenicolous fungi was found in an inventory made in the lowland rain forest at La Selva Biological Station, Costa Rica. The species composition reflects 50 % of the world's diversity of foliicolous lichens and is representative for neotropical lowland rain forests. The most common species are Gyalectidium filicinum, Sporopodium leprieurii, Tricharia vainioi, Porina epiphylla, Phyllophiale alba, Trichothelium epiphyllum, Mazosia phyllosema, Tricharia urceolata, and Arthonia leptosperma. Many species show distinct microsite preferences: (1) Characteristic of the shady understory, including Arthoniaceae, Opegraphaceae, Pilocarpaceae, and Trichotheliaceae; (2) characteristic of light gaps, including Gomphillaceae and Ectolechiaceae; (3) characteristic of the canopy, including Asterothyriaceae and Gomphillaceae. Only few species exhibit preferences towards certain leaf types, either dicotyledoneous or palm leaves. The microsite preferences agree with earlier established indices, except for a few species for which modified indices are proposed. Communities resulting from these preferences are illustrated by clustering of phorophytes and associations of foliicolous lichens. The three principal associations correspond to the shady understory, light gaps and the canopy, whereas two subassociations reflect subtle phorophyte preferences. Species diversity and composition are strongly affected by the degree of disturbance of vegetation types at La Selva. Diversity is highest in the primary forest and lowest in young successional stages. The foliicolous lichen flora of open, anthropogenic vegetation resembles that of light gaps or the canopy in the primary forest, while species characteristic of the forest understory disappear.
Key words
Foliicolous lichens, Costa Rica, La Selva, inventory, diversity, associations, anthropogenic influence.
La exuberante colonización de la superficie de hojas de plantas vasculares por líquenes y briófitas folícolas, los llamados "epífilos", es un fenómeno particular de bosques tropicales húmedos (Santesson 1952, Richards 1984, Gradstein y Pócs 1989, Sérusiaux 1989, Sipman y Harris 1989, Lücking 1995a). Con respecto a los líquenes, la mayor diversidad en el Neotrópico se encuentra en bosques húmedos de bajura, como en el Norte de Suramérica (Amazonas) o en Costa Rica en los bosques de la vertiente caribeña (Caño Negro, Tortuguero, Hitoy Cerere) y Pacífica Central y Sur (Carara, Corcovado; Lücking 1992a, 1992b, 1995a, 1997a). En un sitio pueden coexistir más de 200 especies, y en una hoja se han encontrado 48-82 especies (Lücking 1995a, 1998a, Lücking y Matzer, in prep.).
Costa Rica es el país con el más alto número de especies de líquenes folícolas reportadas hasta la fecha, con alrededor de 350 de las 550 especies que se conocen mundialmente (Lücking 1995a, d). La alta diversidad de zonas de vida que se encuentra en el país ha permitido estudios detallados sobre la distribución de especies con respecto a condiciones ambientales y tipos de vegetación (Lücking 1992a, 1992b, 1995a, 1997b). También ha sido investigada la distribución de especies dentro de un sitio, para establecer preferencias por determinados micrositios que se deben al microclima y a la composición de forófitos. Estos estudios, que se llevaron a cabo en el sendero Botarrama del Parque Nacional Braulio Carrillo, un bosque pluvial premontano, revelaron tres comunidades distintas de líquenes folícolas distribuidas en el sotobosque, en los claros y en el dosel (Lücking 1995b, 1998b-d).
Con base en estos resultados y incluyendo datos de estudios semejantes realizados en otras regiones (Busse 1905, Fitting 1910, Allan 1928, Santesson 1952, Nowak y Winkler 1970, Pócs 1978, Sérusiaux y de Sloover 1986, Sérusiaux 1989, Barillas et al. 1993), se estableció una lista de índices para 270 especies de líquenes folícolas, que permite la bioindicación de zonas altitudinales, estacionalidad, perturbaciones antropogénicas, y micrositios (Lücking 1997b).
En vista de lo que fue hecho anteriormente, los objectivos del presente trabajo, realizado en la Estación Biológica La Selva, fueron los siguientes: (1) Hacer por primera vez un inventario completo, incluyendo el dosel, de líquenes folícolas en un bosque tropical muy húmedo de bajura. (2) Aumentar el conocimiento de la biodiversidad que existe en La Selva y establecer una base para un inventario más amplio de líquenes y briófitas. (3) Estudiar la distribución de líquenes folícolas en diferentes micrositios dentro del bosque primario, así como en tipos de vegetación con diferentes grados de perturbación. (4) Comparar los resultados actuales con los obtenidos anteriormente en el sendero Botarrama, para establecer similitudes y diferencias en la composición de especies y la formación de comunidades entre un bosque muy húmedo de bajura y un bosque pluvial premontano pertenecientes al mismo ecosistema, el Parque Nacional Braulio Carrillo.
Materiales y Métodos
Área de estudio: La Estación Biológica La Selva está localizada en la vertiente Atlántica, al Norte de la Cordillera Volcánica Central en la Provincia de Heredia, Sarapiquí (Fig. 1A). Está conectada con el Parque Nacional Braulio Carrillo por un corredor que incluye un transecto sin interrupción desde La Selva a la cima del volcán Barva. La precipitación excede 4.000 mm anuales, y la vegetación principal consiste en bosque tropical muy húmedo de bajura, con parches de bosque pantanoso. También incluye vegetación secundaria de diferentes edades y grados de perturbación, además de parcelas de sucesión que permiten estudios comparativos de la dinámica de un bosque tropical (McDade et al. 1994).
El árbol característico de La Selva es Pentaclethra macroloba (Willd.) Ktze (Mimosaceae). En el subdosel se destacan las palmas Euterpe macrospadix Oersted, Iriartea deltoidea Ruíz & Pavón, Socratea exorrhiza (C. Martius) Wendland yWelfia georgii Wendland ex Burret. Parches de bosque secundario son dominados por Cecropia insignis Liebm., C. obtusifolia Bertol., Pourouma bicolor Martuis (Cecropiaceae), y Rollinia microsepala Standley (Annonaceae). Abundantes en el sotobosque son las palmas Asterogyne martiana (H. Wendl.) H. Wendl., Chamaedorea tepejilote Liebm., Geonoma congesta Wendland ex Spruce y G. cuneata Wendl. ex Spruce. Entre las dicotiledoneas hay que mencionar Ocotea atirrensis Mez & J. D. Smith ex Mez (Lauraceae) y Mabea occidentalis Benth. (Euphorbiaceae). Araceas como Anthurium bakeri Hook. f., Dieffenbachia longispatha Engler & K. Krause, Monstera tenuis K. Koch y Rhodospatha wendlandii Schott ex Engler crecen abundantemente en el suelo y como (hemi)epífitos (Hartshorn y Hammel 1994), todos como forófitos para los líquenes folícolas.
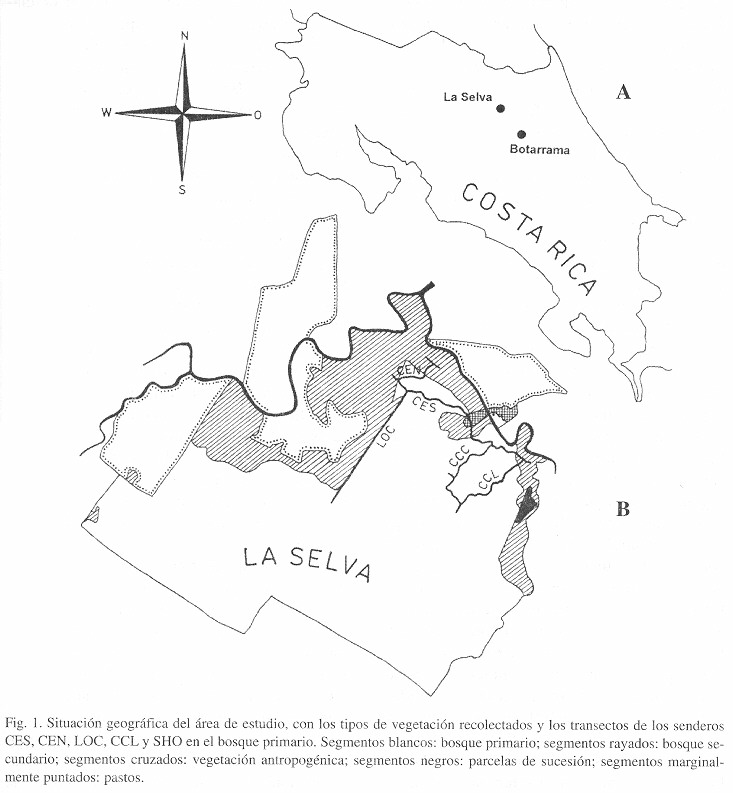
Trabajo de campo: El trabajo de campo se realizó de septiembre 1991 a enero 1992 y de enero a agosto de 1997. Fueron establecidos tres métodos de recolección: (1) Recolección general en todo el área de La Selva, con la finalidad de obtenerse el mayor número posible de especies, siguiendo las instrucciónes sugeridas por Lücking y Lücking (1996). (2) Recolección en cinco tipos de vegetacíon, para establecer probables diferencias en la diversidad y composición de especies: bosque primario, bosque secundario, parcelas de sucesión, margen de bosque, y vegetación antropogénica (Fig. 1B). (3) Recolección sistemática dentro del bosque primario, para establecer diferencias en la diversidad y composición de especies entre sotobosque, claros y el dosel, y sobre diversos tipos de forófitos. Para este objectivo, fueron seleccionados 100 forófitos, de los cuales 40 pertenecientes al sotobosque, 40 a claros, y 20 al dosel. Dentro del sotobosque y de los claros, cada 20 de los 40 forófitos representaron el tipo de hojas dicotiledoneas de tamaño mesofilo (hoja "normal" según Vareschi 1980), como se encuentra frecuentemente en la familias Annonaceae (Guatteria), Lauraceae (Ocotea), Meliaceae (Guarea), o Moraceae (Naucleopsis), entre otros, mientras que los otros 20 forófitos representaron el tipo de hoja palmera, típico para las familias Arecaceae y Cyclanthaceae. En el dosel, solamente se tomaron en cuenta hojas dicotiledoneas (Cecropia, Pourouma, Brosimum, Rollinia), ya que estas son mucho más frecuentes que palmas en este micrositio.
La selección de los 100 forófitos fue realizada a lo largo de los senderos CES, CEN, LOC, CCL y SHO, con cuatro transectos puestos en parches de bosque primario (Fig. 1B). Para diferenciar entre sotobosque y claros con respecto a la intensidad de luz relativa ("diffuse site factor"; Anderson 1964), fue utilizada una cámara fotográfica con lente "ojo de pez" y fue medido el tiempo de exposición en comparación con un punto fijado fuera del bosque. Usando una apertura que resulta en un tiempo de exposición de 1/1000 segundos fuera del bosque, del sotobosque fueron considerados forófitos con un tiempo de exposición de 1/8 a 1/15 segundos, lo que corresponde a una intensidad relativa de luz de 1-2 %. En los claros se tomaron en cuenta forófitos con un tiempo de exposición de 1/60 a 1/125 segundos (= 5-10 % de intensidad relativa de luz). En el dosel, fueron seleccionados forófitos con hojas completamente expuestas, lo que corresponde a una intensidad relativa de luz de 70-100 %. La recoleccion de las hojas del dosel fue realizada escalándose los árboles con la técnica establecida por Perry y Williams (1981) y también mediante cuerdas puestas con una ballesta encima de los árboles. En cada forófito fueron seleccionadas tres hojas de diferentes ramas, y se tomaron en cuenta solamente hojas con una cobertura relativa de líquenes folícolas estimada a por lo menos 20 %.
Los 100 forófitos seleccionados de esta manera no representan la abundancia exacta de micrositios y tipos de forófitos en el área de estudio. Por eso, a lo largo de los transectos se estimó también la abundancia actual de micrositios y tipos de forófitos: sotobosque vs. claros, forófitos con hojas de tipo dicotiledoneas vs. palmas vs. otros, y el porcentaje de forófitos con cobertura relativa de líquenes folícolas de al menos 20 % en hojas particulares. También se estimó la relación de área entre sotobosque, subdosel y dosel, tomando en cuenta la estratificación del bosque en tres estratos idealizados. Estas estimaciones se tomó como base para proyectar la abundancia actual de líquenes folícolas.
Determinación de líquenes folícolas: Para la determinación de líquenes folícolas, fueron utilizadas las claves de Santesson (1952), Kalb & Vzda (1988) y Lücking (1992c, 1997c), además de otras referencias recientes (Farkas & Sipman 1997). Colecciones representativas de especímenes fueron depositadas en el Herbario Nacional de Costa Rica (CR), en el Instituto de Biodiversidad (INBio), en el herbario de la Escuela de Biología de la Universidad de Costa Rica (USJ), en el herbario de la Estación Biológica La Selva (hb. La Selva), en el herbario del autor (hb. Lücking) y en la exsicata "Lichenes Foliicoli Exsiccati" (Lücking 1997d).
Evaluación de datos: La composición de especies de líquenes folícolas encontradas en cada uno de los 100 forófitos recolectados fue determinada. Para obtenerse la frecuencia de cada especie, se tomó en cuenta el número de forófitos en los cuales esta especie fue encontrada, también considerando la abundancia actual de diferentes micrositios y tipos de forófitos.
Para establecer similitudes en la composición de especies entre forófitos, fue realizado un análisis cluster, usando el método de agrupación de Ward y el índice de similaridad de Sørensen (1948): S = 2 na+b / (na + nb), donde S = índice de similaridad (con valores entre 0 y 1), na+b = número de especies de líquenes folícolas en común entre dos forófitos a y b, y na / nb = número de especies de líquenes folícolas presentes en los forófitos a y b, respectivamente. Para verificarse la existencia de patrones repetitivos, los 100 forófitos fueron separados en dos grupos de 50 individuos cada uno.
Diferencias significativas en la frecuencia de líquenes folícolas de diferentes micrositios o forófitos fueron comprobadas mediante una prueba de Chi-Cuadrado. Para ilustrar comunidades que resultan de estas diferencias, fue utilizado un análisis de asociaciones (Goodall 1978, Greig-Smith 1983), usando un valor de Chi-Cuadrado estándarizado según Lücking (1999d) para cada pareja de especies posible: stand. = (
2 / 100)1/2. Este valor tiene variación entre los valores de -1 y +1 y indica la co-occurrencia de especies que están significativamente arriba o abajo de lo esperado por su frecuencia. Los datos relacionados a las asociaciones multiples fueron inseridos en un programa de escala multidimensional para crear un diagrama bidimensional de estas especies.
Utilizando la frecuencia de especies en diferentes micrositios, se establecio un código de preferencia para cada especie, con base en el promedio relativo ("weighted average"; Gauch 1982, Jongman et al. 1995), dando a los micrositios los codigos 1 (sotobosque), 3 (claros), y 5 (dosel; vease Lücking 1997b): CP = (hsotobosque 1 + hclaros 3 + hdosel 5) / (hsotobosque + hclaros + hdosel), donde CP = código de preferencia y h = frecuencia absoluta de la especie en un micrositio dado. Estos códigos también fueron utilizados para la comparación con los índices de micrositio propuestos por Lücking (1997b).
Mediante un análisis de componentes principales ("principal component analysis"; Gauch 1982, Jongman et al. 1995), basado en la composición y frecuencia de líquenes folícolas, se hizo una ordinación de los cinco diversos tipos de vegetación, adicionalmente separando el bosque primario en sotobosque, claros y dosel. Todos los cálculos estadísticos fueron hechos utilizandose el programa STATISTICA 5.0, con excepción de los índices de Sørensen y el análisis de asociaciones que fueron calculados usando programas en Q-BASIC escritos por el autor.
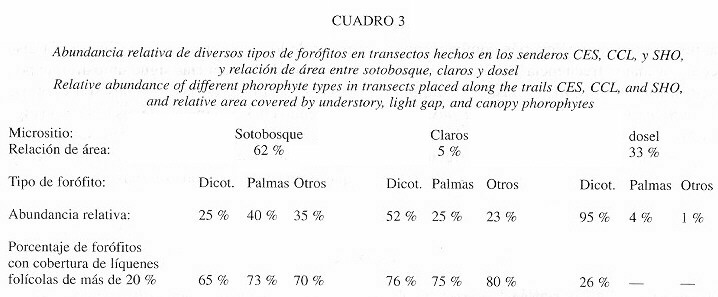
Diversidad y composición de especies: El inventario reveló 280 especies de líquenes folícolas en 54 géneros, 19 familias y 10 órdenes, además de 12 especies de hongos liquenícolas en 7 géneros y 7 familias (Cuadro 1). Sobre los 100 forófitos recolectados en el bosque primario fueron encontradas 221 especies. Los diez táxones más abundantes presentes en los 100 forófitos del bosque primario son Gyalectidium filicinum, Sporopodium leprieurii, Tricharia vainio, T. urceolata, Dimerella epiphylla, Porina epiphylla, Phyllobathelium epiphyllum, y Anisomeridium foliicola, los isidios de tipo Phyllophiale alba, y los campilidios de tipo Calopadia (Cuadro 2A). Si se considera la frecuencia relativa de los diversos tipos de forófitos, así como la proporción de área cubierta por sotobosque, claros y dosel (Cuadro 3), el resultado es diferente (Cuadro 2B). Aunque Gyalectidium filicinum, Sporopodium leprieurii y Tricharia vainioi se mantienen como especies más comunes, aparecen con maior frecuencia Porina epiphylla, P. rubentior, P. mirabilis, P. fusca, P. radiata, Trichothelium epiphyllum, Mazosia phyllosema, Arthonia leptosperma, y Strigula phyllogena, ya que son las especies más frecuentes en el sotobosque.
| Líquenes folícolas autónomos: | Calopadia fusca (Müll. Arg.) V |
| Calopadia phyllogena (Müll. Arg.) V |
|
| ARTHONIALES: ARTHONIACEAE | Calopadia puiggarii (Müll. Arg.) V |
| Lasioloma arachnoideum (Kremp.) R. Sant. | |
| Amazonomyces farkasiae (R. Lücking) R. Lücking & Sérus. | Loflammia flammea (Müll. Arg.) V |
| Arthonia accolens Stirt. | Loflammia gabrielis (Müll. Arg.) V |
| Arthonia aciniformis Stirt. | Pseudocalopadia mira R. Lücking ined. |
| Arthonia cyanea Müll. Arg. | Sporopodium antonianum Elix, Lumbsch & R. Lücking. |
| Arthonia leptosperma (Müll. Arg.) R. Sant. | Sporopodium citrinum (Zahlbr.) Elix, Lumbsch & Lücking |
| Arthonia mira R. Sant. | Sporopodium leprieurii Mont. |
| Arthonia orbygniae (H. B. P. Upadhyay) Matzer | Sporopodium phyllocharis (Mont.) Massal. |
| Arthonia palmulacea (Müll. Arg.) R. Sant. | Tapellaria epiphylla (Müll. Arg.) R. Sant. |
| Arthonia trilocularis Müll. Arg. | Tapellaria phyllophila (Stirt.) R. Sant. |
| Cryptothecia candida (Kremp.) R. Sant. | Tapellariopsis octomera R. Lücking ined. |
| Cryptothecia sp. A | |
| Cryptothecia sp. B | LECANORALES: PANNARIACEAE |
| Cryptothecia sp. C | |
| Cryptothecia sp. D | Pannaria sp. |
| Eremothecella calamicola Syd. | |
| LECANORALES: PILOCARPACEAE | |
| ARTHONIALES: OPEGRAPHACEAE | |
| Badimia dimidiata (Babingt. ex Leight.) V |
|
| Mazosia bambusae (Vain). R. Sant. | Badimia cf. galbinea (Krempelh.) V |
| Mazosia dispersa (Hedr.) R. Sant. | Byssolecania deplanata (Müll. Arg.) R. Sant. |
| Mazosia longispora R. Lücking & Matzer | Byssolecania fumosonigricans (Müll. Arg.) R. Sant. |
| Mazosia melanophthalma (Müll. Arg.) R. Sant. | Byssolecania imenocarpa (Vain) Kalb, V |
| Mazosia paupercula (Müll. Arg.) R. Sant. | Byssolecania variabilis Vzda, Kalb & R. Lücking |
| Mazosia phyllosema (Nyl.) Zahlbr. | Byssoloma absconditum Farkas & V |
| Mazosia pilosa Kalb & V |
Byssoloma aurantiacum Kalb & V |
| Mazosia praemorsa (Stirt.) R. Sant. | Byssoloma chlorinum (Vain.) Zahlbr. |
| Mazosia pseudobambusae Kalb & V |
Byssoloma fadenii V |
| Mazosia rotula (Mont.) A. Massal. | Byssoloma leucoblepharum (Nyl.) Vain. |
| Mazosia rubropunctata R. Sant. | Byssoloma minutissimum Kalb & V |
| Mazosia tenuissima R. Lücking & Matzer | Byssoloma subdiscordans (Nyl.) P. James |
| Opegrapha lambinonii Sérus. | Byssoloma tricholomum (Mont.) Zahlbr. |
| Byssoloma vanderystii Sérus. | |
| DOTHIDEALES: MICROTHELIOPSIDACEAE | Byssoloma wettsteinii (Zahlbr.) Zahlbr. |
| Fellhanera angustispora R. Lücking | |
| Microtheliopsis uleana Müll. Arg. | Fellhanera aff. angustispora R. Lücking |
| Fellhanera badimioides R. Lücking, Lumbsch & Elix | |
| DOTHIDEALES: Genera incertae sedis | Fellhanera bouteillei (Desm.) V |
| Fellhanera dictyospora R. Lücking | |
| Caprettia nyssaegenoides Sérus. ined. | Fellhanera fuscatula (Müll. Arg.) V |
| Lyromma nectandrae Bat. &. H. Maia | Fellhanera lisowskii (V |
| Lyromma palmae (Cavalc. & Silva) R. Lücking & Serus. | Fellhanera longispora R. Lücking |
| Fellhanera cf. misionensis Ferraro & Lücking ined. | |
| GRAPHIDALES: THELOTREMATACEAE | Fellhanera muhlei R. Lücking |
| Fellhanera paradoxa (V |
|
| Chroodiscus australiensis Lumbsch & V |
Fellhanera pilomarginata R. Lücking |
| Chroodiscus coccineus (Leight.) Müll. Arg. | Fellhanera rhapidophylli (Rehm) V |
| Chroodiscus neotropicus Kalb & V |
Fellhanera rubida (Müll. Arg.) R. Lücking |
| Fellhanera santessonii Barillas & Lücking | |
| GYALECTALES: GYALECTACEAE | Fellhanera stanhopeae (Müll. Arg.) Lücking et al. |
| Fellhanera subternella (Nyl.) V |
|
| Coenogonium interplexum Nyl. | Fellhanera tricharioides R. Lücking ined. |
| Coenogonium interpositum Nyl. | Fellhanera verrucifera R. Lücking |
| Coenogonium linkii Ehrenb. | |
| Coenogonium ciliatum Kalb. & R. Lücking | MELANOMMATALES: ASPIDOTHELIACEAE |
| Dimerella dilucida (Kremp.) R. Sant. | |
| Dimerella epiphylla (Müll. Arg.) Malme | Aspidothelium arachnoideum R. Lücking ined. |
| Dimerella fallaciosa (Müll. Arg.) V |
Aspidothelium fugiens (Müll. Arg.) R. Sant. |
| Dimerella flavicans V |
Aspidothelium geminiparum (Malme) R. Sant. |
| Dimerella hypophylla V |
Aspidothelium papillicarpum R. Lücking ined. |
| Dimerella isidiifera R. Lücking ined. | |
| Dimerella lisowskii V |
MELANOMMATALES: MONOBLASTIACEAE |
| Dimerella cf. lutea (Dicks.) Trevis. | |
| Dimerella minima (Müll. Arg.) R. Sant. | Anisomeridium foliicola R. Sant. & Tibell |
| Dimerella siquirrensis R. Lücking ined. | Anisomeridium sp. A |
| Dimerella vezdana R. Lücking ined. | Anisomeridium sp. B |
| Musaespora kalbii R. Lücking & Sérus. | |
| LECANORALES: BACIDIACEAE | |
| MELANOMMATALES: STRIGULACEAE | |
| Bacidia corallifera R. Lücking | |
| Bacidia nigrescens (Müll. Arg.) Vain. | Flavobathelium epiphyllum R. Lücking, Aptroot & Thor |
| Bacidia psychotriae (Müll. Arg.) Zahlbr. | Phyllobathelium anomalum R. Lücking ined. |
| Bacidina apiahica (Müll. Arg.) V |
Phyllobathelium epiphyllum (Müll. Arg.) Müll. Arg. |
| Bacidina defecta V |
Phyllobathelium leguminosae (Cavalc. & Silva) Lücking |
| Bacidina hypophylla R. Lücking & Kalb ined. | & Sérus. |
| Bacidina mirabilis (V |
Strigula antillarum (Fée) Müll. Arg. |
| Bacidina pallidocarnea (Müll. Arg.) V |
Strigula concreta (Fée) R. Sant. |
| Bacidina scutellifera (V |
Strigula janeirensis (Müll. Arg.) R. Lücking |
| Bapalmuia lineata R. Lücking ined. | Strigula macrocarpa Vain. |
| Bapalmuia palmularis (Müll. Arg.) Sérus. | Strigula maculata (Cooke & Massee) R. Sant. |
| Bapalmuia aff. palmularis (Müll. Arg.) Sérus. | Strigula microspora R. Lücking |
| Woessia pseudohyphophorifera R. Lücking & Sérus. | Strigula nemathora Mont. |
| Strigula nigrocarpa R. Lücking | |
| LECANORALES: COCCOCARPIACEAE | Strigula nitidula Mont. |
| Strigula obducta (Müll. Arg.) R. C. Harris | |
| Coccocarpia domingensis Vain. | Strigula phyllogena (Müll. Arg.) R. C. Harris |
| Coccocarpia palmicola (Spreng.) L. Arvidss. & D. Gall. | Strigula platypoda (Müll. Arg.) R. C. Harris |
| Coccocarpia pellita (Ach.) Müll. Arg. | Strigula prasina Müll. Arg. |
| Coccocarpia stellata Tuck.. | Strigula schizospora R. Sant. |
| Strigula smaragdula Fr. | |
| LECANORALES: COLLEMATACEAE | Strigula subelegans Vain. |
| Strigula subtilissima (Fée) Müll. Arg. | |
| Leptogium sp. | Strigula viridis (R. Lücking) R. C. Harris |
| LECANORALES: ECTOLECHIACEAE | OSTROPALES: ASTEROTHYRIACEAE |
| Calopadia foliicola (Fée) V |
Asterothyrium cf. anomalum Kalb & V |
| Asterothyrium argenteum Müll. Arg. | Porina fusca R. Lücking |
| Asterothyrium aulaxinoides R. Lücking ined. | Porina guianensis R. Lücking & V |
| Asterothyrium chroodisciforme R. Lücking ined. | Porina imitatrix Müll. Arg. |
| Asterothyrium hedbergii Kalb & V |
Porina leptosperma Müll. Arg. |
| Asterothyrium leucophthalmum (Müll. Arg.) R. Sant. | Porina leptospermoides Müll. Arg. |
| Asterothyrium microsporum R. Sant. | Porina limbulata (Kremp.) Vain. |
| Asterothyrium monosporum Müll. Arg. | Porina lucida R. Sant. |
| Asterothyrium pittieri Müll. Arg. | Porina mirabilis R. Lücking & V |
| Asterothyrium rondoniense Bat. & Maia ex Henssen & R. | Porina nitidula Müll. Arg. |
| Lücking | Porina octomera (Müll. Arg.) F. Schill. |
| Asterothyrium tetrasporum R. Lücking ined. | Porina papillifera (Stirt.) F. Schill. |
| Asterothyrium uniseptatum R. Lücking ined. | Porina pseudoapplanata R. Lücking & Cáceres |
| Gyalidea epiphylla V |
Porina radiata R. Lücking, Kalb & V |
| Linhartia albomaculans (Rehm) Sacc. & Syd. | Porina repanda (Stirt.) R. Lücking & R. Sant ined. |
| Linhartia patellarioides (Rehm) Vzda | Porina rubentior (Stirt.) Müll. Arg. |
| Linhartia vezdana R. Lücking | Porina rubescens (R. Lücking) Hafellner & Kalb |
| Psorotheciopsis premneella (Müll. Arg.) R. Sant. | Porina rubrosphaera R. Sant. |
| Porina rufula (Kremp.) Vain. | |
| OSTROPALES: GOMPHILLACEAE | Porina subepiphylla R. Lücking & V |
| Porina tetramera (Malme) R. Sant. | |
| Actinoplaca strigulacea Müll. Arg. | Porina triseptata (V_zda) R. Lücking |
| Aulaxina dictyospora R. Sant. | Porina vezdae R. Lücking |
| Aulaxina intermedia R. Lücking | Trichothelium alboatrum Vain. |
| Aulaxina microphana (Vain.) R. Sant. | Trichothelium annulatum (Karst.) R. Sant. |
| Aulaxina minuta R. Sant. | Trichothelium bipindense F. Schill. |
| Aulaxina opegraphina Fée | Trichothelium epiphyllum Müll. Arg. |
| Aulaxina quadrangula (Stirt.) R. Sant. | Trichothelium juruense (P. Henn.) F. Schill. |
| Aulaxina caleniopsidoides R. Lücking & Cáceres ined. | Trichothelium longisporum R. Lücking |
| Bullatina aspidota (Vain.) V |
Trichothelium minus Vain. |
| Calenia chroodisciformis R. Lücking ined. | Trichothelium minutum (R. Lücking) R. Lücking |
| Calenia conspersa (Stirt.) R. Sant. | Trichothelium mirum R. Lücking |
| Calenia echinoplacoides R. Lücking & Cáceres ined. | Trichothelium pallescens (Müll. Arg.) F. Schill. |
| Calenia graphidea Vain. | Trichothelium pallidesetum R. Lücking |
| Calenia lobulata R. Lücking | Trichothelium porinoides V |
| Calenia monospora V |
Trichothelium sipmanii R. Lücking |
| Calenia phyllogena (Müll. Arg.) R. Sant. | Trichothelium ulei (P. Henn.) Höhnel |
| Calenia rolandiana Hartmann | |
| Calenia solorinoides R. Lücking | VERRUCARIALES: VERRUCARIACEAE |
| Calenia thelotremella Vain. | |
| Calenia triseptata Zahlbr. | Mazentina cererensis R. Lücking ined. |
| Caleniopsis laevigata (Müll. Arg.) V |
Mazentina perminuta V |
| Echinoplaca cf. atrofusca R. Sant. | Mazentina sp. |
| Echinoplaca bispora Kalb & V |
Phylloblastia amazonica Kalb & V |
| Echinoplaca campanulata Kalb & V |
Pocsia septemseptata V |
| Echinoplaca diffluens (Müll. Arg.) R. Sant. | |
| Echinoplaca epiphylla Fée | BASIDIOLICHENES |
| Echinoplaca furcata Sérus. | |
| Echinoplaca gemmifera R. Lücking | Dictyonema phyllogena (Müll. Arg.) Zahlbr. |
| Echinoplaca hymenocarpoides (Vain.) R. Lücking | |
| Echinoplaca cf. intercedens V |
LICHENES IMPERFECTI |
| Echinoplaca leucotrichoides (Vain.) R. Sant. | |
| Echinoplaca marginata R. Lücking | Phyllophiale alba R. Sant. |
| Echinoplaca melanotrix R. Lücking | Phyllophiale fusca R. Sant. |
| Echinoplaca pellicula (Müll. Arg.) R. Sant. | Phyllophiale viridis.R. Lücking & Cáceres |
| Echinoplaca tricharioides Kalb & V |
|
| Echinoplaca triseptata R. Lücking | Hongos lichenícolas: |
| Gyalectidium catenulatum (Cavalc. & Silva) Ferraro et al. | |
| Gyalectidium eskuchei Sérus. | ARTHONIALES: ARTHONIACEAE |
| Gyalectidium filicinum Müll. Arg. | |
| Gyalectidium imperfectum V |
Arthonia cinnabarinula Müll. Arg. |
| Gyalideopsis intermedia R. Lücking | Arthonia cryptotheciae R. Sant. ex Matzer & R. Sant. |
| Gyalideopsis rubescens V |
|
| Gyalideopsis vulgaris (Müll. Arg.) R. Lücking | ARTHONIALES: OPEGRAPHACEAE |
| Gyalideopsis sp. | |
| Paratricharia paradoxa (R. Lücking) R. Lücking | Opegrapha sipmanii Matzer |
| Tricharia albostrigosa R. Sant. | |
| Tricharia amazonum Zahlbr. | DOTHIDEALES: DACAMPIACEAE |
| Tricharia carnea (Müll. Arg.) R. Sant. | |
| Tricharia heterella (Stirt.) R. Lücking | Pyrenidium santessonii R. Lücking |
| Tricharia hyalina Kalb & V |
Pyrenidium sporopodiorum Matzer |
| Tricharia lancicarpa Kalb & V |
Pyrenidium zamiae Matzer |
| Tricharia longispora Kalb & V |
|
| Tricharia planicarpa R. Lücking | DOTHIDEALES: HYSTERIACEAE |
| Tricharia helminthospora R. Sant. | |
| Tricharia urceolata (Müll. Arg.) R. Sant. | Hemigrapha tenellula (Müll. Arg.) R. Sant. ex Matzer |
| Tricharia vainioi R. Sant. | Hemigrapha strigulae Matzer |
| TRICHOTHELIALES: TRICHOTHELIACEAE | DOTHIDEALES: MYCOSPHAERELLACEAE |
| Porina andreana R. Lücking & V |
Stigmidium porinae Matzer |
| Porina annulata Schubert, Greber & R. Lücking ined. | |
| Porina aff. aspera V |
OSTROPALES: GOMPHILLACEAE |
| Porina atriceps (Vain.) Vain. | |
| Porina atrocoerulea Müll. Arg. | Gyalideopsis cochlearifer Sérus. & R. Lücking |
| Porina atropunctata R. Lücking & V |
Gyalideopsis parvula Hafellner & V |
| Porina conspersa Malme | |
| Porina curtula Malme | SPHAERIALES: NECTRIACEAE |
| Porina epiphylla (Fée) Fée | Nectria sp. |
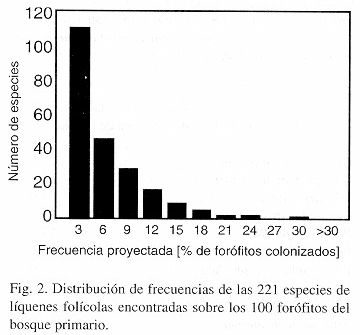
Basándose en la frecuencia proyectada a partir de los 100 forófitos investigados, la distribución de frecuencias sigue un patrón exponencial: la mitad de las especies son escasas, creciendo en 3 % o menos de los forófitos (Fig. 2). A esto hay que agregar las 59 especies que no fueron encontradas en los 100 forófitos y que supuestamente son aún más raras.

Patrones de diversidad ,
,
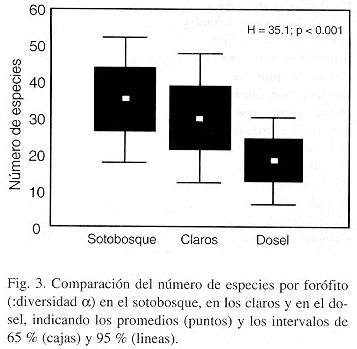
: La diversidad promedia de especies por forófito, o diversidad
, varía significativamente entre los tres tipos de micrositios (test de Kruskal & Wallis: H = 35.1, p < 0.001): es más alta en el sotobosque (35 especies/forófito) que en los claros (30), y relativamente baja en el dosel (18; Fig. 3). El número total de especies por tipo de micrositio, o diversidad
, se comporta parcialmente diferente: es más alta en los claros (169 especies/micrositio) que en el sotobosque (157), pero también baja en el dosel (65). Esto indica una diversidad
más alta en los claros en comparación con el sotobosque, lo que significa que los forófitos en los claros son menos homógenos en su composición de líquenes folícolas que los forófitos en el sotobosque.
La diversidad es mayor en las palmas del sotobosque (37.2 ± 10.2) en comparación con las dicotiledoneas (33.4 ± 6.7) pero menor en las palmas de los claros (27.9 ± 10.7) vs. las dicotiledoneas (32.4 ± 6.8). Sin embargo, estas diferencias no son significativas (test de Mann-Whitney: U = 157, p = 0.244 para el sotobosque; U = 143.5, p = 0.126 para los claros). En ambos casos, la variabilidad en la diversidad (deviación estándar) es más grande en palmas que en dicotiledoneas (10.2-10.7 vs. 6.7-6.8). No hay una diferencia entre las dicotiledoneas del sotobosque y los claros mientras que la diferencia en relación con las palmas es significativa (test de Mann-Whitney: U = 103, p = 0.009), así que la diferencia entre sotobosque y claros en la diversidad se debe principalmente a las palmas.
Agrupación de forófitos: Los dos dendrogramas muestran un patrón muy semejante (Fig. 4A-B). Los forófitos forman 3 grupos separados que corresponden a los tres tipos de micrositios: sotobosque, claros y del dosel, indicando diferencias significativas en la composición de especies de líquenes folícolas en cada tipo de micrositio. En cuanto a los tipos de forófitos (dicotiledoneas vs. palmas), solo se forman algunos grupos pequeños: se notan seis grupos de dicotiledoneas de 3-5 miembros cada uno, mientras que las palmas forman dos grupos de 4 y 6 miembros. Los dos forófitos del sotobosque que se encuentran en el grupo de los claros (Fig. 4B) son palmas. Aparentemente, entre dicotiledoneas hay más semejanzas en la composición de especies que entre palmas, y en algunas palmas el tipo de forófito es más importante que el microclima.
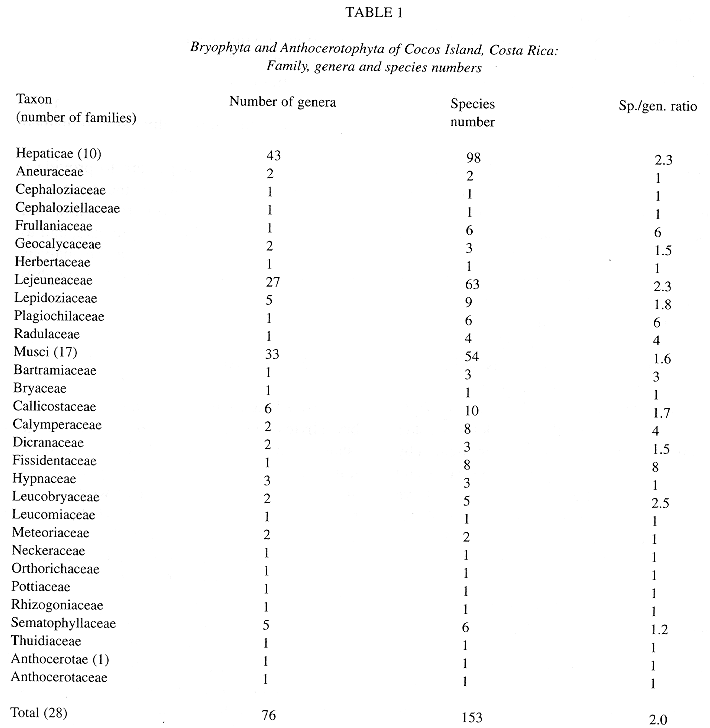
Preferencias de micrositios: En cuanto a sus preferencias por micrositios, las especies pueden ser divididas en seis grupos (Cuadro 4). El grupo 1 consiste en especies que crecen con alta frecuencia sobre forófitos del sotobosque pero son raras en los otros micrositios, mientras que las especies del grupo 2 son intermedias entre sotobosque y claros. Estos dos grupos son dominados por las familias Arthoniaceae, Opegraphaceae, Pilocarpaceae, Strigulaceae (especies supracuticulares), y Trichotheliaceae. El grupo 3 está formado por especies con alta frecuencia en claros, y en el grupo 4 se encuentran especies con transición al dosel. Ambos grupos tienen en común especies de las familias Ectolechiaceae, Gomphillaceae, y Strigulaceae (especies subcuticulares). Finalmente, el grupo 5 está formado por especies con alta frecuencia en o restritas al dosel. Destácanse en este último grupo las familias Asterothyriaceae y Gomphillaceae.
| Grupo 1: | Trichothelium ulei | Tricharia carnea |
| Características del sotobosque | Tricharia planicarpa | |
| Grupo 2: | Trichothelium sipmanii | |
| Amazonomyces farkasiae | Intermedias entre sotobosque y claros | |
| Arthonia accolens | Grupo 4: | |
| Arthonia leptosperma | Anisomeridium foliicola | Intermedias entre claros y dosel |
| Arthonia palmulacea | Arthonia aciniformis | |
| Aspidothelium papillicarpum | Aulaxina minuta | Asterothyrium microsporum |
| Bapalmuia lineata | Byssoloma leucoblepharum | Aulaxina opegraphina |
| Bapalmuia palmularis | Calenia graphidea | Aulaxina quadrangula |
| Badimia dimidiata | Calenia phyllogena | Bacidina apiahica |
| Byssolecania deplanata | Calopadia phyllogena | Calopadia puiggarii |
| Byssolecania fumosonigricans | Chroodiscus coccineus | Dimerella epiphylla |
| Byssoloma minutissimum | Chroodiscus australiensis | Echinoplaca hymenocarpoides |
| Cryptothecia candida | Eremothecella calamicola | Echinoplaca verrucifera |
| Dimerella flavicans | Fellhanera lisowskii | Fellhanera bouteillei |
| Dimerella siquirrensis | Gyalideopsis vulgaris | Lasioloma arachnoideum |
| Fellhanera badimioides | Mazosia rotula | Strigula antillarum |
| Fellhanera rhapidophylli | Phyllophiale alba | Strigula nitidula |
| Fellhanera santessonii | Phyllobathelium epiphyllum | Strigula smaragdula |
| Flavobathelium epiphyllum | Porina leptosperma | Tapellaria nana |
| Gyalidea epiphylla | Porina subepiphylla | |
| Mazosia melanophthalma | Porina tetramera | Grupo 5: |
| Mazosia phyllosema | Sporopodium antonianum | Características para dosel |
| Mazosia pilosa | Sporopodium leprieurii | |
| Mazosia tenuissima | Strigula nemathora | Asterothyrium argenteum |
| Microtheliopsis uleana | Trichothelium bipindense | Asterothyrium leucopthalmum |
| Paratricharia paradoxa | Trichothelium minutum | Asterothyrium monosporum |
| Porina atropunctata | Asterothyrium pittieri | |
| Phylloblastia amazonica | Grupo 3: | Asterothyrium rondoniense |
| Phyllophiale fusca | Características para claros | Asterothyrium tetrasporum |
| Porina epiphylla | Asterothyrium uniseptatum | |
| Porina fusca | Bacidina scutellifera | Bullatina aspidota |
| Porina imitatrix | Byssoloma chlorinum | Calenia solorinoides |
| Porina limbulata | Calenia depressa | Echinoplaca triseptata |
| Porina lucida | Calopadia foliicola | Gyalectidium catenulatum |
| Porina mirabilis | Calopadia fusca | Pseudocalopadia mira |
| Porina radiata | Echinoplaca epiphylla | Psorotheciopsis patellarioides |
| Porina rubentior | Echinoplaca leucotrichoides | Psorotheciopsis philippinensis |
| Porina rufula | Echinoplaca pellicula | Psorotheciopsis premneella |
| Strigula maculata | Gyalectidium imperfectum | |
| Strigula phyllogena | Loflammia flammea | Grupo 6: |
| Strigula platypoda | Tapellaria epiphylla | Especies Indiferentes |
| Tricharia heterella | Phyllobathelium leguminosae | Aspidothelium fugiens |
| Tricharia hyalina | Porina atrocoerulea | Actinoplaca strigulacea |
| Trichothelium annulatum | Porina nitidula | Gyalectidium filicinum |
| Trichothelium epiphyllum | Sporopodium citrinum | Tricharia urceolata |
| Trichothelium pallescens | Strigula schizospora | Tricharia vainioi |
Las cinco especies del grupo 6 son indiferentes, entre ellas cuatro de la familia Gomphillaceae: Actinoplaca strigulacea, Gyalectidium filicinum, Tricharia urceolata, y T. vainioi. Estas especies se puede considerar como generalistas. El resto de las especies, que conforman más de la mitad de la diversidad total, no demuestran preferencias significativas porque son demasiado raras.
Preferencias de forófitos: De los 221 táxones encontrados en los 100 forófitos, solamente 26 muestran diferencias significativas en sus frecuencias sobre dicotiledoneas o palmas (Cuadro 5), así confirmando el bajo grado de preferencias forofíticas obvio en los dendrogramas. De estas 26 especies, 15 prefieren forófitos del sotobosque y 11 forófitos de claros. Mientras especies que suelen preferir dicotiledoneas en el sotobosque son escasas, 12 especies prefieren palmas en el sotobosque: Arthonia palmulacea, Byssoloma wettsteinii, Calenia triseptata, Chroodiscus coccineus, Eremothecella calamicola, Fellhanera badimioides, F. lisowskii, F. santessonii, Tricharia helminthospora, T. heterella, T. hyalina, y T. urceolata. Nueve especies muestran tendencias no significativas en relación con estos micrositios. Puede ser destacada la frecuencia de especies de Fellhanera, del grupo de Byssoloma minutissimum, y de Tricharia en este grupo.

En los claros, ocho especies muestran preferencias significativas por dicotiledoneas, mientras ocho tienen tendencias no significativas. Aquí se destaca la frecuencia de especies de Bacidina y Strigula. Solo tres especies suelen preferir palmas, y cinco más tienen tendencias no significativas en los claros. Por lo tanto, se puede concluir que, aparentemente, las preferencias por diferentes forófitos son más pronunciadas en el sotobosque que en los claros, y en el sotobosque hay más preferencias por palmas mientras que en claros hay más preferencias por dicotiledoneas.
Asociaciones de especies y comunidades: El diagrama de asociaciones muestra tres asociaciones principales y dos subasociaciones (Fig. 5). Los tres asociaciones principales corresponden a los grupos de especies 1, 3, y 5, respectivamente (véase Cuadro 4), o sea a los diferentes micrositios: sotobosque, claros, y dosel. Las dos subasociaciones estan formadas por especies que prefieren hojas de palmas o dicotiledoneas en el sotobosque (vease Cuadro 5), con la asociación sobre palmas siendo relativamente grande. El género Porina [números 92-100, 102-104 en Fig. 5] se destaca como grupo característico en el sotobosque, el género Echinoplaca [79-82] en los claros y el género Asterothyrium [62-67] en el dosel. Dentro de un género, las especies con cuerpos fructíferos más oscuros crecen en micrositios más abiertos, como se puede observar comparando Calenia depressa [75; apotecios oscuros] con C. phyllogena [77] y C. graphidea [76; apotecios claros], o Calopadia puiggarii [29; apotecios oscuros] con C. fusca [28; apotecios claros]. Solo dos especies de Porina, P. atrocoerulea [91] y P. nitidula [101], crecen en los claros; ambos tienen peritecios negros.
Las tres especies de Gyalectidium demuestran una diferenciación interesante: G. filicinum es generalista, pero más común en sotobosque y claros, mientras que G. imperfectum es más abundante en claros y G. catenulatum está restringida al dosel. En el caso de Trichothelium sipmanii, la forma con esporas 7-septadas es más común en los claros, mientras la forma con esporas 8-11-septadas es más común en el sotobosque.
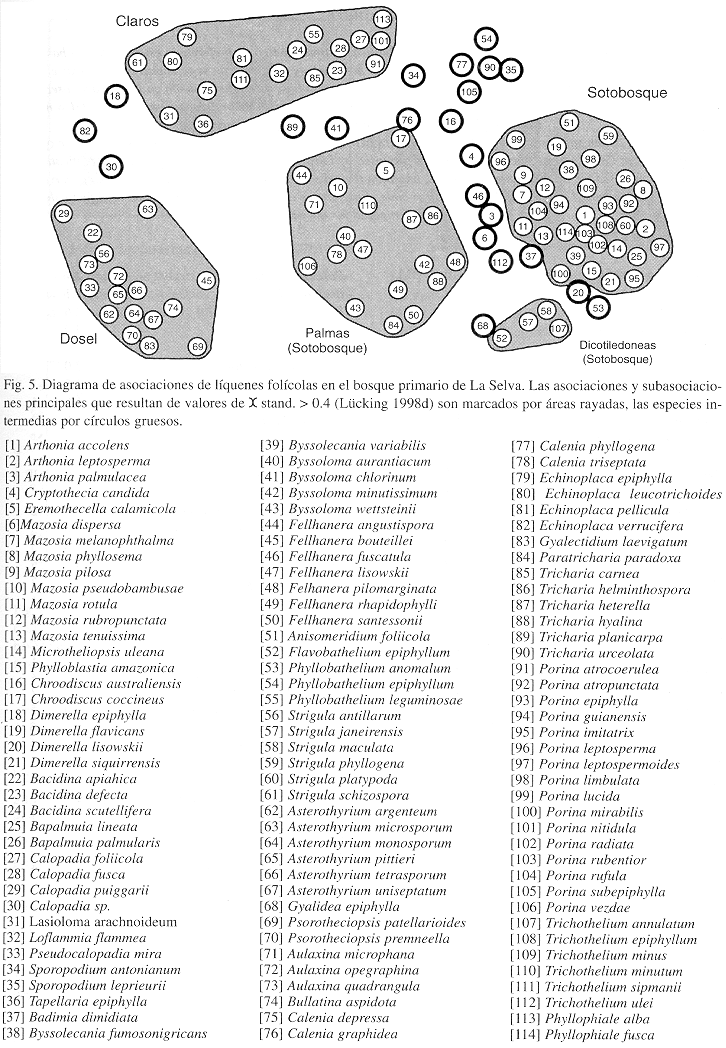
Indices de micrositios: Las variables microclimáticas tiene gran correlación con los índices de micrositios propuestos por Lücking (1997b), con excepción del sotobosque y el grupo intermedio entre sotobosque y claros que no parecen bien separados (Fig. 6). Con base en estos resultados, y considerando especies con una frecuencia alta, se propone una modificación del índice de micrositios para 53 del los 270 especies incluidas en la lista original (Lücking 1997b), mientras que para otras 19 especies se propone por primera vez un índice (Cuadro 6).

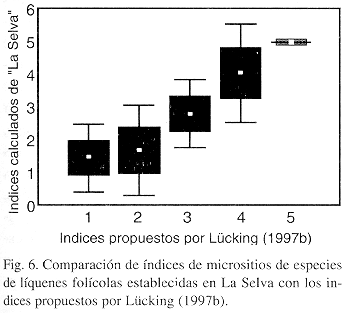
Comparación florística de cinco diversos tipos de vegetación: Comparando el sotobosque primario, el margen del bosque primario y el sotobosque secundario, no hay diferencias significativas en la diversidad de especies; incluso, la diversidad parece más alta en el bosque secundario (Fig. 7). En la vegetación antropogénica y especialmente en las parcelas de sucesión la diversidad es drasticamente reducida (Fig. 7).
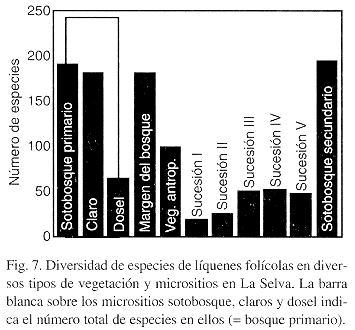
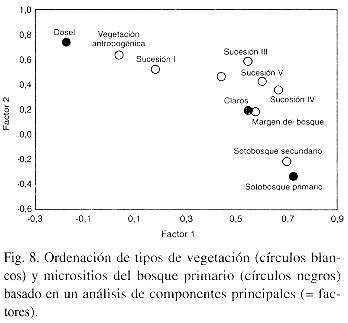
La composición de especies de los diversos tipos de vegetación puede ser proyectada en una linea mediante una ordinación por componentes principales, con el sotobosque primario y el dosel del bosque primario siendo las extremas (Fig. 8). En esta comparación, el margen del bosque se asemeja a los claros dentro del bosque primario, mientras que la vegetación antropogénica y las parcelas de sucessión se encuentran entre los claros y el dosel.
Discusión
El número de 280 especies de líquenes folícolas es el más alto de todos los sitios investigados hasta la fecha, incluso el sendero Botarrama en el parque nacional Braulio Carrillo, donde se encontró 217 especies (Lücking 1999a). Esta diversidad se debe parcialmente a la consideración de especies facultativamente folícolas en los géneros Coccocarpia (2), Coenogonium (3), Cryptothecia (4), Leptogium (1) y Pannaria (1). Sin embargo, aún sin estas especies la diversidad en La Selva sigue siendo excepcionalmente alta, confirmando la hipótesis que líquenes folícolas son generalmente más diversos en bosques de bajura (Lücking 1995a, 1997b). Los especies encontrados en La Selva significan 80-85 % de todas las especies comunicadas para Costa Rica (Lücking 1995a) y aproximadamente 50 % de las especies conocidas mundialmente (Farkas & Sipman 1997), así que se destaca como un sitio representativo a nivel mundial para líquenes folícolas. La distribución de frecuencias demuestra la importancia de especies raras para la diversidad, ya que suman más que la mitad del número total.
La Selva probablemente es el sitio mejor estudiado en el Neotrópico en cuanto a la diversidad de especies (McDade et al. 1994). Hasta la fecha se han encontrado alrededor de 1700 especies de plantas vasculares y 705 vertebrados. Para briófitas se puede estimar un número de 200-250 especies, entre ellas 60-80 epífilas (A. Lücking 1997). Estudios preliminares en líquenes cortícolas en otras regiones (Sipman 1995, Aptroot 1997) sugieren 250-300 especies para un bosque muy húmedo de bajura como La Selva. La presente lista de líquenes folícolas aumenta considerablemente el conocimiento de la diversidad de La Selva. La densidad de especies con 50 % de los táxones conocidos mundialmente es particularmente impresionante cuando se compara con plantas vasculares y vertebrados, donde estos porcentajes alcanzan 0.7 % y 1.6 %, respectivamente. Este fenómeno se debe al hecho de que criptógamas no vasculares tienen una distribución muy amplia (Grolle 1968, Lücking 1995a).
Una comparación entre La Selva y el sendero Botarrama (Lücking 1999a) muestra un alto grado de similaridad con 80 %. La gran mayoría de especies discriminativas entre los dos sitios prefiere zonas bajas o zonas más altas. Especies típicas para el bosque de bajura (Lücking 1997b) y solamente presentes en La Selva incluyen Bacidia nigrescens, Bapalmuia spp., Byssolecania spp., Calenia conspersa, Cryptothecia spp., Dimerella hypophylla, Fellhanera badimioides, F. lisowskii, Loflammia gabrielis, Mazosia praemorsa, Porina guianensis, P. imitatrix, P. papillifera, P. radiata, P. repanda, Strigula janeirensis, Tricharia amazonum, T. carnea, y Trichothelium pallescens. Especies frecuentes en zonas más altas y solamente presentes en el sendero Botarrama son Aspidothelium cinerascens, Byssoloma multipunctata, Calenia subdepressa, Echinoplaca lucernifera, E. serusiauxii, Fellhanera emarginata, Gyalideopsis spp., Tricharia farinosa, T. pseudosantessonii, Trichothelium album, T. echinocarpum, y T. poeltii. Esto confirma que el sendero Botarrama en cuanto a su composición de líquenes folícolas es intermedio entre un bosque de bajura y un bosque montano (Lücking 1999a), mientras que la composición de especies en La Selva es típica para un bosque de bajura.
Los patrones de diversidad (,
,
) son comparables con los encontrados en el sendero Botarrama. En particular, la diversidad
entre forófitos siempre parece más alta en los claros que en el sotobosque, lo que se explica por el hecho de que la dispersión de líquenes folícolas es más estocástico en los claros y más determinístico en el sotobosque (Lücking 1998a). La principal importancia del microclima para la composición de especies de líquenes folícolas también es consistente con los resultados encontrados en el sendero Botarrama (Lücking 1998b). En general, preferencias por forófitos parecen ser muy sútiles; los patrones más distinctos encontrados en La Selva se deben al hecho de que en el presente caso fueron seleccionados solamente dos tipos principales de forófitos, mientras que en el Botarrama se investigaron un gran número de forófitos diferentes (Lücking 1998a, 1999a). Obviamente, en el caso de palmas el forófito es más importante que el micrositio, lo que se podría explicar por el hecho de que palmas tienen hojas relativamente grandes que forman un microclima particular menos influenciado por el micrositio. Por eso, en palmas situadas en micrositios más abiertos también pueden establecer líquenes folícolas que normalmente prefieren sitios sombreados. Un fenómeno similar se ha observado en palmas del (sub)dosel, donde la composición de especies es más semejante al sotobosque que a otros forófitos del dosel (Lücking 1995b, Sipman 1997).
Las asociaciones de líquenes folícolas y su composición corresponden en muchos detalles a los encontrados en el sendero Botarrama y en otras investigaciones (Lücking 1995b, 1999b; Lücking et al. 1998b). Generalmente, se puede observar tres asociaciones principales: (1) en el sotobosque, dominadas por Arthoniaceae, Opegraphaceae, Trichotheliaceae y especies supracuticulares del género Strigula; (2) en los claros, dominadas por Gomphillaceae y Ectolechiaceae; (3) en el dosel, dominadas por Asterothyriaceae. Además se forman dos subasociaciones en hojas de palmas del sotobosque (con transición a claros), dominados por Pilocarpaceae y algunas especies de Arthoniaceae, Opegraphaceae y Gomphillaceae, y en hojas dicotyledoneas de claros, dominados por especies subcuticulares del género Strigula. Las especies de las diferentes asociaciones demuestran diferentes características que se puede interpretar como adaptaciones. Por ejemplo, el color de los cuerpos fructíferos es considerado como una adaptación a la intensidad de luz, como protección contra la irradiación, siendo generalmente pálido a transparente en el sotobosque y oscuro en sitios abiertos (Lücking 1999b). La preferencia de especies subcuticulares del género Strigula por hojas dicotiledoneas es un fenómeno conocido (Santesson 1952, Nowak y Winkler 1970, Barillas et al. 1993, Lücking 1998c), y su crecimiento subcuticular también explica su abundancia en claros, por la protección que tienen estas especies por su cobertura con la cutícula de la hoja (Lücking 1992a, b, 1999b).
Las asociaciones del sotobosque y del dosel son más densas que la de los claros. Esto se debe a la distribución de micrositios, que es continuo en el sotobosque y el dosel y necesariamente discontinuo entre los claros. Por eso, la dispersión de especies es más estocástica entre los claros y más determinística dentro del sotobosque y dosel, lo que reduce la probabilidad de encontrar una especie en un claro determinado y así resulta en valores de stand. más bajas y asociaciones menos densas (Lücking 1999b).
La observación de que la diversidad de especies parece más alta en el bosque secundario es un fenómeno que se puede observar en muchos organismos y se debe al hecho que en el bosque secundario la diversidad es concentrada en el tiempo y espacio. Por ser más abierto y más variado en su estructura, en el sotobosque secundario se puede encontrar especies que en el bosque primario sólo crecen en claros o en el dosel. Tomando en consideración todos los micrositios (sotobosque, claros y dosel), la diversidad de especies es significativamente más alta en el bosque primario; sin embargo, esta diversidad es más dificil de reconocer y necesita más esfuerzos en cuanto al tiempo y las técnicas de recolección. La baja diversidad en la vegetación antropogénica y especialmente en las parcelas de sucesión se debe al hecho de que las especies del sotobosque que no soportan una alta intensidad de luz relativa desaparecen en vegetación abierta. La ordinación de los diversos tipos de vegetación secundaria entre la vegetación primaria demuestra que actualmente no existen especies típicas para vegetación secundaria, muchas veces llamadas especies "ruderales". Aunque en muchos casos son más faciles de observar en vegetación secundaria, su hábitat natural suele ser el dosel del bosque primario donde son difíciles de observar.
La diversidad de líquenes folícolas en un bosque tropical es más alta que lo anteriormente esperado y hasta puede sobrepasar las 300 especies. Junto con briófitas y líquenes cortícolas, el número de especies de criptógamas no vasculares en un bosque muy húmedo de bajura como La Selva puede alcanzar 700-800 especies. Además de esta diversidad, destaca la densidad de especies que representa hasta 50 % de la diversidad mundial. Esto significa que sitios como La Selva son representativos para la flora de criptógamas no vasculares tropicales y presentan condiciones ideales para estudiar la ecología de estos organismos.
Las preferencias por micrositios y forófitos de líquenes folícolas son iguales a las encontradas en otros sitios y confirman que estos resultados pueden ser generalizados y representan patrones universales de la ecología de comunidades de líquenes folícolas, particularmente en bosques de bajura. Entre estos, destacan la formación de tres asociaciones microclimáticas correspondientes al sotobosque, claros y el dosel, y la presencia de una subasociación forofítica en palmas intermedia entre el sotobosque y claros. Para cada asociación se puede identificar géneros característicos: Porina para el sotobosque, Echinoplaca para los claros, Asterothyrium para el dosel, y Fellhanera para las palmas. Estos asociaciones se puede considerar como modelos cuya realización depende de la estructura y dinámica actual de un bosque y de esta manera demuestran ciertas variaciones según el sitio.
El estudio inclusivo de todos los micrositios, junto con el dosel, confirma que el bosque primario soporta la más alta diversidad de especies. Indicaciones de alta diversidad en bosques secundarios que también se conoce de otros organismos se deben al hecho de que en este tipo de vegetación la diversidad se puede observar más facilmente. En el caso de líquenes folícolas, la estructura más abierta de un bosque secundario resulta en la presencia de especies del sotobosque, de claros y del dosel en un área reducida, a veces en una única hoja. Generalmente, la diversidad disminuye en vegetación secundaria y está drasticamente reducida en vegetación abierta. Las especies presentes en este tipo de vegetación no son especies "ruderales" como usualmente se definen, sino tienen su origen en el dosel del bosque primario.
Agradecimientos
Agradezco al Servicio de Parques Nacionales y a la Dirección de Vida Silvestre por el permiso para estudiar líquenes folícolas en Costa Rica. Bruce Young amablemente permitió las investigaciones en la Estación Biológica La Selva y se interesó mucho por el presente trabajo. Este estudio fue financiado por la DFG (Deutsche Forschungsgemeinschaft) y el DAAD (Deutscher Akademischer Austauschdienst). También quiero expresar mis gracias a María Isabel Morales, Julieta Carranza y Julián Monge-Nájera y al personal del herbario Nacional, y a Andrea por su apoyo, compañía y paciencia. Dos revisores anónimos hicieron sugerencias valiosas sobre una versión anterior de este trabajo.
Referencias
Allan, H. H. 1928. Ecological. In A. Zahlbruckner, K. Keissler & H. H. Allan. The epiphyllous lichens of Kitchener Park, Feilding, New Zealand. Trans. New Zeal. Inst. 59: 304-314. [ Links ]
Anderson, M. C. 1964. Light relations of terrestrial plant communities. Biol. Rev. 39: 425-486. [ Links ]
Aptroot, A. 1997. Lichen biodiversity in Papua New Guinea, with the report of 173 species on one tree. Bibl. Lichenol. 68: 203-213. [ Links ]
Barillas, R., R. Lücking & S. Winkler. 1993. Vergesellschaftungen foliikoler Flechten im Biotopo del Quetzal, Guatemala. Cryptogamie Bryol. Lichénol. 14: 49-68. [ Links ]
Busse, W. 1905. Über das Auftreten epiphyllischer Kryptogamen im Regenwaldgebiet von Kamerun. Ber. Deutsch. Bot. Gesellsch. 23: 164-172. [ Links ]
Farkas, E. & H. J. M. Sipman. 1997. Checklist of foliicolous lichenized fungi. In E. Farkas & T. Pócs (eds). Cryptogams in the phyllosphere: Systematics, distribution, ecology, and use. Abstr. Bot. 21: 173-206. [ Links ]
Fitting, H. 1910. Über die Beziehungen zwischen den epiphyllen Flechten und den von ihnen bewohnten Blättern. Ann. Jard. Bot. Buitenzorg, ser. 2, suppl. 3: 505-518. [ Links ]
Gauch, H. G. jr. 1982. Multivariate analysis in community ecology. Cambridge University, Cambridge. [ Links ]
Goodall, D. W. 1978. Sample similarity and species correlation. Pp. 99-149, In R. H. Whittaker (ed.). Ordination of plant communities. Junk, The Hague. [ Links ]
Gradstein, S. R. & T. Pócs. 1989. Bryophytes. Pp. 311-325, In H. Lieth & M. J. A. Werger (eds). Tropical rain forest ecosystems – Biogeographical and ecological studies (Ecosystems of the world 14B). Elsevier, Amsterdam. [ Links ]
Greig-Smith, P. 1983. Quantitative Plant Ecology (Studies in ecology vol. 9). University of California, California. [ Links ]
Grolle, R. 1968. Grossdisjunktionen in Artarealen lateinamerikanischer Lebermoose. Pp. 562-582 In E. J. Fittkau, J. Illies, H. Klinge, G. H. Schwabe & H. Sioli (eds). Biogeography and ecology in South America. Junk, The Hague. [ Links ]
Hartshorn, G. S. & B. E. Hammel. 1994. Vegetation types and floristic patterns. Pp. 73-89, In L. A. McDade, K. S. Bawa, H. A. Hespenheide & G. S. Hartshorn (eds). La Selva. University of Chicago, Chicago. [ Links ]
Jongman, R. H. G., C. J. F. ter Braak & O. F. R. van Tongeren. 1995. Data analysis in community and landscape ecology. Cambridge University, Cambridge. [ Links ]
Kalb, K. & A. Vzda. 1988. Neue oder bemerkenswerte Arten der Flechtenfamilie Gomphillaceae in der Neotropis. Bibl. Lichenol. 29: 1-80, 39 pl. [ Links ]
Lücking, R. 1992a. Zur Verbreitungsökologie foliikoler Flechten in Costa Rica, Zentralamerika. Teil I. Nova Hedwigia 54: 309-353. [ Links ]
Lücking, R. 1992b. Zur Verbreitungsökologie foliikoler Flechten in Costa Rica, Zentralamerika. Teil II. Herzogia 9: 81-112. [ Links ]
Lücking, R. 1992c. Foliicolous lichens – A contribution to the knowledge of the lichen flora of Costa Rica, Central America. Beih. Nova Hedwigia 104: 1-179. [ Links ]
Lücking, R. 1995a. Biodiversity and conservation of foliicolous lichens in Costa Rica. In C. Scheidegger, P. A. Wolseley & G. Thor (eds). Conservation biology of lichenised fungi. Mitteil. Eidgenöss. Forsch.anstalt Wald, Schnee Landsch. 70: 63-92. [ Links ]
Lücking, R. 1995b. Foliikole Flechten auf Cecropiaceen im Kronendach eines tropischen Regenwaldes. Bibl. Lichenol. 58: 261-274. [ Links ]
Lücking, R. 1995c. Additions and corrections to the foliicolous lichen flora of Costa Rica. The family Arthoniaceae, with notes on the genus Stirtonia. Lichenologist 27: 127-153. [ Links ]
Lücking, R. 1995d. Lista preliminar de líquenes folícolas de las principales areas protegidas de Costa Rica. Brenesia 43-44: 39-46. [ Links ]
Lücking, R. 1997a. Estado actual de investigaciones sobre líquenes folícolas en la región neotrópica, con un análisis biogeográfico preliminar. Trop. Bryol. 13: 87-114. [ Links ]
Lücking, R. 1997b. The use of foliicolous lichens as bioindicators in the tropics, with special reference to the microclimate. In E. Farkas & T. Pócs (eds). Cryptogams in the phyllosphere: Systematics, distribution, ecology, and use. Abstr. Bot. 21: 99-116. [ Links ]
Lücking, R. 1997c. Additions and corrections to the knowledge of the foliicolous lichen flora of Costa Rica. The family Gomphillaceae. Bibl. Lichenol. 65: 1-109. [ Links ]
Lücking, R. 1997d. Notes on "Lichenes Foliicoli Exsiccati", Fasc. I-VI. In E. Farkas & T. Pócs (eds). Cryptogams in the phyllosphere: Systematics, distribution, ecology, and use. Abstr. Bot. 21: 89-98. [ Links ]
Lücking, R. 1997e. Additions and corrections to the knowledge of the foliicolous lichen flora of Costa Rica. The genus Fellhanera, with notes on Bacidia pauciseptata. Trop. Bryol. 13: 141-173. [ Links ]
Lücking, R. 1998a. Ecology of foliicolous lichens at the "Botarrama" trail (Costa Rica), a neotropical rain forest. II. Patterns of diversity and area cover and their dependence on microclimate and phorophyte species. Ecotropica 4 : 1-24. [ Links ]
Lücking, R. 1998b. Ecology of foliicolous lichens at the "Botarrama" trail (Costa Rica), a neotropical rain forest. III. Phorophyte range and patterns of phorophyte specifity. Phyton (Horn) 38: 195-219. [ Links ]
Lücking, R. 1998c. Additions and corrections to the knowledge of the foliicolous lichen flora of Costa Rica. The genus Trichothelium. Nova Hedwigia 66: 375- 417. [ Links ]
Lücking, R. 1999a. Ecology of foliicolous lichens at the "Botarrama" trail (Costa Rica), a neotropical rain forest. I. Species composition and its ecogeographical implications. Biotropica (en prensa). [ Links ]
Lücking, R. 1999b. Ecology of foliicolous lichens at the "Botarrama" trail (Costa Rica), a neotropical rain forest. IV. Species associations, their salient features, and their dependence on environmental parameters. Lichenologist 31: 369- 289. [ Links ]
Lücking, R., A. Aptroot & G. Thor. 1997. New species or interesting registros of foliicolous lichens. II. Flavobathelium epiphyllum (Lichenized Ascomycetes: Melanommatales). Lichenologist 29: 221-228. [ Links ]
Lücking, R., U. Becker & G. Follmann. 1998b. Foliikole Flechten aus dem Taï-Nationalpark, Elfenbeinküste (Tropisches Afrika). II. Ökologie und Biogeografie. Herzogia 13: 207-228. [ Links ]
Lücking, R. & A. Lücking. 1996. Foliicolous lichens and bryophytes. In P. Hietz, R. Lücking, A. Lücking, H. J. M. Sipman, H. F. M. Vester, H. F. M., J. H. D. Wolf & E. Gardette. How to sample the epiphytic diversity of tropical rain forests. Ecotropica 2: 59-72. [ Links ]
Lücking, R., T. H. Lumbsch & J. A. Elix. 1994. Chemistry, anatomy and morphology of foliicolous species of the genera Fellhanera and Badimia (Lichenized Ascomycotina: Lecanorales). Bot. Acta 107: 393-401. [ Links ]
Lücking, R. & M. Matzer. 1996. Ergänzungen und Verbesserungen zur Kenntnis der foliikolen Flechtenflora Costa Ricas. Die Familie Opegraphaceae (einschließlich der Gattung Mazosia). Nova Hedwigia 63: 109-144. [ Links ]
Lücking, R. & E. Sérusiaux. 1997. Musaespora kalbii sp. nov. (Lichenized Ascomycetes: Melanommatales), a new foliicolous lichen with pantropical distribution. Nord. J. Bot. 16: 661-668. [ Links ]
Lücking, R., E. Sérusiaux, L. C. Maia & E. C. G. Pereira. 1998a. A revision of names of foliicolous, lichenized fungi published by Batista and co-workers between 1960 and 1975. Lichenologist 30: 121-191. [ Links ]
Lücking, R. & A. Vzda. 1998. Taxonomic studies in foliicolous species of the genus Porina. II. The Porina epiphylla aggregate. Willdenowia 28: 181- 225. [ Links ]
Matzer, M. 1996. Lichenicolous Ascomycetes with fissitunicate asci on foliicolous lichens. Myc. Pap. 171: i-x, 1-202. [ Links ]
McDade, L. A., K. S. Bawa, H. A. Hespenheide & G. S. Hartshorn (eds). 1994. La Selva. University of Chicago Press, Chicago. [ Links ]
Nowak, R. & Winkler, S. 1970. Foliicole Flechten der Sierra Nevada de Santa Marta (Kolumbien) und ihre gegenseitigen Beziehungen. Österr. Bot. Zeitsch. 118: 456-485. [ Links ]
Perry, D.R. & J. Williams. 1981. The tropical rain forest canopy: a method providing total access. Biotropica 13: 283-285. [ Links ]
Pócs, T. 1978. Epiphyllous communities and their distribution in East Africa. Bryophyt. Bibl. 13: 681-713. [ Links ]
Richards, P. W. 1984. The ecology of tropical forest bryophytes. Pp. 1233-1270 In R. M. Schuster (ed.). New manual of bryology, vol. 2. Hattori Botanical Laboratory, Nichinan. [ Links ]
Santesson, R. 1952. Foliicolous lichens. I. A revision of the taxonomy of the obligately foliicolous lichenized fungi. Symb. Bot. Ups. 12(1): 1-590. [ Links ]
Sérusiaux, E. 1989. Foliicolous lichens: ecological and chorological data. Bot. J. Linn. Soc. 100: 87-96. [ Links ]
Sérusiaux, E. & J. R. De Sloover 1986. Taxonomical and ecological observations on foliicolous lichens in northern Argentina, with notes on the hyphophores of Asterothyriaceae. Veröff. Geobot. Inst., Zürich 91: 260-292. [ Links ]
Sipman, H. J. M., 1995. Preliminary review of the lichen biodiversity of the Colombian montane forests. Pp. 313-320 In S. P. Churchill et al. (eds). Biodiversity and conservation of Neotropical montane forests. New York Botanical Garden, New York. [ Links ]
Sipman, H. J. M. 1997. Observations on the foliicolous lichen and bryophyte flora in the canopy of a semi-deciduous tropical forest. In E. Farkas & T. Pócs (eds). Cryptogams in the phyllosphere: Systematics, distribution, ecology, and use. Abstr. Bot. 21: 153-161. [ Links ]
Sipman, H. J. M. & R. C. Harris. 1989. Lichens. Pp. 303-309 In H. Lieth & M. J. A. Werger (eds). Tropical rain forest ecosystems – Biogeographical and ecological studies (Ecosystems of the world 14B). Elsevier, Amsterdam. [ Links ]
Sørensen, T. 1948. A method of establishing groups of equal amplitude in plant sociology based on similarity of species content. Biol. Skrift. K. Danske Vidensk. Selsk. 5: 1-34. [ Links ]
Vareschi, V. 1980. Vegetationsökologie der Tropen. Ulmer, Stuttgart. [ Links ]
Wilbur, R. L. et al. 1994. Vascular plants: An interim checklist. Pp. 350-378, In L. A. McDade, K. S. Bawa, H. A. Hespenheide & G. S. Hartshorn (eds). La Selva. University of Chicago, Chicago. [ Links ]
1 Institut für Pflanzensystematik, Universität Bayreuth, D-95447 Bayreuth, Alemania. Fax: 0049-921-552786. Correo electrónico: rlucking@hotmail.com












 uBio
uBio 

