Services on Demand
Journal
Article
Indicators
-
 Cited by SciELO
Cited by SciELO -
 Access statistics
Access statistics
Related links
-
 Similars in
SciELO
Similars in
SciELO  uBio
uBio
Share
Revista de Biología Tropical
On-line version ISSN 0034-7744Print version ISSN 0034-7744
Rev. biol. trop vol.47 n.1-2 San José Jun. 1999
(Schizaeaceae)
Aniceto Mendoza, Blanca Pérez-García y Ramón Riba 1
Recibido 15-IV-1998. Corregido 25-X-1998. Aceptado 30-X-1998.
Abstract
The development of the gametophytes of Lygodium heterodoxum Kunze and Lygodium venustum Sw. is described on the basis of spores collected in the States of Veracruz and Sinaloa, México. The germination of the spores is of the Vittaria-type or Lygodium-type. Prothallial development is of the Adiantum-type with transition to Ceratopteris-type. The gametangia are the usual for leptosporangiate ferns. The first leaf of the sporophyte appeared 85 days after spore sowing; it is digitate-flabelliform, with unicellular club shaped trichomes in margin and both surfaces, and the stomata anomocytic. Unisexual gametophytes (only with antheridia or archegonia) were found in the cultures, so the presence of hormonal substances with "antheridogenic effects" is suggested.
Key words
Gametophyte, germination, Lygodium, México, morphology, prothallus, Schizaeaceae.
Lygodium Sw., es un género de amplia distribución a nivel mundial, cuenta con 40 especies, de tres a cuatro especies en el viejo mundo, seis a ocho se localizan en los trópicos americanos; dos en los Estados Unidos de América y la mayoría ( ±35 spp) son de distribución pantropical (Mickel y Beitel 1988).
Se distinguen por sus hojas escandentes, trepadoras, dimorfas y 2-3 pinnadas, pinnas alternas, ramificadas seudodicotómicamente, pínnulas palmado-lobadas o pinnado-divididas, nervaduras libres o anastomosadas, soros indusiados, esporas triletes, de color amarillo, desprovistas de perina, con ornamentación verrucosa o reticulada (Holttum 1959, Devi 1966), crecen desde el nivel del mar hasta los 1000 m snm. Se establecen frecuentemente en vegetación perturbada, en bosques secundarios y claros de selvas (Mickel y Beitel 1988, Tryon y Tryon 1982).
Con respecto al estudio de la fase sexual de Lygodium, se ha encontrado que los gametofitos son cordiformes, simétricos y desnudos en L. circinatum , L. flexuosum, L. japonicum, L. palmatum (Atkinson 1960, 1962, Bauke 1878, 1880, Britton y Taylor 1901, Burck 1875,Chandra 1963, Heim 1896, Kny 1896, Mahabale y Kulkarani 1949, 1950, Nayar y Kaur 1971, Rogers 1923, 1926 y Twiess 1910). Rogers (1923) y Mahabale y Kulkarani (1949) citaron la presencia de tricomas en forma de clava en los gametofitos de algunas especies de Lygodium, sin embargo, esto requiere de confirmación.
El presente trabajo es una contribución al estudio morfogenético de la fase gametofitica de L. heterodoxum Kunze y L. venustum Sw.
Materiales y Métodos
El material estudiado, fue recolectado en los estados de Sinaloa y Veracruz, México (véase Cuadro 1). Las esporas de Lygodium se obtuvieron de pinnas fértiles que fueron guardadas en sobres de papel, dejándolas secar a temperatura ambiente, para propiciar la apertura de los esporangios y la liberación de la esporas. La separación de los fragmentos de hojas y de esporangios se realizó a través de un tamiz con poros de 0.074 mm de diámetro. Las esporas de cada especie, fueron sembradas en 20 cajas de Petri con agar y medio nutritivo de Thompson (Klekowski 1969, Pérez-García 1989) previamente esterilizado, con una densidad promedio de 120-250 esporas por cm2; cuatro cajas fueron cubiertas con papel esta o para probar fotoblastismo.
Especies estudiadas, localidades de recolección de material
| | | | y altitud |
| Lygodium heterodoxum Kunze | RR-1962 | -A los lados del camino que conduce a Laguna Escondida, Estación de Biología Tropical los Tuxtlas, Mpio. San Andrés Tuxtla, Veracruz. | SAP, 600 m snm |
| Lygodium venustum Sw. |
| -2 km al N de la carretera Acaponeta- Mazatlán, rumbo a la antena demicroondas, Mpio. Escuinapa, Sinaloa. -15 km al E de Coatzacoalcos, sobre la carretera federal 180 rumbo a Villahermosa, Mpio. Coatzacoalcos, Veracruz. -10 km al NW de Minatitlán, rumbo a Coatzacoalcos, Mpio. Coatzacoalcos, Veracruz. | SBC, 120 m snm
|
Las cajas se guardaron en bolsas de polietileno transparente, para evitar contaminación y deshidratación, los cultivos se mantuvieron en condiciones de laboratorio, con un régimen lumínico de 12 hrs luz x 12 hrs oscuridad con lámparas de luz solar de 75 W, a una temperatura de 23-28oC (Mendoza et al. 1996-1997).
Las observaciones se realizaron desde la germinación hasta la obtención de las primeras hojas del esporofito. Las fotomicrografías fueron tomadas del material vivo.
Resultados
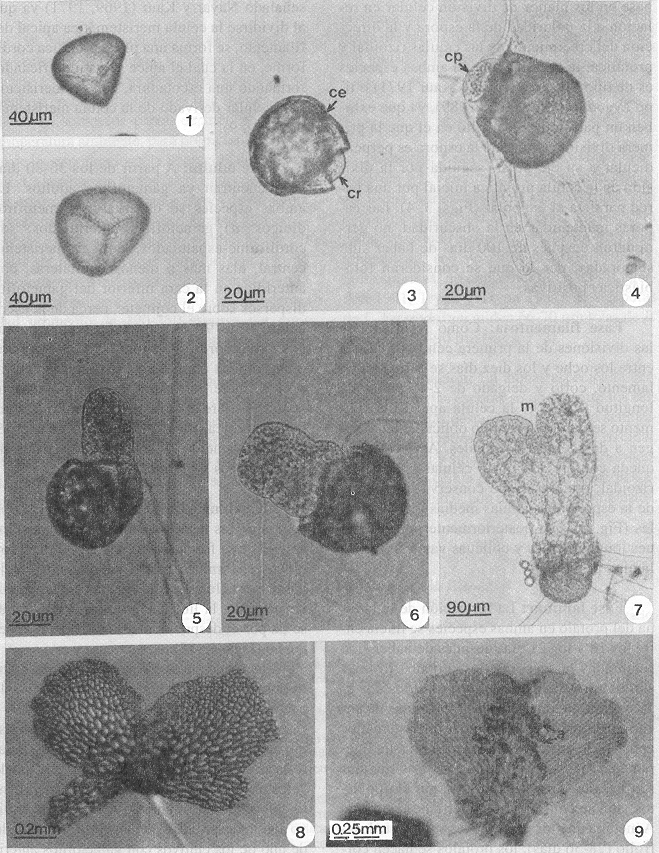
Esporas: Las esporas de Lygodium heterodoxum y L. venustum son de apertura trilete, de forma tetraédrica-globosa, superficie con depósitos esféricos más o menos densos, cara distal a menudo verrucada y la cara proximal tuberculada, son de color amarillo brillante, homospóricas, no clorofílicas (Tryon y Lugardon 1991, Tryon y Tryon 1982). Las esporas de L. heterodoxum miden 66-70 µm y las de L. venustum 85-90 µm (Figs. 1, 2).
Germinación: En ambas especies la germinación de las esporas se inicia entre los seis y los ocho días después de haber sido sembradas, diferenciándose primero la célula rizoidal, corta, hialina y sin cloroplastos; posteriormente emerge la célula protálica, que es perpendicular a la rizoidal, con numerosos cloroplastos, conservando la cubierta de la espora. Con base en los planos de división celular en relación a la polaridad de la espora y la dirección del crecimiento de las células rizoidal y protálica, la germinación en ambas especies es de tipo Vittaria (Nayar y Kaur 1971) o tipo Lygodium (Raghavan 1989), ya que exhiben un patrón de desarrollo en el que la primera división celular de la espora es perpendicular a su eje polar, seguida por la división de la célula protálica inicial por una pared paralela al eje polar (Figs. 3, 4). Las esporas mantenidas en la obscuridad, no germinaron después de 100 días de haber sido sembradas, por lo que se consideran fotoblásticas positivas.
Fase filamentosa: Como resultado de las divisiones de la primera célula protálica, entre los ocho y los diez días se forma un filamento, corto y delgado de 2-4 células de longitud (Fig. 5); la célula apical del filamento se divide en sentido oblicuo dando origen a dos células desiguales. Así el protalo queda conformado por 6 células, una célula rizoidal, una basal que conserva la cubierta de la espora, dos células medias y dos apicales (Fig. 6), que posteriormente por divisiones longitudinales y oblicuas van a formar la lámina protálica.
Fase laminar: La formación de la lámina del protalo en ambas especies se inicia entre los 18 y los 21 días después de haber sido sembradas las esporas, los protalos jóvenes son de forma espatulada, constituidos por 8-12 células de longitud y de 3-5 células de ancho en la base, con una zona meristemática apical y de posición central, con una ala ligeramente más grande que la otra. Los rizoides son basales, largos y hialinos, sin cloroplastos; aun se conserva la cubierta de la espora. A medida que los gametofitos siguen su desarrollo (28-36 días), los protalos se hacen cordiformes y las alas más amplias. El desarrollo protálico de estas especies corresponde al tipo Adiantum, aunque algunos gametofitos muestran una transición del tipo Adiantum al tipo Ceratopteris (Fig. 7, 8) como ya lo han se alado Nayar y Kaur (1969, 1971) ya que al dividirse la célula meristemática apical del filamento, se forma una placa protálica cordiforme, en la cual el ápice se va modificando, formando una escotadura, con un meristemo pluricelular derivado de la célula meristemática (Fig. 9).
- Figs. 1-9. Desarrollo de los gametofitos de Lygodium heterodoxum y Lygodium venustum. Fig.1. Espora trilete de L. heterodoxum. Fig. 2. Espora trilete de L. venustum. Fig. 3. Inicio de la germinación. Fig. 4. Primera célula protálica y rizoidal. Figs. 5-6. Fases filamentosas. Figs. 7-8. Fases bidimensionales jóvenes. Fig. 9. Gametofito adulto. a= anteridios, ce= cubierta de la espora, cm= célula meristemática, cp= célula protálica, cr= célula rizoidal, m= meristemo.
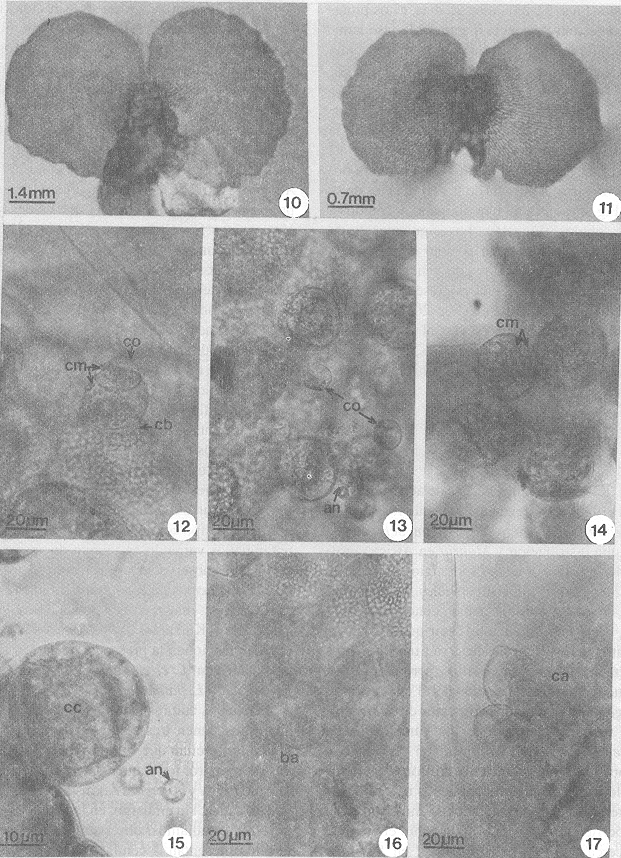
- Figs. 10-17. Fases gametofíticas adultass y gametangios de L. heterodoxum y L. venustum. Figs. 10-11. Gametofitos cordiformes arquegoniados. Figs. 12-15. Anteridios. Figs. 16-17. Boca y cuello de aruegonio. a= arquegonios, an= anterozoide, ba= boca de arquegonios, ca= cuello del arquegonio, cb= célula basal, cc= célula central del anteridio, cm= célula media, co= célula opercular.
Fase adulta: A partir de los 36-80 días se encuentran ya gametofitos adultos. En ambas especies se observaron gametofitos dioicos: a) gametofitos anteridiados: son cordiforme-espatulados, con el meristemo central, alas más o menos equiláteras, con anteridios en la cara inferior del gametofito dispersos sobre el cojinete , cerca de la escotadura (Fig. 9). b) gametofitos arquegoniados: son cordiforme-reniformes, con alas muy amplias equiláteras, meristemo central y el cojinete corto, los arquegonios se encuentran sobre el cojinete cercanos a la zona meristemática (Figs. 10, 11). En ambas especies, los gametofitos son desnudos y con rizoides largos y hialinos.
Gametangios: Estos corresponden al tipo común de los helechos leptosporangiados, los anteridios se forman entre los 28-32 días, son globosos, formados por 4 células: una célula basal, dos células medias y una célula opercular peque a, la liberación de los anterozoides se da por el desprendimiento del opérculo peque o (Figs. 12-15).
Los arquegonios inician su desarrollo entre los 32-35 días, y tienen un cuello corto de cuatro hileras de células (Fig. 16, 17).
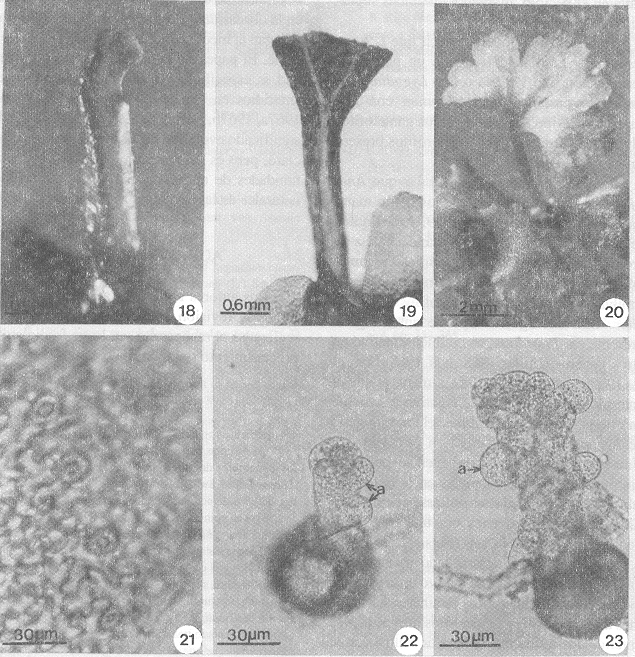
En virtud de haberse encontrado en el mismo cultivo protalos unisexuados, lo que sugiere la presencia de substancias hormonales de "efecto anteridogénico", se hizo un experimento colocando un fragmento de medio de cultivo sólido desprovisto de gametofitos y tomado de uno de los cultivos con gametofitos anteridiados y arquegoniados sobre un medio nuevo en el que se sembraron esporas. A los 14 días después de la siembra, se observaron diminutos protalos cortamente filamentosos y con abundantes anteridios en varias partes del filamento (Figs. 22-23). a los 25 días, estos protalos muestran tendencia a entrar a la fase laminar, sin diferenciación de cojinete ni de célula meristemática.
Esporofito: Una vez que la oosfera ha sido fecundada por el anterozoide, se inicia la formación y desarrollo del embrión, para así dar paso a la fase esporofítica. La primera hoja se desarrolla a partir de los 84 días, es erecta (Fig. 18), obtriangular alargada, y con dos a tres lóbulos (Fig. 19). Las siguientes hojas (107 días) muestran un pecíolo corto, erecto, una lámina flabeliforme con venación dicotómica, tricomas unicelulares no secretores, distribuidos uniformemente (Fig. 20), las células epidérmicas de las caras adaxial y abaxial tienen paredes laterales onduladas, los estomas son anomocíticos, sin células subsidiarias (Van Cotthem 1973) (Fig. 21).
- Figs. 18-23. Esporofitos y gametofitos anteridiados de L. heterodoxum y L. venustum. Fig. 19. Esporofito obtriangular. Fig.20. Esporofito flabeliforme. Fig.21. Estomas anomocíticos. Figs.22-23. Gametofitos anteridiados (14 días). a= anteridios.
La familia Schizaeaceae de acuerdo a Moran (1995) comprende actualmente los géneros Anemia, Actinostachys, Lygodium, Schizaea de amplia distribución y Mohria en Africa, agrupados en ella por tener esporangios piriformes, sésiles y con anillos subapicales. La morfología de los esporofitos es bien conocida.
En general podemos decir que los gametofitos de las Schizaeaceae son tan diferentes entre sí como sus esporofitos, pero todos ellos tienen anteridios formados por 3 células (4 en Lygodium y en algunas especies de Schizaea). Se sabe en general que los gametofitos de Anemia, Lygodium y Mohria son epigeos, con clorofila, asimétricos u obcordiformes, engrosados y a menudo con peque os tricomas, los anteridios y los arquegonios se localizan en la superfice inferior del protalo sobre el cojinete y cerca del área meristemática; en Schizaea son hipogeos y con las áreas clorofílicas expuestas, filamentosos, ramificados y parcialmente micorrícicos, los anteridios y arquegonios se encuentran sobre las ramas de los protalos, las cuales pueden ser cortas o largas; en Actinostachys son subterráneos, sin clorofila, alargados, usualmente ramificados e irregularmente tuberosos con la edad, micorrícicos y con los anteridios y arquegonios distribuidos sobre toda la superficie (Atkinson 1973, Tryon y Tryon 1982).
Los gametofitos de Lygodium (Chandra 1963, Mahabale y Kulkarani 1949, 1950, Rogers 1923, 1926), Mohria (Atkinson 1960) y Anemia (Atkinson 1962) comparten el mismo patrón básico de germinación, que es del tipo Vittaria, sus fases filamentosas varian de 5-6 células, aunque para LygodiumRaghavan (1989) ha postulado el nuevo tipo Lygodium, que difiere del tipo Vittaria en que la célula inicial del rizoide resulta de una división de una célula intermedia que también forma una célula en forma de cu a entre las células iniciales del rizoide y del filamento. En lo que al desarrollo protálico se refiere, Mohria y Anemia presentan el tipo Ceratopteris que se caracteriza por presentar un meristemo lateral, en Lygodium pudimos observar una transición del tipo Adiantum al tipo Ceratopteris.
En los tres géneros el talo adulto varía de forma espatulada a cordiforme, sus gametangios son del tipo común de los helechos leptosporangiados variando en tiempo de aparición. En nuestras observaciones hechas en L. heterodoxum y L. venustum encontramos gametofitos unisexuados, mientras que Chandra (1963), Mahabale y Kulkarani (1949, 1950) y Rogers (1923) mencionan la presencia de gametofitos bisexuados en L. circinatum, L. flexuosum, L. japonicum y L. palmatum.
Diversos autores han mencionado que los anteridios tienen tres células (basal, media y opercular) y citan que su dehiscencia es a través de un poro, los esquemas de Mohria (Atkinson 1960) y Anemia (Atkinson 1962) apoyan esta idea, sin embargo, en las especies que nosotros estudiamos, observamos que los anteridios presentan 4 células (Atkinson 1973) una basal, dos medias y una opercular peque a (Fig. 13) y consideramos que la dehiscencia es por el desprendimiento de una peque a célula opercular. Es decir que en estos géneros se presentan los anteridios con generalmente tres o cuatro células y lo que llaman poro es la pared rota o desgarrada de la célula central (célula inicial de los anteridios). Otra diferencia observada, es que los gametofitos adultos de Mohria y Anemia tienen tricomas en el margen y en ambas superficies del protalo, aunque algunos autores como Mahabale y Kulkarani (1949) y Rogers (1923) citan la presencia de escasos pelos glandulares unicelulares y en forma de clava cerca de la escotadura en L. palmatum. Los gametofitos de L. heterodoxum y L. venustum son desnudos lo que apoya la idea de Heim (1896) que cita la ausencia de tricomas en el protalo de Lygodium mientras que en Anemia y Mohria hay tricomas característicos conteniendo ácido tánico e inclinados hacia el ápice en todas partes del talo ("neieren-förmige- Haare").
Las hojas de los esporofitos jóvenes de los tres géneros son flabeladas, con venación dicotómica y llevan tricomas peque os en forma de clava en el pecíolo, margen y en ambas superficies de la lámina.
En conclusión podemos decir que L. heterodoxum y L. venustum siguen un patrón de germinación tipo Vittaria o tipo Lygodium, un desarrollo protálico tipo Adiantum con una transición al tipo Ceratopteris, los gametofitos adultos son desnudos y sus esporofitos presentan tricomas en forma de clava.
Tambien es interesante se alar que Anemia y Lygodium han sido usados como material experimental por Näf (1959, 1960) quien detecta la presencia de una sustancia capaz de promover el desarrollo de anteridios en gametofitos jóvenes. El efecto del anteridógeno es similar al producido en gametofitos de Pteridium. Sin embargo, el tipo de anteridógeno presente en Pteridium, es también efectivo en otros géneros (Miller 1968; Näf 1968, Näf et al. 1975, Voeller 1964, 1971), mientras que el anteridógeno de Anemia es efectivo solamente en este género y en Lygodium; el anteridógeno de Lygodium no es efectivo en otro géneros. Nuestras observaciones nos hacen sospechar la presencia de estas substancias en L. heterodoxum y L. venustum al desarrollarse gametofitos filamentosos muy jóvenes con una gran cantidad de anteridios (14 días) (Figs. 22, 23).
El experimento desarrollado transfiriendo un fragmento de medio de cultivo en el que hubieron crecido gametofitos laminares cordiformes arquegoniados y gametofitos mas peque os anteridiados a una nueva caja de cultivo en la que se sembraron esporas dió como resultado el que a los 14 días despues de la siembra crecieron gametofitos inicialmente anteridiados, que al paso de los días mostraron tendencia a adquirir la forma espatulada, sin indicios de zona meristemática ni de cojinete. Los anteridios se mostraron normales con salida de anterozoides activos al colocar los gametofitos en agua para hacer observaciones al microscopio. De manera indirecta se demuestra que en el medio de cultivo tomado de la caja de cultivo "vieja" y transferido a la caja nueva habia sustancias con actividad anteridogénica (Voeller 1966).
Muchas esporas de helechos requieren de luz para germinar, pero diversas investigaciones muestran que la germinación puede ocurrir en la obscuridad (Pérez-García et al. 1994) si se agregan al medio anteridógenos de la misma especie. El papel del anteridógeno en la obscuridad es específico y estimula la producción de anteridios en gametofitos jóvenes (Näf 1966, 1967a, 1967b, Näf et al. 1975, Voeller 1971). El significado evolutivo de los anteridógenos no es claro, pero es evidente que aumentan las oportunidades de entrecruzamiento en poblaciones naturales de las especies (Tryon y Vitale 1977).
Agradecimientos
Los autores agradecen a los árbitros anónimos la revisión, comentarios y sugerencias realizadas al manuscrito y a Jorge Lodigiani el procesamiento del material fotográfico.
Resumen
Se describe la morfogénesis y la morfología adulta de los gametofitos de Lygodium heterodoxum Kunze y Lygodium venustum Sw. El patrón de germinación corresponde al tipo Vittaria de acuerdo con Nayar y Kaur (1971) o al tipo Lygodium en opinión de Raghavan (1989). El desarrollo protálico es tipo Adiantum con transición al tipo Ceratopteris. Los gametangios son del tipo común de los helechos leptosporangiados y el esporofito se desarrolla a los 85 días a partir de la siembra, sus hojas son flabeliformes, con tricomas en forma de clava, unicelulares, en el margen y ambas superficies de la lámina; los estomas son anomocíticos. El experimento desarrollado transfiriendo un fragmento de medio de cultivo en el que hubieron crecido gametofitos arquegoniados y gametofitos anteridiados mas peque os a una nueva caja de cultivo en la que se sembraron esporas, dió como resultado el que, a los 14 días después de la siembra crecieran gametofitos inicialmente anteridiados con tendencia a forma espatulada sin zona meristemática ni cojinete; los anteridios se mostraron normales con anterozoides activos en agua. Se demuestra de esta manera la presencia en el medio de cultivo de sustancias con actividad anteridogénica.
Referencias
Atkinson, L.R. 1960. The Schizaeaceae: The gametophyte of Mohria. Phytomorphology 10: 351-367. [ Links ]
Atkinson, L.R. 1962. The Schizaeaceae: The gametophyte of Anemia. Phytomorphology 12: 264-288. [ Links ]
Atkinson, L.R. 1973. The gametophyte and family relationships. p. 73-90. In A.C. Jermy, J.A. Crabbe & B.A. Thomas (eds.). The phylogeny and classification of the ferns. Koeltz, Koenigstein, Alemania. [ Links ]
Bauke, H. 1878. Zur kenntniss der sexuellen generation bei den gattungen Platycerium, Lygodium und Gymnogramme. Bot. Zeit. 36: 753-760, 769-780. [ Links ]
Britton, E.G. & A. Taylor. 1901. Life history of Schizaea pusilla. Bull. Torrey Bot. Club. 28: 1-19. [ Links ]
Burck, W. 1875. Vorläufige Mittheilung über die Entwickelungsgeschichte des prothalliums von Anemia. Bot. Zeit. 33: 499-501. [ Links ]
Chandra, P. 1963. The gametophytes of Lygodium circinnatum (Burm.) Sw. and L.flexuosum (L.) Sw. Curr. Sci. 32: 34-35. [ Links ]
Devi, S. 1966. Spore morphology of Indian ferns. Ph. D. Thesis. Agra University, Agra, India. [ Links ]
Duek, J.J. 1978. A taxonomical revision of Lygodium (Filicinae) in America. Fedde Repert 89: 411-423. [ Links ]
Heim, C. 1896. Untersuchungen über farnprothallien. Flora 82: 329-373. [ Links ]
Holttum, R.E. 1959. Schizaeaceae. Flora Malesiana, ser. II. 1: 37-64. [ Links ]
Klekowski, E.J. 1969. Reproductive biology of the Pteridophyta. III. A study of the Blechnaceae. J. Linn. Soc. Bot. 62: 361-377. [ Links ]
Kny, L. 1896. Entwickelungsgeschichte des Vorkeims der Polypodiaceen und Schizaeaceen. Bot. Zeit. 27:46. [ Links ]
Mahabale, T.S. & N. Kulkarani. 1949. Prothallus of Lygodium flexuosum Bedd. Proc. 36th Indian Sci. Congr. III: 124. [ Links ]
Mahabale, T.S. & N. Kulkarani. 1950. Prothalli of Lygodium japonicum Sw. and Aneimia rotundifolia Schrad. Proc. 37th Indian Sci. Congr. III: 41. [ Links ]
Mendoza, A., B. Pérez-García, I. Reyes-Jaramillo & M. Ricci. 1996-1997. Desarrollo del gametofito de Pteris berteroana (Pteridaceae: Pterideae). Rev. Biol. Trop. 44/45: 51-57. [ Links ]
Mickel, J.T. & J.M. Beitel. 1988. Pteridophyte Flora of Oaxaca, Mexico. Mem. New. York Bot. Garden 46: 1-568. [ Links ]
Miller, J.H. 1968. Fern gametophytes as experimental material. Bot. Rev. (Lancaster) 34: 361-440. [ Links ]
Moran, R.C. 1995. Lygodium. p. 56-57. In R.C. Moran & R. Riba (eds.). Flora Mesoamericana. Vol. 1. Psilotaceae a Salviniaceae. Universidad Nacional Autónoma de México, Jardín Botánico de Missouri, Museo de Historia Natural (Londres). [ Links ]
Näf, U. 1959. Control of antheridium formation in the fern species Anemia phyllitidis. Nature 184: 798-800. [ Links ]
Näf, U. 1960. On the control of antheridium formation in the fern species Lygodium japonicum. Soc. Exp. Biol. Med. 105: 82-86. [ Links ]
Näf, U. 1966. On dark-germination and antheridium formation in Anemia phyllitidis. Physiol. Pl. 19: 1079-1088. [ Links ]
Näf, U. 1967a. On the induction of a phase inhibitory to antheridium formation in the juvenile prothallus of the fern species Anemia phyllitidis. Z. Pflanzenphysiol. 56: 353-365. [ Links ]
Näf, U. 1967b. Anemia phyllitidis: inducibility of physiological state antagonistic to antheridium formation. Science 156: 1117-1119. [ Links ]
Näf, U. 1968. On separation and identity of fern antheridiogens. Pl. Cell Physiol. Tokyo 9: 27-33. [ Links ]
Näf, U., K. Nakanishi & M. Endo. 1975. On the physiology and chemistry of fern antheridiogen. Bot. Rev. 41: 315-359. [ Links ]
Nayar, B.K. & S. Kaur. 1969. Types of prothallial development in homosporous ferns. Phytomorphology 19: 179-188. [ Links ]
Nayar, B.K. & S. Kaur. 1971. Gametophytes of Homosporous Ferns. Bot. Rev. 37: 295-396. [ Links ]
Pérez-García, B. 1989. Morfogénesis de gametofitos de Cyatheaceae (Pterophyta: Filicales). Tesis doctoral, Fac. Ciencias, UNAM, p. 1-224. [ Links ]
Pérez-García, B., A. Orozco-Segovia & R. Riba. 1994. The effects of white fluorescent light, far-red light, darkness, and moisture on spore germination of Lygodium heterodoxum (Schizaeaceae). Amer. J. Bot. 81: 1367-1369. [ Links ]
Raghavan, V. 1989. Developmental biology of fern gametophytes. In P.W. Barlow, P. B. Green & J.M.W. Slack (eds.). Developmental and biology series. Cambridge University, Nueva York. p. 361. [ Links ]
Rogers, L.M. 1923. Development of the prothallus of Lygodium palmatum. Bot. Gaz. 75: 75-85. [ Links ]
Rogers, L.M. 1926. Development of the archegone and studies in fertilization. Cellule 37: 327-352. [ Links ]
Tryon, A.F. & B. Lugardon. 1991. Spores of the Pteridophytes: surface, wall structure and diversity based on electron microscope studies. Springer-Verlag, NuevaYork. p. 104-106. [ Links ]
Tryon, R.M. & A. F. Tryon. 1982. Ferns and Allied Plants: With Special Reference to Tropical America. Springer-Verlag, Nueva York. p.857. [ Links ]
Tryon, R.M. & G. Vitale. 1977. Evidence for antheridogen production and its mediation of a mating system in natural populations of fern gametophytes. Bot. J. Linn. Soc. 74: 243-249. [ Links ]
Twiess, E.M. 1910. The prothallia of Aneimia and Lygodium. Bot. Gaz. (Crawfordsville) 49: 168-181. [ Links ]
Van Cotthem, W.R.J. 1973. Stomatal types and systematic. p. 59-71. In A.C. Jermy, J.A. Crabbe & B.A. Thomas (eds.). The Phylogeny and Classification of the ferns. Academic, Nueva York. [ Links ]
Voeller, B.R. 1964. Gibberellins: their effects on antheridium formation in fern gametophytes. Science 143: 373-375.. [ Links ]
Voeller, B.R. 1971. Developmental physiology of fern gametophytes: relevance for biology. BioScience 21: 266-270. [ Links ]
1 Departamento de Biología, C. B. S., Universidad Autónoma Metropolitana, Unidad Iztapalapa, A.P. 55-535, 09340 México, D. F. Fax: (52-5) 724 4688 amr@xanum.uam.mx