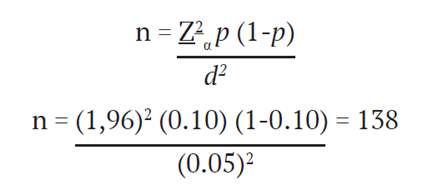El síndrome de Stein-Leventhal, también cono- cido como síndrome de ovario poliquístico (SOP), es la principal disfunción endocrino-metabólica que afec- ta a las mujeres en edad reproductiva.1,2 Es un cuadro clínico heterogéneo y complejo que se ha asociado con el 75 % de los casos de infertilidad anovulatoria1,3 y que afecta a una de cada quince mujeres a nivel mundial.4 El Instituto Nacional de Salud (NIH, por sus siglas en inglés) de los Estados Unidos de América4 estima que su prevalencia es del 7 %, mientras que la prevalencia puede variar desde un 5 % hasta un 22 % según diferentes poblaciones estudiadas.1,2,5 Aguirre y colaboradores (2007) han reportado hasta un 15 % de prevalencia de SOP en mujeres latinoamericanas.6 Esta variabilidad encontrada a nivel mundial en la prevalencia de este síndrome depende de los criterios utilizados para su diagnóstico.1,2,7
En 1990, el NIH definió el SOP como la pre- sencia de disfunción ovárica con hiperandroge- nismo bioquímico o clínico y la exclusión de otros padecimientos como el síndrome de Cushing, la hi- perplasia adrenal congénita, la hiperprolactinemia, los tumores adrenales secretores de andrógenos o la disfunción tiroidea.4,8 En el año 2003, la Sociedad Europea de Reproducción y Embriología y la Socie- dad Americana de Medicina Reproductiva propu- sieron agregar, a los criterios definidos por el NIH, la presencia de ovarios poliquísticos en la ultraso- nografía como otro criterio diagnóstico.9
De acuerdo con la guía internacional basada en la evidencia del SOP del 2018, entre la sintomatología se encuentra: ciclos menstruales irregulares (oligo- menorrea o amenorrea), disfunción ovárica, hiperandrogenismo bioquímico, hiperandrogenismo clínico y ovarios poliquísticos detectados por ultrasonido.10
La presencia de dos o más de estos criterios sugiere el diagnóstico de SOP y da origen a cuatro fenotipos en los que los ovarios poliquísticos no necesariamente deben estar presentes para definir el síndrome, y en los que tampoco la presencia de ovarios poliquísticos por sí sola establece dicho diagnóstico.11 Recientemente, se ha observado que cada uno de estos fenotipos se asocia a manifestaciones clínicas, reproductivas y metabólicas distintas, así como a un riesgo metabólico diferente.12 La principal causa patológica del SOP ha pasado de los ovarios al eje hipotálamo-hipófisis y a defectos en la actividad de la insulina, donde el hiperandrogenismo ovárico o adrenal es el hallazgo más consistente a nivel bioquímico y es la clave para el diagnóstico del SOP, con o sin acné o hirsutismo.4
Hasta el momento, el desarrollo del SOP no se ha podido atribuir a una sola causa y la evidencia científica sugiere que es un modelo multifactorial en el que intervienen factores ambientales, polibilidad asociada entre SOP y la depresión es alta, especialmente entre las adolescentes, porque se les ha asociado con los aspectos metabólicos (como la RI) y hormonales (niveles altos de testosterona libre).21,22 La depresión afecta la salud mental a largo plazo y se ha visto que mujeres con SOP tienden a un riesgo más alto de episodios depresivos mayores o recurrentes y a intentos de suicidio.23
La importancia de la obesidad en nuestros tiempos y la íntima relación que tiene este síndrome con el sobrepeso y el síndrome metabólico son las ra- zones por las cuales el SOP adquiere tanta relevancia en la salud pública actual. El síndrome metabólico y la obesidad son considerados las epidemias del siglo XXI. Además, el SOP representa la primera causa de infertilidad en las mujeres en edad reproductiva a ni- vel mundial, incluyendo a Costa Rica.1,10,17
A la fecha, se han realizado muy pocas investigaciones sobre SOP en pacientes costarricenses. El objetivo de este estudio fue describir en grupo de mujeres universitarias costarricenses los hallazgos clínicos y bioquímicos asociados al SOP.
Métodos
En el presente estudio observacional- descriptivo, participaron 160 mujeres estudiantes de la Sede Rodrigo Facio de la Universidad de Costa Rica. Se efectuaron dos muestreos de carácter voluntario en la Facultad de Microbiología y en el Laboratorio Clínico de la Oficina de Bienestar y Salud de la Universidad de Costa Rica.
Cada una de las mujeres participantes tuvo que firmar un consentimiento informado, aprobado por el Comité Ético Científico de la Vicerrectoría de Investigación de la Universidad de Costa Rica (VI- 7136-2009). Para estimar el tamaño de la muestra, se estableció un intervalo de confianza del 95 % (Zα= 1,96), un error máximo de 5 % (d = 0.05) y se decidió usar una prevalencia del 10 % (p = 0.10) como valor promedio en la bibliografía consultada. El tamaño de la muestra se obtuvo con la siguiente fórmula:
Por lo tanto, se determinó que el total mínimo necesario de universitarias participantes en el estudio debía ser de 138. Sin embargo, al final fueron reclutadas 180 mujeres. Entre los criterios de inclusión, se encuentran mujeres, entre los 17 y 28 años, que fueran estudiantes de la Universidad de Costa Rica y que sospecharan o tenían conocimiento de padecer SOP. Entre los criterios de exclusión del estudio se consideraron los siguientes: presentar tras- tornos de función tiroidea, diagnóstico de síndrome de Cushing, hiperplasia suprarrenal, hiperprolactinemia y/o tumores secretores de andrógenos. Los trastornos de función tiroidea y la hiperprolactinemia fueron descartados a través de análisis bioquímicos de tamizaje y los tumores de andrógenos, el síndrome de Cushing y la hiperplasia suprarrenal, por historia clínica según el relato de las participantes. Aquellas participantes que ingerían me- dicamentos tales como levotiroxina, metformina, anticonceptivos orales o esteroides también fueron excluidas del estudio. Un total de 20 mujeres fueron descartadas por ingerir alguno de los medicamentos citados o por presentar trastornos de la glándula tiroidea. La muestra final de la investigación incluyó a 160 participantes.
La información general de cada mujer, así como algunas preguntas relacionadas con el uso de anticonceptivos orales, edad de la primera menstruación, día del ciclo menstrual, antecedentes ginecoobstétricos, trastornos menstruales y de carácter endocrino, fue recolectada mediante entrevista con un cuestionario previamente validado. Algunas características físicas de las pacientes, como hirsutismo, acné, alopecia, acantosis nigricans y voz ronca fueron valoradas por las investigadoras mediante observación. El peso (kg) de las participantes se estimó mediante una báscula de bioimpedancia Tanita SC-331S (sin columna) y la estatura se midió con un estadiómetro marca SECA, modelo 217.
Una muestra de sangre de cada participante fue recolectada en tubos al vacío Vacutainer (Becton-Dickinson, Rutherford, NJ, EUA) sin anticoagulante luego de un ayuno de 12-14 horas por extracción de la vena antecubital y de acuerdo con los procedimientos establecidos por el Instituto de Estándares Clínicos y de Laboratorio (NCCLS. Procedures for the Collection of Diagnostic Blood Specimens by Venipuncture; Approved Standard- Fifth Edition. NCCLS document H3-A5 (ISBN 1-56238-515-1). NCCLS, 940 West Valley Road, Suite 1400, Wayne, Pennsylvania 19087-1898 USA, 2003). La muestra fue centrifugada a 3000 revoluciones por minuto durante 10 minutos y a temperatura ambiente para obtener el suero. Para garantizar su estabilidad, las muestras de suero de las participantes fueron almacenadas en congelación a −20 °C hasta ser analizadas.
La concentración de glucosa sérica y el perfil lipídico (colesterol total (CT), HDL-colesterol (HDL-C) y triglicéridos (TG)) se determinaron utilizando métodos colorimétricos enzimáticos en un equipo automatizado Roche Hitachi modelo 911. Las determinaciones de las concentraciones séricas de LH, FSH, estradiol, progesterona, prolactina, testosterona total, insulina, hormona estimulante de la tiroides (TSH) y la fracción libre de tiroxina se efectuaron en el equipo automatizado AxSYM System® (Abbott Diagnostics) mediante la tecnología enzimoinmunoanálisis de micropartículas. Todos los resultados de laboratorio están respaldados por un sistema de control de calidad conforme a la norma INTE/ISO 15189:2014.
Para el cálculo de la RI, se utilizó el modelo matemático Homeostasis Model Assessment (HOMA-IR) planteado por Matthews y colaboradores:24 (insulina (μUI/mL) x glucosa (mg/ dL))/405. La relación entre las hormonas LH y FSH se planteó mediante el cociente LH/FSH. El Índice de Castelli se estimó al dividir el CT/HDL-C y para calcular la concentración de LDL-C se empleó la fórmula de Friedewald (LDL-C= CT- (HDL-C + TG/5).25
El estado nutricional de las participantes se estimó conforme a la clasificación internacional de bajo peso, peso normal, sobrepeso y obesidad adulta de acuerdo con el índice de masa corporal (IMC) establecido por la Organización Mundial de la Salud: peso (kg)/talla (m2) (Organización Mundial de la Salud. El estado físico: uso e interpretación de la antropometría. Ginebra: WHO; 1995. (accesado 06-03-2021). Disponible en: https://apps.who.int/ iris/handle/10665/42132.pdf). De acuerdo con los criterios establecidos por la Asociación Americana de Diabetes, un valor de glucosa normal es inferior a los 5,55 mmol/L (American Diabetes Association (ADA). Diagnosis and classification of diabetes mellitus. United States: ADA; 2014. (accesado 05- 23-2021). Disponible en: https://diabetesjournals.org/care/article/37/Supplement_1/S81/37753/Diagnosis-and-Classification-of-Diabetes-Mellitus). En relación con las pruebas tiroideas, se consideró un intervalo de referencia para TSH de 0,47 a 4,64 μUI/mL, mientras que para la FT4 fue de 0,71 a 1,85 ng/dL. El estradiol, la progesterona, la LH y la FSH fueron interpretadas con los intervalos de referencia de los panfletos comerciales para las fases folicular, de ovulación y lútea. Valores superiores a 29,12 ng/mL de prolactina fueron considerados como criterio excluyente para participar en el estudio. La relación LH/FSH fue considerada normal cuando su valor estaba por debajo de 2,8.
Los valores de referencia establecidos para insulina en ayuno fueron 1-17 μUI/mL y se consideró que existía RI cuando el valor de HOMA-IR era mayor a 3,2. El Índice de Castelli debe ser menor a 4,5 para no tener riesgo cardiovascular. Por último, la hiperandrogenemia bioquímica se definió cuando las concentraciones de testosterona total en suero eran superiores a 62 ng/dL y el diagnóstico de SOP se estableció de acuerdo con los criterios mayores y menores según Ben-Rafael y Orvieto,26 los cuales se presentan en el Cuadro 1. La presencia de dos criterios menores constituye una forma leve de SOP. Un criterio mayor y uno menor, o dos o más criterios mayores y menores indican una forma moderada o severa de la enfermedad.
Cuadro 1 Criterios mayores y menores para el diagnóstico del síndrome de ovario poliquístico
| Criterios mayores | Criterios menores |
|---|---|
| Anovulación/oligomenorrea | Hirsutismo leve |
| Hiperinsulinemia/insulina-resistencia | Acné |
| Hiperandrogenemia | Obesidad |
| Hirsutismo severo | Relación LH/FSH alterada (predominio de LH) |
| Evidencia ultrasonográfica de quistes en ovarios |
Ben-Rafael Z y Orvieto R (2000).
Los datos fueron analizados con el programa SPSS (SPSS Inc., versión 24,0 para Windows, Chi- cago, Illinois) con el uso de estadística descriptiva. La prueba t-Student se usó para comparar los pro- medios de las variables bioquímicas con distribución normal, mientras que la prueba de Mann-Whitney se empleó para variables no paramétricas. Un valor de p< 0,05 se consideró como significativo. Los coeficientes de Spearman se utilizaron para determinar los niveles de correlación entre las diferentes variables con distribución normal del estudio. Estas fueron significativas a los niveles de 0,05 y 0,01(bilaterales).
Resultados
En el estudio participaron 160 mujeres con una edad promedio de 22 ± 2 años. El 10,9 % de las mujeres con SOP presentó la condición de obesidad y un 67,2 %, trastornos menstruales en relación con las mujeres con que no presentaron el síndrome (p= 0,014 y p= 0,029 respectivamente). Además, su peso (62,92 kg ± 13,78 vs 57,68 kg ± 8,08; p=0,003) y su IMC (23,93 ± 4,13 vs 22,11 ± 2,65; p< 0,001) fueron significativamente superiores en comparación con las mujeres sin SOP (Cuadro 2). En relación con los parámetros bioquímicos, un 45,3 % de las mujeres con SOP mostró hiperandrogenemia; un 21,9 %, hiperinsulinemia; un 28,1 %, RI y una relación LH/FSH > 2,8 en el 14,1 % de los casos, siendo estas proporciones significativamente superiores a las de mujeres sin el SOP. Asimismo, sus valores de testosterona total, TG, LDL-colesterol e Índice de Castelli fueron también significativamente superiores a los valores de las mujeres sin SOP. Los valores de HDL-colesterol fueron significativamente menores en las mujeres con SOP (50 ± 14 mg/dL vs 58 ± 15 mg/dL; p <0,001) al compararlos con el grupo sin SOP (Cuadro 3). El 21,9 % de las mujeres con SOP presentó hirsutismo; un 81,3 %, ciclos menstruales irregulares y un 46,9 %, morfología de ovario poliquístico en el ultrasonido (Cuadro 4) en comparación con las mujeres sin SOP. En el Cuadro 5, se estratificaron los resultados del perfil lipídico y la glucosa de las participantes de acuerdo con los criterios clínicos del Programa Nacional de Educación en Colesterol y de Diabetes Care, lo que evidenció diferencias estadísticamente significativas entre ambos grupos en los valores de HDL-colesterol, TG y en el índice de riesgo cardiovascular.
Cuadro 2 Comparación de las características antropométricas, sociales y antecedentes familiares de las mujeres con o sin el síndrome de ovario poliquístico
| Variables | Con SOP (n= 64) | Sin SOP (n=96) | Valor p** |
| 1. Antropométricas y sociales | |||
| Edad en años cumplidos | 21,67 ± 2,06* (18-28) | 22,02 ± 1,98* (17-26) | <0,282 |
| Peso (kg) | 62,92 ± 13,78* (44-127) | 57,68 ± 8,08* (43-79) | <0,003 |
| Talla (metros) | 1,62 ± 0,07* (1,47-180) | 1,62 ± 0,06* (1,47-180) | <1,000 |
| Índice de masa corporal (kg/m2) | 23,93 ± 4,13* (17,72-39,20) | 22,11 ± 2,65* (17,65-32,05) | <0,001 |
| Sobrepeso (%) | 18,8 | 10 | <0,174 |
| Obesidad (%) | 10,9 | 1 | <0,014 |
| Actividad física (%) | 46,90 | 52,10 | <0,629 |
| Edad en años de primera menstruación | 12,43 ± 1,27* (10-15) | 12,27 ± 1,17* (9-16) | <0,414 |
| Embarazo (%) | 4,7 | 3,2 | <0,949 |
| Fumado (%) | 14,1 | 7,3 | <0,257 |
| Presión alta (%) | 3,1 | 1,0 | <0,713 |
| Uso de pastillas anticonceptivas (%) | 25,4 | 40,0 | <0,082 |
| Uso de anticonceptivas con otro fin (%) | 57,1 | 45,2 | <0,189 |
| 2. Antecedentes familiares | < | ||
| Trastornos menstruales (%) | 67,2 | 48,4 | <0,029 |
| Diabetes (%) | 76,6 | 68,8 | <0,370 |
| Quistes en los ovarios (%) | 50,8 | 43,6 | <0,464 |
| Problemas cardiovasculares (%) | 59,4 | 52,6 | <0,493 |
*Promedio± DE (intervalo). **Diferencia significativa cuando p<0,05. n= número de participantes, SOP=síndrome de ovario poliquístico
Cuadro 3 Comparación de los parámetros bioquímicos de las mujeres con o sin el síndrome de ovario poliquístico
| Variables | Con SOP (n= 64) | Sin SOP (n=96) | Valor p** |
|---|---|---|---|
| 1. Parámetros bioquímicos | |||
| Glucosa (mg/dL) | 84 ± 29 * (58-304) | 83 ± 7 * (62-97) | 0,629 |
| Insulina (mUI/L) | 13,80 ± 12,55* (3-85,7) | 10,82 ± 8,27* (2,6-49,6) | 0,072 |
| Testosterona total (ng/dL) | 58,97 ± 23,21* (13,1-123,6) | 46,41 ± 16,61* (18,2-108,7) | <0,001 |
| Colesterol total (mg/dL) | 182 ± 35* (105-249) | 173 ± 39* (96-262) | 0,143 |
| Triglicéridos (mg/dL) | 135 ± 78* (45-437) | 100 ± 41* (37-220) | <0,001 |
| HDL-colesterol (mg/dL) | 50 ±14 (23-91) * | 58 ±15 (29-92)* | <0,001 |
| LDL-colesterol (mg/dL) | 105 ± 26 (45-164)* | 95 ±26 (43-179)* | 0,020 |
| Índice de Castelli | 3,9 ± 1,4 (2,0 - 9,0)* | 3,1 ± 0,9 (1,7-6,0)* | <0,001 |
| TSH | 2,2 ± 0,9* (0,6-4,6) | 1,9±0,9* (0,5-4,1) | 0,099 |
| T4 libre | 0,96 ± 0,11* (0,8-1,3) | 0,97 ± 0,10* (0,7-1,3) | 0,553 |
| Hiperandrogenemia bioquímica (%) | 45,3 | 16,7 | <0,001 |
| Hiperinsulinemia (%) | 21,9 | 8,3 | 0,027 |
| Resistencia a la insulina (%) | 28,1 | 10,4 | 0,007 |
| Relación LH/FSH > 2,8 (%) | 14,1 | 2,1 | 0,009 |
*Promedio± DE (intervalo). **Diferencia significativa cuando p<0,05. n= número de participantes, SOP=síndrome de ovario poliquístico, TSH=Hormona estimulante de la tiroides, LH=Hormona luteinizante, FSH= Hormona folículo estimulante
Cuadro 4 Comparación de las características físicas y clínicas de las mujeres con o sin el síndrome de ovario poliquístico
| Variables | Con SOP (n= 64) | Sin SOP (n=96) | Valor p** |
|---|---|---|---|
| 1. Características físicas | |||
| Acné (%) | 17,2 | 12,5 | <0,548 |
| Hirsutismo (%) | 21,9 | 04,2 | <0,001 |
| 2. Otras características clínicas relacionadas al síndrome | |||
| Aborto espontáneo (%) | c2,3 | 02,1 | <0,817 |
| Ciclos irregulares (%) | 81,3 | 17,9 | <0,001 |
| Morfología ovario poliquístico (US) (%) | 46,9 | 14,6 | <0,001 |
**Diferencia significativa cuando p<0,05. n= número de participantes, SOP=síndrome de ovario poliquístico, US= ultrasonido
Cuadro 5 Distribución de la población con o sin síndrome de ovario poliquístico según las normas del Programa Nacional de Educación en Colesterol (NCEP, 2001 y Diabetes Care, 2003)
| Variable | SOP | Sin SOP | p* | |||||
|---|---|---|---|---|---|---|---|---|
| Glucosa (mg/dL) | n | % | n | % | ||||
| <100 | 62 | 97,0 | 96 | 100,0 | 0,334 | |||
| 100-125 | c1 | c1,5 | c0 | 000,0 | 0,874 | |||
| ≥ 126 | c1 | c1,5 | c0 | 000,0 | 0,874 | |||
| CT (mg/dL) | ||||||||
| <200 | 45 | 70,3 | 78 | 081,3 | 0,154 | |||
| 200-240 | 13 | 20,3 | 15 | 015,6 | 0,579 | |||
| >240 | c6 | c9,4 | c3 | 003,1 | 0,179 | |||
| HDL (mg/dL) | ||||||||
| <40 | 16 | 25,0 | c8 | 008,3 | 0,008 | |||
| 40-60 | 36 | 56,3 | 50 | 052,0 | 0,709 | |||
| >60 | 12 | 18,7 | 38 | 039,7 | 0,008 | |||
| LDL (mg/dL) | ||||||||
| <100 | 28 | 43,8 | 54 | 056,3 | 0,165 | |||
| 100-160 | 34 | 53,1 | 40 | 041,7 | 0,209 | |||
| >160 | c2 | c3,1 | c2 | 002,0 | 0,935 | |||
| TG (mg/dL) | ||||||||
| <150 | 45 | 70,3 | 84 | 087,5 | 0,013 | |||
| 150-200 | c8 | 12,5 | c9 | 009,4 | 0,718 | |||
| >200 | 11 | 17,2 | c3 | 003,1 | 0,005 | |||
| Índice Castelli | ||||||||
| <4,5 | 49 | 76,6 | 89 | 092,7 | 0,008 | |||
| ≥4,5 | 15 | 23,4 | c7 | 007,3 | 0,008 | |||
*Diferencia significativa cuando p<0,005; n= número de participantes; CT: colesterol total, HDL: colesterol ligado a lipoproteínas de alta densidad; LDL: colesterol ligado a lipoproteínas de baja densidad; TG: triglicéridos.
Discusión
Ambos grupos de mujeres (con SOP y sin SOP) tuvieron un comportamiento muy similar en cuanto a características demográficas: un promedio de edad de 21-22 años, una posición socioeconómica similar (clase media es el estrato social dominante) y la edad del primer periodo menstrual (alrededor de los 12 años). Un aspecto para destacar son los hábitos de ejercicio físico de ambos grupos, ya que solo la mitad de la población realizaba algún tipo de actividad física, lo cual es desfavorable puesto que el sedentarismo se relaciona con un mayor riesgo de padecer enfermedades cardiovasculares y metabólicas tipo diabetes mellitus.
La población con SOP tuvo un peso y un IMC promedios significativamente mayores que la población sin SOP. Según Gómez et al.,27 en el Estudio Latinoamericano de Nutrición y Salud en el 2020, la prevalencia de sobrepeso y obesidad para mujeres costarricenses de 20 a 44 años es del 59,7 % y aumenta con la edad al 77,3 % en mujeres de 45 a 65 años. El sobrepeso y la obesidad representaron un 13 % y un 4,9 % de la población de estudio, respectivamente, en la que el 57,1 % de las participantes con sobrepeso tenía SOP (p = 0,110) y, de aquellas con obesidad, el 87,5 % tenía SOP (p = <0,001).
Estudios en poblaciones específicas de mujeres con sobrepeso y obesidad reportan una prevalencia de SOP del 28,3%, lo cual difiere con los datos obtenidos, según los cuales, la mayoría de estas mujeres (57,1 % con sobrepeso y 87,5% con obesidad) tienen el síndrome. Esto se explica debido al sesgo en el muestreo del estudio donde la población atraída tenía sospechas de padecer el síndrome.
Investigaciones en otros países hablan de que entre un 38-88 % de las mujeres con SOP tienen sobrepeso u obesidad, pero no especifican un rango de edad.27-28 Según los resultados obtenidos, un 30 % de las participantes con SOP tenían sobrepeso u obesidad, lo cual es considerable si se toman en cuenta las edades de las participantes. El 70 % restante de las mujeres con el síndrome tuvieron un peso normal (63,7%) o incluso bajo peso (6.3 %) lo que nos indica que la obesidad es una manifestación importante del síndrome, pero no un criterio pragmático para su diagnóstico y que mujeres con IMC normales, o incluso bajos, también pueden padecer el síndrome.28
En cuanto al perfil de lípidos, se esperaba obtener un patrón de dislipidemia que involucrara un aumento de triglicéridos, altos niveles de LDL-colesterol o niveles disminuidos de HDL-colesterol.29 El grupo con SOP tuvo significativamente tanto valores mayores, en el caso del LDL-C y los triglicéridos, como menores, en el caso de HDL, lo cual concuerda con lo esperado. Según la distribución del Programa Nacional de Educación en Colesterol, en el mismo grupo con SOP, la mayoría presentó un perfil de lípidos dentro de los valores de referencia; solo un 25 % tuvo HDL-colesterol considerado de alto riesgo, lo mismo en un 3,1% con el LDL colesterol y un 17,2 % en el caso de los triglicéridos. Esta dislipidemia es consecuencia de la RI e hiperandrogenemia, su prevalencia aumenta con la edad y es un factor de riesgo si se halla ligada a problemas cardiovasculares.30 El Índice de Castelli también fue marcadamente mayor en la población con SOP.
Se obtuvieron correlaciones positivas significativas entre el IMC con triglicéridos en suero, LDL-colesterol, Índice de Castelli y la RI según HOMA-IR; a la vez, se obtuvo una correlación negativa significativa con el HDL-colesterol. Estos resultados coinciden con los hallazgos de estudios previos y resaltan el eje obesidad-RI-dislipidemia, el cual aumenta el riesgo de sufrir diabetes y accidentes cardiovasculares, ambos con alta morbilidad y mortalidad hoy en día.1,9,17
Una minoría de la población de estudio (1,9 %) dijo padecer de presión alta, lo cual es comprensible puesto que es baja la prevalencia de hipertensión en ese grupo etario. Pese a ello, es notable que, de ese porcentaje, más del doble de las participantes presentaban SOP. Esto se explica porque la hipertensión es parte de las complicaciones del síndrome, por lo que es de suponer que a largo plazo más de las universitarias con SOP sean hipertensas.2,9 Debido a que la presión arterial no fue tomada a cada participante en la toma de muestra, es probable que haya un subregistro.
La relación hipertensión y SOP va más allá de un perfil de lípidos aumentado. Estudios han demostrado que los andrógenos contribuyen a la hipertensión en pacientes con SOP.1,2,9,31 El rol de los andrógenos en la modulación de la presión arterial aún no está claro. Sin embargo, se cree que los andrógenos aumentan la expresión de los componentes del sistema renina-angiotensina.32
La población con SOP presentaba más hábitos de fumado y más sedentarismo que la población sin SOP, lo cual aumenta el riesgo de obesidad, RI y, por ende, hiperandrogenemia y las demás complicaciones del síndrome.14
El 28,1 % de la población con SOP poseía RI y un 21,9 %, hiperinsulinemia. El porcentaje de resistencia arrojado fue bajo, pues, en otros estudios, se ha visto que más del 50% de las mujeres con SOP tiene RI.17 El porcentaje de hiperinsulinemia y la RI presenta una diferencia significativa en la población con SOP, no así el valor promedio de insulina. Debido a la obesidad y a la RI, la presencia de hiperinsulinemia en mujeres con SOP podría elevar aún más los niveles biodisponibles de andrógenos, esto causado por una disminución de los niveles de SHBG.17 El 10,4 % de la población sin SOP presentaba RI asociada a otras patologías, como el síndrome metabólico.
Se vio una correlación positiva significativa entre los valores séricos de insulina y RI con respecto a la concentración sérica de lípidos y al IC. Dicho hallazgo se explica debido al aumento de la oxidación de los ácidos grasos libres en músculo que restringe tanto la captación como la utilización de glucosa por parte de este tejido.33
El hiperandrogenismo fue el criterio diagnóstico más observado en la población con SOP con una frecuencia de 45,3 %. Tanto la media en suero como el porcentaje de hiperandrogenemia fueron significativamente mayores en las pacientes con SOP. Se consideró como parámetro único de hiperandrogenemia la testosterona total por efectos prácticos y de presupuesto del estudio. Para futuros estudios, se planteará la cuantificación de otros andrógenos como la testosterona libre y el dehidroepiandrosterona-sulfato para ampliar el criterio diagnóstico. No se encontraron correlaciones positivas significativas entre los niveles de andrógenos, perfil de lípidos y RI, lo cual hubiese sido lo esperado según la fisiopatología del síndrome reportada en la literatura27 y la relación existente entre niveles de testosterona, dislipidemia y presión arterial.2,32
Características clínicas como hirsutismo y acné son causadas por la concentración elevada de andrógenos, de entre las cuales, el hirsutismo fue significativamente mayor. Aunque es considerado un criterio de diagnóstico, el hiperandrogenismo físico presentado hasta en un 70 % de las mujeres con SOP,2,33 en la población universitaria solo estaba presente en el 21,9 %. La acantosis nigricans se observó en un 1,6 % de las universitarias con SOP y en un 2,1 % de las mujeres sin SOP, esta característica es sugestiva de la RI pero no específica del SOP. Se esperaba que la población que más presentara RI fuera la que más poseyera esta característica; sin embargo, no se presentó dicha relación.
Una característica que prevaleció en la población SOP fue la irregularidad menstrual (80 %), razón principal por la que las participantes dijeron tomar anticonceptivos orales, además de evitar un embarazo. Las mujeres con SOP son el mayor grupo de mujeres con ovulación disfuncional, esto debido a que el exceso de andrógenos estimula una mayor secreción de LH y una inversión de la relación LH/ FSH, lo que causa anovulación al no madurarse los folículos. 1,2,4,9,14,18,34 Está relación invertida se vio en un 14,1 % de las mujeres con SOP, teniendo una diferencia significativa con respecto a aquellas sin SOP, 2,1 % (p = 0,009). Esta relación se utilizó como criterio diagnóstico menor.9 Durante muchos años, esta característica se utilizó como parte del diagnóstico, pero en la actualidad, este parámetro no es estrictamente necesario ya que puede haber mujeres con SOP y relación LH/FSH normal, especialmente cuando presentan obesidad.35
Se obtuvo una correlación positiva significativa entre la relación LH/FSH y la testosterona total, debido al efecto de los andrógenos sobre la inversión en la relación LH/FSH y, por ende, las irregularidades menstruales.2-4,8,14,34,36
Las pastillas anticonceptivas han sido el tratamiento más común para regular la ovulación, así como para tratar los síntomas del SOP.Estas interfieren en la reducción de la producción de andrógenos, en el aumento de síntesis hepática de SHBG y en la competencia por la unión a receptores de andrógenos por parte de ciertos progestágenos.4 Al disminuir los andrógenos, se da una adecuada secreción de LH y FSH y, por ende, una ovulación normal.4
Es común entre las personas pensar que la presencia de quistes en los ovarios es sinónimo de padecer SOP. Aunque el síndrome lleva ese nombre debido a que fue una de las primeras características documentadas, la poliquistosis ovárica ultrasonográfica no es una característica patognomónica del síndrome.1,9 Esa característica se demostró en el estudio, en el que apenas un 46,9
% de las mujeres con SOP dijo tener quistes en los ovarios. Por el contrario, en el grupo sin SOP un 14,6 % de las participantes dijo tener quistes en los ovarios y no se le diagnosticó el síndrome según los parámetros bioquímicos. Sin embargo, el estudio presenta la limitante que se realizó solamente por referencia de las participantes y no llevó a cabo una valoración médica para determinar la presencia de ovario poliquístico por ultrasonido.
Pese a la falta de elementos diagnósticos para determinar la prevalencia del SOP en una población femenina universitaria en etapa reproductiva, la hipótesis se comprobó de manera parcial al demostrar que la prevalencia obtenida es alta. No obstante, la investigación sirvió para ver el comportamiento de este síndrome en esta población de mujeres, lo que permitió determinar que las participantes con SOP presentan significativamente mayor prevalencia de sobrepeso y obesidad que aquellas sin el síndrome, lo cual se relaciona con riesgo a padecer diabetes mellitus tipo 2 y problemas cardiovasculares.5,17,19,31,34 La RI es la principal causa del síndrome y está directamente relacionada con la obesidad y la hiperandrogenemia.14
La hiperandrogenemia estimula la aparición de la RI, así como trastornos ovulatorios consecuencia de una secreción de FSH disminuida.14 Además, el mismo exceso de andrógenos es el principal responsable de las características clínicas de este tipo de pacientes.1,2,9 El SOP cobra importancia en nuestra sociedad actual no solo por ser la principal causa de infertilidad en el mundo, sino también, por estar relacionado con las principales causas de morbilidad y mortalidad de la sociedad moderna como lo son la obesidad, la diabetes, los accidentes cardiovasculares y el cáncer.5,6,17,19,31,34,37 La ejecución de futuros proyectos con perfiles bioquímicos más amplios junto con pruebas de ultrasonido son los nuevos retos para investigaciones del SOP en Costa Rica en los próximos años.