La leucemia linfocítica aguda (LLA) es el cáncer más frecuente en la niñez.1-5Específicamente en Costa Rica la LLA representa un tercio de los casos de cáncer infantil en menores de 14 años y el 80% del total de casos de leucemia.1 La LLA es más frecuente en varones y su pico de incidencia ocurre entre los 1 y 5 años de edad.4
La leucemia se clasificaba históricamente según la morfología de los blastos en L1, L2 y L3;6,7 sin embargo, actualmente se clasifica también según su inmunofenotipo en linaje B, T o mixto3,8 y según criterios moleculares y citogenéticos.7 Aproximadamente 75-80% de las LLA en niños son del linaje de los precursores de la línea B, 15% son de linaje T, 5% B maduro3,8 y de un 2-5% son de inmunofenotipo mixto.9
Los pacientes con LLA se clasifican en diferentes grupos de riesgo de acuerdo con ciertas características clínicas y de laboratorio al debut (como edad, conteo de leucocitos, enfermedad extra medular, inmunofenotipo, citogenética, ploidía, entre otros);3,9 esto permite estratificar la intensidad del tratamiento según el riesgo particular de cada paciente.9-11
El compromiso testicular y de sistema nervioso central (SNC) al diagnóstico tiene importancia pronóstica.9,11 Se ha descrito que alrededor de 3-5% de los pacientes tienen compromiso de SNC al debut y 30-40% en las recaídas,12 mientras que un 1,1-2,4% de los pacientes tienen compromiso testicular.13 Ambos sitios anatómicos se consideran sitios santuario; donde la vigilancia inmunológica es limitada y las células tumorales se protegen del tratamiento estándar.12,13 Es por esto que se ha utilizado quimioterapia intratecal, altas dosis de metotrexate, radioterapia y otros tratamientos novedosos, con el fin de mejorar el efecto terapéutico sobre los sitios santuario.12,13
La radioterapia en LLA está indicada en: 1) casos con diseminación a SNC (al diagnóstico o recaída), 2) recaída testicular, 3) control de dolor por infiltración ósea y 4) condicionamiento previo a un trasplante de médula ósea.14-17 Si bien se usan técnicas para maximizar la dosis de radiación al tumor y minimizar la exposición de tejido normal, existe el riesgo de efectos secundarios que pueden ser agudos, subagudos o tardíos.18
El grado de toxicidad depende de diversos factores, como el área anatómica irradiada, la dosis, la proximidad de estructuras sensibles, el efecto aditivo de otros tratamientos, entre otros.19-23 La mayoría de los efectos secundarios son auto limitados (resuelven al disminuir el edema tisular), pero algunos efectos pueden ser tardíos o permanentes, como fibrosis, infertilidad o segundas malignidades.19,20,24,25
Actualmente, aproximadamente el 98% de los niños con LLA alcanzan remisión con tratamiento y la sobrevida a 5 años ronda el 90%;9,26 sin embargo, se ha descrito que hasta un 20% de los niños con LLA recaen.11 En Costa Rica se han publicado estudios acerca del diagnóstico y tratamiento de la leucemia en población pediátrica, pero ninguno específico acerca del uso de radioterapia en el tratamiento de la LLA. El objetivo de este estudio fue describir las características epidemiológicas y clínicas de los pacientes con LLA atendidos en el hospital nacional especializado y que recibieron radioterapia externa durante el periodo del 1 de enero del 2009 al 31 de diciembre del 2017.
Métodos
Este es un estudio observacional, descriptivo. Se revisaron todos los expedientes clínicos de pacientes pediátricos de 0-13 años, con diagnóstico de LLA, que recibieron radioterapia externa entre el 1 de enero del 2009 y el 31 de diciembre del 2017. Se excluyeron los pacientes con expedientes incompletos, definido como menos del 50% de las variables de interés.
Se recolectaron datos demográficos (sexo, edad), y clínicos (tipo de LLA, grupo de riesgo al diagnóstico, sitio anatómico irradiado, dosis de radiación, indicación de radioterapia y efectos secundarios). Un mismo paciente pudo haber recibido radioterapia en más de una ocasión por indicaciones distintas, lo que se contempló como sesiones de tratamiento diferentes. Se recolectó la información en una base de datos confeccionada con Epi Info versión 3.1. Se analizaron los datos con los programas Excel 2007 y Stata 14.0. Se realizó un análisis estadístico descriptivo (frecuencias, promedios, mínimos, máximos, cuartiles, desviación estándar).
El protocolo del estudio fue aprobado por el Comité Ético Científico del HNN con el código CECHNN-040-2017.
Resultados
Se revisaron un total de 66 expedientes, de los cuales 6 no cumplieron con los criterios de inclusión y 2 se excluyeron por información incompleta. Se incluyó un total de 58 pacientes con LLA que recibieron radioterapia, de estos 46 (79,3%) eran hombres. La edad promedio de los pacientes irradiados fue de 7,3 ± 2,6 años (rango de 2,6-12,9 años). El grupo de edad más frecuentemente irradiado fue entre los 4 y 6 años de edad. El promedio de edad de las pacientes femeninas (5,3 ± 2,3 años) fue menor que el de los hombres (7,9 ± 2,5 años).
Un 84,2% (48/57) de las LLA eran de morfología L1, mientras que el 15,8% (9/57) eran L2. En cuanto al inmunofenotipo, 48/57 (84,2%) de las LLA eran B común, 5/57 (8,8%) eran T cortical y 4/57 (7,0%) tenían otra clasificación (pre-T, pre-B tardía o B nula). El 56,9% (33/58) de los pacientes irradiados se catalogaron en el grupo de alto riesgo al diagnóstico, 25,9% (15/58) de riesgo estándar y 17,2% (10/58) de riesgo intermedio.
Dos de los 58 pacientes incluidos recibieron 2 tratamientos de radioterapia por indicaciones distintas al tratamiento inicial (recaídas) y un paciente recibió 3 tratamientos de radioterapia, es por esto que el total de tratamientos asciende a 62 tratamientos. La indicación de radiación en el 67,7% (42/62) de los tratamientos fue por recaída, el 21,0% (13/62) por profilaxis a SNC, el 9,7% (6/62) por infiltración a SNC y el 1,6% (1/62) por irradiación nodal total. En el Cuadro 1 se puede observar la indicación de radioterapia de acuerdo con cada grupo de riesgo.
Cuadro 1: Indicación de radioterapia según la clasificación del grupo de riesgo al debut de los pacientes con diagnóstico de leucemia linfocítica aguda. Enero del 2009 a diciembre del 2017; Departamento de Hematooncología, Hospital Nacional de Niños, Caja Costarricense Seguro Social (n = 62 tratamientos en 58 pacientes)
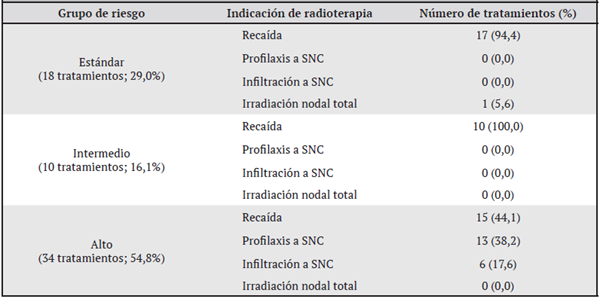
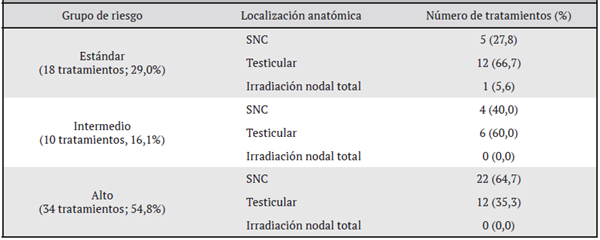
El 94,8% (55/58) de los pacientes con LLA se irradiaron en un solo sitio anatómico, 3,4% (2/58) en dos sitios anatómicos y 1,7% (1/58) en tres sedes anatómicas. El 50,0% (31/62) de los tratamientos de radioterapia fueron a SNC, el 48,4% (30/62) a testículos y el 1,6% (1/62) recibió irradiación nodal total. La población femenina recibió radioterapia únicamente a nivel de SNC. En el Cuadro 2 se puede observar que los pacientes con LLA de alto riesgo se irradiaron más frecuentemente a SNC, mientras que los de riesgo estándar e intermedio más a nivel testicular.
Cuadro 2: Localización anatómica irradiada según la clasificación del grupo de riesgo al debut de los pacientes con diagnóstico de leucemia linfocítica aguda. Enero del 2009 a diciembre del 2017; Departamento de Hemato-oncología, Hospital Nacional de Niños, Caja Costarricense Seguro Social (n = 62 tratamientos en 58 pacientes)
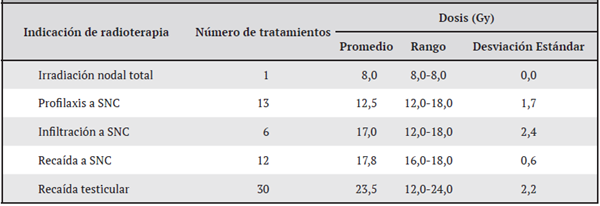
En el Cuadro 3 se muestran las dosis de radioterapia según las distintas indicaciones. La región testicular fue la que recibió mayor dosis de irradiación. Además, los pacientes con recaídas recibieron dosis mayores que aquellos con otras indicaciones de radioterapia.
Cuadro 3: Dosis (Gy) suministrada, según indicación de radioterapia externa en los pacientes con diagnóstico de leucemia linfocítica aguda. Enero del 2009 a diciembre del 2017; Departamento de Hemato-oncología, Hospital Nacional de Niños, Caja Costarricense Seguro Social (n = 62 tratamientos en 58 pacientes)
Discusión
Este estudio incluyó 58 pacientes, de los cuales la mayoría (79,3%) eran hombres, lo cual podría explicarse porque la incidencia de cáncer infantil, y específicamente de LLA, es mayor en hombres.1,4,27 En dos artículos previos realizados en población pediátrica costarricense se reportó que el 59% de los pacientes irradiados eran hombres,28,29 porcentaje menor al obtenido en este estudio. Lo anterior se explica debido a que este analizó específicamente población con LLA irradiada y que casi la mitad de los pacientes recibieron radioterapia a nivel testicular.
El promedio de edad de los pacientes con LLA que recibieron tratamiento con radioterapia externa fue de 7,3 ± 2,6 años, con una edad de inicio discretamente menor en mujeres. Estos datos son comparables con lo reportado por Chen et al, quienes describieron una edad media de inicio de radioterapia en pacientes con LLA de 7 años (rango de 2-14 años) y también documentaron que la edad de inicio fue menor en mujeres.30
En este estudio los pacientes más comúnmente irradiados fueron los que tenían inmunofenotipo B (84,2%); lo cual es esperable, ya que el linaje B es el más frecuente en las LLA en niños.3,8 Moghrabi et al reportaron en su estudio que el 88% de las LLA eran de linaje B y el 11% de linaje T,31 datos similares a los obtenidos.
La mayoría de pacientes en este estudio eran de alto riesgo (56,9%), lo cual es reflejo de las indicaciones de radioterapia en LLA, donde aquellos pacientes catalogados de alto riesgo o con infiltración de SNC al diagnóstico ameritan irradiarse.14,32 Los pacientes que más se irradiaron fueron aquellos en recaída (67,7%), lo cual también se mantuvo en los diferentes grupos de riesgo. Lo anterior refleja el hecho de que las recaídas son de las principales indicaciones de radioterapia en LLA.12,14,15,32 A diferencia de los pacientes con LLA de alto riesgo que se irradiaron más a SNC, es entendible que los de riesgo estándar e intermedio se irradiaran más a testículos, ya que la indicación de radioterapia en estos casos era la recaída testicular o a SNC.13,14
En este estudio se encontró que el SNC fue irradiado casi con la misma frecuencia que testículos (50,0% vs 48,4% respectivamente). Esto se explica, porque el principal motivo de la radioterapia fue por recaída (67,7% de los casos). Se ha descrito que luego de la recaída medular, la recaída a SNC y testicular son las dos más frecuentes.32
Los pacientes en este estudio recibieron dosis de 12,0-18,0 Gy a SNC y de 24 Gy a nivel testicular. Si bien la dosis puede variar según el protocolo de tratamiento utilizado, estas son acordes a las descritas en la literatura (dosis profiláctica a SNC 12-18 Gy, dosis terapéutica a SNC 18 Gy, dosis testicular 20-24 Gy).13-15,32
La mayoría de los pacientes (63,8%) presentaron algún efecto adverso. Un estudio realizado en Alemania documentó que el 73% de los pacientes entre 1-19 años presentaron alguna toxicidad aguda por la radioterapia,20 porcentaje superior al obtenido en este estudio posiblemente porque incluyeron pacientes con todos los diagnósticos oncológicos.
El daño que ocasiona la radioterapia al tejido normal es por efecto directo de la energía ionizante, por efecto indirecto y por inflamación.19 Cada tejido toma diferente tiempo para expresar el daño recibido, aquellos como la piel y mucosas, que tienen una actividad y capacidad de regeneración alta, responden rápidamente con mecanismos de apoptosis, ocasionando así efectos agudos más evidentes.19,33 Por lo tanto, es comprensible que los efectos cutáneos fueran los más frecuentes. Se ha reportado que hasta la mitad de los pacientes irradiados presentan algún grado de radiodermitis.34
Es esperable que los efectos adversos testiculares fueran los segundos más frecuentes, ya que con la dosis recibida (24 Gy) se ha descrito disfunción gonadal severa y azoospermia.13 El tejido gonadal es muy sensible a la radioterapia, se ha descrito que dosis bajas desde los 1,2 Gy pueden generar daño,21 incluso dosis de ≥ 4 Gy se asocian con infertilidad.13 Por otro lado, se ha descrito que los pacientes que reciben radioterapia a SNC tienen alto riesgo de efectos adversos tardíos como disfunción cognitiva, alteraciones neurosensoriales, alteraciones endocrinas, entre otras.19,33 Dosis desde los 18 Gy son suficientes para generar efectos adversos22,25 y los pacientes de tumores de SNC, linfomas de Hodgkin y leucemias agudas son los más propensos a efectos adversos neurológicos,21 lo cual explica por qué estos efectos fueron los terceros más frecuentes en este estudio.
Las limitaciones del estudio fueron las relacionadas con el carácter retrospectivo de la recolección de los datos ante la falta de información registrada en los expedientes médicos de los pacientes.
En conclusión, se obtuvieron resultados comparables con lo reportado en la bibliografía consultada. Los sitios anatómicos irradiados y la dosis recibida responden a las indicaciones de radioterapia en LLA. Este tratamiento es fundamental sobre todo en las recaídas de LLA y algunos pacientes de alto riesgo.















