La radiación ionizante (RI) es un proceso en el cual las partículas emitidas por elementos radiactivos son capaces de depositar energía suficiente para desplazar electrones de los átomos por lo que rompen los enlaces químicos y provocan cambios moleculares que dañan las células afectadas.1 (Organismo Internacional de Energía Atómica. Dosimetría citogenética: Aplicaciones en materia de preparación y respuesta a las emergencias radiológicas. [Internet]. Vienna: OIEA; 2014. [accesado 30-08-2017]. Disponible en: https://www-pub.iaea.org/MTCD/Publications/PDF/ EPR_Biodosimetry_S_web.pdf). Su uso ayuda a mejorar de muchas maneras la calidad de vida de los pacientes tratados con ella, como es el caso de utilización de rayos gamma en radioterapia. Este es una radiación de baja transferencia lineal de energía caracterizada por ser de gran penetrancia, lo que la hace útil en procesos médicos. Sin embargo, por su condición de RI, genera cambios moleculares que pueden repercutir en daños en el ADN, en efectos cancerígenos y cromosomopatías.2-4
Las cromosomopatías producidas por este tipo de radiación son inestables ya que, gracias a los mecanismos de reparación génica del ciclo celular, tienden a ser reparadas o, si son irreparables, inducen la entrada a apoptosis.3 Entre las cromosomopatías observables encontradas en pacientes después de aplicársele radioterapia en diferentes tipos de cáncer4, se encuentran los cromosomas dicéntricos (dic), cromosomas en anillo (r) y excesos acéntricos (eace). Aunque la radioterapia puede producir diversas cromosomopatías, las más características son los dic, marcadores más utilizados por ser fáciles de analizar y porque su frecuencia basal en población sana y sin haber sido irradiada ronda de uno a dos por cada mil células analizadas. Sin embargo, la frecuencia de cada tipo de alteración cromosómica y su distribución por célula dependen de la dosis, la sensibilidad del paciente y del tipo de célula que va a ser sometida a la irradiación.5 Los linfocitos tienden a ser muy sensibles a la radiación y en la mayoría de los casos su exposición provoca apoptosis o bien la inducción de diversas cromosomopatías.7 (International Atomic Energy Agency. Accidental overexposure of radiotherapy patients in Białystok. [Internet] Vienna: IAEA; 2004. [accesado 30 -08-2017]. Disponible en: https://www-pub.iaea.org/MTCD/Publications/PDF/Pub1180_web.pdf). Se espera que un paciente con tratamiento inicial de radioterapia no presente aberraciones inestables antes del tratamiento, a menos que haya estado en un esquema previo de tratamiento con radioterapia, debido a que las aberraciones inestables desaparecen con el tiempo y pueden observarse hasta dos años después de haber sido expuesto el paciente.7
De los 5 000 casos nuevos de cáncer que se informan al año en Costa Rica, 2 000 son sensibles a radioterapia, y de estos, alrededor de 700 (14%) son tratados con ella (Caja Costarricense del Seguro Social. Informe Institucional sobre el cáncer en Costa Rica. [Internet]. San José: CCSS; 2001. [accesado 30-8-2017]. Disponible en: https://www.binasss.sa.cr/opac-ms//media/digitales/Informe%20institucional%20sobre%20el%20c%C3%A1ncer%20en%20Costa%20Rica.%20CCSS.pdf). Además, según el documento Incidencias 2014, de estadísticas y bases de datos del Ministerio de Salud, 2014, "Este valor crece con el tiempo ya que para el 2014 se informaron el doble de nuevos casos, 10 906, y siguiendo el patrón del 2001, se espera que aumente el número de pacientes tratados con este método de radiación" (Ministerio de Salud. Incidencia 2014 diferentes características. Versión:1. [Internet]. San José: MS; 2016. [accesado 29-9-2017]. Disponible en: https://www.ministeriodesalud.go.cr/index.php/bibliotecade-archivos-left/documentos-ministerio-desalud/material-informativo/material-publicado/estadisticas-y-bases-de-datos/estadisticasy-bases-de-datos-vigilancia-de-la-salud/estadisticas-vigilancia-de-la-salud/estadistica-decancer-registro-nacional-tumores/incidencia/1692-incidencia-2014-diferentes-caracteristicas/file).
Se ha observado en diversos estudios que la irradiación produce dic y r y que conforme aumenta la dosis irradiada aumenta el número de estas cromosomopatías.4,6,8-12 Ramesh y Bhargava16 realizaron un estudio en cuatro pacientes antes de realizarles cualquier tratamiento contra el cáncer y encontraron que el porcentaje de anomalías cromosómicas como los dic, ace, r, lagunas cromatídicas (chtg), fracturas cromatídicas (chtb) y dobles minutas (dmin) es muy bajo, siendo lo máximo siete dic en un paciente en 222 metafases. Venkatachalam y colaboradores17 realizaron un estudio sobre efectos cromosómicos antes del tratamiento con radioterapia y quimioterapia en pacientes con cáncer, comparándolo con un grupo control de pacientes sanos y encontraron que el valor observado de dic es mayor en los pacientes, aun cuando no existen registros de haber sido expuestos a radioterapia o quimioterapia antes. Sin embargo, Gil y otros investigadores18 demuestran en 22 pacientes de cáncer de tiroides que no existe un incremento de anomalías como dicéntricos o micronúcleos antes del tratamiento con respecto a un grupo control de pacientes sanos. Gershkevitsh y sus compañeros7 realizaron un estudio en pacientes con cáncer de próstata y endometrio y hallaron que el número de dic aumenta conforme el volumen o área irradiada aumenta. También se ha observado que el número de aberraciones cromosómicas incrementa conforme va aumentando el número de sesiones de radioterapia recibidas por el paciente.13
En Costa Rica no existe ningún estudio registrado en el campo de la dosimetría para radiaciones ionizantes que utilice la citogenética u otro marcador biológico. En 1996, ocurrió un accidente en el Hospital San Juan de Dios por el cual se sobreirradió con cobalto a 115 pacientes con cáncer; se estima que 17 de ellos murieron en los dos años siguientes por esa causa (Organismo Internacional de Energía Atómica (OIEA). Sobreexposicion accidental de pacientes de radioterapia en San José (Costa Rica). [Internet]. Vienna: OIEA; 1999. [accesado 30-8-2017]. Disponible en: https://www-pub.iaea.org/MTCD/Publications/PDF/P027s_scr.pdf). Es por esto que existe la necesidad de realizar investigación en el campo de la dosimetría biológica, para entender mejor el comportamiento de las cromosomopatías producto de la radiación in vivo. El objetivo de este trabajo fue analizar las cromosomopatías observadas antes y después de radioterapia en pacientes con cáncer tratados en el Hospital San Juan de Dios, así como implementar en Costa Rica, por primera vez, el ensayo dicéntrico utilizando la técnica de tinción de Giemsa en fluorescencia (FPG, por sus siglas en inglés).
Materiales y métodos
Participantes: Participaron nueve pacientes del servicio de radioterapia del Hospital San Juan de Dios entre los años 2014 y 2016. La escogencia de los pacientes se realizó según el esquema de radioterapia convencional (1.8-2 Gy/día, cinco días a la semana por cinco a ocho semanas aproximadamente) o hipofraccionamiento (dosis fraccionadas más grandes que las utilizadas en la radioterapia convencional, administradas de 5 a 15 días). Este manuscrito forma parte del proyecto 742- B0-304, "Verificación Biológica de la dosis recibida en pacientes tratados con radioterapia del Hospital San Juan de Dios", proyecto aprobado por el Comité Local de Bioética del Hospital San Juan de Dios (HSJD) con el número CLOBI-HSJD-005-2010 y por el Comité Ético Científico de la Universidad de Costa Rica (oficio: VI-7869-2010).
Todos los participantes en el estudio firmaron un formulario de consentimiento informado. No se realizó ningún cambio en el tratamiento de los pacientes. El radioterapeuta llevó un cuidadoso registro de todos los detalles del tratamiento de cada uno de los pacientes. Criterios de inclusión y de exclusión: Se incluyó en el estudio a pacientes de ambos sexos, mayores de edad (sin límite superior de edad) con diferentes tipos de tumores malignos. Se excluyó a las personas que, por criterio del médico tratante, estaban en un estado de salud tal que no permitía la flebotomía.
Toma de la muestra: A cada participante se le tomaron dos muestras de sangre periférica (5 mL en tubos Vacutainer con heparina sódica liofilizada) mediante flebotomía convencional. Una muestra se recolectó antes del inicio del esquema de radioterapia y la segunda el día de la última sesión de radiación.
Recolección de datos: Se incluyeron datos sobre características de tipo de cáncer y del paciente, tales como sexo, edad, antecedentes de enfermedades virales, tratamientos de radioterapia o quimioterapia previos, exposición a medios contaminados (agroquímicos), hábitos de fumado y toma de medicamentos; esto para tener en cuenta otros agentes químicos, físicos o biológicos que pueden producir anormalidades cromosómicas.
Cultivo y cosecha de linfocitos: Se utilizó el protocolo para cromosomas dicéntricos del Cytogenetic Dosimetry Application in Preparedness for and Response to Radiation Emergencies. (International Atomic Energy Agency. Cytogenetic dosimetry application in preparedness for and response to radiation emergencies. [Internet].Vienna,IAEA; 2011.[accesado 30-8-2017].Disponible en: https://www-pub.iaea.org/MTCD/Publications/PDF/EPR-Biodosimetry%202011_web.pdf).
Tinción: Se empleó el método Giemsa en fluorescencia (FPG) utilizando BrdU y naranja de acridina.14. Para la estandarización del método se contó con el apoyo del Centro de Protección e Higiene de las Radiaciones (CPHR), Habana, Cuba, referentes regionales en estudios citogenéticos asociados a las radiaciones ionizantes. La BrdU es un agente intercalante análogo de la timidina que establece enlaces con bases nitrogenadas y ayuda a la distinción entre cromátidas monosustituidas y bisustituidas (Fig. 1), lo que permite la diferenciación de las cromátidas hermanas por microscopia óptica convencional de la primera división mitótica (M1) de la segunda (M2),13 de manera que el conteo dic es más exacto, ya que se pueden perder en la segunda división mitótica, por ser una cromosomopatía inestable.

Figura 1 A) Metafase en segunda división mitótica (M2), en que se observan las cromátidas monosustituidas (cromosomas arlequines). B) Metafase en primera división mitótica (M1), en la que se observan cromátidas donde no se ha realizado sustitución. Aumento 100X.
Análisis: Se analizaron solo las metafases con 45 a 47 centrómeros. Se contó el número de cromosomas, la cantidad de dic, fragmentos acéntricos (ace), r, eace y cualquiera otra cromosomopatía visible en cada metafase de acuerdo con los siguientes criterios para el análisis citogenético:
Los dic y r se tomaron en cuenta cuando estuvo presente su respectivo ace.
Las metafases con dic y su respectivo ace deben contar 46 cromosomas, en cambio las metafases con r con su correspondiente ace deben contar 47 cromosomas.
Las aberraciones tricéntricas equivalen a dos dic y deberán aparecer dos ace.
Los ace no asociados a dic o r se contaron como eace.
Dmin, r y excesos acéntricos fueron tomados como eace.
Se contabilizó toda otra cromosomopatía encontrada, distinguible al microscopio en tinción convencional y se clasificó como anomalía cromosómica (AM).
Se analizaron como mínimo 200 metafases antes y 200 metafases después de terminado el esquema de tratamiento con radioterapia; todas las metafases analizadas se encontraban en Metafase I. Para el análisis, se utilizaron los microscopios Olympus CX-31 y Olympus CX-51.
Análisis estadístico: Para cada paciente se obtuvo la frecuencia de cada cromosomopatía encontrada y se compararon las frecuencias antes y después de cumplido el esquema de tratamiento. En los casos en que los pacientes presentaron el mismo tipo de cáncer y fueron irradiados en la misma zona, se compararon las frecuencias de las cromosomopatías. Se realizó el análisis no paramétrico de la prueba U de Mann Whitney para análisis de correlación utilizando SPSS versión 19 de IBM.
Resultados
En el Cuadro 1 se presentan las características clínico-patológicas de los nueve participantes; cinco de ellos recibieron quimioterapia previa, el participante dos recibió simultáneamente quimioterapia y radioterapia previa. Cuatro de los nueve participantes en estudio presentaron cáncer de mama. Antes de la radioterapia se encontraron conteos de cero a ocho dic y se observó un aumento de dic después de la radioterapia (de tres a 22 dic) en todos los casos (Cuadro 2, Fig. 2a). Además, se observaron r (Fig. 2b), ace (Fig. 2c), fracturas cromatídicas (chtb) (Fig. 2d) y asociaciones satelíticas (AS) (Fig. 2e). Cualquier alteración de tamaño o aneuploidia de algún cromosoma, se contabilizó como alteración morfológica (AM). Uno de los participantes presentó un 19 % de sus metafases sin un cromosoma del grupo G. Solo se observó un tricéntrico en un paciente. Uno de los participantes fue sujeto a quimioterapia un mes antes de la radioterapia; entre los medicamentos con que fue tratado resaltan el paclitaxel (taxol) y el docetaxel (Cuadro 1).
Cuadro 1 Datos demográficos, enfermedad y tipo de tratamiento de cada paciente participante en la investigación (n= 9)
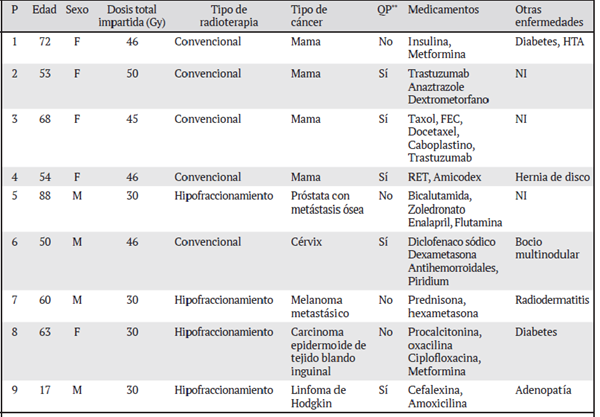
Datos demográficos, enfermedad y tipo de tratamiento de cada paciente participante en la investigación (n= 9)

Figura 2 Cromosomopatías observadas en el análisis a los pacientes con cáncer que recibieron radioterapia (la flecha roja señala los ace; las otras cromosomopatías están señaladas con flechas azules): a) cromosomas dicéntricos, fragmentos acéntricos (ace) b) un cromosoma en anillo (r), c) un ace, d) una fractura cromatídica(chtb), e) una asociación satelítica (AS).
Se observó una diferencia estadísticamente significativa entre el conteo antes y después de dic (p<0.05) y un aumento después de la radioterapia para cada participante (Cuadro 2). Este mismo comportamiento se observa al analizar en conjunto los dic y los r y todos los datos a excepción de AS (Cuadro 2). Se excluye de este análisis al paciente cuatro, debido a que no se alcanzó el número de metafases requeridas para el análisis (200 metafases). En el caso de las AS se advirtió que solo en los casos de los participantes uno y seis (Cuadro 2) existe una diferencia significativa entre el conteo antes y después de la radioterapia, en el que se detectó, al igual que en las otras comparaciones, un aumento de AS después de la radioterapia. Uno de los participantes es un agricultor, por lo que muy probablemente estaba ocupacionalmente expuesto a plaguicidas (Cuadro 1), aunque al momento de la entrevista no indica el tiempo de trabajo como agricultor, tampoco los químicos a los que estuvo expuesto, por lo que no se puede ahondar más sobre el efecto específico de los plaguicidas en él. Quienes presentaron anomalías morfológicas antes de la radioterapia fueron pacientes con cáncer de mama (Cuadro 2). El índice mitótico para el participante cuatro fue de cero antes de la radioterapia, ya que no se encontraron metafases (razón por la que se le excluyó del análisis estadístico); es importante aclarar que en el material analizado de este participante se observaron núcleos de linfocitos, lo que descarta una falla técnica a la hora del cultivo. Además, este participante, al momento de la toma de la primera muestra, se encontraba en tratamiento con quimioterapia.
Discusión
Cuadro 2 Frecuencia de alteraciones morfológicas encontradas en nueve participantes antes y después de la radioterapia con cobalto 60
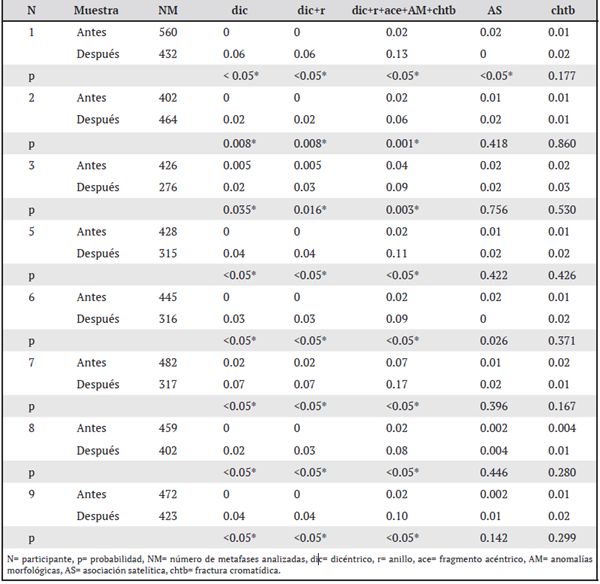
Después de la radioterapia es común observar dic, ace, r, translocaciones y deleciones15, ya que la radiación por cobalto 60 es clastógeno S-independiente. 4, 9, 10, 12, 16--23, 31 Rondón, Caicedo y Robledo (2006)30 encuentran en sus estudios que en pacientes de cáncer de mama en distintos estadioses posible observar alteraciones cromosómicas en linfocitos de sangre periférica, ya sean numéricas o estructurales, como deleciones, derivados, duplicaciones, translocaciones y dic, lo cual coincide con lo observado en esta investigación. La frecuencia aumentada de dic antes de la radioterapia hallada en nuestra investigación ya se ha informado en otros estudios, en los que se demuestraun aumento de dic en pacientes con distintos tipos de cáncer; este aumento se atribuye al efecto de un virus o algún mutágeno (p. ej., medicamentos para la quimioterapia, diabetes, osteoporosis o plaguicidas).1,3,24 En relación con los medicamentos, se conoce que el taxol tiene capacidad genotóxica en humanos, ratones y Drosophila sp., tanto en células somáticas como en células germinales.25, 26 El docetaxel es genotóxico en humanos, pues produce un aumento de micronúcleos (MN) y dic.27 Además, se ha observado que el topotecano, componente del tratamiento RET, produce una disminución drástica del índice mitótico desde las 24 h después de su administración en células de ratón.35 En modelos animales existe evidencia de que la metformina provoca rupturas cromosómicas en células de ovario de hámster chino;32 sin embargo, no hay reportes de efectos genotóxicos en humanos. También se ha documentado que el zoledronato produce rupturas en el ADN in vitro en tres líneas de cáncer (MDAMB-231, Hs 578T y MCF-7).30 Gentile, Bernardi, Bosch, Mañas y Aiassa (2016)28 indican una asociación estadísticamente significativa entre la frecuencia de MN y aberraciones cromosómicas (incluyendo dic) en personas expuestas a plaguicidas en comparación con una población control. Las AS, de acuerdo con la literatura, se han observado tanto en poblaciones sanas como en pacientes de cáncer y consumidores de tabaco.34 No obstante, en este estudio, alrededor del 2 % de las metafases observadas presentan AS, lo cual es mucho menor a lo notado en poblaciones sanas; se desconocen la causa y las implicaciones biológicas de este hallazgo. Un participante del sexo masculino presentó una pérdida del 19% de un cromosoma del grupo G. Es conocido que en hombres sanos mayores de 60 años puede presentarse una pérdida del cromosoma Y, ya sea en la totalidad de las metafases o en forma de mosaico en células de sangre periférica,35-37 lo que explicaría lo reportado en este estudio. Dentro de los alcances de esta investigación, podemos concluir que las cromosomopatías producidas por radioterapia se observan tanto antes como después del tratamiento. En el caso de los dic y r, lo que cambia es su frecuencia, la cual aumenta después del tratamiento. Los pacientes con cáncer de mama presentan el mismo tipo de cromosomopatíaque los demás participantes y se advierte un aumento significativo de dic después de la radioterapia. Todos estos hallazgos son congruentes con la exposición a la radiación por cobalto 60. En lo que respecta a las chtb, AS y alteraciones morfológicas, su frecuencia no se ve afectada por la radioterapia. El bajo recuento mitótico del paciente cuatro pudo ser producido por efecto de la radiación en la médula ósea o por el propio sistema de reparación celular y apoptosis y, en algunos casos, por la genotoxicidad producida por tratamientos previos (quimioterapia, medicamentos contra la diabetes). Este estudio presenta la limitación de no tener como objetivo una clasificación general de anomalías cromosómicas por tipo de cáncer, para lo que sería necesario realizar técnica de bandeo GTG en estudios posteriores que permita catalogar el tipo específico de aberración cromosómica presentada en estos pacientes. En lo futuro, se recomienda realizar estas investigaciones en pacientes con el mismo diagnóstico y, de ser posible, con el mismo esquema de tratamiento, de manera que las incertidumbres producidas por las diferencias antes mencionadas entre los participantes del estudio no obstaculicen las conclusiones debido a las distintas características para cada tipo de cáncer, que produce una fisiopatología y evolución distintas, así como por las diferencias en el tratamiento y de la zona del cuerpo irradiada. Un aporte adicional fue la implementación de la técnica Giemsa más fluorescencia utilizada en el ensayo de cromosomas dicéntricos (dic), utilizado actualmente en el Servicio de Dosimetría Biológica del Instituto de Investigaciones en Salud (INISA). Este ensayo sirve para estimar dosis recibidas en personas en las que se sospecha de sobreexposición a radiaciones. Esta investigación, al ser la primera realizada en Costa Rica, abre un camino para futuras investigaciones en el tema de la radioterapia y el uso de los cromosomas dicéntricos como biomarcadores asociados a las radiaciones ionizantes que nos ayuden a comprender mejor esta área de la ciencia.
Agradecimientos y colaboradores
Esta investigación fue financiada por la Vicerrectoría de Investigación de la Universidad de Costa Rica. Agradecemos a la Dra. Isabel Castro Volio (q.e.p.d.), al personal del Instituto de Investigaciones en Salud (INISA) y del Laboratorio de Citogenética por el apoyo para realizar el análisis del material en sus instalaciones; a Nelson Brenes Obando, por toda la ayuda brindada y apoyo técnico para la ejecución de los procedimientos; al personal del servicio de Radioterapia del Hospital San Juan de Dios y al Sr. Fernando Ortiz Morales por el mejoramiento de la resolución de las imágenes.















