A finales del año 2019 en Wuhan, China, surgió en seres humanos una infección aguda del sistema respiratorio causada por el coronavirus llamado SARS-CoV-2, el cual se convirtió, posteriormente, en una pandemia mundial. Se conoce que la COVID-19 provoca síntomas y complicaciones pulmonares severas; sin embargo, se ha visto que la enfermedad involucra otros sistemas, incluyendo el hematopoyético.1
La “Púrpura trombocitopénica inmune” (PTI) o llamada también trombocitopenia inmune, dado que muchos de estos pacientes no presentan síntomas de sangrados, se define como una enfermedad autoinmune asociada con trombocitopenia aislada, luego de excluir otras causas de plaquetopenia.2 El corte clásico para el diagnóstico de la PTI es de <100 x 10^3/μL plaquetas.3 Se clasifica en primaria o secundaria, según se encuentre un factor causal o no.2 Las causas de PTI secundaria, que corresponden aproximadamente al 18-20% de todos los casos en adultos, incluyen algunas infecciones virales.3 Se han descrito múltiples mecanismos que explican la relación entre SARSCoV- 2 y trombocitopenia, siendo el más relevante el mimetismo molecular entre los componentes virales y las glicoproteínas plaquetarias.6
Presentación del caso
Paciente femenina de 67 años, independiente para actividades básicas e instrumentales de vida diaria, con diagnóstico de diabetes mellitus tipo II mal controlada, quien se presentó con historia de 6 días de evolución de dolor abdominal, diarrea, dificultad respiratoria, cefalea y fiebre no cuantificada. Su tratamiento crónico incluye únicamente metformina. Se realizó prueba de reacción en cadena de polimerasa en tiempo real o RT-PCR por SARS-CoV-2, con resultado positivo.
Al ingreso hospitalario, presentó temperatura de 36 °C, frecuencia respiratoria en 27 rpm, frecuencia cardiaca en 64 lpm, glicemia por micrométodo en 258 mg/dl, presión arterial en 126/74 mmHg y saturación de oxígeno en 93%; con requerimientos de oxígeno suplementario mediante cánula de alto flujo con los siguientes parámetros: fracción inspirada de oxígeno (FiO2) del 70% y flujo 60 litros por minuto (lpm). El resto del examen físico no arrojó hallazgos patológicos relevantes. Sus exámenes iniciales y subsecuentes de laboratorio se muestran en el cuadro 1.
El estudio radiológico de tórax inicial mostró infiltrados difusos bilaterales de distribución periférica y predominio basal. Se desparasitó con albendazol (400 mg cada día por tres días vía oral) e ivermectina (12 mg cada semana por dos semanas vía oral) y se inició tratamiento según protocolo local para paciente COVID-19 severo suministrando 10 días de dexametasona (20 mg por 5 días, posteriormente 10 mg por 5 días vía intravenoso) y tromboprofilaxis con enoxaparina (40 mg cada 12 horas vía subcutánea).
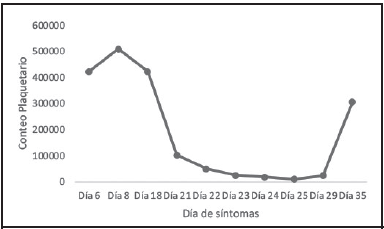
Durante su estancia hospitalaria, cursó con reducción lenta y paulatina de requerimientos de oxígeno y hubo mejoría de marcadores inflamatorios en conjunto con un aumento del conteo de linfocitos absolutos. Para el día 21, desde la fecha de inicio de síntomas, la paciente cumplía con criterios clínicos de recuperabilidad por COVID-19 según los Lineamientos del Ministerio de Salud en su versión número 17: más de 20 días de evolución desde el inició de síntomas con más de 72 horas asintomática. 5 No se realizó RT-PCR dado que ya no era requerido según la legislación vigente. Sin embargo, previo al egreso, se observó una caída abrupta del recuento plaquetario. El conteo se redujo desde 422 x 10^3/μL plaquetas, reportadas al día 18 de evolución de COVID-19, hasta un nadir de 10.00 x 10^3/ μL plaquetas al día 25 (ver cuadro 1 y figura 1). El hemograma no mostró alteración de otras líneas celulares. El único hallazgo reportado en el frotis de sangre periférica fue el de macroplaquetas. No se documentaron signos clínicos de sangrado. El abordaje ecográfico de abdomen no evidenció visceromegalias ni adenopatías.
Cuadro 1 Perfil de resultados de laboratorio, según el día de evolución de COVID-19 desde la fecha de inicio de síntomas, durante la estancia hospitalaria en el Centro Especializado de atención de pacientes COVID-19 de la Caja Costarricense del Seguro Social de Costa Rica, año 2021
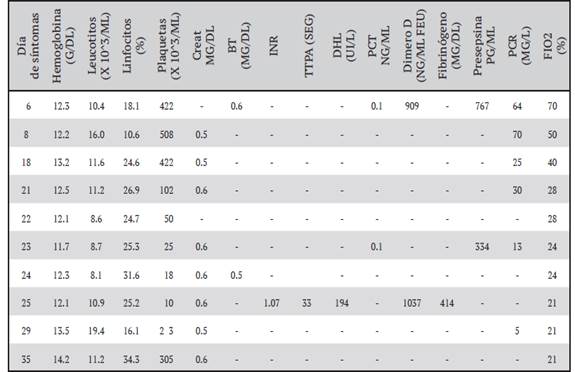
Creat: creatinina, BT: Bilirrubina Total, DHL: Deshidrogenasa láctica, FiO2: fracción inspirada de oxígeno, INR: índice internacional normalizado, PCR: Proteína C reactiva, PCT: procalcitonina, TTPa: tiempo de tromboplastina activado.
Discusión y análisis del caso
Se inicia el análisis del caso que caracteriza el cuadro como una trombocitopenia aguda aislada. El primer paso en el abordaje diagnóstico corresponde a la exclusión de pseudotrombocitopenia. Esta es una entidad caracterizada por un falso descenso del conteo automatizado de plaquetas.7 El ácido etilenodiaminatetraacético (EDTA) de los tubos recolectores de hemograma induce un cambio de conformación en el complejo GpIIB-IIIa plaquetario, lo que provoca que este sea susceptible a la unión de autoanticuerpos, ocasionando la subsecuente aglutinación plaquetaria. En la mayoría de ocasiones (83%) el uso de un anticoagulante no EDTA permite un recuento plaquetario certero.7 En este caso, no se documentaron grumos de plaquetas al frotis de sangre periférica y se evidenció que persistía la trombocitopenia, luego de realizar la medición en un tubo con citrato de sodio.
Posteriormente, fue necesario considerar etiologías que orientaran a un proceso inflamatorio crónico neoplásico de origen hematológico.8
No se reportaron manifestaciones clínicas compatibles como pérdida de peso, sudoración nocturna, síntomas constitucionales, adenopatías, hepatoesplenomegalia, blastos u otros hallazgos relevantes al frotis de sangre periférica. Además, los valores de deshidrogenasa láctica y velocidad de eritrosedimentación, que tienden a elevarse en varias de estas entidades, resultaron normales.
El estado hiperinflamatorio y de coagulopatía observado en pacientes con COVID-19, conlleva la necesidad de considerar procesos como coagulación intravascular diseminada (CID) y microangiopatías trombóticas.3 La paciente no mostró signos de anemia por fragmentación, lo que aleja la posibilidad de mecanismos microangiopáticos como etiología de la trombocitopenia. Además, no se evidenciaron manifestaciones de sangrado ni tampoco de daño orgánico por trombosis. Esto, sumado a una escala de la sociedad internacional de trombosis y hemostasis (ISTH) menor a 5 puntos, hacen improbable una CID.
Ante la estancia prolongada y la desregulación inmunológica encontrada en el COVID-19, debe examinarse la posibilidad de una trombocitopenia en el contexto de una sobreinfección bacteriana o fúngica. No se documentó fiebre ni otros hallazgos clínicos sugerentes de un nuevo proceso infeccioso como síntomas urinarios, respiratorios, gastrointestinales, flebitis o signos de respuesta inflamatoria sistémica. Tampoco se observó elevación de marcadores como presepsina, procalcitonina o proteína C reactiva, lo que hacía poco probable una etiología de esta índole.
La trombocitopenia inducida por drogas ocurre producto de varios mecanismos. El más comúnmente descrito es la formación de anticuerpos contra nuevos epítopos generados, producto de la interacción del fármaco con las plaquetas. El descenso de plaquetas puede ser rápido (en 2-3 días) en caso de que el paciente ya esté sensibilizado de previo al medicamento; o ameritar una latencia de 1-3 semanas cuando ocurre una primera exposición.8,9
Entre los fármacos más comúnmente atribuidos a esta afección están los antibióticos. La paciente no recibió fármacos que comúnmente se han asociado con trombocitopenia (como antibacterianos, tiazidas, entre otros). No se han reportado casos de trombocitopenia inducida por ivermectina.8 En lo que respecta al albendazol, su asociación es muy esporádica. Este compuesto tiende a generar supresión medular de varias líneas celulares y está descrita con el uso prolongado a causa de patologías como quiste hidatídico.10
La trombocitopenia inducida por heparina (HIT), es una complicación inmunológica que sucede producto de la formación de autoanticuerpos contra complejos heparina-factor plaquetario 4.
Se manifiesta como trombocitopenia con conteos moderados (rara vez menores a 20.00 x 10^3/μL) y predisposición a eventos trombóticos. Cuando el paciente recibe por primera vez el tratamiento, la trombocitopenia suele presentarse en los primeros 5-10 días; no obstante, cuando se ha recibido un tratamiento anterior, el padecimiento se desarrolla en las primeras 24 horas.8 En este caso, la paciente recibió profilaxis con enoxaparina desde su ingreso y fue suspendido transitoriamente al iniciar la trombocitopenia; sin embargo, dado que el inicio de la plaquetopenia fue posterior a 14 días desde el inicio de la heparina, hubo un descenso de plaquetas hasta un nivel de 10.00 x 10^3/μL, ausencia de manifestaciones trombóticas, y un resultado negativo de anticuerpos anti factor plaquetario 4 en conjunto con una escala “4T” menor a 3 puntos, se descartó esta entidad como etiología del cuadro actual de la paciente.
La trombocitopenia puede asociarse a enfermedades sistémicas de mecanismo autoinmunitario.
8 En este caso, no se demostró ninguna manifestación clínica compatible con brote cutáneo, fiebre, alopecia, nefritis, artralgias, artritis, uveitis, úlceras en mucosas, serositis, anemia hemolítica, o trombosis.
Además, se obtuvo un panel general de autoinmunidad con niveles de complemento, marcadores de hemólisis, anticuerpos antinucleares y antifosfolípidos, todos dentro del rango de normalidad.
La inducción viral de autoinmunidad se puede explicar por fenómenos como mimetismo molecular, infección directa y liberación de factores inflamatorios, lo cual podría conllevar al desarrollo de trombocitopenia, usualmente, transcurrida la primera semana de la infección.4,11 Dado lo anterior, resulta relevante en el abordaje diagnóstico, el estudio de agentes como el del virus de la hepatitis B (HBV), hepatitis C (HCV) y el virus de inmunodeficiencia humana (HIV), así como Epstein-Barr (EBV) y citomegalovirus (CMV).11 En este caso las serologías para HBV, HCV y HIV resultaron negativas. Con respecto al VEB y CMV, en ningún momento se documentaron manifestaciones típicas de este tipo de infecciones como esplenomegalia, hepatomegalia, adenopatías, fiebre, faringitis, fatiga, elevación de transaminasas, aumento de deshidrogenasa láctica o DHL, linfocitosis, alteración de otras líneas celulares del hemograma o presencia de linfocitos atípicos en el frotis sanguíneo.12, 13 Lo anterior, aunado a serologías negativas, conlleva a un diagnóstico poco probable de infección aguda por estos patógenos.
En consecuencia, posterior a un abordaje etiopatogénico extenso que no documentó una etiología alternativa de la trombocitopenia, se clasificó como una PTI secundaria a SARS-CoV-2.
Se decidió iniciar tratamiento de primera línea para PTI, avalado por la Sociedad Americana de Hematología en sus últimas recomendaciones del año 2019.14 Se utilizó un ciclo de dexametasona 40 mg IV por 4 días. Además, se decidió agregar una aplicación de inmunoglobulina IV (IVIG) a dosis de 1 gr/kg. Lo anterior basado en que se observó una disminución rápida y marcada del conteo plaquetario con riesgo de progresar a valores menores a 10.00 x 10^3/μL. En estos casos, el uso de IVIG es recomendado por algunos autores para reducir el riesgo de sangrado severo debido a que produce un incremento en el número de plaquetas dentro de 12-48 horas de iniciado el tratamiento, mientras que los glucocorticoides usualmente provocan una elevación en el conteo plaquetario de forma más larvada (en 2 a 5 días).3,14,15 Tras siete días del inicio del tratamiento, se mostró recuperación completa del conteo plaquetario (ver cuadro 1 y figura 1), cumpliéndose la definición de respuesta temprana (elevación a más de 30.00 x 10^3/μL plaquetas a la primera semana de inicio del tratamiento).14
La asociación entre el SARS-CoV-2 y PTI, ya ha sido descrita en múltiples publicaciones internacionales.
En una revisión sistemática publicada por Bhattacharjee y colegas en el año 2020, que incluyó una muestra de 47 casos, se describe el perfil clínico de estos pacientes. En general, esta presentación hematológica es más frecuente en mayores de 50 años, sobre todo, en pacientes con COVID-19 moderado o severo. Tiende a ocurrir entre la segunda y tercera semanas de evolución y el nadir suele ser menor a 20.00 x 10^3/μL plaquetas. Las manifestaciones de sangrado descritas son variables y van desde petequias hasta sangrado intracraneal; sin embargo, hasta un 30% de los pacientes la sobrellevan de manera asintomática.3
En este caso, la asociación causal del virus SARS CoV-2 y la trombocitopenia está respaldada por varios puntos: 1) la exclusión de otras etiologías alternativas, 2) la concordancia de este caso con el perfil clínico reportado a nivel internacional y, 3) la respuesta al tratamiento.
En el caso que se presenta, la paciente fue egresada del Centro en excelente condición clínica para completar su seguimiento por la especialidad en hematología del hospital correspondiente al área de atracción y se espera que el curso de su enfermedad sea favorable, según lo reportado en la literatura para PTI asociadas tanto al SARS-CoV-2 como a otros virus.4
Finalmente, se concluye que el SARS-CoV-2, al igual que otros virus, puede ocasionar trombocitopenia inmune, usualmente luego de dos semanas de evolución en pacientes que se vieron afectados por una enfermedad grave; tiende a asociarse con una buena respuesta al tratamiento y cursa con buen pronóstico.
Hasta donde se tiene noticia, este es el primer caso de trombocitopenia inmunológica severa secundaria a COVID-19 publicado en Costa Rica desde que inició la pandemia, producto de este patógeno. Agradecimientos y colaboraciones: Los autores agradecen al personal del CEACO, por su disposición y colaboración con el manejo de la paciente.