La toxicidad, la no adherencia y la resistencia son factores que pueden limitar la eficacia y seguridad de la TARGA, siendo esta última la principal causa de fracaso terapéutico y por tanto una amenaza para el impacto sostenido de la TARV, contribuyendo al fracaso terapéutico. La resistencia a la TARV es la pérdida total o parcial de la susceptibilidad a los antirretrovirales, siendo un mecanismo viral evolutivo de adaptación (World Health Organization, HIV drug resistance report 2019. http://apps.who.int/iris/bitstre am/10665/255896/1/9789241512831-eng.pdf).
Los estudios de resistencias a los fármacos empleados en el tratamiento de la infección por el VIH son una herramienta fundamental para la correcta monitorización y seguimiento de los pacientes. Existen dos tipos de estudio de resistencia: genotípicos y fenotípicos, las primeras son más empleadas en la práctica clínica habitual ya que son más económicas, rápidas y menos complejas de realizar (ONUSIDA. Ginebra, Suiza: ONUSIDA; 2019. http://www.unaids.org/sites/default/files/ media_asset/UNAIDS_FactSheet_es.pdf).
En el reporte de la Organización Mundial de la Salud (OMS) sobre la resistencia antirretroviral del 2019, basados en la información obtenida de 18 países de diferentes continentes, en 12 de ellos (Argentina, Eswatini, Cuba, Guatemala, Honduras, Namibia, Nepal, Nicaragua, Nueva Guinea, África del Sur, Uganda y Zimbabwe) se demostró que más del 10% de los pacientes estudiados presentaban resistencia pre-tratamiento a los inhibidores de la transcriptasa inversa no análogos de nucleósidos (ITI- NAN) (ONUSIDA. Ginebra, Suiza: ONUSIDA; 2019. http://www.unaids.org/sites/default/files/media_ asset/UNAIDS_FactSheet_es.pdf). La prevalencia de resistencia antirretroviral entre los individuos que reciben TARGA varía, de forma general, entre el 3% y el 29%, ligeramente superior entre aquellos que han recibido la terapia por más de 48 meses. Entre las poblaciones en las que se presenta fallo virológico a las terapias de primera línea basadas en ITINAN, la resistencia adquirida en los primeros 12 meses (±3 meses) se encuentra entre el 50% y el 97%. La resistencia doble, tanto a los ITINAN como a los inhibidores de la transcriptasa inversa análogos de nucleósidos y nucleótidos (ITIAN), se presenta entre el 21% y el 91% de esos pacientes en el mismo período de tiempo. Es preocupante que en pacientes tratados con estos regímenes por más de 48 meses se encuentra una prevalencia de resistencia adquirida incluso superior (ONUSIDA. Ginebra, Suiza: ONUSIDA; 2019. http://www.unaids. org/sites/default/files/media_asset/UNAIDS_FactS- heet_es.pdf).
En Cuba los reportes de resistencia desde el 2009 hasta el 2013, indicaron una alta tasa de resistencia a la TARV, tanto en pacientes tratados como en no tratados; principalmente a los medicamentos que se emplean en la terapia cubana de primera línea; así como la aparición de resistencia cruzada a la TARV de última generación 1,2 (Ministerio de Salud Pública. Cuba. Dirección de Registros Médicos y Estadística de Salud. Anuario Estadístico de Salud 2018 [Internet]. http://files.sld. cu/dne/files/2018/05/Anuario_Estad%C3%ADstico_de_Salud_e_2018_edici%C3%B3n_2018.pdf).
A pesar de los grandes avances logrados en la terapéutica antirretroviral contra el VIH, la aparición de resistencia es una de las principales amenazas al impacto sostenido de la terapia con antirretrovirales (ARVs) en Cuba.3
Esto impone nuevos retos a la comunidad científica en el manejo de la enfermedad. La utilización correcta de las Pruebas Genotípicas de Resistencias (PGR) puede jugar un papel primordial en la lucha contra este flagelo. Por lo que resulta de gran importancia conocer el impacto que ha tenido la realización rutinaria de dicho estudio en la respuesta al tratamiento y la evolución de los pacientes cubanos con fracaso a la TARV. Es importante identificar además, el subgrupo de pacientes que más pueden beneficiarse con la realización de las PGR en el contexto cubano, por lo que resulta vital para el personal médico asistencial conocer la respuesta virológica e inmunológica, la aparición de enfermedades oportunistas y la supervivencia a la terapia de rescate de aquellos pacientes infectados con el VIH-1 que tuvieron fallo terapéutico previo, en dependencia de la forma de selección de la terapia de rescate: pruebas de resistencia o criterio de expertos.
Por todo lo anterior, este estudio se propuso determinar la influencia de la forma de selección de la terapia de rescate en la respuesta terapéutica y en la supervivencia a largo plazo de los pacientes infectados con el VIH-1 que presentaron fracaso a la terapia antirretroviral en el IPK entre los años 2012 y 2016.
Métodos
Tipo de estudio: De cohorte, analítico y retrospectivo, en pacientes infectados con el VIH- 1, con fracaso terapéutico a la TARV que fueron atendidos en el Instituto de Medicina Tropical “Pedro Kourí” durante los años 2012 al 2016.
Universo de estudio: todos los pacientes con infección por el VIH-1 y tratamiento antirretroviral mantenido como mínimo por 6 meses, que fueron discutidos en la Comisión Nacional de tratamiento antirretroviral con sede en el IPK, entre los años 2012 y 2016.
Criterios de inclusión: pacientes en fracaso virológico a los cuales se le indicó TARGA de rescate y con carga viral (CV) >1 000 copias por mL en dos o más ocasiones consecutivas.
Criterios de exclusión: 1. pacientes con abandono de la TARGA dos semanas previas al cambio de tratamiento, 2. Pacientes con cambio de TARGA basada en PGR previamente, 3. pacientes que no acudieron a la consulta de seguimiento 4. pacientes no adherentes al tratamiento.
Fueron seleccionados 212 pacientes que fueron divididos en dos grupos, según la forma de selección del tratamiento de rescate: Grupo A: 107 pacientes con tratamiento de rescate seleccionado en base al resultado de la PGR y Grupo B: 105 pacientes con tratamiento de rescate seleccionado en base al criterio de expertos. Como criterio de expertos se consideró el criterio de la Comisión Nacional de tratamiento antirretroviral: todo tratamiento de rescate que se elige sin contar con una prueba genotípica de resistencia previa e incluye al menos dos fármacos nuevos, potencialmente activos.
Se tuvieron en cuenta como variables de salida: a) la respuesta virológica a los 6, 12, 18 y 24 meses de iniciada la terapia de rescate (supresión virológica completa CV < 50 copias por mL y fracaso virológico CV > 200 copias por mL); b) la respuesta de células CD4+ a los 6, 12, 18 y 24 meses de iniciada la terapia de rescate (incremento promedio de los Linfocitos T CD4+ células/mm3; c) porcentaje de pacientes que alcanzaron Linfocitos T CD4+>200 células/mm3; d) incidencia de enfermedades oportunistas durante el período de estudio; y e) supervivencia a los 48 meses.
Como variables independientes se considera- ron: a) prueba genotípica de resistencia; b) demo- gráficas (edad, sexo, color de la piel); y c) clínicas y de laboratorio al momento de iniciar la terapia de rescate (tiempo de diagnóstico VIH, tiempo de TARV, número de esquemas de tratamientos previos, exposición previa a tres familias diferentes de ARVs y conteo de Linfocitos T CD4+ y CV basal).
Las variables se estudiaron antes del cambio de la terapia de rescate y a los 6, 12, 18, y 24 meses del cambio de tratamiento de rescate.
Se obtuvo la información de las actas de la Comisión Nacional de Terapia Antirretroviral (TARV), la base de datos Sidatrat (base de datos del Hospital del IPK donde se incluyen todos los pacientes con diagnóstico de infección por el VIH) y los expedientes clínicos de los pacientes estudiados.
Los datos se introdujeron directamente en una base de datos Excel 2010 (Microsoft Corporation, Redmond, Washington, USA) y para su análisis se exportaron al paquete estadístico SPSS 21 (IBM Corp., Chicago, Illinois, USA).
Se utilizaron números absolutos y algunas medidas de tendencia central, como media y mediana, con sus respectivas desviaciones estándares (DE).
Se utilizó el estadígrafo Chi2, se aplicó el Riesgo Relativo (RR) y Prueba U de Mann-Whitney, también llamadas “Prueba de la suma de rangos de Wilcoxon”, “Prueba W de Wilcoxon” ó “Wilcoxon rank sum test”.
La probabilidad de supervivencia se analizó con el método de Kaplan-Meier. Las curvas de supervivencia se compararon mediante la prueba de Mantel-Haenszel (log rank), prueba exacta de Wilcoxon (Gehan) y Tarone-Ware.
Resultados
Se estudiaron 212 pacientes infectados con el VIH y que presentaron fracaso terapéutico a la TARGA. Los dos grupos de estudio se definieron de acuerdo la forma de selección de la terapia de rescate utilizada. El grupo A (n=107) recibió tratamiento acuerdo la forma de selección de la terapia de rescate utilizada. El grupo A (n=107) recibió tratamiento antirretroviral de rescate guiado por las PGR y el grupo B (n=105) por el criterio de expertos.
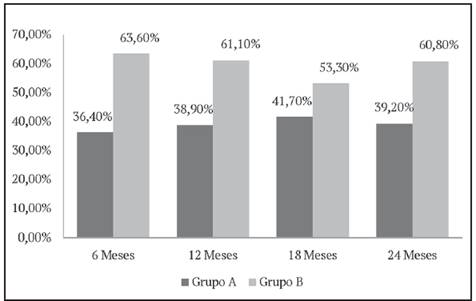
Figura 1 Porcentaje de pacientes con fracaso virológico según la forma utilizada para elegir el tratamiento y tiempo desde el inicio del rescate. IPK 2012-2016. Nótese que, en el grupo de pacientes a los cuales se les asignó la terapia de antirretroviral en base a prueba genotípica de resistencia (Grupo A), el porcentaje de fracaso virológico fue significativamente inferior para cada uno de los momentos de corte, en comparación con el grupo donde la selección se realizó bajo criterio de expertos (Grupo B).
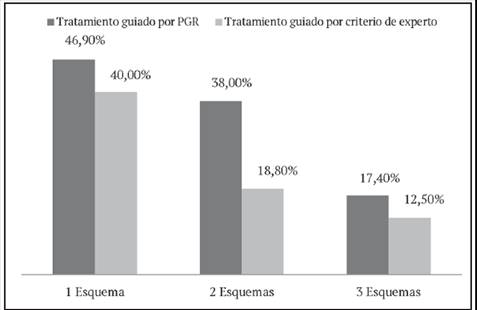
Figura 2 Porcentaje de pacientes con supresión virológica completa según método utilizado para elegir el tratamiento y número de esquemas previos de tratamiento. IPK 2012- 2016. Se conformaron dentro de cada grupo tres subgrupos de pacientes, en relación con el número de esquemas de terapia antirretroviral usados previamente. Nótese que, independientemente de la forma utilizada para seleccionar el tratamiento antirretroviral, a mayor número de esquemas de tratamiento previos, menor el porcentaje de pacientes que lograron la supresión virológica completa. En el subgrupo donde la forma de selección de tratamiento tuvo un mayor impacto fue en el cual los pacientes utilizaron dos esquemas anteriores.
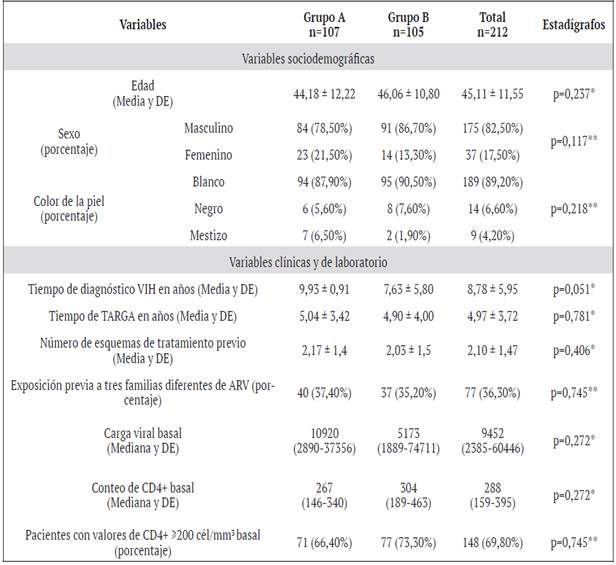
Cuadro 1 Características generales de los pacientes de ambos grupos de estudio al inicio del tratamiento de rescate. IPK 2012-2016
U-Mann Whitney χ2 DE: desviación estándar
En el cuadro 1 se muestra la distribución de los pacientes estudiados según las características generales y la forma de selección del tratamiento de rescate previo al inicio de este.
No existieron diferencias significativas entre las características generales de los dos grupos de pacientes estudiados, lo que demuestra la homogeneidad entre los grupos A y B al momento de decidir la forma de selección de la terapia de rescate.
La respuesta virológica evolutiva obtenida tras la terapia de rescate para los dos grupos se analizó mediante fracaso y supresión virológicos.
Como se ilustra en la Figura 1, el porcentaje de pacientes en fracaso virológico a los 6, 12, 18 y 24 meses de iniciado el tratamiento fue significativamente superior en pacientes del Grupo B (63,6%, 61,10%; 53,30%, y 60,80%) en comparación con los pacientes del grupo A (36,4%, 38,90%; 41,70% y 39,20%), respectivamente.
Al estratificar los resultados con base en el número de esquemas previos de tratamiento recibido por los pacientes al momento del estudio (Figura 2), se observó que los porcentajes de supresión virológica completa a los 6 meses de iniciado el tratamiento disminuían en los pacientes de ambos grupos en la medida que tenían una mayor exposición previa a la TARV y, que a su vez, eran mejores en los pacientes del grupo A con independencia del número de esquemas previos de tratamiento, pero la diferencia más significativa con respecto a los del grupo B se observó en los pacientes que habían recibido 2 esquemas previos de tratamiento 38% vs 18% (p<0,005).
Cuadro 2 Respuesta de las células CD4+ según grupo de estudio y tiempo desde el inicio del tratamiento de rescate. Pacientes VIH en fracaso terapéutico. IPK 2012-2016
| Variables | Grupo A n=107 | Grupo B n=105 | Estadígrafos |
|---|---|---|---|
| Incremento promedio de los LT CD4+ ( cél/mm3) (Media) | |||
| 6 meses | 72,25± 111,722 | 38,18±68,210 | p=0,003* |
| 12 meses | 117,40± 163,516 | 30,04± 76,299 | p<0,001* |
| 18 meses | 126,99±163,586 | 51,09±108,078 | p<0,001* |
| 24 meses | 125,72±168,163 | 43,76±96,321 | p<0,001* |
| Porcentaje de pacientes que alcanzaron LT CD4+>200 células/mm3 | |||
| 6 meses | 72 (68,60%) | 71 (66,40%) | p=0,731 |
| 12 meses | 81(75,70%) | 63(60%) | p=0,014 |
| 18 meses | 79(73,80%) | 75(71,40%) | p=0,695 |
| 24 meses | 75 (70,10%) | 67 (63,80) | p= 0,331 |
Un bajo porcentaje de pacientes de ambos grupos con 3 o más esquemas previos de tratamiento lograron suprimir completamente la carga viral 17,40% y 12,50% para los pacientes de los grupos A y B, respectivamente. Aunque los resultados fueron ligeramente mejores en los pacientes a los que se les realizó PGR, la diferencia no fue estadísticamente significativa (p<0,05).
En el cuadro 2 se muestra la respuesta de células CD4+ al tratamiento de rescate en los pacientes de ambos grupos de estudio.
Los pacientes del grupo A tuvieron una respuesta inmunológica más vigorosa que aquellos del grupo B. El incremento promedio de los linfocitos T CD4+ fue significativamente mayor en los pacientes del grupo A en todos los cortes realizados.
A pesar de que los pacientes del Grupo B tenían cifras de CD4+ ligeramente superiores al inicio del estudio, se encontraron porcentajes más elevados de pacientes que alcanzaron conteos de CD4+ > 200 células/mm3 en el grupo A, durante el seguimiento de los casos (Cuadro 2). Sin embargo, las diferencias no fueron significativas.
De manera global, las enfermedades oportunistas se presentaron en el 15,56% de los pacientes estudiados. En el cuadro 3 se muestra que se diagnosticaron enfermedades oportunistas en 6 (5,60%) de los pacientes del Grupo A y en 27 (25,20%) de los pacientes del grupo B (RR 5,827; IC 2,293-14,807; p<0,001), demostrando un mayor riesgo de incidencia de enfermedades oportunistas en aquellos tratados bajo criterios de expertos.
Se registraron 24 pacientes fallecidos durante el período de estudio, lo que representa un 11,3% del total de los casos. El mayor porcentaje se concentró en el grupo B con 22 pacientes fallecidos (21,0%) de 105 que lo conformaban; en comparación con el grupo A, dónde sólo fallecieron 2 pacientes (1,9%).
Cuadro 3 Incidencia de enfermedades oportunistas para cada grupo de estudio desde el inicio del tratamiento de rescate. Pacientes con fracaso terapéutico. IPK 2012-2016
| Variables | Con Enfermedad Oportunista | Sin Enfermedad Oportunista | Total | Estadígrafo (χ2) |
|---|---|---|---|---|
| PRG no (Grupo B) | 27 | 78 | 105 | |
| PGR si (Grupo A) | 6 | 101 | 107 | p<0,001 |
| Total | 33 | 179 | 212 |
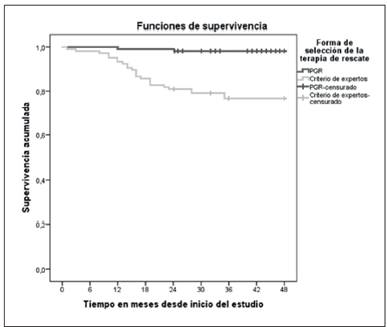
Figura 3 Curvas de Supervivencia de Kaplan-Meier para los pacientes de ambos grupos de estudio a los 48 meses. IPK 2012-2016. El mayor porcentaje de sobrevida acumulada se observó en el grupo que recibió el cambio del tratamiento basado en la PGR con un 98,1% al finalizar el estudio, en comparación con el grupo tratado en base a criterio de expertos con un 79% durante los 48 meses que duró la investigación.
Las curvas de Kaplan-Meier demuestran el impacto de la introducción de la terapia antirretroviral de rescate, según la forma de elección, sobre la supervivencia de los pacientes infectados con el VIH-1 en fracaso terapéutico durante los 48 meses que duró la investigación.
El mayor porcentaje de sobrevida acumulada se observó en pacientes del grupo A con un 98,1% al finalizar el estudio, en comparación con los pacientes del grupo B con un 79% en igual período de tiempo (Figura 3).
Al aplicar Log Rank para determinar la igualdad de distribución de la supervivencia, se demostró que existieron diferencias estadísticamente significativas entre ambos grupos: Log Rank = 20,26 (p<0,001); Generalized Wilcoxon = 19,21 (p<0,001) y Tarone-Ware = 19,73 (p<0,001).
Discusión
Las características sociodemográficas de los pacientes incluidos en el presente estudio fueron similares a las descritas en la epidemia cubana.4-7 Más allá de realizar comparaciones con estudios realizados en otros países, es importante enfocar la presente investigación en el contexto de Cuba, con sus particularidades socio-culturales y las propias de su sistema de salud.8
En algunos de los estudios clínicos iniciales no se logró demostrar el efecto beneficioso de las pruebas de resistencia sobre la respuesta virológica.9, 10
Al interpretar dichos resultados es importante tener en cuenta que el conocimiento de los genotipos predictores de respuesta al tratamiento y la disponibilidad de fármacos con actividad contra virus resistentes eran muy limitados en aquel entonces.
Actualmente las PGR constituyen una parte importante del manejo de pacientes con infección por el VIH.Las guías nacionales e internacionales actuales recomiendan realizar dichos estudios para optimizar el tratamiento de rescate en pacientes con fracaso a la terapia antirretroviral (Panel on Antiretroviral Guidelines for Adults and Adolescents. Guidelines for the Use of Antiretroviral Agents in Adults and Adolescents with HIV. Department of Health and Human Services. Available at www.aidsinfo.nih. gov/ContentFiles/AdultandAdolescentGL.pdf ). Sin embargo, las evidencias que soportan dicha recomendación son escasas o contradictorias. Los estudios clínicos consultados estudiaron el efecto a corto plazo de las PGR sobre la respuesta virológica e inmunológica al tratamiento de rescate,11,12 y muy pocos estudios evaluaron la repercusión de las PGR en la supervivencia de pacientes VIH con exposición amplia a la TARV.13
Está demostrada la utilidad de las pruebas de resistencia para guiar la selección de medicamentos antirretrovirales en pacientes que presentan fracaso virológico. De manera general, los cambios en la terapia basados en los resultados de las pruebas de resistencia propician una mejor respuesta virológica temprana que los cambios en el régimen guiados solo por el juicio clínico 14,15 (Boillat-Blanco N, Darling KE, Schoni-Affolter F, y col. Virological outcome and management of persistent low-level viraemia in HIV-1-infected patients: 11 years of the Swiss HIV Cohort Study. Resultado virológico y tratamiento de la viremia de bajo nivel persistente en pacientes infectados por VIH-1: 11 años del Estudio suizo de cohorte VIH. Antivir Ther), como tambien se pudo observar en este estudio.
Tras un primer fracaso terapéutico, la mayoría de los pacientes tienen un gran número de opciones de fármacos antirretrovirales de rescate, lo que facilita la elección de esquemas con 2 o más fármacos potencialmente activos basándose solamente en el historial de tratamiento y en el conocimiento de la barrera de resistencia de los fármacos utilizados,10 no siendo así en aquellos con fracaso a varios esquemas de TARV, que presentan patrones complejos de resistencia a los fármacos y tienen escasas o nulas opciones de tratamiento. En estos pacientes la utilidad de los estudios de resistencia parece más limitada.16
Otro objetivo primordial de la TARV es alcanzar la reconstitución inmune. La cifra de los Linfocitos T CD4+ es el principal indicador del estado inmunológico de la persona viviendo con el VIH (Plan Estratégico Nacional para la Prevención y el Control de las ITS y el VIH/SIDA. MINSAP. Cuba 2014-2018 (PEN)).
Su medición es particularmente útil para el seguimiento de los pacientes vírgenes de tratamiento, definir el momento del inicio de la TARV y la necesidad de administrar profilaxis contra enfermedades oportunistas (EO). En la actualidad la TARV se recomienda para todos los pacientes con independencia de la carga viral y del conteo de CD4+ (Panel on Antiretroviral Guidelines for Adults and Adolescents. Guidelines for the Use of Antiretroviral Agents in Adults and Adolescents with HIV. Department of Health and Human Services. www.aidsinfo.nih.gov/ContentFiles/ AdultandAdolescentGL.pdf; Plan Estratégico Nacional para la Prevención y el Control de las ITS y el VIH/SIDA. MINSAP. Cuba 2014-2018 (PEN)).
Se registra en la bibliografía que el aumento medio del conteo de Linfocitos T CD4+ en los pacientes con fracaso terapéutico y tratamiento de rescate basado en las PGR es superior al de aquellos en los que la terapia se basa solo en el juicio clínico,9 tal como se visualizó en el presente estudio.
Sin embargo, algunos estudios que evaluaron la efectividad de las PGR en el manejo terapéutico de pacientes infectados con el VIH-1, no lograron demostrar un efecto beneficioso sobre la respuesta de células CD4+.4, 14 Un aspecto que pudo haber influido en la disparidad de esos resultados con los de la presente investigación es la diferencia en cuanto
a los períodos de observación de los pacientes. En la mayoría de los estudios consultados, la re- evaluación de los conteos de CD4+ se realizó a los 3 meses del cambio de tratamiento antirretroviral y en algunas se extendió hasta los 6 meses.4,11, 14
Teniendo en cuenta que la restauración inmunológica es un proceso lento que requiere de un tiempo relativamente largo en supresión virológica para establecerse, sobre todo si se parte de niveles de CD4+ muy bajos, se necesitan evoluciones más largas en el tiempo para poder visualizarla, (Grupo de estudio del SIDA-SIMC (GeSIDA). Documento de consenso de GeSIDA/Plan Nacional sobre el Sida respecto al tratamiento antirretroviral en adultos infectados por el virus de la inmunodeficiencia humana. Ministerio de Sanidad, Servicios Sociales e Igualdad. Gobierno de España. (Actualización enero de 2019). En la actual investigación el tiempo de seguimiento se prolongó hasta 24 meses posteriores a la instauración del tratamiento de rescate, por lo que pudo evidenciarse mejor la restauración inmunológica de los pacientes enrolados en la misma.
El objetivo final de la TARV es disminuir el riesgo de aparición de EO y evitar la muerte. En la actualidad se considera como fracaso clínico el desarrollo de enfermedades oportunistas o muerte por enfermedades asociadas al sida después de 6 meses de iniciado un esquema de TARV (Pérez J, Pérez D, Gonzalez I, Diaz Jidy M, Orta M, et al. Perspectives and practice in antiretroviral treatment. Approaches to the management of HIV-AIDS in Cuba: case study. Geneva: WHO. http://www.who.int/hiv/pub/prev_ care/en/cuba.pdf. Accessed 27 May 2014).
El mayor incremento de los Linfocitos T CD4+ en los pacientes a los que se realizó PGR parece explicar, al menos en parte, las diferencias entre los grupos de estudio en cuanto a la incidencia de EO. Varios estudios prospectivos han demostrado que para los pacientes que viven con el virus, el conteo de los Linfocitos T CD4+ < de 200 células/ mm3 representa un nivel crítico por debajo del cual aumenta considerablemente el riesgo de sufrir enfermedades oportunistas (Pérez J, Pérez D, Gonzalez I, Diaz Jidy M, Orta M, et al. Perspectives and practice in antiretroviral treatment. Approaches to the management of HIV-AIDS in Cuba: case study. Geneva: WHO. http://www.who.int/hiv/pub/ prev_care/en/cuba.pdf. Accessed 27 May 2014.).
La mayor supresión virológica alcanzada por los pacientes tratados en base a la PGR, también puede haber contribuido a la menor incidencia de EO en los pacientes de este grupo durante el estudio. Es conocido que algunas EO como la neumonía por Pneumosystis jirovesi (PCP), se presentan con menor frecuencia en pacientes con supresión virológica completa gracias a la TARV, aun cuando estos no hayan alcanzado niveles de CD4 superiores a las 200 células/mm3 (Panel on Opportunistic Infections in HIV-Infected Adults and Adolescents. Guidelines for the prevention and treatmentof opportunistic infections in HIV-infected adults and adolescents: recommendations from the Centers for DiseaseControl and Prevention, the National Institutes of Health, and the HIV Medicine Association of the Infectious Diseases Society of America. http://aidsinfo.nih.gov/contentfiles/ lvguidelines/adult_oi.pdf).
Algunas EO como las neoplasias oportunistas, las infecciones herpéticas y la tuberculosis pueden aparecer incluso con cifras de linfocitos T CD4+ superiores a las 200 células/mm3, particularmente en pacientes sin tratamiento o con viremia persistente por fracaso de la TARV (Grupo de estudio del SIDA- SIMC (GeSIDA). Documento de consenso de GeSIDA/ Plan Nacional sobre el Sida respecto al tratamiento antirretroviral en adultos infectados por el virus de la inmunodeficiencia humana. Ministerio de Sanidad, Servicios Sociales e Igualdad. Gobierno de España. (Actualización enero de 2019)).
El uso de las PGR en la selección de la TARV tuvo un impacto estadísticamente significativo en la sobrevida de los pacientes a largo plazo, concordando con la evidencia recogida en estudios anteriores y de otros autores.17,18 Esto pudo estar mediado, al menos en parte, por el mayor incremento porcentual de los conteos de CD4+, la mayor supresión virológica y la menor incidencia de enfermedades oportunistas en el Grupo A del estudio.
Los pacientes en los cuales el tratamiento de rescate se escogió basado en una prueba genotípica de resistencia tuvieron una mejor respuesta virológica, un mayor incremento de Linfocitos T CD4+ y una mayor supervivencia que aquellos en los que el tratamiento se eligió basado en el criterio de expertos.











 texto em
texto em 



