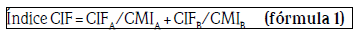Neoscytalidium dimidiatum es un ascomicete filamentoso no dermatofito de importancia médica1-4 que desde 19705,6 se ha descrito como agente causal de infecciones diseminadas, onicomicosis y otras manifestaciones clínicas en seres humanos.1,7-14 Desde los años noventa se ha encontrado a N. dimidiatum en las Américas.8,15,16 Se adquiere de la tierra o la materia vegetal por contacto directo o traumatismos,3,17 aunque algunos autores como Moore (1986) y Campbell (1971) sugieren la posibilidad de transmisión persona a persona.12,18 Es un patógeno primario gracias a su capacidad queratolítica (queratinasas, lipasas y amilasas hidrolizan la queratina de piel o uñas para facilitar su ingreso) y su pigmento melanina, como factor de virulencia, lo protege contra la acción del sistema inmune del hospedero.3,12,15,16,18,19 Las onicomicosis son micosis de alta prevalencia mundial.20,21 En Costa Rica estas infecciones se han estimado entre un (16 - 24) %, donde N. dimidiatum figura como causal de onicomicosis en un 2,8 % en uñas de los pies y en un 4,8 % en uñas de las manos.22,23 N. dimidiatum generalmente ingresa por el lecho ungueal y los pliegues laterales distales. Una vez instalado genera onicodistrofia, con despigmentación blanquecina y onicolisis. Con el tiempo se presenta coiloniquia, hiperqueratosis subungueal, pigmentación amarillosa-café-negruzca y si la infección alcanza el borde proximal puede desarrollarse una paroniquia.8,24 En inmunosupresos, ya sea por trasplante (de órgano sólido o médula ósea), lupus eritematoso sistémico, artritis reumatoide, uso de corticoesteroides a largo plazo, infección por el virus de la inmunodeficiencia humana (VIH), diabetes mellitus, cirrosis o ser mayor de 60 años, los factores de riesgo pueden llevar a una infección sistémica con una mortalidad hasta del 50 %.10- 12,25-27 Respecto del tratamiento de las onicomicosis, en la práctica clínica N. dimidiatum ha mostrado resistencia a muchos antimicóticos azólicos, derivados de alilaminas, morfolinas y ciclopirox28 y en la actualidad no se ha estandarizado un protocolo de tratamiento eficaz.22,23,29-31 Estudios como el de Lacroix y de Chauvin (2008) han analizado la susceptibilidad in vitro de este hongo frente a distintos antimicóticos, de lo cual reportan concentraciones mínimas inhibitorias (CMI) probadas en solitario de 0,25 μg/mL para vorizonazol; 0,50 μg/mL para anfotericina B; 0,50 μg/mL para terbinafina; 2 μg/mL para posaconazol; 8 μg/mL para caspofungina y >16 μg/mL para itraconazol.24,29 No obstante, a la fecha en la bibliografía no se reporta un estudio como este, en el cual se determine el efecto combinado de antifúngicos sobre el hongo en cuestión. Por lo tanto, el objetivo de la presente investigación ha sido determinar la interacción combinada in vitro de itraconazol y terbinafina sobre aislamientos clínicos de onicomicosis positivas por N. dimidiatum.
Métodos
Aislamientos: se analizaron 15 aislamientos de N. dimidiatum obtenidos de distintos pacientes diagnosticados con onicomicosis y depositados en la Micoteca de la Facultad de Microbiología, Universidad de Costa Rica, entre los años 2009 al 2016. Los hongos se cultivaron en tubos con agar Sabouraud glucosado (ASG) a temperatura ambiente (25 - 35) °C. Previo a los análisis de susceptibilidad se analizó su morfología colonial y microscópica (en lactofenol claro) para verificar que fenotípicamente los aislamientos correspondieran a N. dimidiatum.32
Método del tablero de ajedrez: la concentración mínima inhibitoria (CMI) y la concentración inhibitoria fraccionada (CIF) se determinaron mediante el método del tablero de ajedrez.33,34 Todos los cultivos y ensayos se realizaron por duplicado. Para ello se preparó una solución madre de cada antifúngico (terbinafina 6400 μg/mL e itraconazol 1600 μg/mL) (Royal Pharm, Hangzhou, China) utilizando dimetil sulfóxido (DMSO) (Sigma Chemicals Co., St. Louis, Mo, EE. UU) como diluente. A partir de la solución madre se hicieron diluciones dobles seriadas en medio RPMI (Roswell Park Memorial Institute) y se rotularon de la siguiente manera: A1 a A8 para terbinafina y B1 a B8 para itraconazol. Para el esquema del llenado de placas de microtitulación figura 1.
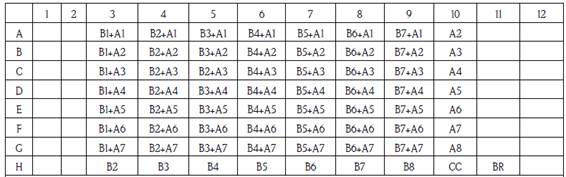
Figura 1 Distribución de los antifúngicos para la determinación de la concentración inhibitoria fraccionaria mediante el método del Tablero de Ajedrez en la microplaca de 96 hoyos (A: terbinafina, B: itraconazol, CC: control de crecimiento y BR: blanco de reactivos)
Preparación de los inóculos: los aislamientos en ASG se sembraron con técnica aséptica en agar papa dextrosa (APD) y se incubaron por 7 días a temperatura ambiente, para favorecer la esporulación. A partir del APD se preparó cada suspensión de artrosporas de N. dimidiatum en solución salina al 0,85 %; utilizando una cámara de Bürker (Poly-Optik GmbH, Blankemburg, Alemania) y se ajustó a una concentración de (1 - 5) x106 artrosporas/mL. Luego se diluyó 1:50 en caldo RPMI. Los pocillos de microtitulación se inocularon con 100 μL de la suspensión de esporas. Las placas se incubaron a temperatura ambiente sin agitación durante 72 horas hasta obtener crecimiento en el pocillo del control de crecimiento (CC).
Determinación de la CMI: la CMI se determinó como la concentración más baja que produjo inhibición del 80 % del crecimiento, al compararla contra el CC. La lectura espectrofotométrica (λ = 450 nm) se realizó con un lector de placas Synergy HT (BioTek Instruments, Inc.; Winooski, VT, EE. UU).
Determinación de la CIF: se restó a cada pocillo la absorbancia del medio (esto es, la absorbancia del pocillo 11H). El valor de las CIF (o índice CIF) se calculó con base en la siguiente ecuación: Índice CIF = CIFA/ CMIA + CIFB/CMIB, donde CIFA es la CMI del fármaco A en combinación y CMIA es la CMI del fármaco A en solitario; CIFB es la CMI del fármaco B en combinación y CMIB es la CMI del fármaco B en solitario. El índice CIF se basa en la hipótesis de que un fármaco no puede interactuar consigo mismo y, por tanto, el efecto de la combinación si CIF es ≤ 0,5 se considera sinergismo; si CIF ˃ 0,5 pero < 4,0 significa no efecto y por último cuando CIF es ≥ 4,0 significa antagonismo.34-40 Análisis estadístico: los resultados se analizaron con el programa SPSS para Windows versión 20 (SPSS Inc., Chicago, Illinois, EE. UU). Se estimó la media geométrica y los percentiles CMI50 y CMI90 donde terbinafina e itraconazol inhibían la multiplicación fúngica. Posteriormente, se realizó un análisis de t student para determinar si existen diferencias estadísticamente significativas entre las concentraciones en solitario y las concentraciones en combinación.
Ecuación A-1 para el cálculo de la concentración inhibitoria fraccionada.
Resultados
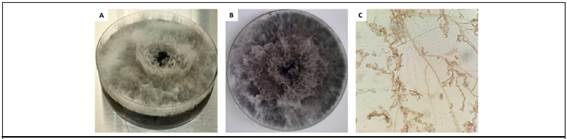
Aislamientos clínicos: los 15 aislamientos exhibieron la morfología colonial típica correspondiente a hongos de la especie N. dimidiatum. Los montajes de todos los aislamientos en lactofenol claro demostraron la presencia de micelio fuliginoso septado y artrosporas (figura 2).
Determinación de los patrones de susceptibilidad in vitro: con base en los ensayos realizados se estimaron las CMI (cuadro 1) y las CIF de los aislamientos clínicos de N. dimidiatum. Los antifúngicos utilizados fueron itraconazol y terbinafina, probados en forma individual y combinados. En el cuadro 2 se presentan los patrones de susceptibilidad de cada antifúngico evaluado. Se encontraron diferencias estadísticamente significativas entre las medias de la CMI al comparar al itraconazol usado en solitario respecto del itraconazol combinado con terbinafina (t = 2,958; gl = 14; p = 0,01). También entre las medias de la CMI de terbinafina usada en solitario y la terbinafina combinada con itraconazol (t = 4,721; gl = 14; p < 0,001). Se obtuvieron CMIs menores al combinar ambas drogas. En el caso del itraconazol el 93,33 % (n = 14) de los aislamientos presentó resistencia (CMI ≥ 1 μg/mL)41 cuando se evaluó su efecto al aplicarlo en solitario; pero al combinarlo con la alilamina este porcentaje disminuyó al 60,00 % (n= 9) (cuadro 1).
Cuadro 1 Actividad in vitro de la terbinafina e itraconazol combinados o en solitario, aplicados sobre aislamientos clínicos de N. dimidiatum (n = 15)
| *CMI Itraconazol (µg/mL) | CMI Itraconazol combinado (µg/mL) | **CMI Terbinafina (µg/mL) | CMI Terbinafina combinada (µg/mL) |
|---|---|---|---|
| 64,00 | 4,00 | 0,50 | 0,13 |
| 64,00 | 2,00 | 0,50 | 0,25 |
| 64,00 | 4,00 | 0,50 | 0,13 |
| 0,40 | 0,20 | 0,13 | 0,02 |
| 1,00 | 0,50 | 0,13 | 0,01 |
| 1,00 | 0,50 | 0,13 | 0,03 |
| 4,00 | 2,00 | 0,13 | 0,02 |
| 32,00 | 16,00 | 0,13 | 0,03 |
| 64,00 | 16,00 | 0,25 | 0,02 |
| 2,00 | 0,50 | 0,52 | 0,07 |
| 1,50 | 0,38 | 0,13 | 0,02 |
| 128,00 | 16,00 | 0,25 | 0,03 |
| 3,00 | 1,50 | 0,50 | 0,03 |
| 1,60 | 0,80 | 1,00 | 0,13 |
Cuadro 2 Distribución de la concentración mínima inhibitoria (CMI) de los aislamientos clínicos de N. dimidiatum (n = 15) utilizando itraconazol y terbinafina como antimicóticos
| Antifúngico | Promedio (DS) | Rango | CMI (µg/mL) CMI50 | CMI90 |
|---|---|---|---|---|
| Itraconazol | 30,83 ± 38,35 | 0,40 - 128,00 | 3,00 | 64,00 |
| Itraconazol combinado* | 4,49 ± 6,07 | 0,20 - 16,00 | 2,00 | 16,00 |
| Terbinafina | 0,33 ± 0,25 | 0,13 - 1,00 | 0,13 | 0,50 |
| Terbinafina combina- da** | 0,07 ± 0,07 | 0,01 - 0,25 | 0,03 | 0,13 |
*Combinación de itraconazol con terbinafina
**Combinación de terbinafina con itraconazol
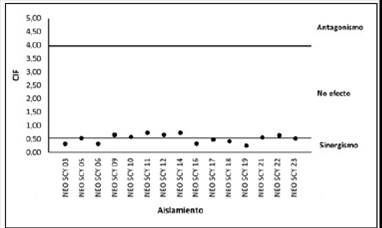
La CIF promedio de ambos antifúngicos combinados fue de 0,59 μg/mL requerida para inhibir la multiplicación fúngica. El resultado neto de mezclar los antimicóticos evidenció un 40 % (n = 6) de sinergismo en los casos estudiados (CIF ≤ 0,5). No se presentó ningún caso de antagonismo en los aislamientos estudiados (figura 3).
Discusión
Aunque las onicomicosis causadas por N. dimidiatum pueden considerarse un reto terapéutico,23,29-31 el presente trabajo probó el efecto conjunto de itraconazol y terbinafina sobre 15 aislamientos del hongo, en aras de encontrar una alternativa de tratamiento.
En la presente investigación, al aplicar la terbinafina en solitario se encontró una CMI entre (0,13 - 1,00) μg/ mL, la cual concuerda con lo reportado en países como Inglaterra, Francia, España, Canadá, Colombia y Brasil donde el rango de la CMI reportado es de (0,03 - 4,00) μg/mL.29,42-46 La variabilidad en los valores de las CMI puede deberse a que los aislamientos provienen de cepas distintas y por eso exhiben diferentes susceptibilidades a esta alilamina. Los resultados in vitro podrían correlacionarse con el hecho de que in vivo la terbinafina se absorbe muy rápido independiente de la acidez, alcanza valores máximos a las dos horas post-ingesta, es altamente queratinolítica y lipofílica, fungicida y no sufre un metabolismo de primer paso.47-50
En el presente trabajo, la CMI50 de terbinafina usada en solitario fue 0,13 μg/mL y para la CMI90 fue de 0,50 μg/ mL. En Holanda, Dorsthorst et al. (2002) encontraron una CMI50 de 4 μg/mL de terbinafina en solitario para inhibir el crecimiento de Aspergillus fumigatus.33 En España, el estudio de García et al. (2005) mediante la técnica de microdilución Sensititre YeastOne® estimó la CMI50 para A. fumigatus en 0,50 μg/mL.51 En Colombia, mediante el método E-test, Chávez et al. (2010) encontraron una CMI90 de 0,38 μg/mL para inhibir A. fumigatus.52 En Costa Rica, Ramírez-Hernández y colaboradores (2020) por medio de microdilución en placa (CLSI) encontraron una CMI50 de 0,50 μg/mL y CMI90 de 1,36 μg/mL para interrumpir el crecimiento de Aspergillus versicolor.53 Esto permite inferir que N. dimidiatum requiere menores concentraciones de terbinafina en solitario que Aspergillus sp. para inhibir su multiplicación. Los resultados de otros trabajos incluyendo a este sugieren a la terbinafina como antimicótico contra N. dimidiatum, ya que se pudo determinar que esta alilamina usada en solitario ejerció un efecto inhibitorio mayor que el azol. Es importante resaltar que se comparan resultados entre el género Aspergillus sp. y Neoscytalidium sp. porque ambos son hongos filamentosos causantes de onicodistrofias y pueden generar infecciones sistémicas en pacientes inmunocomprometidos. Por su parte, el itraconazol analizado en solitario presentó una CMI entre (0,40 - 128,00) μg/mL, lo cual coincide con lo reportado en países como Inglaterra, Holanda, Francia, Bélgica y Colombia donde el rango de la CMI reportado es de (0,03 - >64,00) μg/mL.24,29,38,42,44,54 Las variantes en las CMI de estos estudios derivan de que los aislamientos evaluados pueden pertenecer a cepas diferentes y por tal motivo presentan resistencias distintas.
En la presente investigación la CMI50 de itraconazol usado en solitario fue 3,00 μg/mL y para la CMI90 fue de 64,00 μg/mL. En Colombia, Chávez et al. (2010) mediante el método E-test encontraron que ambas CMI50 y CMI90 >1,00 μg/mL para inhibir A. fumigatus; CMI50 de 1,5 μg/mL y CMI90 de 3,00 μg/mL contra Aspergillus niger; y ambas CMI50 y CMI90 en 0,50 μg/mL contra Aspergillus flavus.52 En Costa Rica, se encontró una CMI50 de 1,00 μg/mL y CMI90 de 1,80 μg/mL para interrumpir el crecimiento de A. versicolor, por la técnica de microdilución en caldo del CLSI.53 En España, el estudio de García et al. (2005) mediante microdilución Sensititre YeastOne® estimó la CMI50 en 0,13 μg/ mL para A. fumigatus; CMI50 en 0,50 μg/mL contra A. niger; y CMI50 en 0,25 μg/mL contra A. flavus.51 En Holanda, Dorsthorst et al. (2002) determinaron la CMI50 en 0,25 μg/mL de itraconazol en solitario para detener la multiplicación de A. fumigatus.33 Los resultados de otros trabajos incluyendo a este demuestran el requerimiento de mayores concentraciones de itraconazol usado en solitario para inhibir el crecimiento de N. dimidiatum y menores concentraciones contra Aspergillus sp. Esto sugiere que itraconazol, cuando se usa solo, ejerce un menor efecto inhibitorio sobre N. dimidiatum. Estos resultados de itraconazol en solitario in vitro podrían correlacionar in vivo con que este medicamento es dosis dependiente, su absorción duodenal amerita un pH ácido (lo cual no es fácil de lograr porque el vaciado gástrico ácido induce la alcalinización del duodeno), además se requiere como mínimo una concentración en sangre ≥ 5 μg/mL para observar algún efecto, lo que también es difícil porque el CYP3A4 realiza un metabolismo de primer paso a nivel de intestino delgado, lo que reduce su biodisponibilidad antes de llegar al lecho vascular ungueal para ejercer su efecto fungistático; también puede haber resistencia intrínseca de algunos aislamientos del hongo hacia los azoles.41,47,49,55 Además, el uso generalizado de fármacos antifúngicos azólicos se ha asociado con la aparición de especies resistentes o con menos sensibilidad en muchas regiones del mundo y en poblaciones concretas de pacientes.56
Con respecto al efecto de la combinación de ambos tratamientos, en el año 2002, Dorsthorst y colaboradores reportaron un efecto sinérgico al combinar itraconazol y terbinafina sobre aislamientos de A. fumigatus.33 En el estudio de un caso fatal de aspergilosis pulmonar, liderado por Meletiadis y colaboradores (2010) (apoyados por el Programa de Investigación Intramural del Instituto Nacional del Cáncer, en Bethesda, Maryland, EE. UU.) y el estudio de Hall et al. (1983) en los cuales se analizó terbinafina e itraconazol, se confirmó que aun las interacciones débiles con CIF entre 0,5 y 0,99 demostraron ser estadísticamente significativas.40,57 Por otro lado, Ramírez-Hernández y colaboradores (2020) encontraron un efecto potenciador de la terbinafina sobre el itraconazol con aislamientos de A. versicolor.53
El presente estudio encontró, no solo este efecto potenciador, sino también un 40 % de sinergismo.
El efecto sinérgico deriva de que la terbinafina inhibe a la enzima escualeno epoxidasa (en el primer paso de la biosíntesis del ergosterol) y el itraconazol, a la 14-alfaesterol- desmetilasa (a la mitad del ciclo biosintético).47,55 Lo anterior supone una ventaja farmacocinética y farmacodinámica porque a nivel hepático ambos medicamentos se metabolizan por vías distintas, no hay interacción negativa ni saturación enzimática de los citocromos detoxificantes, lo cual reduce la acumulación hepática de estos medicamentos. Esto redunda en un beneficio farmacológico para el paciente porque su sinergia cuando se combinan y su rápido aclaramiento contribuyen a una menor probabilidad de daño hepatocelular.48,50,55,58-60 La acción farmacológica neta de combinar itraconazol y terbinafina interrumpe dos pasos claves en la biosíntesis del ergosterol del hongo; esto debilita su membrana, facilita el ingreso de dichos fármacos dentro del hongo con lo cual queda expuesto a la acción de los leucocitos del sistema inmunológico.55,59
Cabe mencionar que cuando un paciente recibe terapias como ciclosporina, sirolimus, tacrolimus, efavirenz, lovastatina, sinvastatina, atorvastatina y fluvastatina la inhibición competitiva de itraconazol sobre el CYP3A4 induce un aumento plasmático de estos fármacos mencionados, lo que deriva en intoxicaciones, el riesgo de rabdomiólisis y miopatías.50,55,59 Por su parte ritonavir, nelfinavir, cobicistat, darunavir o miconazol ejercen inhibición competitiva sobre el CYP2D6, de modo que la terbinafina se acumula en hígado ocasionando hepatopatías como necrosis del tejido. Estas interacciones negativas se potencian con polimorfismos que produzcan metabolizadores lentos homocigotos y las intoxicaciones pueden derivar en la muerte del paciente.50,58,60 Por lo tanto, el médico debe valorar cada caso antes de administrar una terapia que incluya itraconazol o terbinafina en pacientes inmunosupresos o que reciben antirretrovirales.
En conclusión, la monoterapia con itraconazol no resultó efectiva in vitro para eliminar a N. dimidiatum. La monoterapia con terbinafina fue efectiva in vitro para inhibir al hongo. Por su parte, la combinación de itraconazol y terbinafina in vitro presentó una acción sinérgica total o parcial en la inhibición del crecimiento del hongo estudiado.
Agradecimientos y colaboradores: Se agradece a la señorita Alejandra Gómez, a la Dra. Pilar Salas Chaves y a la Dra. Norma T. Gross Martínez, de la Facultad de Microbiología de la Universidad de Costa Rica, por su apoyo y recomendaciones durante la realización de esta investigación.











 texto em
texto em