El cáncer (CA) es la segunda causa de muerte en el mundo; para 2015 se notificaron 8,8 millones de muertes por esta enfermedad. El de pulmón, hígado, colón y recto, estómago y mama, son los principales tipos de cáncer con mayor mortalidad en todo el mundo.1
Cáncer, tumores o neoplasias malignas, son términos que se asignan a un conjunto de enfermedades que afectan a múltiples órganos blancos. En esta enfermedad ocurre un crecimiento acelerado y múltiple de células anormales, que sobrepasan los espacios normales e invaden otros sitios donde no suelen presentarse, colonizando tejidos y órganos, es decir, lo que comúnmente se conoce como metástasis.2
En las Américas, cada año se diagnostican más de 462 mil mujeres con CA de mamá, y se estima que 100 mil mueren por esta enfermedad. Se prevé que para 2030 los casos de cáncer mamario aumentarán hasta un 34 % en estas regiones. Se diagnostican más casos de neoplasias mamarias en menores de 65 años en las Américas, que en los Estados Unidos y Canadá, donde son más comúnes cuanta más edad.3,4Por lo tanto, un diagnóstico oportuno y precoz reduce significativamente la mortalidad en pacientes con cáncer mamario. Cada vez la esperanza de vida es mayor en pacientes oncológicos con CA de mama, partiendo del hecho de donde las mujeres tienen mayor probabilidad de supevivencia que los hombres. Resalta que algunas de las complicaciones más comunes en el tratamiento para el cáncer incluyen alteraciones musculoesqueléticas, cardiovasculares y pulmonares, tales como: infección, diarrea, dolor, linfedema, náuseas, fatiga, osteopenia.5,6
La fatiga es una de las manifestaciones más comunes en el tratamiento para el manejo del cáncer, y aumenta la limitación y la discapacidad progresiva. Se ha sugerido el ejercicio como parte de la intervención terapéutica en el manejo paliativo del cáncer. De esta manera, los beneficios del ejercicio en el CA varían dependiendo del momento del tratamiento, tipo y estadio, como también de la actividad física o no de los pacientes en tratamiento.7
El ejercicio físico en pacientes oncológicos, durante o a partir del tratamiento terapéutico, previene la disminución de la función cardiovascular y cardiorrespiratoria, mejora la composición corporal, inmunológica, la fuerza muscular y flexibilidad, la imagen corporal, la autoestima y el estado de ánimo.8 A nivel vascular, el ejercicio promueve el estrés de cizallamiento vascular y reduce el estrés oxidativo, lo que estimula la función endotelial. El entrenamiento en intervalos de alta intensidad (HIIT) es una propuesta que busca aumentar la intensidad del ejercicio a partir de incrementos sobre el esfuerzo con períodos de recuperación activa. Además, diferentes estudios 9-11han demostrado los beneficios positivos de este programa de entrenamiento en pacientes con cáncer, al punto de que mejoran la función física, la calidad de vida y las actividades diarias. Así, el entrenamiento continuo de intensidad moderada (MICT, por sus siglas en inglés), ha mostrado beneficios, al igual que el HIIT, pero de una manera menos riesgosa, al tratarse de una intervención basada en ejercicio aeróbico a una intensidad moderada.12,13
Dicho lo anterior, surge como pregunta de investigación: ¿cuáles son los cambios de la fatiga asociada al cáncer de mama luego de un programa entrenamiento de alta intensidad (HIIT), o continuo a intensidad moderada (MICT), en pacientes con cáncer de mama en estadio II? El objetivo principal de la presente investigación es determinar los cambios de la fatiga asociada al cáncer de mama, luego de un programa de entrenamiento de alta intensidad (HIIT), o un entrenamiento continuo a intensidad moderada (MICT).
Métodos
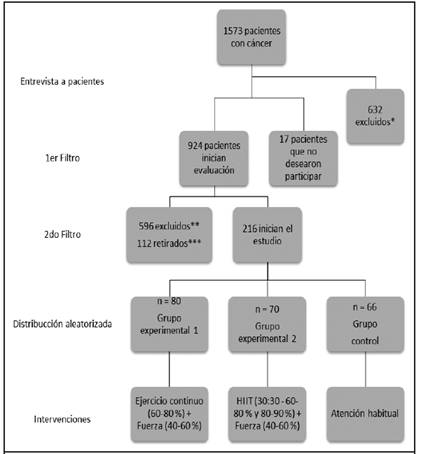
Esta investigación fue un ensayo clínico aleatorizado, con una muestra de 1573 pacientes con cáncer, y después de los criterios de inclusión y exclusión, 216 pacientes con cáncer de mama en estadio II, finalmente iniciaron la investigación, organizados en 3 grupos: el grupo MICT (Grupo experimental 1), el grupo HIIT (Grupo experimental 2) y el grupo de consideraciones usuales (Grupo control) (Figura 1). Se hizo un muestreo probabilístico básico por medio de una tabla de números aleatorios, cuyo orden fue aleatorio y cegado a través del programa Microsoft Excel 16.0, con resultado de 80 participantes para el grupo experimental 1, 70 en el grupo experimental 2 y 66 en el grupo control (recomendaciones verbales sobre ejercicio, dieta, seguimiento vía llamada telefónica y realización de actividades de la vida diaria).
El artículo es producto del macroproyecto randomizado de ONCO-EXE TRIAL, registrado en el sistema de registro y resultados de protocolo ClinicalTrials.gov de la National Library of Medicine (NLM), the National Institutes of Health (NIH) y la Food and Drug Administration (FDA): NCT03915288. El periodo de ejecución fue de 3 años y 4 meses (noviembre 2015 - febrero 2019) para obtener los siguientes atributos:
Características de los participantes
Los pacientes tenían particularidades semejantes desde el punto de vista de: etapa del cáncer, fracción de eyección, clase funcional, porcentaje muscular, grasa e IMC (índice de masa corporal), circunferencia abdominal, sobrepeso, obesidad, prevalencia de diabetes, hipertensión arterial (HTA), factores de riesgo cardiovascular. También, todos los individuos mostraron “riesgo alto”, según la estratificación propuesta por la Asociación Americana de Rehabilitación Cardiopulmonar.
Criterios de inclusión y exclusión
Los individuos debían tener cáncer en estadio II, ser mayores de 18 años, querer asistir a un programa de entrenamiento y firmar un consentimiento informado protegido por el comité de ética e investigación de la institución. De la misma manera, fue obligatorio tener una fracción de eyección mayor al 35 %, sin dificultad para realizar los cuestionarios, pruebas y las medidas requeridas por la investigación. Se evitaron los pacientes con dolor intenso en los miembros inferiores, angina inestable, frecuencia cardíaca >120 lpm (latidos por minuto) en reposo, presión arterial sistólica >190 mmHg, diastólica >120 mmHg, y los pacientes con cáncer en otro estadio que no fuera el II.
*632 pacientes excluidos inicialmente (132 por cáncer fase 1; 351 por cáncer fase 3; 149 por cáncer fase 4). **596 pacientes excluidos por no cumplir criterios de inclusión (otros tipos de cáncer: 249 cáncer de próstata, 79 colorrectal, 70 tiroides, 48 cervicouterino, 37 pulmón, 29 estómago, 25 hepático, 24 páncreas, 22 riñón, 13 esófago) ***112 pacientes excluidos por contraindicación (5 por proceso infeccioso, 13 por dificultad para el traslado al sitio de entrenamiento, 22 por alteraciones arrítmicas, 35 por hipertensión sistólica >190 mmHg, 37 dolor articular).
Metodología a ciegas
Se realizó un estudio clínico simple a ciegas, en el que los pacientes fueron evaluados inicialmente por un profesional no investigador (médico oncólogo del Servicio de Oncología). Luego, los pacientes se ingresaron a una base de datos en Microsoft Excel 16.0, exclusivamente con un número de identificación que permitió el cegamiento de los autores. Asi como iban ingresando al ensayo clínico aleatorizado, el participante era ubicado de manera aleatoria en uno de los tres grupos (MICT-HIIT-GC), conforme el computador generaba la secuencia de ubicación de grupo. Todos los participantes y profesionales, incluyendo a los investigadores, fueron cegados a lo largo del protocolo.
Para los grupos 1 y 2 (MICT-HIIT), los investigadores prepararon los cuestionarios y las pruebas sin que ellos supieran la asignación de cada paciente. Para el grupo experimental 1 y 2, los autores evaluadores fueron D. P-F. - P. P-R. y R. P-R. - Y. C-P., respectivamente.
Después de las pruebas, se sugirió a los participantes que se acercaran al autor principal (J. P-R) para informarles su horario y la fecha de inicio del programa de capacitación. Debe enfatizarse que, desde los exámenes iniciales hasta el final del programa de entrenamiento, los autores no establecieron una conversación sobre el tema con los participantes o los terapeutas. Exclusivamente, los autores realizaron cuestionarios y pruebas pre y postentrenamiento. Y solo el autor J. P-R., sostuvo reuniones periódicas con los fisioterapeutas entrenadores para conocer y armonizar el entrenamiento de cada grupo, pero no para intimar con los participantes o revisar sus datos.
Después del programa de entrenamiento, de nuevo se realizaron pruebas y exámenes a los pacientes de cada grupo para calcular los cambios posteriores al entrenamiento.
Teniendo en cuenta la información recopilada antes y después, los análisis estadísticos para el grupo experimental 1 se llevaron a cabo por D. P-F. y R. P-R.; para el grupo experimental 2, por P. P-R. y X. V-B. y para el grupo control, por los autores J. P-R. y Y. C-P. Una vez que las diferentes variables se estudiaron a ciegas, todos los autores fueron informados sobre los grupos con sus pacientes y los resultados para generar las conclusiones.
Medidas antropométricas
Para todos los participantes se obtuvieron los siguientes datos: antecedentes familiares y personales, utilizando un cuestionario de creación propia, y medidas antropométricas (peso, talla, índice de masa corporal, circunferencia abdominal, porcentaje de grasa y músculo), con técnicas estandarizadas en la población mexicana.
El peso, el porcentaje de grasa y el músculo se obtuvieron utilizando la balanza digital Tezzio TB-30037 calibrada y ubicada en una superficie plana y estable, utilizando las indicaciones del manual del usuario. Por otro lado, la talla se obtuvo con el Adult Acrylic Halter Wall Kramer 2104. Con estas variables se determinó el IMC en kg/m-1. Luego, con una cinta métrica y una precisión de 1 mm, se recogió la medida de la circunferencia abdominal, a partir de la referencia anatómica descrita por Frisancho.14
Signos vitales
La frecuencia cardíaca fue detectada por el sistema Polar Multisport RS800CX, y la respiratoria, al igual que la presión arterial sistólica y diastólica, manualmente, mientras que la saturación de oxígeno se obtuvo con un oxímetro portátil Nellcor Puritan Bennett. De manera similar, la disnea percibida y el esfuerzo se evaluaron utilizando la escala de Borg modificada.15
Función cardiovascular
Cada participante de la investigación fue sometido a una ecocardiografía 2-D (bidimensional) antes y después del programa de entrenamiento, para revisar las diferentes estructuras anatómicas, presiones, fracción de eyección (FEVI) como también su respectiva movilidad. La mencionada valoración, además de arrojar datos importantes sobre lo mencionado, permitió clasificar a los pacientes en falla cardiaca con fracción de eyección reducida o preservada, y así determinar su participación. Además, se clasificaron según las 4 clases (I, II, III y IV) de la NYHA con base en las limitaciones de la actividad física del paciente, causadas por síntomas cardíacos.
Prueba de esfuerzo y caminata de 6 minutos
La Declaración ATS Statement: Guidelines for the sixminute walk test of the American Thoracic Society16,17 fue la guía para la realización de la prueba de caminata de los 6 minutos. Luego, el participante debía volver al día siguiente para una prueba de esfuerzo de acuerdo con el protocolo de Naughton, recomendado en pacientes de alto riesgo y cuya velocidad e inclinación en la banda sin fin es por estadios de 2 minutos. Para estas pruebas, se le dijo al paciente que debía evitar fumar, tomar bebidas, o cualquier tipo de medicamento que pudiera alterar sus signos vitales o el rendimiento durante la prueba.
Fuerza
La fuerza fue valorada mediante dinamometría con el Hand Grip CAMRY Electronic hand dynamometer model EH101. Para esta prueba se requirió cumplir con la siguiente técnica: sujeto de pie o sentado en posición cómoda y sin apoyabrazos. Hombros aducidos y sin rotación. Codo flexionado a 90°. Antebrazo y muñeca en posición neutra. Se mide la fuerza de prensión en la mano hábil y se registran tres determinaciones consecutivas, respetando el tiempo de recuperación muscular, que es de aproximadamente un minuto. Por otro lado, para conocer el peso inicial del entrenamiento de fuerza para las extremidades superiores (MMSS) e inferiores (MMII), se consideró apropiada la prueba de una repetición máxima (1RM) con una extensión completa del grupo muscular utilizado, sin sustituciones musculares.
Fatiga
La fatiga se valoró mediante la FACT-Fatigue Scale (Escala de Fatiga de la Evaluación Funcional de la Terapia del Cáncer), que es un inventario de 13 items que evalúa la gravedad de la fatiga asociada al cáncer (FAC) en la última semana, con una escala de 0 a 4, y que con puntuaciones más altas refleja una FAC más baja.18
Calidad de vida
Para este apartado se utilizó el cuestionario EORTC QLQ C-30 (European Organisation for Research and Treatment of Cancer quality of Life Questionnaire Core 30),19 con su respectiva interpretación, siguiendo la guía del manual de la European Organisation for Research and Treatment of Cancer.20 La prueba fue solicitada directamente (por J. P-R) en español, a los autores principales EORTC Quality of Life Group website, quienes aprobaron su uso en la investigación.
Intervenciones por grupo
Durante las respectivas intervenciones, los participantes estuvieron monitoreados por un Polar Multisport RS800CX, oximetría y seguimiento mediante la escala de Borg, con el fin de evitar sobrepasar la intensidad de entrenamiento (60-80 % frecuencia cardíaca máxima (FCM), 6 a 8 Borg). La inclinación, resistencia o velocidad de los ejercicios fueron asignadas según los parámetros indicativos (FCM, Vo2, Borg) para intensidad moderada.
Grupo experimental 1 (n= 80)
El programa de entrenamiento tuvo una duración de 36 semanas, con asistencia de 3 veces a la semana, con 70 minutos por intervención, en donde 10 minutos eran de calentamiento (ejercicios respiratorios, caminata, estiramientos), 30 minutos de entrenamiento aeróbico continuo a intensidad moderada (60-80 % FCM), 20 minutos de entrenamiento de fuerza (40-60 % fuerza máxima) con mancuernas y theraban de manera progresiva, y los últimos 10 minutos, para el enfriamiento (ejercicios de coordinación, equilibrio, caminata y ejercicios respiratorios). Referente al MICT, este fue realizado con caminata rápida o trote en banda sin fin, con el piso inclinado para alcanzar la intensidad deseada, lo mismo que en bicicleta, remo y elíptica.
Grupo experimental 2 (n= 70)
Este grupo posee las mismas características del grupo experimental 1; las fases de calentamiento, fuerza y enfriamiento fueron idénticas a la del GE1. La diferencia consistió en una intensidad de entrenamiento intervalica. Es decir, los pacientes intervenidos durante los 30 minutos de ejercicio aeróbico, siguieron un protocolo creado por el autor principal (J.P-R) para este grupo experimental, que denominamos 30-30: 30 segundos a intensidad moderada (60-80 % FCM) y 30 segundos a intensidad alta (80-90 %).
Cuadro 1 Características iniciales de la población de estudio (n= 216)
| Características | Grupo experimental 1 n= 80 | Grupo experimental 2 n= 70 | Grupo control n= 66 |
| Sexo | H:0 M: 80 | H: 0 M: 70 | H:0 M: 66 |
| Edad (Años) | 51 ± 4 | 55 ± 5 | 53 ± 7 |
| Fracción de eyección (%) | 51 ± 4,5 | 45 ± 5,3 | 48 ± 4,1 |
| Altura (m) | 1,50 ± 10,2 | 1,53 ± 7 | 1,53 ± 3,4 |
| Peso (kg) | 79 ± 12,9 | 83 ± 10,5 | 80 ± 8,1 |
| IMC (Peso/Talla2) | 29 ± 5,4 | 31 ± 3,9 | 30 ± 4,2 |
| Circunferencia abdominal (cm) | 90 ± 5,2 | 93 ± 3,5 | 86 ± 6,9 |
| Porcentaje graso (%) | 26 ± 7,4 | 28 ± 4,4 | 27 ± 6,3 |
| Porcentaje muscular (%) | 29 ± 15,6 | 32 ± 8,1 | 30 ± 12,8 |
| Fuerza (Kg) | 24,5 ± 10,5 | 27,4 ± 5,7 | 29,7 ± 6,3 |
| Vo2 estimado (Ml/kg/o2/min) | 8,3 ± 3,2 | 8,5 ± 8,3 | 8,9 ± 5,7 |
| METs (O2/kg x min) | 2,3 ± 0,9 | 2,4 ± 2,3 | 2,5 ± 1,6 |
| Fatiga (FACT-F) | 18,6 ± 9,5 | 20,4 ± 5,6 | 16,6 ± 5,5 |
| Calidad de vida | 60,7 ± 16,7 | 58,6 ± 17,0 | 64,5 ± 12,9 |
| Distancia recorrida (m) | 231 ± 28 | 253 ± 10,8 | 279 ± 18,6 |
| FCM en prueba de esfuerzo (lpm) | 156 ± 6 | 152 ± 12 | 155 ± 7 |
| Sobrepeso y/u Obesidad (%) | 81 % | 85 % | 88 % |
| Obesidad abdominal (%) | 84 % | 88 % | 79 % |
| Dislipidemia (%) | 34 % | 45 % | 27 % |
| Hipertensión arterial (%) | 56 % | 41 % | 35 % |
| Diabetes (%) | 20 % | 13 % | 7 % |
| Enfermedad renal (%) | 5 % | 3 % | 6 % |
| Sedentarismo* (%) | 90 % | 91 % | 87 % |
| Tabaquismo (%) | 54 % | 31 % | 25 % |
| Alcoholismo (%) | 2 % | 9 % | 1 % |
| Ingesta de comida inadecuada (%) | 14 % | 16 % | 10 % |
| Historial de IAM (%) | 6 % | 4 % | 9 % |
| Sexo femenino (%) | 100 % | 100 % | 100 % |
IMC: índice de masa corporal, VO2: consumo máximo de oxigeno, FCM: frecuencia cardíaca máxima, kg: kilogramos; cm: centímetros, m: metros,
lpm: latidos por minuto, IAM: infarto agudo del miocardio
* Menos de 150 minutos por semana
Grupo control (n= 66)
Este grupo no realizó ejercicio supervisado, ni se le otorgaron recetas de ejercicio, ni programas formales de intervención. Solo se continuó con la atención habitual y se le dieron indicaciones para mantener un estilo de vida saludable, basado en una nutrición adecuada y actividades habituales. En las instituciones adonde asistían los pacientes de los 3 grupos, no se cuenta con un área de entrenamiento físico supervisado por un profesional. Por ende, no se excluyó o negó el protocolo de intervención a los participantes del grupo control, simplemente se dio continuidad y supervisión con fines investigativos, a su proceso y tratamiento. Además, ninguno de los 3 grupos detuvo su tratamiento médico ni el de los otros profesionales que conforman el equipo interdisciplinario.
Consideraciones éticas
El diseño y desarrollo de la investigación se llevó a cabo bajo las consideraciones éticas de la Declaración de Helsinki, firma de consentimiento informado y con la autorización de los pacientes, gerentes, coordinadores y comité de ética de la institución.
Análisis estadistico
Luego de crear una base de datos en Microsoft Excel 16.0, se obtuvieron las estadísticas descriptivas. La normalidad de los datos se evaluó mediante la prueba de Kolmogorov-Smirnov y la indicación de especificidad fue evidente para todos los análisis. Con la prueba de Tukey, se utilizó el análisis de varianza ANOVA (Análisis de varianza de una vía) y, posteriormente, las pruebas post hoc para evaluar las características de los diferentes grupos de edad, género y antropometría. En todos los casos, se estableció un nivel de significación del 5 % (p <0,05) y todo lo realizado se llevó a cabo en el programa Stata.
Resultados
El presente ensayo clínico aleatorizado inició con una muestra de 1573 pacientes con cáncer, y luego de los filtros se contó con la participación de 216 mujeres con cáncer de mama en estadio II.
En cuanto al nivel académico de las participantes, el 46,2 % (n=100) había completado solo la escuela primaria, el 13,9 % (n=30) estudió hasta la educación secundaria, el 17,1 % (n=37) el nivel universitario y el 22,6 % (n=49) no estudió. Los tratamientos oncológicos realizados fueron: cirugía (14 %), radioterapia (70 %), quimioterapia (60 %) y terapia hormonal (43 %). Los factores de riesgo más prevalentes en la población de estudio fueron: sedentarismo, sobrepeso y obesidad, obesidad abdominal, hipertensión arterial, tabaquismo, dislipidemia, diabetes mellitus, dieta inadecuada, enfermedad renal y otros más (Cuadro 1).
Por otro lado, al comparar el porcentaje de músculo (GE1: 29±15,6 vs 32±3,5; GE2: 32±8,1 vs 38±6,7; GC: 30±12,8 vs 31±8,4), grasa (GE1: 26±7,4 vs 21±2,9; GE2: 28±4,4 vs 20±3,5; GC: 30±12,8 vs 28±8,2) e IMC (GE1: 29±5,4 vs 24±2,8; GE2: 31±3,9 vs 24±1,3; GC: 30±4,2 vs 30±7,1) y el consumo máximo de oxígeno (VO2) (GE1: 8,3±3,2 vs 13,1±5,8; GE2: 8,5±8,3 vs 16,7±5,5; GC: 8,9±5,7 vs 8,8±4,0), como un indicador de tolerancia al ejercicio y los metros recorridos antes y después de la intervención de cada programa de entrenamiento, basados en el MICT (Grupo 1) y HIIT (Grupo 2), con un componente de fuerza muscular, se observó una mejora significativa en todas las variables (p= <0,05 %). Además, al comparar los resultados entre los grupos, fue posible demostrar mejores resultados con una diferencia significativa en el grupo experimental 2 (p= <0,05 %) (Cuadro 2).
Cuadro 2 Análisis de cambios postentrenamiento (n= 216)
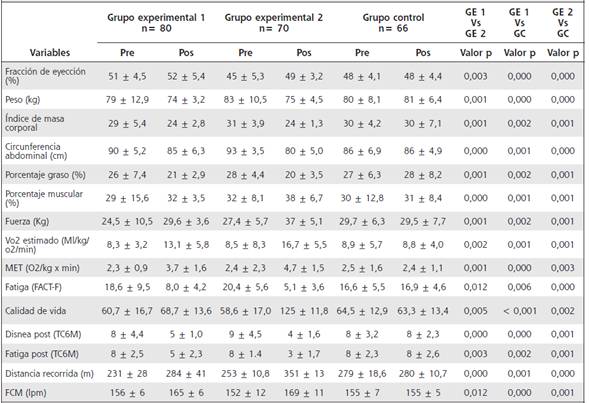
VO2: consumo máximo de oxigeno, FCM: frecuencia cardíaca máxima, MET: equivalente metabólico, TC6M: test de caminata de los 6 minutos, lpm: latidos por minuto.
Durante las sesiones de los programas de entrenamiento, los participantes informaron una disnea percibida según la escala de Borg, entre 6 y 8 (intensidad moderada), en los grupos 1 y 2, resaltando que el grupo 2 tuvo picos entre 9 y 10, así como la sensación de fatiga durante el ejercicio.
Luego de las respectivas intervenciones, se encontraron cambios significativos en la fracción de eyección del ventrículo izquierdo del grupo MICT (51±4,5 vs 52±5,4) y grupo HIIT (45±5,3 vs 49±3,2). Además, los niveles de Vo2 y MET fueron superiores en el GE1 (8,3±3,2 vs 13,1±5,8) y GE2 (8,5±8,3 vs 16,7±5,5) en comparación con el GC (8,9±5,7 vs 8,8±4,0). Al igual, la fatiga asociada al cáncer de mama en el grupo HIIT (20,4±5,6 vs 5,1±3,6) y MICT (18,6±9,5 vs 8,0±4,2). Para el grupo control no hubo mejoría (16,6±5,5 vs 16,9±4,6) (Cuadro 2). Durante los programas de intervención no se presentaron complicaciones ni eventos adversos debidos al entrenamiento físico realizado por las pacientes con cáncer de mama en estadio II.
Discusión
En un estudio realizado por Adamsen et al.,21 con 269 pacientes con cáncer que realizaron ejercicio supervisado, se incluyó entrenamiento cardiovascular y de resistencia de alta intensidad, entrenamiento de relajación y conciencia corporal. Las sesiones tuvieron una duración de 9 horas semanales, durante 6 semanas, donde se determinó que la intervención redujo la fatiga y mejoró la vitalidad, capacidad aeróbica, fuerza muscular, actividad física y el bienestar emocional, pero no la calidad de vida. Al igual, Heinrich et al.22 investigaron la viabilidad y la eficacia de un programa de ejercicios en grupo de entrenamiento funcional de alta intensidad (HIFT) en 8 adultos sobrevivientes de cáncer, dentro de los 5 años del último tratamiento. Los hallazgos mostraron que hubo mejoras significativas para el estado emocional (p= 0,042) y la composición corporal (masa magra p= 0,008; masa grasa p= 0,001; porcentaje de grasa corporal p<0,001). Los participantes, también mejoraron significativamente en cinco de los siete movimientos funcionales: equilibrio (p= 0,032), portando un objeto ponderado (p= 0,004), fuerza y potencia de la parte inferior del cuerpo (p= 0,009), capacidad aeróbica y resistencia (p= 0,039), y flexibilidad (p= 0,012). Estos datos coinciden con nuestros resultados donde el HIIT mejoró todos los valores frente al MCIT y el grupo control.
Por otro lado, Schmitt et al.23 compararon los efectos de una rehabilitación multimodal de 3 semanas que incluye entrenamiento supervisado por intervalos de alta intensidad (HIIT) en mujeres sobrevivientes de cáncer de mama con respecto a variables clave de acondicionamiento aeróbico, composición corporal, gasto de energía, fatiga relacionada con el cáncer y calidad de vida. Schulz et al.24 evaluaron la viabilidad de una intervención de ejercicio que consiste en resistencia a intervalos de alta intensidad y entrenamiento de fuerza en 26 mujeres con cáncer de mama no metastásico. Se mostró una mejora en el pico de VO2 (12,0 ± 13,0 %) y el rendimiento de la fuerza (25,9 ± 11,2 %), al igual que en la presente investigación y en la de Schulz et al.
Mijwel et al 25 compararon los efectos de la resistencia y el entrenamiento en intervalos de alta intensidad (RT - HIIT), y el entrenamiento aeróbico de intensidad moderada y el entrenamiento en intervalos de alta intensidad (AT - HIIT), con la atención habitual en 240 mujeres con cáncer de mama sometidas a quimioterapia; este programa de ejercicios constó de 16 semanas de entrenamiento de resistencia y HIIT. Los hallazgos determinaron que el grupo RT - HIIT tuvo mejoraría sobre la capacidad funcional (p= 0,02) y las actividades de la vida diaria (p= 0,01). El grupo de AT-HIIT mejoró significativamente el funcionamiento emocional (p= 0,01) y los síntomas del dolor (p = 0,03). Sin embargo, el grupo de RT-HIIT mostró una disminución de síntomas, mientras que AT - HIIT se mantuvo estable (p<0,01), lo que sugiere que las implicaciones del entrenamiento de la resistencia, al igual que en nuestro estudio, mejorarían los valores determinantes de la capacidad aeróbica y funcional en los pacientes con CA de mama. Otros estudios actuales7,26 han demostrado los beneficios del entrenamiento interválico de alta intensidad con ejercicio de resistencia o fuerza en pacientes con cáncer de mama.
Ahora bien, los diferentes hallazgos expresados en la presente investigación también concuerdan claramente con el National Comprehensive Cancer Network Guidelines, que señala que el ejercicio es uno de los tratamientos no farmacológicos más efectivos para la fatiga asociada al cáncer. Sin embargo, la inclusión de programas de ejercicio en las guías actuales de rehabilitación oncológica todavía no es estándar. Nuestros resultados indican claramente que esto debe considerarse. Esto concuerda con los resultados de publicaciones de los países bajos,27 Asia,28,29 India,30 China31 y otros.32-39
Conclusiones
El entrenamiento HIIT se mostró seguro y beneficioso para las mujeres con cáncer de mama en estadio II. Mejoró la tolerancia al ejercicio, la fuerza, vo2, MET, y sobre todo, la fatiga asociada al cáncer y la calidad de vida de las pacientes. De hecho, fue posible demostrar mayores beneficios en las pacientes que recibieron HIIT en comparación con el grupo MICT y el grupo control. No obstante, el grupo de entrenamiento MICT también presentó diferencias significativas en todas las variables evaluadas. El grupo control de atención habitual sin entrenamiento físico ni ejercicio supervisado no presentó cambios significativos ni mejoras en la fatiga asociada al cáncer de mama.