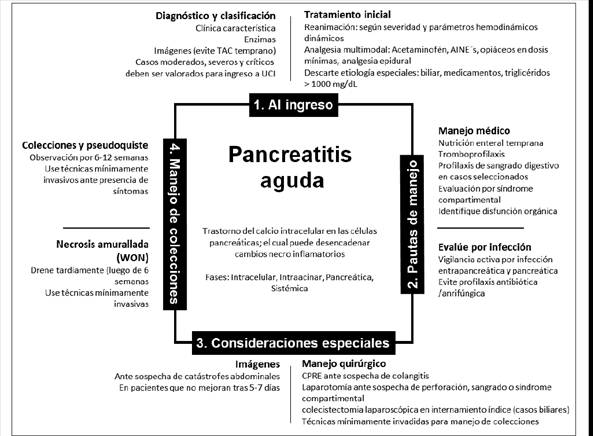
La pancreatitis aguda es un trastorno intracelular del calcio en las células pancreáticas, que puede desencadenar cambios necroinflamatorios y complicaciones locales y sistémicas.1
En los Estados Unidos es la causa número 21 de ingreso hospitalario y la principal causa de ingreso por motivo gastrointestinal (13 a 45 casos por 100 000 habitantes).1 Cada año ocurren en ese país más de 250 mil casos y cerca de 3 mil fatalidades, con costos de hospitalización que superan los 2,5 billones de dólares.2
La mortalidad en los casos leves oscila en cerca del 1 % y llega al 35 % en los casos severos. Ante la presencia de síndrome compartimental abdominal, las fatalidades pueden llegar al 49 %.3,4
Según el Colegio Americano de Gastroenterología, el diagnóstico de la pancreatitis aguda se basa en la presencia de 2 de 3 de los siguientes criterios: (i) dolor abdominal consistente con la enfermedad, (ii) amilasa o lipasa séricas mayores de 3 veces el límite superior normal, (iii) hallazgos característicos en los estudios de imagen.5
La realización de US de abdomen se recomienda para todos los pacientes, ya que permite diferenciar entre etiología biliar y no biliar, orienta ante la presencia de dilatación de la vía biliar o sospecha de colangitis, y en pacientes mayores de 40 años, evaluar la posibilidad de neoplasia pancreática. La tomografía de abdomen contrastada o imágenes de resonancia magnética se debe reservar para los pacientes con diagnóstico no claro -parte de la evaluación de diagnósticos diferenciales que así lo ameriten-, los que no mejoran tras 48-72 horas de admisión hospitalaria, o posteriormente para evaluar complicaciones locales.5,6
Fisiopatología
El calcio es un ion cuya concentración es robustamente regulada en las células pancreáticas.7 La generación de señales citosólicas es un fenómeno con múltiples y complejos eventos que regulan los niveles de calcio libre intracelular. En estado de reposo, las células acinares presentan oscilaciones lentas en los niveles de calcio. En condiciones fisiológicas, la estimulación máxima de estas células por sustancias como la acetilcolina o la colecistocinina, se asocia con aumento en la frecuencia de estas oscilaciones, sin cambios significativos en su amplitud; este aumento de frecuencia desencadena activación de kinasas calcio dependientes como la calmodulina, y llevan a activación de fenómenos exocíticos. En contraste, concentraciones supramáximas de secretagogos se asocian con espigas de calcio de mayor amplitud, las cuales bloquean subsecuentes oscilaciones en el nivel intracelular de calcio e inhiben la secreción de vesículas por distintos mecanismos.8
Con propósitos académicos se distinguen 4 fases de la fisiopatología de la pancreatitis aguda:9
Fase intracelular: debido al aumento desregulado en calcio citosólico por factores tóxicos y estrés celular. Ocurre además lesión del retículo endoplásmico y se ha observado aclaramiento anormal del calcio y disfunción mitocondrial, por lesión del poro de transición de permeabilidad mitocondrial. Todo esto lleva a secreción ductal y acinar anormal, activación intracelular de zimógenos, ruptura de organelas y necrosis.10,11
Fase intra-acinar: la activación de zimógenos por la catepsina B de forma sostenida desencadena estrés oxidativo,12-14 el cual junto con la lesión mitocondrial y el estrés del retículo endoplásmico, favorece mecanismos de necrosis,15,16apoptosis y autofagia.17,18 La lesión acinar se asocia con liberación de DAMPs, activación del inflamosoma9 y activación del NFκB, y una respuesta celular inflamatoria a nivel local que perpetúa la lesión inicial.15
Fase pancreática: la lesión acinar favorece liberación de citoquinas y quimioquinas, desencadenando infiltración pancreática por leucocitos generando un sistema local con retrocontrol positivo, lo que perpetúa la lesión y favorece el desarrollo de complicaciones sistémicas.14
Fase sistémica y síndrome de disfunción orgánica múltiple: la extensión de la respuesta inflamatoria pancreática lleva a anormalidades en la microcirculación peripancreática, trastornos de coagulación, aumento de endotelina, activación plaquetaria, aumento de IL-1β, IL-6, IL-17, IL-22 y factor de necrosis tumoral α, los cuales causan aumento de permeabilidad de la barrera intestinal con translocación bacteriana,19,20además de un desbalance en el microbioma habitual.20,21
La inflamación sistémica asociada con estos cambios fisiopatológicos lleva a compromiso de órganos distantes y es responsable de la disfunción orgánica múltiple.22-24
Se han descrito factores genéticos relacionados con la regulación del calcio, activación de zimógenos y patrones de secreción ductal que favorecen el desarrollo de patología pancreática,25los cuales ante estímulos específicos, se asocian con un mayor riesgo relativo de desarrollo de patología pancreática.26 Las diferentes entidades clínicas asociadas con pancreatitis aguda comparten esta fisiopatología.27
Etiología
Las causas más comunes de pancreatitis aguda van a ser litos o barro biliar en 40 - 50 % de los casos; el alcohol es la segunda causa más frecuente con 20 - 40 %. Causas menos frecuentes incluyen medicamentos, postcolangiopancreatografía retrógrada endoscópica, trauma, cirugía, hipercalcemia e hipertrigliceridemia.3,28
Manejo
Reanimación y manejo de fluidos
En la pancreatitis aguda se describe una importante fuga capilar que puede conducir al paciente a una disminución del volumen circulante efectivo, shock y hemoconcentración.29 La reanimación con líquidos es uno de los pilares fundamentales del manejo inicial y debe tener como meta alcanzar parámetros hemodinámicos óptimos y acordes para la condición clínica del paciente,30 sin embargo, las características vasculares del paciente y las propiedades del fluido administrado van a repercutir en el desenlace.31
Las guías del Colegio Americano de Gastroenterología recomiendan una administración “agresiva” de líquidos en el paciente con pancreatitis aguda con 250-500 mL/h, por las primeras 12-24 horas.5 Estos valores pueden ser altamente peligrosos si se aplican de forma literal y con poco juicio clínico. El término “hidratación agresiva” en los estudios ha significado en promedio 4,5 litros en las primeras 24 horas con un rango de 3,5 a 4,5; la aplicación no juiciosa de las guías podría llevar a cantidades significativamente mayores.28
Con la administración usual de líquidos se ha documentado mayor puntaje de APACHE, necesidad de ventilación mecánica, sepsis, síndrome compartimental abdominal y muerte.32La hemodilución rápida que busca hematocrito < 35 se ha asociado también con mayor porcentaje de sepsis, aparición más temprana de infección, mayor puntaje de APACHE, menor aclaramiento de creatinina y más del doble de mortalidad.33
La administración excesiva de líquidos puede llevar a edema peripancreático con mayor porcentaje de necrosis,31 incremento de presión venosa central con edema renal, aumento de presión venosa renal y elevación el riesgo de lesión renal aguda,34 edema intestinal, ascitis, hipertensión abdominal y síndrome compartimental abdominal; esto empeora el desenlace clínico del paciente y aumenta aún más el riesgo de lesión renal aguda.35 Estas alteraciones comprometen el desempeño ventilatorio y cardiovascular del paciente y perpetúan los mecanismos causales del síndrome compartimental, del síndrome multicompartimental y del síndrome de disfunción orgánica múltiple.4,35
Más que considerar los fluidos como una intervención buena o mala, se les debe utilizar juiciosamente y tener en cuenta que mientras el proceso fisiopatológico continúa activo, el líquido administrado va a fugarse, por lo que empeorará el cuadro y la evolución subsecuente.
La administración de cristaloides debe ser la regla inicial, con preferencia de soluciones balanceadas sobre solución de NaCl al 0,9 %.5 Los pacientes que reciben en las primeras 24 horas más de 4 litros de soluciones, presentan mayor deterioro ventilatorio que los que reciben menor volumen.36
Una estrategia adecuada incluirá uso temprano de solución balanceada, guiado por parámetros hemodinámicos estáticos y dinámicos, con un bolo inicial en los casos leves de 20 cc/ kg y 10 cc/kg en los casos severos, durante la primera hora, seguido de una infusión de 2-3 cc/kg en casos leves y 1-2 cc/ kg en los casos severos.37,38Se puede ser más permisivo en los casos leves dada la fisiopatología del proceso subyacente, pero en los severos se debe procurar administrar menos de 4 L de cristaloides en las primeras 24 horas, siempre asegurando optimización hemodinámica y vigilando gasto urinario, función renal y hematocrito. La presión venosa central no es un parámetro para monitoreo, debido a la gran fuga capilar y la hipoalbuminemia. Se puede utilizar albúmina si la medición inicial en suero es menor a 2 g/dL, o si se desea evitar mayor balance positivo.29
Analgesia
El dolor es frecuentemente el síntoma principal de los pacientes con pancreatitis, por lo que debe ser abordado de forma temprana y agresiva, con evaluación frecuente y analgesia con múltiples medicamentos y modalidades.3 En distintos estudios se han probado acetaminofén, antiinflamatorios no esteroideos y opiáceos, todos con rango aceptable de seguridad, siempre y cuando se individualice según las condiciones del paciente.3 Cabe destacar que con frecuencia se sobreutilizan opiáceos y buscapina de forma inadecuada, mientras que los antiinflamatorios no esteroideos y el acetaminofén se emplean de manera subóptima.39
Se deben alcanzar niveles adecuados de analgesia con múltiples modalidades farmacológicas, incluido el uso de bloqueo epidural en casos moderado y severos.3El bloqueo epidural se ha asociado con disminución de mortalidad,40 menor extensión de la necrosis, control de acidosis, vasodilatación esplácnica y mejora de microcirculación en el lecho peripancreático.41
Clasificación
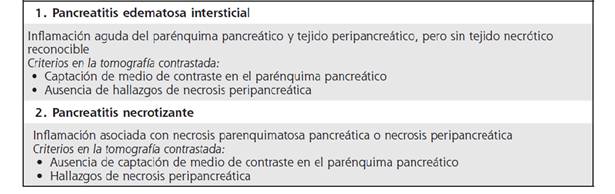
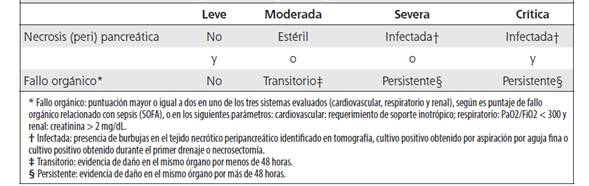
Desde el punto de vista morfológico, la pancreatitis aguda se clasifica en dos tipos: pancreatitis edematosa intersticial y pancreatitis necrotizante (Cuadro 1).6 De acuerdo con severidad, hay 4 categorías de pancreatitis aguda (Cuadro 2).42 La división de los casos de pancreatitis aguda en leves, moderados, severos y críticos, tiene implicaciones pronósticas y de manejo sumamente importantes, ya que la mortalidad asociada con pancreatitis leve oscila alrededor del 1 %, mientras que supera el 35 % en pancreatitis severa y crítica.3 El balance entre factores proinflamatorios / antiinflamatorios y entre lesión por necrosis / apoptosis, es uno de los determinantes de la severidad en un paciente individual.11
Los pacientes que no respondan a la resucitación inicial, los que presenten falla orgánica persistente o complicaciones locales, deben ser transferidos a centros de mayor volumen. Los centros de alto volumen (> 118 casos por año) tienen una mortalidad un 25 % menor.43
Imágenes
El diagnóstico de pancreatitis incluye en sus criterios la presencia de imágenes compatibles con el diagnóstico.5 La clasificación de Atlanta de 1992 define morfológicamente las pancreatitis agudas y las colecciones pancreáticas y peripancreáticas en la tomografía computarizada (Cuadro 1),44 sin embargo, estos estudios rara vez se justifican en los primeros días y su realización tardía se asocia con mejor certeza diagnóstica,45 ya que en los primeros 3-4 días son poco confiables en la detección de la extensión de la necrosis y la presencia de colecciones, por lo que solamente se debe realizar en los casos en que se sospechen catástrofes abdominales (como perforación, sangrado, isquemia), los que presentan abdomen agudo (sin que esto retrase la evaluación quirúrgica), o los que no mejoran tras 5-7 días de inicio de tratamiento.3,46
Evaluación etiológica
Se debe investigar las causas más probables y comunes en el paciente, con el objetivo de individualizar situaciones que requieren manejo particular, como la identificación de litos, la suspensión de medicamentos asociados a pancreatitis aguda o aféresis, en casos de pancreatitis con triglicéridos mayores a mil.47,48
Colangiopancreatografía retrógrada endoscópica
En casos en los cuales se sospecha obstrucción biliar o colangitis, se debe realizar una colangiopancreatografía retrógrada endoscópica (CPRE) con papilotomía, en las primeras 24 horas;49,50sin embargo, no se debe efectuar de rutina en pacientes con pancreatitis leves ni moderadas, ya que se asocia con mayores complicaciones.51 Tampoco en pacientes sin colangitis,52 dado que se puede asociar con mayor morbilidad y su relación riesgo - beneficio no es óptima.53 Una revisión sistemática con 8 estudios de CPRE en pacientes sin colangitis, no evidenció reducción de mortalidad, complicaciones de la pancreatitis ni fallo orgánico, si este procedimiento se hacía de forma temprana.54 En pacientes sin colangitis se puede valorar realizar el procedimiento antes de la colecistectomía laparoscópica si hay alta sospecha de litos en el ducto biliar, o posoperatorio de colecistectomía laparoscópica si se demuestran litos con colangiograma.52
Nutrición
No es necesaria la resolución completa del dolor ni la normalización de los niveles de enzimas pancreáticas para reiniciar dieta, siempre y cuando haya ausencia de dolor severo, náuseas, vómitos e íleo severo.55El deseo del paciente por comer es el mejor predictor de tolerancia oral en pacientes con pancreatitis, y la alimentación, tomando en cuenta este parámetro, se asocia a menor tiempo de ayuno y menor estancia hospitalaria.56
Los pacientes con pancreatitis deben recibir nutrición enteral temprana al ingreso con dieta sólida hipograsa.57 Cerca del 70 % de los pacientes toleran dieta sin necesidad de sonda enteral58 y no hay evidencia de superioridad de la sonda naso-yeyunal sobre la nasogástrica, y esta última funciona hasta en el 80 % de los casos.59,60
El inicio temprano de dieta se asocia con disminución de mortalidad en un 64 % (RR = 0,36, 95 % CI 0,20- 0,65, P= 0,001), así como reducción en un 61 % en la frecuencia de fallo multiorgánico (RR = 0,39, 95 % CI 0,21-0,73, P = 0,003).43,61Cabe aclarar que estos beneficios se pierden si la alimentación se retrasa en más de 48 horas, siendo máximos si se inician en las primeras 24 horas.62,63El papel de la inmunonutrición ha sido ampliamente estudiado en pancreatitis aguda, con resultados discordantes, por lo que de momento no se recomienda de rutina el uso de probióticos, prebióticos, ni elementos traza.64 La suplementación con glutamina se asocia con menor tasa de infección, disfunción orgánica y mortalidad.65
Evaluación ante la sospecha de infección
La mortalidad de los pacientes se modifica significativamente ante la presencia de infección.66
Los pacientes con pancreatitis aguda pueden tener complicaciones infecciosas locales pancreáticas a través de ruta hematógena, ascitis, linfática, biliar y translocación bacteriana desde colon,67 o extrapancreáticas (pulmonares, vías urinarias, vía biliar), así como infecciones sistémicas (bacteremia, fungemia).3 La proporción de pacientes infectados aumenta según el porcentaje de necrosis (< 30, 30-50, > 50).67
Ningún parámetro de laboratorio aislado ni en combinación predice de forma adecuada la infección en un paciente con pancreatitis y característicamente, parámetros utilizados ante sospecha de infección en pacientes sin pancreatitis se alteran en esta patología, tales son los casos de: la fiebre, el hemograma, el leucograma, la proteína C reactiva, la procalcitonina, la eritrosedimentación, etc.68
En el paciente con pancreatitis aguda, ante la sospecha de infección, en la primera semana se debe buscar causas extrapancreáticas de infección y valorar el uso de antibióticos, según los hallazgos clínicos y la epidemiología local. Si esto ocurre entre la segunda y tercera semana, se debe abordar además de las causas extrapancreáticas, la posibilidad de infecciones pancreáticas asociadas.3
Las infecciones pancreáticas se desarrollan con una media de 26 días, típicamente por gérmenes nosocomiales. La exposición previa a antibióticos predispone a gérmenes multirresistentes y su uso sin un adecuado control de foco (por ejemplo: drenaje endoscópico o percutáneo) puede ser inefectivo.31 Se debe considerar la infección del tejido necrótico en pacientes con necrosis pancreática o extrapancreática que se deterioran clínica y hemodinámicamente, o que no mejoran tras 7 - 10 días de hospitalización. Se puede administrar antibióticos de forma empírica ante alta sospecha de infección clínica o por imágenes (la presencia de aire a nivel tomográfico correlaciona con la presencia de infección), o tras la toma de muestra para cultivo con aguja fina guiada por tomografía. Este abordaje se puede reservar para los pacientes que no mejoran tras tratamiento empírico, ya que el uso de carbapenémicos, quinolonas y metronidazol puede ser útil en retrasar o incluso evitar intervenciones, con lo que disminuyen la mortalidad y morbilidad asociadas.69 No se recomienda la administración de profilaxis antibiótica o antifúngica.69,70
Complicaciones
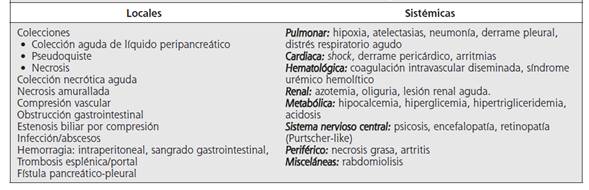
Múltiples complicaciones locales o sistémicas se pueden presentar en los pacientes con pancreatitis aguda (Cuadro 3), por lo que se debe mantener un alto índice de sospecha. La medición de la presión intraabdominal es mandatoria en los casos severos y ante la presencia de disfunción orgánica, ya que el síndrome compartimental abdominal se asocia con mortalidad cercana al 50 % y obliga a realizar manejo agresivo de esta patología, tanto con medidas médicas como quirúrgicas.4
Manejo quirúrgico
La realización de necrosectomía abierta se asocia con alta morbilidad (fístulas, diabetes, insuficiencia pancreática exocrina, hernias de pared abdominal en el 34 - 95 % de los casos) y mortalidad de hasta el 25 % en centros especializados (más alta cuando se realiza de forma más temprana).71,72Un estudio local reveló que la realización de colecistectomía requirió múltiples intervenciones quirúrgicas (en promedio 6,3), así como largas estancias en cuidado intensivo y hospitales (26,6 y 47,5 días, respectivamente). La fístula pancreática y los abscesos postoperatorios se detectaron en el 53,6 % de los casos y la mortalidad fue del 35,7 %, siendo la perforación intestinal la principal condición de riesgo.73Por todo esto, se deja la realización de necrosectomía abierta como la última opción terapéutica.72
Las técnicas menos invasivas permiten el drenaje con catéteres seguido de métodos de necrosectomía mínimamente invasivos (asistida por video) y se asocian con disminución de mortalidad, fallo multiorgánico, lesiones de pared abdominal, diabetes, insuficiencia pancreática exocrina, necesidad de terapia intensiva, días en cuidado intensivo y días de hospitalización.74 Sin embargo, críticos de estas técnicas señalan que con frecuencia se requieren varias intervenciones,43 aunque esto no es exclusivo de las técnicas endoscópicas y más bien se asocian con menor número de intervenciones.74,75
Las técnicas endoscópicas se perfilan como el estándar de oro para manejo de las complicaciones locales de los pacientes con pancreatitis aguda.75,76Aunque no se asocien a menor mortalidad que las técnicas percutáneas,77 las técnicas endoscópicas tienen mayor tasa de éxito, menor recurrencia, necesidad de reintervención y estancia hospitalaria.76 Actualmente se están utilizando varias técnicas de drenaje endoscópico como los stents o catéteres entre la colección y la cavidad gástrica, así como necrosectomía endoscópica directa.78Es necesario para el abordaje endoscópico, que la lesión sea mayor a 3 cm de diámetro, que tenga una pared madura (> 4 mm) y que esté a menos de 10 cm de proximidad de la luz gastrointestinal.1Hay estudios en curso para evaluar cuál aproximación se asocia con menores complicaciones.79
Respecto a la colecistectomía en los casos de pancreatitis biliar, una revisión sistemática de 9 estudios con 998 pacientes con pancreatitis biliar, demostró que la colecistectomía temprana (en el mismo internamiento) se asocia con menor incidencia de admisiones recurrentes por pancreatitis, colecistitis y cólico biliar,69,80con reportes de estas complicaciones hasta en el 25 - 30 % de los pacientes.81 La realización de este procedimiento no se asoció con mayores complicaciones transoperatorias, conversión a colecistectomía abierta o mortalidad.80 Se debe realizar tras la recuperación en todos los pacientes con pancreatitis biliar, incluidos aquellos a los que se les realizó esfinterotomía endoscópica durante la hospitalización, en los casos leves en los primeros 7 días, y en los de mayor severidad o complicaciones locales, cuando se encontraran estables.82,83
El manejo de la pancreatitis aguda requiere un conocimiento adecuado del fenómeno clínico y fisiopatológico subyacente del paciente. La evaluación secuencial, el diagnóstico adecuado y el tratamiento óptimo y oportuno favorecen un adecuado desenlace clínico y se asocian con menor desarrollo de complicaciones, morbilidad y mortalidad.
Conflicto de interés: no hay conflicto de interés económico o académico asociado a esta publicación.pabloalvarez83@gmail.com.