La diabetes es un problema creciente de salud pública en todo el mundo con altos riesgos de complicaciones microvasculares y macrovasculares graves. La nefropatía diabética se encuentra entre las complicaciones crónicas de la diabetes, representa el 30-47% de los casos de enfermedad renal crónica.1
Los factores de riesgo conocidos para nefropatía diabética incluyen hiperglucemia crónica, hipertensión, dislipidemia, tabaquismo y obesidad, así como predisposiciones étnicas, familiares y genéticas.2 Uno de los cambios iniciales de la nefropatía diabética es la hiperfiltración, la cual surge debido a vasodilatación en la arteriola aferente (incrementando la fracción de filtración de glucosa) y aumento en la presión intraglomerular. Las prevalencias reportadas de hiperfiltración en el riñón entero varían enormemente entre un 6% y un 73% en los pacientes con diabetes tipo 2.3 Por consiguiente, la TFG estimada se incrementa en cerca de un 16% en los pacientes recientemente diagnosticados con DM tipo 2.3
La hiperfiltración precede a la albuminuria en las etapas iniciales de esta entidad, caracterizada por menores cantidades de proteinuria o microalbuminuria (excreción de 30-299 mg de albuminuria en 24 horas), y si no se controla, progresa a una proteinuria mayor a 300 mg en 24 horas (macroalbuminuria),1 y por ende, la disminución de la función renal, con predisposición al daño progresivo por el aumento de la presión hidráulica glomerular. La proteinuria también se considera un marcador muy sensible de la progresión de la enfermedad renal.2 Debido a lo expuesto es de suma importancia el énfasis sobre complicaciones microvasculares por patología diabética, en especial la nefropatía diabética.
El objetivo de este artículo es que el lector tenga claros los efectos beneficiosos en la función renal de los antihiperglicemiantes, y queden establecidas las recomendaciones sobre el uso o no uso de los medicamentos basados en las diferentes categorías de la tasa de filtración glomerular estimada, y también sobre la utilización de las dosis establecidas, reducción o suspensión del medicamento a partir de las diferentes categorías de la tasa de filtración glomerular estimada.
Formas de estimar la función renal:
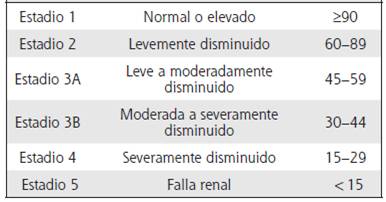
Debido a la afectación renal como una consecuencia de la diabetes mellitus tipo 2, siempre es importante valorar y estimar la tasa de filtración glomerular, ya que se considera el mejor marcador de la función renal, para establecer la etapa de enfermedad renal según categorías de la tasa de filtración glomerular estimada en los pacientes con nefropatía diabética. En la actualidad se utilizan principalmente las fórmulas de modificación de la dieta en enfermedad renal (MDRD), la Colaboración Epidemiológica en Enfermedades Renales Crónicas (CKD-EPI).4-6 (Cuadro1)
Cuadro 1 Estadios de enfermedad renal con base en categorías de tasa de filtración glomerular estimada
Metformina
El mecanismo de acción de la metformina es principalmente activación del AMP-kinasa, que genera una disminución en la producción de la glucosa a nivel hepático.7 La metformina se elimina por los riñones, en su mayor parte sin metabolizar, mediante un proceso tubular. Un 10% de la dosis es excretada en las heces, mientras alrededor del 90% se elimina en la orina.8
En el estudio UKPDS, el cual consistía en la comparación de la terapia intensiva de la glicemia y la terapia estándar sobre la glicemia, mostró, entre lo relevante para esta revisión, que los niveles de creatinina fueron menores con el manejo de la terapia estándar basada en la metformina con respecto a la terapia intensiva. Además, se evidenció una reducción significativa en la relación creatinina/albumina asociada a la terapia intensiva de la glicemia.9
La FDA en 2016 brinda un comunicado sobre las actualizaciones relativas al uso de metformina a nivel de la función renal: La metformina está contraindicada para los pacientes con TFG estimada por debajo de los 30 ml/minuto/1,73 m2.10-11
No se recomienda iniciar un tratamiento con metformina en pacientes con una TFG estimada entre 30 y 45 ml/min/1,73 m2 y se debe reducir la mitad de la dosis en pacientes que previamente la utilizaban y toleraban.7-8En pacientes con niveles de TFG estimada mayor a 45 ml/min/1,73m2, se usa con las recomendaciones usuales y la obtención de una TFG estimada, por lo menos una vez al año con el uso de metformina.
En los pacientes que toman metformina y cuya TFG estimada más adelante cae por debajo de los 45 ml/minuto/1,73 m,2 conviene evaluar las ventajas y los riesgos de continuar el tratamiento. Se debe suspender el uso de la metformina si más adelante la TFG estimada del paciente cae por debajo de los 30 ml/minuto/1,73 m2.
También se debe suspender el uso de la metformina al momento o antes de un procedimiento con medio de contraste yodado, en pacientes con una TFG estimada entre 30 y 60 ml/minuto/1,73 m2 en pacientes con un historial de enfermedades hepáticas, alcoholismo o descompensación aguda de insuficiencia cardíaca crónica, o en pacientes a quienes se les administrará un medio de contraste yodado intravenoso. Es preciso evaluar de nuevo la TFG estimada 48 horas después del procedimiento, y reiniciar el tratamiento con metformina si la función renal es estable.
Sulfonilureas
Estos medicamentos actúan en el cierre de canales de potasio dependientes de ATP en la célula beta, estimulando la secreción de insulina.12 Con respecto a la farmacocinética, se unen extensamente a las proteínas plasmáticas (> 90%) y son metabolizadas en el hígado y eliminadas en la orina y las heces.
El estudio ADVANCE comparó el tratamiento intensivo basado en glicazida MR y la terapia convencional, y sus repercusiones a nivel cardiovascular; uno de los desenlaces que se determinó fueron los eventos microvasculares, específicamente la nefropatía de aparición reciente o empeoramiento de la nefropatía ya establecida, y esto involucra macroalbuminuria, duplicación de creatinina, terapia de reemplazo renal o muerte por enfermedad renal. Entre los resultados se obtuvo que, con respecto a las comparaciones de la terapia estándar con la intensiva, en esta se evidenció una reducción significativa en los eventos renales, que incluían nefropatía reciente o empeoramiento, y microalbuminuria.13
El desenlace que más claramente se redujo con el control intensivo de la glucosa fue el desarrollo de macroalbuminuria, con una tendencia a la reducción de la necesidad de terapia de reemplazo renal o muerte por causas renales, pero sin efecto sobre la duplicación del nivel de creatinina sérica.13 El principal contribuyente a la reducción relativa del 10% en el resultado primario encontrado con un control intensivo en comparación con el control estándar fue una reducción relativa del 21% en el riesgo de nefropatía nueva o empeoramiento de esta. El control intensivo de la glucosa en el ensayo ADVANCE dio como resultado una reducción en el desarrollo de una nueva o empeoramiento de la nefropatía y una reducción más modesta, aunque significativa en el desarrollo de microalbuminuria.13
De las sulfonilureas de segunda generación (glipizida, glibenclamida y glimepirida), la glipizida no tiene metabolitos activos y no aumenta el riesgo de hipoglucemia en pacientes con enfermedad renal crónica.14
La glibenclamida es ampliamente metabolizada en el hígado en varios metabolitos activos que son excretados por el riñón y no se recomienda para uso en insuficiencia renal crónica por diabetes. La glimepirida se asocia con menos hipoglucemia cuando se compara con la glibenclamida. Dado que la tasa de hipoglicemia en insuficiencia renal es mayor, se debe reducir la mitad de la dosis que se esté administrando y titular de manera conservadora si se usa.3 Se recomienda reducir la dosis a la mitad para evitar el riesgo de hipoglicemias en estadios más avanzados.3
La diferencia observada en el riesgo de hipoglicemias entre glicazida y glimepirida puede explicarse por las propiedades farmacocinéticas entre ambas. En primer lugar, los dos fármacos muestran diferentes perfiles farmacocinéticos con la aparición de un metabolito activo eliminado por el riñón para la glimepirida, y ningún metabolito activo circulante de gliclazida MR, compatible con la menor incidencia de hipoglicemias en pacientes con insuficiencia renal con este último agente.15
La glipizida es metabolizada por el hígado en varios metabolitos inactivos, y su eliminación y semivida de eliminación no se ven afectadas por una reducción en TFG estimada, consecuencia, los ajustes de dosis en enfermedad renal crónica no son necesarios con glipizida, lo que la convierte en la sulfonilurea por elegir en esta población.3
Inhibidores de dipeptidilpeptidasa-4:
Sobre el mecanismo de acción inhibe la enzima dipeptidil péptidasa 4, lo cual incrementa la acción de la hormona incretina, principalmente el péptido similar al glucagón 1 (GLP- 1), estimula la secreción de insulina y produce una disminución en la secreción de glucagón, mejorando el control glicémico.30 Entre los fármacos se encuentran: saxagliptina, sitagliptina, alogliptina, linagliptina y vildagliptina.
Saxagliptina
Aproximadamente el 50% de una dosis administrada se metaboliza por CYP3A4 a 5-hidroxi saxagliptina, que tiene cerca del 50% del efecto glucémico de la propia saxagliptina.16
En el estudio SAVOR-TIMI, el tratamiento con saxagliptina mejoró la relación albumina/creatinina, incluso en el rango normoalbuminúrico, sin afectar la TFG estimada. El efecto beneficioso de la saxagliptina en la albuminuria podría no explicarse por su efecto sobre el control glucémico.17
Con respecto a la seguridad renal no hubo diferencias significativas en los resultados entre saxagliptina y placebo, en relación con el desenlace primario (duplicación de creatinina, inicio de diálisis, transplante renal, o creatinina sérica mayor a 6 mg/dl).18 En cuanto al uso de saxagliptina, se recomienda la mitad de la dosis habitual (2,5 mg una vez al día) para pacientes con insuficiencia renal moderada (TFG estimada 30-50 ml/ min/1,73m2) o grave (TFG estimada <30 ml/ min/1,73m2).
Alogliptina
La cantidad de alogliptina excretada en la orina es del 63%. Esto conduce a una acumulación de fármacos con insuficiencia renal que se aproxima a la sitagliptina.7
Un estudio del uso de alogliptina con pacientes con diabetes tipo 2 con insuficiencia renal en estadios 3, 4 y 5, demostró que el tratamiento resultó en una reducción significativa de la relación albumina/creatinina.19
Con base en los hallazgos farmacocinéticos, en lugar de 25 mg una vez al día, se tuvo que administrar 12,5 mg o 6,25 mg en sujetos con enfermedad renal crónica en estadios 3A y 3B (aclaramiento de creatinina ≥30 a ≤60 ml / min) o estadios 4-5, respectivamente.19
Linagliptina
La linagliptina se excreta en principio por vía fecal,7 con el 84,7% de una dosis administrada oralmente, de 10 mg que se eliminan a través de la bilis y el intestino, y el 5,4% se excreta en la orina,20 lo que permite su uso sin ajuste de dosis en cualquier etapa de insuficiencia renal.19
La linagliptina demostró reducción de la relación albúmina/cretinina.19 El tratamiento con linagliptina se asoció con un descenso ligeramente menor en TFG estimada en comparación con el placebo.19 Un estudio, llamado CARMELINA, se encuentra en marcha sobre la acción de nefroprotección de la linagliptina.
Sitagliptina
En cuanto a la farmacocinética de sitagliptina, se excreta predominantemente por vía renal como fármaco inalterado.7
Uno de los subanálisis del estudio TECOS con respecto al efecto en relación albuminuria/creatinina documentó reducción de la microalbuminuria de los pacientes tratados con sitagliptina.21
La sitagliptina comparada con otros antidiabéticos orales, generó una disminución significativa en la relación albúmina/creatinina, incluso en pacientes que presentaron normoalbuminuria, con un claro papel de prevención hacia una de las categorías como microalbuminuria, lo que sugiere efectos beneficiosos en el estadio temprano de la nefropatía diabética.19
La sitagliptina demostró tener un efecto neutro sobre la tasa de filtración glomerular estimada.21 Los pacientes con insuficiencia renal moderada (TFG estimada 30-50 ml/ min/1,73 m2) deben recibir 50 mg diarios; los que tienen insuficiencia renal grave (EGFR estimada menor a 30 ml/min/1,73m2) o enfermedad renal crónica terminal en hemodiálisis, deben recibir 25 mg al día.
Vildagliptina
La eliminación renal de la vildagliptina inalterada es solo del 23% de la dosis administrada y el metabolismo mediado por el citocromo P450 es mínimo.7
En un ensayo de 24 semanas con el uso de 50 mg al día de vildagliptina en pacientes con DM tipo 2 e insuficiencia renal moderada o severa, demostró después de 24 semanas de terapia una reducción del 0,5% de hemoglobina glicosilada con el uso de vildagliptina, y pacientes con insuficiencia renal severa presentaron una reducción del 0,6% de hemoglobina glicosilada con vildagliptina. El uso de vildagliptina evidenció una mejoría en el control glicémico en pacientes con enfermedad renal moderada y severa.22
Cuadro 2 Utilización de los diferentes grupos de antihiperglicemiantes en relación con la dosis en las distintas etapas de enfermedad renal crónica por diabetes mellitus tipo 2
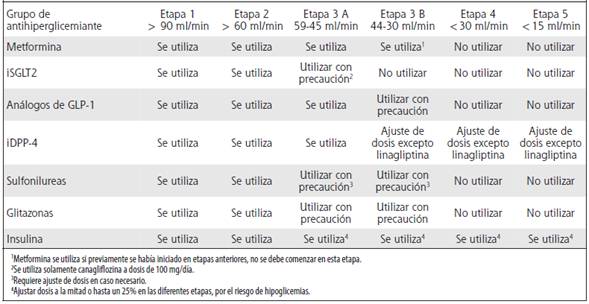
En conclusión, los IDPP-4 especialmente saxagliptina, sitagliptina, alogliptina, linagliptina y vildagliptina, demostraron una reducción en la relación albúmina/creatinina, sin cambios significativos en la tasa de filtración glomerular en comparación con el placebo. Los inhibidores de la DPP-4, excepto la linagliptina, son excretados por los riñones; por lo tanto, para los pacientes con disfunción renal se recomienda ajuste de dosis.31 Con base en los niveles de tasa de filtración glomerular, se recomienda reducir la dosis en estadios de insuficiencia renal de 3A y 3B, y en enfermedad renal terminal desde un 50% a un 25% de la dosis con la que se inicia el tratamiento de base.
Análogos del péptido similar a glucagón tipo 1:
Con respecto al mecanismo de acción de este grupo de antihiperglicemiantes, se activan los receptores de GLP-1,39 estimulando la secreción de insulina, disminuyendo la secreción de glucagón, enlenteciendo el vaciado gástrico y aumentando la saciedad en el paciente. Se mencionan fármacos como: liraglutide, semaglutide y exenatide.
Liraglutide
En un estudio, los pacientes que recibieron como tratamiento liraglutide por 12 semanas, con un desenlace primario establecido sobre cambios de la tasa de excreción de albúmina urinaria, se demostró una reducción de este parámetro. Con respecto a la tasa de filtración glomerular, no hubo cambios significativos entre liraglutide y el placebo.23-24
En el estudio LEADER, los análisis de subgrupos sugieren un mayor beneficio de liraglutide con respecto al resultado primario en pacientes con una TFG estimada menor de 60 ml/ min/1,73 m2, posiblemente en pacientes con antecedentes de enfermedad cardiovascular, al igual que hubo un menor riesgo de progresión a macroalbuminuria.24
En cuanto al componente del desenlace renal en el estudio LEADER en pacientes con diabetes mellitus tipo 2 que incluia inicio persistente de macroalbuminuria, doblamiento persistente de los niveles de creatinina, TFG estimada de 45 o menos ml/min/1,73m2, necesidad de terapia de reeemplazo renal y mortalidad por enfermedad renal se demostró una reducción con el uso de liraglutide.25
En el subgrupo de pacientes con una TFG estimada menor a 60ml/min/1,73m2, se demostró una reducción en el desenlace renal con liraglutide. En el subgrupo de pacientes con una TFG estimada menos de 60 ml/min/1,73m2 y con presencia de micro o macroalbuminuria, también se demostró una reducción en el desenlace renal con liraglutide. Con respecto a la función renal a lo largo del tiempo, en la TFG estimada a 36 meses no hubo una reducción significativa entre liraglutide y el placebo. El incremento estimado en la relación albúmina/creatinina fue menor con liraglutide. En conclusión, se demostró que liraglutide disminuyó el desarrollo y progresión de nefropatía diabética en comparación con el placebo.25
LIRA RENAL es un estudio clínicamente relevante, ya que no mostró empeoramiento de la función renal en los pacientes tratados con liraglutide; la relación albúmina/creatinina fue un 17% menor con liraglutide comparada con el placebo, aunque no fue estadísticamente significativa.26
Semaglutide
Los resultados de un estudio demuestran que en insuficiencia renal moderada o leve, o en sujetos con enfermedad renal crónica, la exposición de semaglutide está dentro de los límites de no efectos, en comparación con el grupo de función renal normal.27 Las propiedades farmacocinéticas del semaglutide no se ven afectadas significativamente por la función renal.27 En el estudio SUSTAIN-6 se demostró una reducción en las tasas de nefropatía nueva o empeoramiento con el uso de semaglutide.28
Exenatide
Es excretado por los riñones y su aclaramiento se reduce un 36% con una TFG estimada de 45 ml/min/1,73 m2 y un 64% con una TFG estimada de 30 ml/min/1,73m.2 Además, exenatide se ha asociado con lesión renal aguda o aceleración de la progresión de la enfermedad renal crónica en reportes de casos.28 Exenatide no debe usarse con una TFG estimada menor a 30 ml/min/1,73m2.21
Recomendaciones del uso de agonistas de GLP-1 en insuficiencia renal: Liraglutide y semaglutide demostraron un efecto beneficioso sobre riñón con menos progresión de albuminuria y menos aparición de casos nuevos de microalbuminuria. Con respecto al uso liraglutide y semaglutide en insuficiencia renal, son recomendados en estadios 1, 2 y 3 A, por lo que no requieren ajuste de dosis. Se recomienda utilizarlo con precaución en estadio 3B, sin embargo, hubo beneficios en pacientes con enfermedad cardiovascular establecida en insuficiencia renal. No se recomienda utilizarlos en estadios más avanzados en 4 y 5 en especial exenatide.
Cuadro 3 Efectos y acciones de los antihiperglicemiantes sobre la función renal en pacientes con diabetes mellitus tipo 2

Inhibidores del cotransportador de sodio-glucosa tipo 2:
Con respecto al mecanismo de acción, los inhibidores del cotransportador de sodio-glucosa tipo 2 reducen las tasas de hiperglucemia en pacientes con diabetes tipo 2, disminuyendo la reabsorción renal de glucosa y aumentando de este modo la excreción urinaria de glucosa y sodio.22
En cuanto al mecanismo de nefroprotección de los iSGLT2, se aumenta la excreción urinaria de sodio y glucosa en el túbulo proximal, por lo que hay un efecto hemodinámico y metabólico en el riñón. A nivel hemodinámico, el efecto natriurético aumenta la retroalimentación túbulo-glomerular, incrementando la disponibilidad de sodio hacia la mácula densa generada por los fármacos; como consecuencia, produce vasoconstricción de la arteriola aferente, contribuye a la reducción de la hipertensión intraglomerular y de la hiperfiltración glomerular, y el efecto diurético genera disminución de la presión arterial sistémica y del volumen plasmático.
Este grupo de fármacos genera al inicio una disminución en la TFG estimada, pero vuelve a la normalidad y se mantiene a largo plazo con el uso de iSGLT2. Las cifras de la función renal mejoraron significativamente, lo que indica que los cambios hemodinámicos glomerulares se invirtieron incluso después de un tratamiento a largo plazo.29
También se cree que los efectos favorables de iSGLT2 sobre las vías neurohormonales sistémicas y renales, la rigidez arterial, la resistencia vascular y los niveles séricos de ácido úrico, contribuyen a una reducción significativa en la progresión de la enfermedad renal durante el tratamiento de pacientes con DM2.29 El mecanismo vasomodulador del bloqueo del sistema renina angiotensina, genera una disminución de la tasa de filtración glomerular en un corto plazo, acompañada por un pequeño declive en la función renal durante el tratamiento, como el visto por el efecto de los iSGLT2.
Empagliflozina
En un estudio acerca de la farmacocinética con el uso de empagliflozina en pacientes con diabetes mellitus tipo 2 demostró un aclaramiento renal durante 72 horas se demostró una variación de la TFG estimada de 32,1 a 51,3 ml/min/1,73 m2.30
Empagliflozina proporcionó reducciones significativas de micro y macroalbuminuria y fue atribuible a las reducciones de HbA1c, peso corporal y la presión arterial sistólica. El hecho de que la inhibición del cotransportador SGLT2 esté también asociada con pequeñas disminuciones en TFG estimada durante las primeras 3-4 semanas de tratamiento, sugiere que las reducciones en la presión intraglomerular con estos agentes pueden contribuir además a los efectos de disminución de la albuminuria.30
En el subestudio de EMPAREG a nivel renal, el cual tenía como objetivo determinar los resultados sobre un desenlace primario que incluía nefropatía incidente o progresión de esta, con variables como progresión a la macroalbuminuria, duplicación del nivel de creatinina sérica, inicio de la terapia de reemplazo renal o muerte por enfermedad renal y albuminuria incidente con respecto a la comparación del tratamiento con empagliflozina y placebo.,31 la empagliflozina no previno la incidencia de albuminuria a pesar de la evidencia previa de que el fármaco disminuye la presión intraglomerular.31 La empagliflozina demostró una reducción significativa en la incidencia de nefropatía o su empeoramiento, en la duplicación de cretinina.31 También se demostró una reducción significativa en la progresión a macroalbuminuria.
La empagliflozina fue más eficaz en la reducción de la hemoglobina glicosilada en los pacientes con diabetes mellitus tipo 2 en estadio 2, que en estadio 3 en enfermedad renal crónica, mientras que en estadio 4 fue del todo ineficaz.31-32 En relación con el uso de empagliflozina en pacientes con diabetes mellitus tipo 2 e insuficiencia renal crónica, se recomienda en TFG estimada mayor a 60 ml/min/1,73m2, se utiliza con precaución en TFG estimada mayor a 45 ml/min/1,73m2, y menor a 60 ml/min/1,73m2, a dosis de 10 mg/día; no se recomienda en menos de 45 ml/min/1,73 m.2
En conclusión, con el uso de empagliflozina en enfermedad renal crónica hay una gran mejoría en la progresión de la enfermedad renal en diabetes mellitus tipo 2, demostrando también mejoría en presencia de microalbuminuria y de la TFG estimada, a pesar de que al inicio del tratamiento ocurre una disminución en la función renal, sin embargo, a largo plazo se estabilizará, ya que es un proceso muy similar al uso de los bloqueadores del sistema renina angiotensina.33
Canagliflozina
Con respecto a la farmacocinética, la O-glucuronidación es la principal vía metabólica de eliminación de la canagliflozina, que es glucuronizada en su mayor parte por uridina difosfato glucuronosiltransferasa para dar dos metabolitos inactivos O-glucurónidos. Aproximadamente el 33% de la dosis administrada se excretó en la orina, en forma de metabolitos O-glucurónidos.34
El estudio CANVAS-RENAL incluyó pacientes con diabetes mellitus tipo 2 y los puntos importantes por evaluar fueron:
biomarcadores en cambios de albuminuria, progresión de albuminuria (aumento del 30% en la albuminuria y un cambio de la normoalbuminuria a microalbuminuria o macroalbuminuria o de la microalbuminurifja a la macroalbuminuria).35 El componente renal en el estudio comprende reducción de un 40% en TFG estimada, necesidad de terapia de reemplazo renal y mortalidad por causas renales.35 Los análisis de albuminuria se basaron en participantes con progresión o regresión en al menos una oportunidad, con un análisis de sensibilidad realizado para aquellos con evidencia de progresión sostenida o de regresión.35 La progresión a albuminuria ocurrió en menor frecuencia en los pacientes asignados a canagliflozina, y la regresión de albuminuria se produjo con mayor frecuencia en los pacientes asignados a canaglifozina.35 El desenlace renal ocurrió con menos frecuencia en el grupo asignado a canagliflozina.35
En conclusión, el estudio CANVAS-R con base en los resultados, señala que la canagliflozina produce una disminución de la albuminuria, reduce la progresión de la albuminuria, induce regresión de albuminuria y reduce eventos renales. También se determinó la eficacia de canagliflozina en comparación con placebo en los distintos estados de la insuficiencia renal.
En un estudio con pacientes con diabetes tipo 2 en tratamiento con metformina y que fueron asignados a canagliflozina 100 mg, canagliflozina 300 mg o glimepiride a una dosis de 6-8 mg durante 2 años, se analizó si la canagliflozina disminuía la albuminuria y reducía la disminución de la función renal, independientemente de sus efectos glucémicos. 36
En los resultados se demostró una declinacion sobre la TFG estimada con glimepiride de 3,3 ml/min/1,73m2, canagliflozina de 100 mg un 0,5 ml/min/1,73m2 y canagliflozina 300 mg un 0,9 ml/min/1,73m2. Con respecto a la relación albumina/ creatinina mayor a 30 mg/g demostró una reducción con canagliflozina de 100 mg un 31,7% y canagliflozina de 300 mg un 49,3% mayor en comparcion con glimepiride.36
Es importante destacar que la canagliflozina induce una caída temprana de TFG estimada que luego se recupera y vuelve a la normalidad. Debido a lo anterior, la FDA emitió una alerta con la indicación de este efecto.31 El riesgo de disminución de la función renal fue mayor en pacientes que presentan desde un inicio insuficiencia renal moderada y se exacerbó aún más si la canagliflozina se usaba concomitantemente con un diurético de asa, un inhibidor de la enzima convertidora de angiotensina, o un bloqueador del receptor de la angiotensina. Otros parámetros de seguridad renal que acompañaron a la disminución de la TFG estimada, incluyen aumentos desde la línea de base en nitrógeno ureico y creatinina, lo que sugiere un papel causal de contracción de volumen como resultado del efecto diurético de la canagliflozina.37
A pesar de esta observación, el número de eventos adversos a nivel renal y los acontecimientos que llevaron a la interrupción en la población con insuficiencia renal moderada fue baja, y no notablemente diferente entre el placebo y los dos grupos de las dos dosis en el tratamiento con canagliflozina. En consecuencia, el equipo de revisión ha recomendado el uso de canagliflozina en pacientes con insuficiencia renal moderada cuya TFG estimada estaba entre 45 y 60 ml/min/1,73m2 a una dosis de 100 mg. En pacientes con TFG estimada entre 30 a 45 ml/min/1,73m,2 se consideró que el beneficio no superaba el riesgo de eventos adversos relacionados con el volumen, por lo cual no se recomienda el uso de canagliflozina en esta etapa de insuficiencia renal.37
Así, con respecto al uso de la canagliflozina en diabetes mellitus tipo 2 en enfermedad renal crónica, no se recomienda en TFG estimada menor a 45 ml/min/1,73m,2 en TFG estimada mayor a 45 ml/min/1,73m2 y menor a 60 ml/min/1,73m,2 se utiliza dosis de 100 mg. Es importante tener en cuenta el evento adverso del riesgo de hiperkalemia en este último grupo de pacientes.
Dapagliflozina
Con respecto a la farmacocinética, la dapagliflozina es metabolizada por la uridina difosfato glucuronosiltransferasa 1A9 (glucuronidación) en el hígado y el riñón, generando un metabolito inactivo principal: la dapagliflozina 3-O-glucurónido, que se purifica principalmente a través del riñón. La dapagliflozina y su metabolito inactivo se eliminan sobre todo a través del riñón.38
En un análisis del uso de dapagliflozina, se examinó los efectos a largo plazo sobre la relación albúmina/creatinina en pacientes con niveles ≥30 mg/ug y con enfermedad renal crónica en estadio 3.33 Se demostró una reducción significativa de albuminuria por parte de dapagliflozina con dosis de 5 mg y 10 mg, comparado con placebo durante las 104 semanas de tratamiento del análisis, y se demostró una mejoría hacia la normoalbuminuria.33 Hubo una disminución inicial en la TFG estimada dentro de las primeras 4 semanas de tratamiento con dapagliflozina, sin otra disminución a las 104 semanas, con lo cual se normalizaba la TFG estimada.39-40
En los pacientes con TFG estimada de 30-60 ml/min/1,73 m2, la dapagliflozina, además de los tratamientos antidiabéticos existentes, no redujo significativamente la hemoglobina glicosilada en comparación con placebo desde la línea de base hasta las 24 y 104 semanas; placebo disminuyó la hemoglobina glicosilada un 0,32%, dapagliflozina de 5 mg la redujo un 0,41% y dapagliflozina de 10 mg redujo un 0,44%. 40
A partir de la evidencia con la dapagliflozina, se recomienda utilizarla en pacientes con diabetes mellitus tipo 2, con insuficiencia renal en TFG estimada mayor a 60 ml/min/1,73m2.
Tiazolidinedionas
El mecanismo de acción de tiazolidinediona activa la transcripción del factor nuclear de los receptores proliferadores de peroxisomas subtipo gamma; se encuentra en células betas pancreáticas, endotelio vascular y macrófagos,41 mejora la sensibilidad a la insulina en los tejidos periféricos y el hígado.19 En este grupo de fármacos existen pioglitazona y rosiglitazona, sin embargo en este artículo se menciona solamente la pioglitazona, ya que la rosiglitazona se ha retirado a del comercio en varios lugares del mundo.
En la administración oral, aproximadamente el 15-30% de la dosis de pioglitazona se recupera en la orina. La eliminación renal de pioglitazona es insignificante, y el fármaco se excreta sobre todo como metabolitos y sus conjugados. Se presume que la mayor parte de la dosis oral se excreta en la bilis, o bien, sin cambios o como metabolitos, y se elimina en las heces.
El estudio PRESERVACIÓN en la función renal en el uso con pioglitazona o con insulina basal como terapia complementaria para pacientes con diabetes mellitus tipo 2, el cual consistió en la adicción de pioglitazona comparada a análogos de insulina, cuando metformina y sulfonilureas fallaban en el manejo, se encontró varias diferencias, una de ellas en la función renal.42
Los resultados demostraron en esta comparación, que hubo diferencias en el cambio de la función renal entre los grupos, contrario a la disminución significativa de la función renal observada en los grupos detemir y glargina; el grupo pioglitazona permaneció estático en cuanto al cambio de la función renal. Además, el porcentaje de progresión de enfermedad renal crónica en el grupo pioglitazona, grupo detemir y grupo glargina fue del 14,0%, 26,4% y 23,4%, respectivamente. Estos resultados sugieren que puede haber un beneficio potencial del tratamiento con pioglitazona en términos de función renal en comparación con la insulina basal.42 Las tiazolidinedionas se asocian con retención de líquidos y edema, lo que puede limitar su utilidad en pacientes con enfermedad renal crónica, debido a esto debe usarse con precaución en estadios más avanzados de la función renal.3-6
En conclusión, la pioglitazona se cataloga como de eficacia neutra en TFG estimada, debido a su preservación de la función renal.
Insulina
Con respecto al metabolismo de la insulina secretada endógenamente, que es degradada por el hígado, la insulina exógena es eliminada en principio por el riñón.43 La insulina se filtra libremente en el glomérulo, luego se reabsorbe de manera extensa en el túbulo proximal.43 También hay captación y degradación de la insulina por las células epiteliales endoteliales y peritubulares, a medida que progresa la insuficiencia renal, aumenta la captación peritubular de insulina. La vida media de la insulina aumenta y suele haber una disminución de los requerimientos generales de la insulina exógena.43
Debido a que las preparaciones específicas de insulina no han sido bien estudiadas en la enfermedad renal crónica y dado que las necesidades individuales de los pacientes varían sustancialmente, no hay directrices definitivas. Existen ajustes de la dosis de insulina sobre la base de TFG estimada. Es esencial que los niveles de glucosa en la sangre se observen de cerca y que las dosis de insulina se individualicen sobre la base de la respuesta y los patrones glucémicos de cada paciente, con un enfoque consciente de la titulación para minimizar el riesgo de eventos hipoglucémicos en esta población de alto riesgo.44
La nefropatía por diabetes mellitus tipo 2 es la principal causa de insuficiencia renal crónica, por ello es fundamental el uso de terapia eficaz y segura a nivel renal, con un efecto de nefroprotección en este órgano sensible a los efectos nocivos de la hiperglicemia crónica. Diferentes grupos de antidiabéticos han demostrado un impacto beneficioso en la función renal, especialmente en reducción de albuminuria y su progresión, al igual que han mostrado preservación en la TFG estimada, principalmente los inhibidores de la dipeptidil peptidasa 4, inhibidores del cotransportador sodio y glucosa tipo 2 y análogos de la GLP-1, por lo que se recomienda su utilización en insuficiencia renal crónica por nefropatía diabética.
Conflicto de interés: los autores declaran no tener conflictos de intereses y declaran que no hubo financiamiento para el artículo de revisión.
Abreviaturas: TFG, tasa de filtracion glomerular estimada; SGLT2, cotransportador de sodio glucosa tipo 2. navarrojs3@hotmail.com














