La enfermedad de Graves’ es una condición autoimmune caracterizada por hipertiroidismo, bocio, orbitopatía y, en ocasiones, edema pretibial.1 Es causada por anticuerpos estimulantes del receptor de la tirotropina que estimulan la síntesis de hormonas tiroideas. Los pacientes con hipertiroidismo tienen varias opciones de tratamiento.2-3 Las agentes los antitiroideos (AAT) como el metimazol, carbimazole, propiltiuracilo, son efectivos para controlar el hipertirodismo en pacientes con enfermedad de Graves, incluyendo a embarazadas, como terapia inicial para preparar pacientes candidatos a tiroidectomía o radioyodo.1-3 Con ATT la recurrencia es hasta del 60%.2 El radioyodo es una posibilidad terapéutica efectiva y segura en pacientes con enfermedad de Graves.1-2
Los AAT tienen efectos adversos incluyendo: alergias, gastritis, hepatitis y agranulocitosis.1 El propósito de este informe es reportar un caso de un paciente con enfermedad de Graves tratado con propiltiuracilo, quien desarrolló neutropenia después de recibir propiltiuracilo. Se describe la evolución y reversión de las alteraciones hematológicas después de descontinuar este medicamento.
Caso clínico
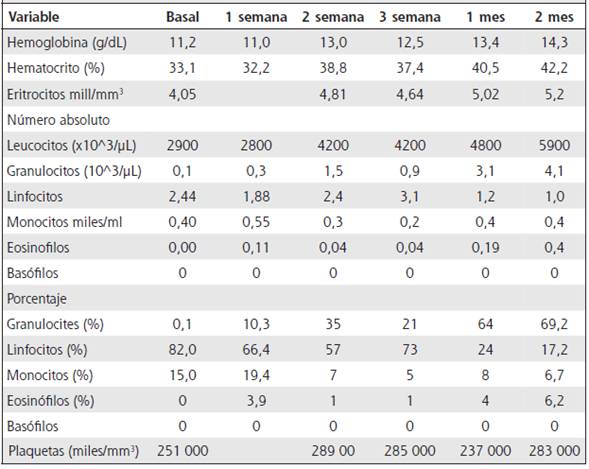
Mujer de 29 años, previamente sana, no expuesta a medicamentos conocidos que pudiesen producir alteraciones hematológicas, presentó cuadro de intolerancia al calor, insomnio, diarrea, palpitaciones y pérdida de peso en julio de 2016. Cuatro meses más tarde, debido al emperoramiento de sus síntomas, fue vista en consulta de Endocrinología. La hormona estimulante de la tiroides (TSH) estaba en 0,01 uUI/ mL (0.4 - 4.0), la tiroxina libre en 0,94 ng/dL (0.7 - 1.48) y T 3 libre en 13,42 pg/mL (2 - 4.4). Se estableció el diagnóstico de hipertiroidismo por enfermedad de Graves, iniciándose el tratamiento con propiltiouracilo (PTU) 150 mg cada 8 horas y propranolol 40 mg al día. Se le indicó, como suele hacerse, que consultara si presentaba odinofagia o fiebre. La paciente evidenció mejoría de los síntomas asociados con el hipertiroidismo. No obstante, dos meses después presentó odinofagia y fiebre. En esa oportunidad fue vista por un médico general a nivel privado, quien prescribió cefalexina, rupatadina por tres días, y le aconsejó consultar al endocrinólogo. La paciente fue vista en un servicio de endocrinología privado una semana después, encontrándose en buen estado general, afebril, sin evidencia de faringitis ni adenopatías. Su peso era de 60 kg, estatura 159 cm, presión arterial sentada 100/80 mmHg, frecuencia cardiaca de 120 latidos/min. Tenía un bocio difuso grado II, sus manos estaban calientes y con ligero tremor, los reflejos osteotendinosos estaban aumentados y presentaba edema pretibial. En ese momento el TSH estaba en 0,001 uIU/mL, la tiroxina libre en 1,59 ng/d y la triiodotironina en 8,24 pg/mL (2-2,4). Las pruebas de función renal y hepática estaban normales. La centillografía de tiroides mostró un bocio difuso mediano, con índice de atrapamiento de tecnecio en el 14,9% (rango normal 0,24% - 3,34%). La paciente fue tratada con betabloqueadores y se programó para tratamiento con radioyodo en un plazo de dos semanas. Sin embargo, la paciente decidió continuar con el PTU a la dosis prescrita previamente, y una semana después de reiniciarlo presentó de nuevo fiebre, odinofagia y cefalea. Se le indicó por teléfono que suspendiera inmediatamente el PTU; se solicitó hemograma completo y fue atendida otra vez. Presentaba hipertiroidismo leve, la presión arterial estaba normal, no había evidencia de faringitis y estaba afebril. El hemograma mostró severa neutropenia y anemia leve (Cuadro 1). La paciente continuó control ambulatorio, indicándole permanecer en su casa, evitar contacto con otras personas y reportar cualquier cambio en su estado general. Dos semanas después recibió 15 mCi of I131. Un mes después del tratamiento con radioyodo la paciente presentó resolución gradual del hipertiroidismo clínico y a los dos meses cursaba hipotiroidismo leve con TSH de 6,87, el cual fue tratado con levotiroxina. Es de notar que se observó normalización del recuento de globulos rojos y de células blancas en forma gradual, en un periodo de dos meses de observación, como se ilustra en el Cuadro 1.
Discusión
Esta paciente con hipertiroidismo por enfermedad de Graves tratada con PTU, presentó dos meses después de iniciado el tratamiento, infección de vías respiratorias altas, y fue evaluada por un médico general quien señaló la posibilidad de que se tratara de un efecto adverso al PTU. Pocos días después de la segunda exposición a este fármaco, presentó recurrencia de los síntomas faríngeos, fiebre, neutropenia severa y anemia leve. En la evolución de esta paciente, se presentó en dos ocasiones separadas manifestaciones clínicas de infección orofaríngea después de haber recibido PTU. En la primera no se realizó hemograma, pero en la segunda, que ocurrió una semana después de la segunda exposición al PTU, se documentó severa neutropenia y anemia. La observación clínica durante las siguientes semanas sin PTU mostró una recuperación gradual de los índices hematológicos, hasta su completa recuperación. Por lo tanto, es altamente probable que las alteraciones hemagológicas que la paciente presentó se asociaran al PTU, similar a reportes previos descritos en la bibliografía científica.4-6
La agranulocitosis se ha reportado en el 0,2% al 0,5% de los pacientes que reciben ATT,5-6y en algunos estudios la agranulocitosis se observó más comúnmente en pacientes mayores expuestos a metimazol a dosis >40 mg/día.6,7 A diferencia del metimazole, el riesgo de agranulocitosis asociada al PTU parece ser dosis dependiente.6-7Sin embargo, en Japón se encontró que la agranulocitosis inducida por tionamida es independiente de la dosis, edad y duración del tratamiento o segunda exposición al medicamento.8
La neutropenia y agranulocitosis inducida por ATT es considerada una reacción idiosincrática. Se han reportado dos mecanismos básicos por los que las drogas causan neutropenia y agranulocitosis. Uno es por destrucción de neutrófilos mediada por anticuerpos inducidos por los ATT y, otro, vinculado a un efecto tóxico de la droga sobre los precursores de granulocitos en la médula ósea.4-7 Las alteraciones hematológicas son potencialmente riesgosas y asociadas a procesos sépticos severos.9 No obstante, no hay evidencia de que la agranulocitosis inducida por esos agentes impacte la mortalidad asociada por el uso de ATT. Afortunadamente, las alteraciones son reversibles en término de semanas a meses, como se evidenció en esta paciente durante el seguimiento estricto de su condición clínica y por medio de la evaluación secuencial de los hemogramas.
A pesar del uso extenso a nivel mundial de AAT, los efectos adversos de estos agentes sobre el sistema hematopoyético se consideran poco frecuentes. En Costa Rica, de febrero 2007 a noviembre 2016, se han reportado 36 casos de efectos adversos de propiltiuracilo, de los cuales 7 correspondieron a efectos adversos hematológicos (Departamento de Farmacovigilancia del Ministerio de Salud 2017 comunicación personal). Existe controversia del valor que tiene el monitoreo del recuento de glóbulos blancos en pacientes que toman AAT.10 Es por eso que se recomienda reportar al médico tratante sobre la presencia de manifestaciones orofaríngeas y fiebre, con el fin de realizar el hemograma.