La artritis reumatoide (AR) es la artropatía inflamatoria autoinmune más frecuente a nivel mundial, afectando aproximadamente al 1% de la población.1 En América Latina la prevalencia estimada es cercana al 0,5%,2 similar a la observada en España en 2001.3 En Brasil para 2013 se calcula que afectó a cerca del 1% de la población.4 Desafortunadamente no se cuentan con estudios epidemiológicos en nuestro país.
Desde el punto de vista fisiopatológico, con frecuencia se descubren nuevas vías implicadas en la cascada inmunológica que caracteriza la AR. El rol de algunos mediadores inflamatorios tales como anticuerpos, factores de crecimiento, factores de adhesión, citoquinas como el factor de necrosis tumoral alfa (TNFα) y metaloproteinasas de matrix (MMP) han sido definidos.
El TNFα desempeña un rol central en la patogenia de la AR.5,7 Es producido principalmente por macrófagos sinoviales y en menor medida por linfocitos en respuesta a estímulos proinflamatorios;1,8,9 es expresada como una proteína transmembrana activada por una MMP especifica (enzima convertidora de TNF), tras lo cual se convierte en una proteína soluble que se oligomeriza para formar un homotrimero que constituye la forma activa. Los efectos del TNFα son mediados por dos receptores estructuralmente distintos: receptor 1 (TNF R-I) y el receptor 2 (TNF R-II).8,10,11
La unión del TNFα con el receptor activa varias vías de señalización intracelular, incluyendo la activación de factores de transcripción como el factor nuclear potenciador de las cadenas ligeras kappa de las células B activadas (NFκB), quinasas de proteínas como la MAPkinasa y proteasas tales como caspasas entre otros.9 En la AR el TNFα induce la producción de citoquinas proinflamatorias tales como interleuquina 1 (IL-1), interleuquina 6 (IL-6), quimiocinas como interleuquina 8, además aumenta la permeabilidad vascular y la expresión de moléculas de adhesión endotelial entre otros efectos.12
Dada su condición crónica, la AR requiere el uso continuo de diversos medicamentos. El arsenal terapéutico actual comprende antiinflamatorios no esteroidales, fármacos antirreumáticos modificadores de enfermedad (FARME) tradicionales, esteroides y en los últimos años han surgido los fármacos antirreumáticos modificadores de enfermedad biológicos o simplemente biológicos que incluye los antagonistas del TNFα (antiTNFα), terapia anti-CD20 y terapia anti-IL-6 entre otros,1,13 fundamentales en el tratamiento de la AR en aquellos pacientes que no responden clínicamente a la terapia con los FARME tradicionales.1,7,14
Los antiTNFα son fármacos que han demostrado en múltiples estudios clínicos controlados ser muy efectivos en el tratamiento de enfermedades inflamatorias tales como AR, artritis idiopática juvenil, enfermedad de Cronh y artritis psoriasica.5,8,15-19 En la AR han demostrado que retrasan la progresión del daño articular,6,20,21 mejoran los síntomas y signos, así como el estatus funcional y calidad de vida.6,22
Los efectos terapéuticos de los antiTNFα en la AR se agrupan principalmente en dos grandes mecanismos: regula a la baja la producción local y sistémica de citoquinas inflamatorias; y disminuye la activación y la migración de linfocitos a nivel articular.23,24 Esto implica la disminución en los niveles de IL-1, IL-6, MMP y en la expresión de moléculas de adhesión endotelial.25,26 Estudios previos han demostrado una disminución en la población de macrófagos sinoviales por inducción de apoptosis mediado por los antiTNFα.8
En Costa Rica el uso de los fármacos antiTNFα inició desde el 2005. Actualmente la seguridad social de nuestro país cuenta con tres antiTNFα: Etanercept, Adalimumab e Infliximab para el manejo de diversas patologías en especialidades tales como Reumatología, Dermatología y Gastroenterología entre otros. En Reumatología los antiTNFα se utilizan para enfermedades que incluyen AR, Espondiloartropatias y Enfermedad de Still del adulto entre otras.
A partir de su uso clínico se hizo notorio que la inhibición del TNFα se asocia a un aumento en la incidencia de procesos infecciosos severos.4,8,27,28 En 2001 la Administración de Alimentos y Medicamentos de los Estados Unidos (FDA) emitió una advertencia en relación a procesos infecciosos vinculados con los antiTNFα.18 Estudios posteriores evidenciaron un riesgo incrementado para infecciones severas por microorganismos intracelulares principalmente en vía respiratoria superior, pulmón y piel; debido a patógenos como tuberculosis(TB) y otras micobacterias, virus, hongos endémicos y algunas bacterias,5,18,19,27,29-32debido a que el TNFα desempeña un papel mayor en la defensa contra microorganismos, (especialmente intracelulares) previniendo la diseminación, al activar la formación de granulomas.8,13,16,30,32,33 Algunos de los mecanismos descritos se relacionan con activación y diferenciación de los macrófagos, así como el estimulo a la formación de los fagosomas.34
Estudios desde hace varios años han demostrado una mayor incidencia de procesos infecciosos severos requiriendo hospitalización en pacientes con AR versus pacientes sin AR, causando importante morbi-mortalidad.5,7,15,27,35,36 Estos se definen como aquellos que requieren hospitalización para su manejo o para terapia antibiótica, que son potencialmente mortales y además aquellos que causaron la muerte.27,37,38 En general se considera que los procesos infecciosos severos están relacionados a alteraciones inmunológicas propias de la enfermedad, en especial la inmunidad celular por disminución en el número y la función de los linfocitos T supresores y los linfocitos asesinos naturales (linfocitos NK),36 a los fármacos utilizados para su control o a una combinación de ambas.5,13,27,30,34,37
Algunos factores asociados con un riesgo incrementado de procesos infecciosos severos con la terapia antiTNFα en pacientes con AR son: dosis de esteroides, primeros seis meses de instaurado el tratamiento antiTNF, cirugía previa reciente, linfopenia y comorbilidades tales como Diabetes Mellitus (DM) y Enfermedad Pulmonar Obstructiva Crónica (EPOC).4,16,18,27,29,38
Costa Rica carece de estudios clínicos acerca de pacientes tratados con fármacos antiTNFα, incluyendo el desarrollo de complicaciones infecciosas y no infecciosas por su prescripción. El propósito del estudio fue caracterizar la demografía de la población usuaria de terapia antiTNFα del Hospital “Dr. Rafael Angel Calderón Guardia”, así como determinar el comportamiento clínico de los procesos infecciosos asociados a los antiTNFα, con el fin de aportar información relevante sobre dicha población y los procesos infecciosos asociados a estos en nuestro país.
Métodos
El presente estudio observacional y retrospectivo se realizó en el Hospital “Dr. Rafael Ángel Calderón Guardia” de la Caja Costarricense de Seguro Social, en Costa Rica. Previa autorización del comité local de bioética (CLOBI-37-09-2014), se analizó la base de datos de pacientes usuarios de terapia antiTNFα del comité local de farmacoterapia del Hospital “Dr. Rafael Ángel Calderón Guardia” y se cotejó con el listado que en forma semestral se envía del servicio de Reumatología a dicho comité. Del listado se identificó la población de pacientes con AR tratados con fármacos antiTNFα, y se incluyeron los tratados por al menos un año, durante el periodo comprendido entre 2006 y 2012; se excluyeron pacientes con diagnóstico diferente a AR, así como aquellos con AR tratados con antiTNFα en forma intermitente, ya sea por embarazo, falla terapéutica o por un periodo menor a un año. A la población se le describieron sus características demográficas, así como las clínicas y epidemiológicas de las infecciones severas desarrolladas tras el inicio del antiTNFα y los factores de riesgo asociados con la(s) infección(es) severa(s).
Los datos clínicos y microbiológicos de los procesos infecciosos severos y no severos se identificaron en los pacientes que cumplieron los criterios de inclusión, pero únicamente se analizaron los relacionados a procesos infecciosos severos. Se definió como infección severa en la cohorte, como aquella caracterizada por requerir hospitalización para su manejo o prescripción de terapia antimicrobiana, potencialmente mortales o que causan la muerte.
Con base en dicha información se revisaron los expedientes clinicos y se estudiaron las siguientes variables: género; edad actual en años; edad al momento del diagnóstico de la AR en años; edad al momento del inicio del antiTNFα en años; número de fármacos antiTNFα utilizados; terapéutica antiTNFα actual, uso de FARME o inmunosupresores al inicio de la terapia antiTNFα; positividad del factor reumatoide; intervalo entre el inicio de la terapia antiTNFα y el desarrollo de la infección severa en meses; localización de la infección severa; microorganismo(s) aislado(s); terapéutica(s) antimicrobiana(s) utilizada(s); dosis del antimicrobiano(s) utilizado(s); duración de la terapéutica antimicrobiana prescrita en días; comorbilidades asociadas al inicio de la terapia antiTNFα incluyendo: DM, linfopenia menor a 1500/mm3, cirugía reciente en los últimos 12 meses y EPOC; pacientes con dosis de esteroides orales menores a 10mg/día al inicio de la terapia antiTNFα; pacientes con dosis de esteroides orales mayores a 10mg/día al inicio de la terapia antiTNFα; presencia de TB latente.Los datos requeridos se recopilaron de los expedientes clínicos de los pacientes mediante una “Hoja de recolección de datos” confeccionada para tal fin y aprobada por el Comité Local de Bioética
Para el análisis e interpretación de los datos obtenidos se utilizaron medidas tales como promedio, mediana, frecuencia entre otras. Se utilizó el programa SPSS para Windows 14.0 como herramienta de análisis estadístico.
Resultados
Hasta junio de 2014 habían recibido terapia antiTNFα por al menos un año un total de 117 personas, de estos, solo 51 pacientes correspondían a diagnóstico de AR. Se encontró 50 expedientes que cumplieron con los criterios de inclusión, 45 correspondían a mujeres y 5 a hombres. La edad promedio de la cohorte a 2014 fue 52.9 años (DE: ±10.9); la mínima correspondió a 35 años y la máxima a 78. La edad promedio al diagnóstico de AR en la población fue 38.6 años (DE: ±10.9) y al inicio de la terapia antiTNFα, 47.9 años (DE: ±10.6).
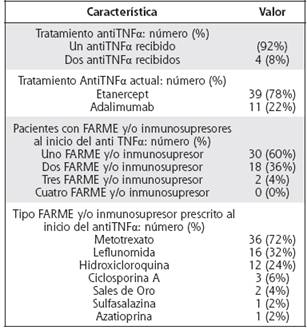
En cuanto a la terapéutica a la fecha del análisis un 78% de los pacientes utilizaron etanercept y 22% adalimumab. El uso de FARME o inmunosupresores al inicio de la terapia antiTNFα fue en promedio de 1.44, siendo el metotrexate el más prescrito. Otros parámetros relacionados con el tratamiento se describen en el Cuadro 1.
Cuadro 1 Características del tratamiento en pacientes con AR en terapia biológica en el HCG de 2006 a 2012.
La determinación del factor reumatoide se encontró en 49 expedientes clínicos, de los cuales 37 son seropositivos (75%); el restante porcentaje fue seronegativo.
En la población analizada se documentó una infección severa, que correspondió a una infección de piel y tejido blando a nivel de muslo derecho. El episodio se produjo 8 meses después del inicio del antiTNFα; no se logró aislamiento microbiano en los diversos cultivos realizados incluyendo hemocultivo y cultivo de secreción. Se obtuvo una adecuada respuesta clínica tras tratamiento antibiótico intravenoso con Oxacilina a dosis de 2 gramos cada 6 horas y Clindamicina a dosis de 600mg cada 8 horas por un periodo de 7 días, alcanzando egreso hospitalario de la paciente.
En la población analizada se encontraron factores de riesgo para el desarrollo de infecciones severas: 2 pacientes portadores de DM, 4 pacientes con antecedente de cirugía reciente y una paciente con linfopenia al inicio de la terapia antiTNFα.
En cuanto a la prescripción de esteroides al inicio de la terapia antiTNFα, 8 pacientes no los tenían prescritos. De los 42 pacientes con esteroides, 24 tenían dosis menores a 10mg/día y 15 con dosis orales iguales o mayores a 10mg/día. En 3 casos se utilizaron esteroides parenterales (se utilizó metilprednisolona a dosis de 250mg cada día) para control clínico de la enfermedad, por un periodo de 3 días. La dosis promedio de esteroide oral en la cohorte fue 6.92mg/día.
Los estudios por TB latente fueron positivos en 5 pacientes de la población analizada. En todos los casos recibieron quimioprofilaxis por parte del servicio de Infectología del Hospital “Dr. Rafael Ángel Calderón Guardia” previa al inicio de la terapia antiTNFα.
Discusión
El perfil demográfico de la cohorte analizada es similar a otros estudios internacionales, con una población predominantemente femenina en edad media. Algunos ejemplos clásicos lo constituyen los estudios CORRONA (Consortium of Rheumatology Researches of North America), ReACT (Research in Active Rheumatoid Arthritis trial) y TEMPO (Trial of etanercept and methotrexate with radiographic Patient Outcomes).39-42
El periodo entre el inicio de la AR y la prescripción de la terapia antiTNFα en la población analizada es similar a otras cohortes, con un promedio cercano a los 10 años.39-42En nuestro país, los antiTNFα se prescriben desde 2005, de forma que los pacientes inicialmente tratados con dicha terapéutica, corresponden a aquellos con una enfermedad de larga data sin respuesta clínica inicial a FARME previo a ese año. La prescripción de terapia antiTNFα se limita a pacientes con enfermedad activa persistente basado en los puntajes DAS28 (Disease Activity Index de 28 articulaciones), CDAI (Clinical Disease Activity Index) o SDAI (Simple Disease Activity Index), que no responden a diferentes esquemas de FARME, recomendados en guías terapéuticas institucionales nacionales e internacionales43, por lo que a la fecha los antiTNFα no representan una opción en pacientes con AR temprana en nuestro sistema de seguridad social.
Similar a otros registros de biológicos como el francés RATIO (Research Axed on Tolerance of bIOtherapies), la mayoría de los pacientes solo han recibido un antiTNFα, en 4 casos fue necesario el cambio de la terapia inicial, ya sea por falla primaria o secundaria. Los fármacos antiTNFα han demostrado a través de múltiples estudios su efectividad en el control clínico de la AR refractaria a los diversos esquemas de FARME, similar a lo descrito en esta cohorte.8,16,20,21 A diferencia del registro francés RATIO donde Etanercept fue el antiTNFα menos prescrito, en nuestro análisis corresponde a la terapia más prescrita, que obedece a razones de índole institucional.
En relación al uso de FARME o inmunosupresor, la mayoría de los pacientes utilizaban únicamente un FARME (especialmente metotrexato y en menor proporción leflunomida) al inicio de la terapia antiTNFα, de manera similar a otros registros como el CORRONA.39 La monoterapia predominante constituye una característica llamativa, dado que es frecuente en el país la prescripción de diversas terapias de combinación, incluyendo la de Odell (metotrexato, hidroxicloroquina y sulfazalacina), o combinaciones de metotrexato con leflunomida entre otras para el manejo de pacientes con enfermedad activa persistente, previo a considerar el uso de terapia biológica. La monoterapia predominante en la cohorte, podría traducir una incapacidad de los diversos esquemas de combinación de FARME para lograr remisión clínica prolongada, o actividad clínica mínima de la AR, o a su vez representar la intolerancia a los diversos efectos secundarios de estos. Dicha observación podría requerir futuras investigaciones, a fin de determinar posibles causas. Por otra parte, es llamativo el uso de inmunosupresores en la población analizada, no considerados como opciones terapéuticas actuales en las diversas guías internacionales de tratamiento para AR, como Sales de oro y Ciclosporina A (algunos asociados a efectos adversos como proteinuria, citopenias severas o hipertensión arterial),43 debido a que estas terapias estaban incluidas en guías institucionales en años previos, antes de considerar el uso de terapia biológica.
El perfil inmunológico de los pacientes se caracteriza por la positividad del factor reumatoide en la mayoría. Actualmente la seropositividad se considera uno de los factores que confieren peor pronóstico a la AR, al igual que al compromiso extraarticular, presencia de erosiones radiológicas o franca limitación funcional y el grado de actividad clínica en base a los índices DAS, DAS28 entre otros; en cuyo caso se debe considerar una terapia temprana agresiva.43
El perfil clínico de la única infección severa documentado concuerda con los primeros reportes de procesos infecciosos severos relacionados a antiTNFα, el análisis del registro alemán de biológicos RABBIT (Rheumatoid Arthritis: Beobachtung der Biologika Therapie) en 2005 y del registro inglés BSRBR (British Society for Rheumatology Biologics Register) en 2006 demostraron incrementos significativos para infecciones de piel y tejidos blandos relacionados con la terapia antiTNFα.4,5,7
La infección severa se desarrolló a los 8 meses de haber iniciado la terapia antiTNFα, que difiere de lo descrito en la bibliografía. El riesgo máximo se ha descrito en los primeros 6 meses de iniciado el tratamiento.4,44 En 2007 Askling y colegas demostraron que el riesgo de infección que requiere hospitalización en pacientes expuestos a fármaco antiTNFα disminuye en el tiempo, de 1.43 (95% intervalo de confianza: 1.18 a 1.73) en el primer año a 0.82 (95% intervalo de confianza: 0.62 a 1.08) en el tercero.18
Con base en la respuesta clínica a la terapéutica antibiótica intravenosa instaurada, es probable que la causa fuese un agente bacteriano, a pesar de no lograr aislamiento microbiano en los cultivos realizados. En 2013 un análisis del registro ingles BSRBR, de infecciones de piel y tejido blando en usuarios de antiTNFα demostró a los cocos gram positivos como principales agentes causales seguido de especies de pseudomona. De 130 procesos infecciosos severos de piel y tejido blando, se aislaron cocos gram positivos en 103 pacientes, de los cuales 84 correspondía a Staphilococcus aureus, 11 a Streptococcus sp y 8 casos a Staphilococcus coagulasa negativo.35
La presencia la inicio de la terapia antiTNFα de comorbilidades como DM, EPOC, así como de linfopenia y de cirugía reciente se han asociado a un riesgo incrementado de eventos infecciosos severos.4,15,16,27-29,34,38 En la presente cohorte la prevalencia de comorbilidades es inusualmente baja en comparación con estudios de otras latitudes. Los efectuados en Estados Unidos, Francia e Inglaterra presentan prevalencias de DM en rangos que varían entre el 6.0% y el 18.9%, y de EPOC entre el 8.0% y el 28.0%.16,17,29,33 Esta menor prevalencia de comorbilidades no tiene una clara explicación y podría ser una causa de la baja incidencia de infecciones severas, por lo que se requieren análisis posteriores para corroborar o descartar tal observación.
El uso de esteroides ha sido identificado como un factor de riesgo importante en los usuarios de antiTNFα,4,15,16 el porcentaje de pacientes que recibían esteroides (84%) es similar al de estudios como el RATIO, pero mayor al reportado en el registro estadounidense SABER (Safety Assessment of Biologic thERapy) un 60.1%. No obstante existe una diferencia importante en relación a dosis altas de esteroides, mientras en el estudio RATIO hasta un 50% recibió dosis orales mayores a 10mg/día o bolos intravenosos y en el estudio SABER un 10.2%, nuestra cohorte en un 36% recibió dosis esteroidales consideradas altas orales y parenterales.17
Diversos estudios han demostrado la importancia del TNFα en el control de TB. En una cohorte retrospectiva de 112300 pacientes canadienses con AR la tasa global de Tb fue de 2.2 casos por 1000 personas/año (95% intervalo de confianza 2.0 a 2.4). La incidencia entre pacientes con terapia antiTNFα fue de 2.6 por 1000 personas/año (95% intervalo de confianza 1.9 a 3.3).30 En el presente estudio se identificaron 5 pacientes con estudios positivos por TB latente previo al inicio de la terapia antiTNFα. La cifra es similar a otros reportes latinoamericanos, una pequeña cohorte colombiana demostró una alta prevalencia de TB latente, mayor a la descrita en cohortes de otras latitudes.45,46
De la presente investigación se concluye que el perfil demográfico de la población usuaria de la terapia antiTNFα es similar al descrito en estudios internacionales, al igual que el perfil clínico y epidemiológico de los procesos infecciosos severos. La baja incidencia de infecciones severas podría relacionarse con una menor prevalencia de comorbilidades en la cohorte analizada, no obstante estudios clínico-epidemiológicos nacionales prospectivos a futuro son necesarios para corroborar o descartar dicha observación.
El estudio presenta algunas limitaciones incluyendo una población pequeña a analizar, en comparación a estudios clásicos de AR que incluyen miles de pacientes.
No se tomaron en cuenta otras variables epidemiológicas en el análisis que pudiesen haber enriquecido los resultados y la discusión, incluyendo presencia de secuelas secundario a la AR, presencia de síndrome anémico o trombocitosis secundario al proceso inflamatorio crónico no controlado, elevación de reactantes de fase aguda, disminución del DAS28 posterior a la prescripción de la terapia antiTNFα, entre otros, por lo que se considera una debilidad importante no haber obtenido una caracterización epidemiológica más amplia.
Tampoco se caracterizó adecuadamente la falla primaria o secundaria a la terapia antiTNFα, que pudo haber enriquecido el análisis, al tratar de establecer posibles causas. Debido a la gran diferencia entre el número de pacientes tratados con diversas terapias antiTNFα, es imposible realizar comparaciones.
Un punto importante que limitó un análisis más amplio lo constituye la ausencia de mediciones en el expediente clínico como las respuestas ACR20, ACR50 y ACR70, utilizadas en forma rutinaria a nivel internacional en estudios clínicos tanto para valorar la respuesta clínica a la terapia antiTNFα como a terapias con FARME.
Trabajo realizado en Servicio de Reumatología Hospital “Dr. Rafael Ángel Calderón Guardia”.
Abreviaturas: AR, artritis reumatoide; antiTNFα, fármaco antagonista del factor de necrosis tumoral alfa; HLA, antígeno leucocitario humano; TNFα, factor de necrosis tumoral alfa; MMP, metaloproteinasas de matrix; FARME, fármacos antirreumáticos modificadores de enfermedad; TB, tuberculosis; DM, diabetes mellitus; EPOC, enfermedad pulmonar obstructiva crónica. marsbcr@gmail.com











 text in
text in 


