La hipertensión arterial aumenta el riesgo de mortalidad total, mortalidad cardiovascular, evento cerebrovascular, infarto de miocardio y angina, insuficiencia cardiaca, enfermedad arterial periférica y renal,1 y la falta de tratamiento puede acortar la vida hasta en 5 años.2
A partir de datos de aseguradoras se ligaba el aumento de presión arterial a muerte prematura aunque la opinión médica prevalente en los años 1950 era que una disminución de la presión resultaría dañina y se asociaría con disminución de perfusión a los órganos vitales.2 Se sabe que por cada aumento de 20 mmHg en la presión sistólica y por cada 10mmHg en la diastólica sobre 115/75 mmHg el riesgo de eventos cardiovasculares se dobla y con tratamiento este riesgo disminuye de forma significativa,3 se cuenta además con un arsenal terapéutico sin precedente para el tratamiento de esta enfermedad; pero, el número de pacientes hipertensos en tratamiento ronda el 50% del total de población hipertensa y de estos solo cerca de la mitad alcanza las metas propuestas de presión arterial.1 , 2
El desconocimiento de la causa de la hipertensión arterial en más de 90% de los casos aumenta la complejidad del manejo de esta enfermedad.4
Ante este panorama se debe tomar en cuenta que las intervenciones que buscan cambios en el estilo de vida para el tratamiento de la hipertensión tienen un costo bajo y pocos efectos adversos; además, tienen efectos favorables en otros factores de riesgo para enfermedad cardiovascular.1 Por esta razón la Organización Mundial de la Salud,5 el Comité Nacional de Prevención, Detección, Evaluación y Tratamiento de la Hipertensión Arterial,6 la Sociedad Europea de Hipertensión,7 el programa Canadiense de Educación en Hipertensión8 y otras organizaciones han introducido dentro de sus recomendaciones para tratamiento de hipertensión arterial la práctica regular de actividad física. Las Guías de Manejo Basado en Evidencia del 2014 (JNC8) no hacen una recomendación específica al respecto.9
Ejercicio y presión arterial
En 1981 el Dr. W. Fitzgerald publicó sus propios cambios de presión arterial tras realizar ejercicio aeróbico isotónico (trotar), asociando de esta manera la práctica de actividad física con disminución de la presión arterial.10
Se ha observado que ocurre un aumento de la presión arterial al realizar ejercicio aeróbico (como correr o pedalear), directamente relacionado con la intensidad; donde se han reportado valores de hasta 260 mmHg durante ejercicio aeróbico vigoroso;11 lo anterior presenta implicaciones distintas al utilizarse individuos sedentarios o deportistas en los estudios.12 , 13 Posterior a la realización de ejercicio se ha observado una disminución de la presión arterial conocida como hipotensión post ejercicio, la cual se ha sugerido sea utilizada como intervención terapéutica y ha sido estudiada a un corto plazo.
Factores asociados a la hipotensión arterial post ejercicio
Tipo de ejercicio
Se ha reportado disminución de la presión arterial tras la realización de distintos tipos de ejercicio como caminar,14 - 16 correr,16 - 18 y ejercicios ergométricos de brazos y piernas.19 , 20
También se ha documentado una disminución un poco menor luego de realizar ejercicio de fuerza (con pesas o poleas).21 , 22 Sin embargo, se debe tomar en cuenta que segundos o hasta minutos luego de finalizado este tipo de ejercicio se puede dar una disminución de la presión arterial por la caída abrupta de la presión al perfundir territorio antes ocluido por la masa muscular.23 Esto no implica una contraindicación para la realización de ejercicio en individuos hipertensos. 8
Intensidad del ejercicio
En la mayoría de estudios se han utilizado protocolos con ergómetros y bandas sin fin con ejercicio entre el 40 y el 100% del VO2max (consumo máximo de oxígeno); en ambas modalidades la disminución de la presión arterial es similar;24 también se ha observado que si se comparan distintas intensidades para una misma modalidad de ejercicio, se obtiene mayor disminución con mayor intensidad.25 No se han observado diferencias al realizar ejercicio contra-resistencia en sets de tres o más repeticiones.26
Duración del ejercicio
La hipotensión post ejercicio se ha observado luego de periodos de ejercicio que abarcan desde los 3 a los 170 minutos.24
En sujetos hipertensos se ha sugerido que la magnitud de la reducción es mayor al incrementar la duración del ejercicio; sin embargo, esto no se ha observado en individuos normotensos. Además, un breve periodo de hipotensión tras la finalización del ejercicio ha sido atribuido a la distribución de la sangre en los vasos sanguíneos dilatados del territorio muscular activo.24
Forjaz demostró en un pequeño grupo de sujetos hipertensos que la disminución tanto de presión arterial sistólica como diastólica era mayor luego de realizar ejercicio en un cicloergómetro a un 50% del VO2max predicho si se mantenía por 45 minutos comparado con 25 minutos;27 sin embargo, estos datos no fueron corroborados por el grupo de MacDonald, el cual en el año 2000 encontró una disminución similar en ambas presiones al realizar ejercicio a un 70% del Vo2max durante 10, 15, 30 y 45 minutos en individuos normotensos y con valores de prehipertensión.19 Tampoco se ha observado diferencia en los efectos si el tiempo de ejercicio se cumple de forma continua o en intervalos.28
Duración e intensidad de la respuesta
El inicio de la hipotensión luego del ejercicio se ha observado inmediatamente tras el ejercicio29,30 o en un intervalo de 30 a 60 minutos luego de este10 , 31 , 32 (la mayoría de estudios en este respecto tienen una duración limitada a 1 ó 2 horas hasta encontrar un nadir y el retorno de la presión arterial a los valores previos o control).
En estudios donde se ha hecho monitoreo ambulatorio de la presión arterial luego del ejercicio se ha demostrado disminución de la presión arterial en individuos hipertensos de distintas edades por tiempos mayores a 2 horas,1 , 15 , 16 , 33 - 35 incluso hasta 22 horas después;36 pero no se han observado estos mismos efectos en individuos normotensos.
Ante las diferencias observadas en la duración del efecto se ha propuesto que existan oscilaciones en los valores de presión arterial, lo cual se ha visto en los estudios de mayor duración.24
La intensidad de la respuesta es variable y depende de múltiples factores; un meta análisis de cinco estudios controlados comprendiendo ejercicio isométrico, demostró que una hora de ejercicio por semana reduce la presión arterial sistólica en 10.4 mmHg y la presión arterial diastólica en 6.7 mmHg.37 Otro metaanálisis de efectos del ejercicio contra resistencia con los brazos mostró una disminución de la presión arterial sistólica de 13.4 mmHg y de la diastólica en 6.1 mmHg.38
Un metaanálisis de entrenamiento aeróbico involucrando 72 estudios mostró una disminución de la presión arterial en 6.77/3.94mmHg39 y otro en 6.9/4.9 mmHg, con una disminución de la resistencia vascular periférica de 7.1%, norepinefrina plasmática en 29%, actividad de renina plasmática en 20%, peso corporal en 1.2% y porcentaje de grasa en un 1.4%.40 Uno de los estudios realizados solamente con individuos hipertensos mostró disminución de la presión de 13.1/6.3 mmHg.41
Mecanismos implicados
Cambios en el gasto cardiaco
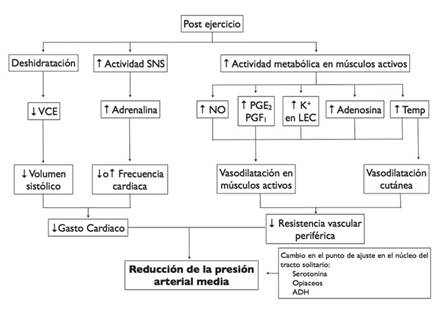
Se ha observado un aumento del gasto cardiaco post ejercicio mediado por aumento de la frecuencia cardiaca, el volumen sistólico o ambos;42 , 43 mientras que en otros estudios se ha observado una disminución mediada por la reducción del volumen sistólico.17 , 44 , 45 Dentro de los estudios anteriormente mencionados, en los que se observó un aumento del gasto cardiaco fueron en los realizados en individuos normotensos, mientras que la disminución se observó en los realizados en hipertensos; por lo tanto, es posible pensar que los mecanismos implicados en la compensación de la presión arterial post ejercicio se preservan de forma normal en los individuos normotensos, por lo que estos reflejos impedirán la caída del gasto cardiaco, algo que podría no darse en las personas hipertensas debido a cambios crónicos en la sensibilidad en la respuesta del barorreflejo.46 , 47
Fenómenos asociados a cambios en el gasto cardiaco y la resistencia vascular periférica
Termorregulación
La vasodilatación cutánea constituye una forma de pérdida de calor en los seres humanos la cual es aumentada como producto de las repetidas contracciones musculares. Esta disminución de la resistencia vascular cutánea se asociaría con una disminución de la presión, especialmente cuando se ejercita en clima cálido. Sin embargo en los climas más fríos o neutros la hipotensión post ejercicio no fue tan marcada.32 Aunque se puede pensar que la vasodilatación cutánea media la disminución de la presión post ejercicio, en realidad este fenómeno sólo sería una explicación parcial, ya que la vasodilatación cutánea no se presenta siempre y la hipotensión se mantiene durante un tiempo más prolongado que la vasodilatación como respuesta termoreguladora.24
Volumen sanguíneo
Durante el ejercicio puede haber una disminución del volumen sanguíneo por distintos mecanismos; primero, el aumento del gasto cardiaco y de presión hidrostática en los capilares puede favorecer una disminución del volumen plamático al aumentar el ultrafiltrado hacia el intersticio. Además se puede perder agua producto de la estimulación de la sudoración por la actividad simpática y los mecanismos termorreguladores asociados. Una reducción del volumen sanguíneo se asociaría a la vez con una disminución del retorno venoso y del volumen sistólico.24 Sin embargo, en un estudio de Hagberg et al, se demostró una leve disminución del volumen sanguíneo tras la realización de ejercicio por individuos hipertensos; esta disminución no fue diferente de la observada en los individuos control.44 En otros estudios no se ha observado cambios en el hematocrito a la concentración de hemoglobina después del ejercicio y durante los periodos de hipotensión.
Por lo tanto, la disminución del volumen plasmático no es un mecanismo fuerte para explicar la hipotensión post ejercicio.24
Actividad simpática
En una serie de estudios se ha examinado la influencia de la actividad neural simpática en la génesis de la hipotensión post ejercicio. Halliwill et al, documentaron una disminución en la actividad simpática muscular en una población normotensa,49 mientras que Floras y su equipo reportaron una disminución de la actividad neural simpática muscular en individuos hipertensos.50
A nivel de otros territorios se ha observado un no cambio o disminución de la actividad simpática a nivel renal e incluso un aumento de la actividad simpática a nivel lumbar.24
Al igual que la actividad simpática se ha monitorizado al variabilidad de la frecuencia cardiaca; tanto en individuos normotensos como en prehipertensos se observan un aumento de la frecuencia cardiaca durante el tiempo que dura la hipotensión post ejercicio, lo cual podría reflejar el funcionamiento normal del barorreflejo; la medición de catecolaminas plasmáticas y en orina no ha sido concluyente en relación al papel de las estas en la hipotensión post ejercicio.30 , 51
Adrenalina y noradrenalina
En individuos hipertensos se ha observado un aumento en la actividad nerviosa simpática basal.52 No se observan cambios importantes en los niveles circulantes de noradrenalina, sin embargo el nivel circulante de adrenalina se mantiene elevado.53
Sistema renina-angiotensina-aldosterona
La renina es liberada por el riñón durante periodos de disminución de perfusión o activación beta drenérgica.54 De esta forma aumenta la liberación de angiotensina I, angiotensina II y aldosterona. Ante una disminución de la presión arterial por disminución de sensibilidad adrenérgica antes citada, se podría esperar lo mismo a nivel renal; sin embargo, en el periodo post ejercicio se ha obtenido un aumento de angiotensina II.55
Aunque en este eje se debe empezar a considerar los posibles efectos de vasodilatación mediados por la angiotensina 1-7.56
Vasopresina
Además de su efecto principal controlando el contenido de agua corporal, la hormona antidiurética o vasopresina puede favorecer constricción del músculo liso vascular al activarse el V1R y aumentar el calcio intracelular.57 Sin embargo, una correlación clara entre la liberación y los niveles de vasopresina con la hipotensión no se ha establecido, aunque queda clara que una disminución de los niveles circulantes de ésta podría generar vasodilatación y disminución del gasto cardiaco especialmente por medio de control de la frecuencia cardiaca en el núcleo del tracto solitario.58 , 59
Péptidos natriuréticos
Durante el ejercicio aumenta la liberación de péptido atrial natriurético por el aumento del retorno venoso; este es aún mayor al realizar ejercicios con los brazos.60 Los efectos vasodilatadores y natriuréticos del péptido atrial son muy superiores a su vida media de solo 2 a 3 minutos, hecho del cual se desconoce el mecanismo.24 Se ha reportado cambios en los niveles de péptido atrial natriurético respecto a valores basales una hora post ejercicio.61
Potasio
El potasio tiene un efecto dilatador en el músculo liso vascular,62 y al ser liberado en los tejidos metabólicamente activos se favorece el efecto vasodilatador de forma proporcional a la intensidad de la actividad.63 - 64 Las concentraciones plasmáticas de potasio son proporcionales a la intensidad de actividad física realizada, pero al parecer la disminución de la presión no parece ser dependiente de la intensidad,27 , 33 lo cual no parece explicar los resultados observados.
Adenosina
La adenosina es liberada por los tejidos activos durante el ejercicio y se asocia a importante vasodilatación.65 Sin embargo, existe un aumento transitorio que es disminuido luego por la recaptura y eliminación de la adenosina.65 , 66
Prostaglandinas
Las prostaglandinas son sustancias con efecto vasodilatador, tanto a nivel arterial como a nivel venoso.63 , 67 , 68 Se ha observado un aumento de los niveles circulantes de PGF1 y PGE2 durante ejercicio isométrico de brazos.69 Las prostaglandinas van a mediar una disminución de la presión durante un intervalo de 35 a 40 minutos tras el ejercicio, sin embargo su papel en la génesis de la hipotensión post ejercicio no queda claro.24
Oxido nítrico
También se ha hablado de una disminución de la sensibilidad vascular como responsable de la caída de la presión arterial; este hecho ha sido estudiado principalmente en modelos animales, donde se ha visto que en anillos de aorta de conejos se da una disminución de la respuesta constrictora ante las catecolaminas posterior al ejercicio.70 En otro estudio usando ratas, se demostró aumento de flujo en las arterias iliacas mediado por una disminución de la sensibilidad de los receptores adrenérgicos.71
Se ha planteado que la disminución de la sensibilidad podría estar mediada por múltiples factores, uno de ellos es el aumento de niveles de óxido nítrico, sin embargo esto aún no ha sido confirmado en estudios en humanos.24
Opioides y serotonina
Cambios en el sistema de opioides endógenos podría afectar centralmente la regulación de la presión arterial.71 , 73
También se sabe ahora que los péptidos opioides pueden actuar en el miocardio donde incluso son producidos; en este sitio se han asociado tanto con inhibición del acople excitación contracción (lo cual tendría un efecto tanto inotrópico como cronotrópico negativo) pero además se han asociado con protección ante la lesión hipóxica e isquémica.74
La serotonina ha sido implicada en el desarrollo de hipotensión luego del ejercicio en ratas. En seres humanos se observa una disminución de la presión arterial al aumentar los niveles de serotonina en el sistema nervioso central.75 , 76 Al utilizar inhibidores de recaptura de serotonina no se ha demostrado variaciones en la respuesta hipotensora.77
Se ha hipotetizado incluso que la actividad física y/o el estilo de vida sedentario se puede asociar con variantes genéticas y epigenéticas conocidas como variantes asociada a hipertensión, las cuales median la tendencia de un individuo a ser hipertenso como isoformas de la óxido nítrico sintasa o de la metil-tetrahidrofolato reductasa,78 así como afectar la expresión proteica a nivel cardiaco y vascular.79
La disminución de la presión arterial post ejercicio podría favorecer prevención del desarrollo de hipertensión en individuos no hipertensos,80 así como también han sido demostrados sus efectos en niños y adolecentes,81 adultos mayores,82 pacientes con nefropatía crónica diabéticos83 y dislipidémicos,84 obesos 85 y sus beneficios incluyen mejores físicas en parámetros cardiovasculares,86 , 87 fuerza, balance, calidad de vida; incluso disminución de mortalidad.82 , 88
Todos estos efectos (Figura 1) han sido demostrados durante periodos cortos de tiempo, los efectos a largo plazo se relacionan con la reiteración de la actividad física pero no se ha estudiado adecuadamente la variación de estos fenómenos con el continuo de la actividad física, aunque si son claros sus beneficios a múltiples niveles incluidos la disminución de eventos cardiovasculares y disminución de mortalidad en múltiples estudios epidemiológicos.89 - 91
Prescripción de un programa sistemático de ejercicio en pacientes hipertensas
Recomendaciones para la evaluación física de una paciente con hipertensión
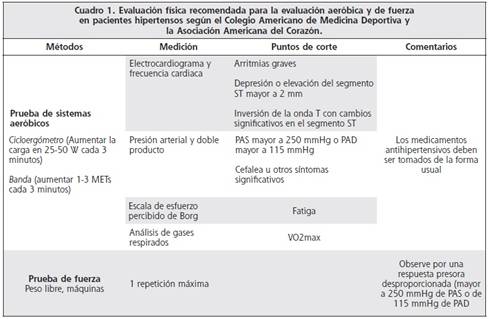
Los métodos estándar para la evaluación de ejercicio pueden ser utilizados en individuos hipertensos.1
Los pacientes con factores de riesgo coronarios adicionales y los varones mayores de 45 años, así como las mujeres mayores de 55 años deben ser sometidas a una prueba de esfuerzo con monitoreo electrocardiográfico si van a iniciar un plan de ejercicio vigoroso (por ejemplo mayor al 60% de la reserva del VO2max). Independientemente de la intensidad del plan de ejercicio que vaya a iniciar debe someterse al procedimiento si hay síntomas compatibles con enfermedad cardiovascular o enfermedad cardiovascular conocida (Cuadro 1).92
Recomendación para un programa de ejercicio en un individuo hipertenso
Se recomienda ejercicio aeróbico regular al menos 30 minutos la mayoría de los días de la semana; caminando inicialmente una milla sobre el nivel de actividad actual del paciente.93
En los pacientes con cifras tensionales mayores de 180/110 mmHg se recomienda empezar la realización de ejercicio solamente tras el inicio de tratamiento antihipertensivo.
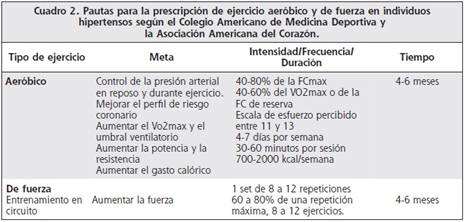
Se recomiendan actividades aeróbicas de grandes grupos musculares la mayoría de los días de la semana (preferiblemente todos), con una duración de más de 30 minutos continuos o acumulados y con una intensidad entre el 40 y el 60 % de la reserva de Vo2max. Se debe procurar mantener durante la presión arterial menor a 220/105 mmHg durante el ejercicio. El entrenamiento de fuerza no es recomendado como único tipo de entrenamiento en individuos hipertensos, pero sí se recomienda como adyuvante del entrenamiento aeróbico.1 , 93
El entrenamiento de fuerza usando poca resistencia y un número intermedio de repeticiones (un set de 8 a 12 repeticiones a un 60-80% de una repetición máxima) disminuye la presión arterial y se asocia a múltiples beneficios en la salud (Cuadro 2).1 , 93
Es importante tomar en cuenta algunas precauciones en personas que están en control por hipertensión arterial:
• Los β bloqueadores atenúan el aumento de la frecuencia cardiaca hasta en 30 latidos por minuto.
• Los bloqueadores α1, α2, bloqueadores de canales de calcio y los vasodilatadores favorecen el desarrollo de hipotensión post ejercicio.
• No se debe realizar ejercicio si la presión arterial es mayor a 200 mmHg la sistólica o 115 mmHg la diastólica.
• El ejercicio es aconsejable cuando la respuesta presora a los medicamentos está claramente determinada.
• El ejercicio con intensidades entre el 40 y 70% del VO2max parece ser tanto o más beneficioso que el ejercicio a mayor intensidad. 93
Conclusión
La aparición de la hipotensión post ejercicio es reproducible a partir de intervalos de ejercicio de tan solo 3 minutos a un 40% del VO2max y no parece variar de forma muy importante entre distintas modalidades o intensidades de duración del mismo.
Es necesario evaluar estos datos en individuos hipertensos y en escenarios diferentes a laboratorios para observar los efectos de esta intervención.
El conocimiento de los mecanismos implicados en la aparición de la hipotensión post ejercicio pueden llevar a un mayor entendimiento de los mecanismos implicados en el desarrollo de la hipertensión arterial. Además se puede explotar como una intervención para el tratamiento de los individuos hipertensos.
El mecanismo principal se orienta hacia una disminución de la resistencia vascular periférica; sin embargo, cambios neurales, bioquímicos o hemodinámicas no son concluyentes como la principal causa de este fenómeno y la evidencia actual parece indicar que este es un fenómeno que es regulado por múltiples factores, tanto centrales como periféricos; incluso dejando la posibilidad de heterogeneidad entre individuos.
Es claro que la tendencia a disminuir la presión es mayor en individuos hipertensos, por lo tanto en ellos se debe evaluar más ampliamente esta intervención con el objetivo de definir protocolos de actividad física reproducibles y con el objetivo de alcanzar disminuciones de la presión arterial de forma mantenida. Además es necesario evaluar los efectos a largo plazo de las intervenciones con ejercicio en personas hipertensas y sus efectos en mortalidad y reducción de eventos cardiovasculares.