Services on Demand
Journal
Article
Indicators
-
 Cited by SciELO
Cited by SciELO -
 Access statistics
Access statistics
Related links
-
 Similars in
SciELO
Similars in
SciELO
Share
Acta Médica Costarricense
On-line version ISSN 0001-6002Print version ISSN 0001-6012
Acta méd. costarric vol.54 n.3 San José Jul./Sep. 2012
Original
Caracterización epidemiológica, clínica y microbiológica del brote de diarrea asociado a Clostridium difficile, ocurrido en el Hospital San Juan de Dios, 2008-2009
Epidemiologic, clinical, and microbiologic description of an outbreak of Clostridium difficile associated diarrhea in Costa Rica
Manuel Antonio Villalobos-Zúñiga1*, Ricardo Boza-Cordero2*
*Dirección para correspondencia:
Resumen
Antecedentes: la enfermedad diarreica asociada a Clostridium difficile (EDACD) es la causa más importante de diarrea nosocomial en el mundo.
En Costa Rica, se presentó recientemente un brote de EDACD en el Hospital San Juan de Dios de San José, hospital de tercer nivel con 700 camas. En el estudio se analizan las características epidemiológicas, clínicas y microbiológicas de los pacientes con EDACD atendidos entre noviembre de 2008 y junio de 2009.
Pacientes y métodos: se definió como caso de EDACD un paciente con cuadro diarréico con detección de ELISA positiva por toxina A de C. difficile en heces. Se realizó un análisis de la incidencia anual desde 2004 de EDACD, y de la incidencia mensual de EDACD en 2009 en el HSJD, así como un estudio observacional y retrospectivo de 112 expedientes médicos correspondientes a pacientes con el diagnóstico de EDACD atendidos en el Hospital, en el periodo comprendido entre el 15 de noviembre de 2008 y el 15 de junio de 2009. El análisis de los datos se efectuó mediante pruebas estadísticas descriptivas y medidas de asociación.
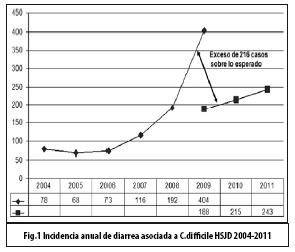
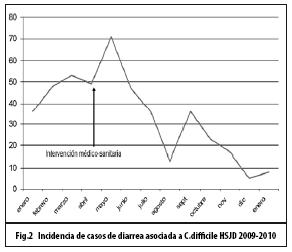
Discusión: se describe un brote de EDACD en un hospital nacional de 700 camas, el cual fue observado con mayor frecuencia en adultos mayores (>65 años), con largas estancias hospitalarias, con múltiples patologías asociadas, quienes habían recibido varios antibióticos por periodos prolongados, principalmente cefotaxima, fluoroquinolonas o clindamicina. Con las medidas médico - sanitarias implementadas, se logró disminuir su incidencia en un 75%, en el transcurso de 8 meses.
Descriptores: diarrea, Clostridium difficile, brote, infección nosocomial
Abstract
Background: Clostridium difficile associated diarrhea (CDAD) is the main cause of nosocomial diarrhea in the world.
Recently there was an outbreak of CDAD in the San Juan de Dios Hospital,
Population and methods: A CDAD case was defined as a patient with diarrhea and with positive ELISA for C. difficile A toxin in feces. An analysis of the annual incidence of CDAD from 2004 to 2008, and the monthly incidence in 2009 at HSJD was made, as well as a retrospective and observational study of 112 medical records for patients diagnosed with CDAD treated at this hospital, from November 15, 2008 to June 15, 2009. The analysis of the data was made using descriptive statistics and measures of association.
Results: The incidence of CDAD increased significantly since the end of 2008 and reached its maximum peak in April 2009, when sanitary measures were implemented. They reduced by 75% the number of patients with CDAD in 8 months. Of the 112 medical records reviewed, 63 (56%) were men. The mean age was 65.33 years, 103 (92%) patients developed the disease while hospitalized; the mean period of hospitalization was 18.6 days. Only 9% did not suffer from any comorbidity. The most frequent comorbidities were: hypertension and type 2 diabetes, with 57.5% and 39.8%, respectively, and neuropsychiatric disease with 29.2%. A 96% (107 patients) had received three or more antibiotics before the onset of diarrhea. The mean duration of antibiotic therapy was 32 days per patient. In average, the duration of diarrhea was 10.2 days (1-90 days). Most patients were treated with metronidazole or vancomycin. The mortality directly associated to CDAD was 7%.
Discussion: An outbreak of CDAD in a national hospital with 700 beds is described. It was observed more frequently in elderly (>65 years) with long hospital stays, with multiple comorbidities and who had received multiple antibiotics for prolonged periods; mainly cefotaxime, fluoroquinolones or clindamycin. After sanitary and medical measures were implemented, the impact was reduced in 75% over 8 months.
Key words: Diarrhea, Clostridium difficile, outbreak, nosocomial infection.
La enfermedad diarreica asociada a Clostridium difficile (EDACD) está en la palestra de la medicina en el mundo, debido a los constantes brotes notificados en la bibliografía médica, con repercusiones en los niveles sanitario, económico y científico.1-3
C.difficile es un bacilo Gram positivo, anaerobio, formador de esporas y productor de toxinas citotóxicas. Está presente en las heces de menos del 5% de la población adulta sana, y el 20- 30% de los pacientes hospitalizados son colonizados por esta bacteria durante la primera semana.1 Debido a su habilidad para formar esporas termoestables, no es fácilmente erradicado del ambiente hospitalario. A pesar de su descubrimiento en 1935, no es hasta 1977 cuando se relaciona con una entidad clínica, la colitis pseudomembranosa asociada al uso de antibióticos, en ese momento, con la clindamicina.4
C. difficile es la causa más frecuente de diarrea adquirida en el hospital, estimándose en decenas de miles de casos por año en todo el mundo, con costos mayores a los mil millones de dólares.5 En las últimas décadas se ha observado un aumento importante en el número de pacientes, debido a la mejora en los métodos diagnósticos, al incremento en el uso de antibióticos y quimioterápicos, así como al aumento de la cantidad de enfermos, lo que eleva la contaminación de los centros de salud con las esporas, con mayor posibilidad de infección de pacientes susceptibles.6
En el Hospital San Juan de Dios, en Costa Rica, ocurrió un brote de EDACD a finales de 2008 y en el primer semestre de 2009. En este trabajo se describen las características epidemiológicas, clínicas y microbiológicas de ese episodio.
Materiales y métodos
La definición de caso de EDACD se realizó por la presencia de diarrea y la positividad de la toxina A de C.difficile en heces, por la prueba de ELISA. Se analizó la incidencia anual de EDACD en el Hospital San Juan de Dios, para pacientes adultos, con aproximadamente 700 camas, desde 2004, y en 2009, la mensual. Se estudiaron los expedientes de 112 pacientes atendidos con el diagnóstico de EDACD, en el periodo comprendido entre el 15 de noviembre de 2008 y el 15 de junio de 2009. El estudio es observacional, retrospectivo, descriptivo y transversal; fue aprobado por el Comité de Bioética del centro médico.
De cada paciente se analizó la siguiente información epidemiológica: edad; género; domicilio por provincia, cantón y distrito; fecha de ingreso al HSJD; fecha de inicio de la diarrea. Se registraron las comorbilidades e infecciones asociadas en todos los pacientes y se consignó el servicio donde desarrolló la diarrea, así como el tipo de antibiótico utilizado y el tiempo de empleo previo al inicio de la diarrea. Se recolectaron las siguientes variables clínicas: cantidad de deposiciones diarias, presencia de dolor abdominal, fiebre según temperatura máxima (su valor más alto en el curso de la enfermedad), uso de laxantes, uso de fármacos que modifican la acidez gástrica, uso de sonda nasogástrica y antecedentes de cirugía reciente (en los últimos 3 meses), leucocitosis, porcentaje de bandas y albúmina sérica.
Se obtuvo el tratamiento inicial para la diarrea: metronidazol oral, metronidazol parenteral, vancomicina oral 125 mg o 500 mg cada 6 horas, probióticos, prebióticos, colestiramina e inmunoglobulina; y por último, la suspensión del uso de “antibióticos agresores”; indicando la duración de estos. También se documentaron las complicaciones de la diarrea: recurrencia, megacolon tóxico, bacteremia, trastorno hidroelectrolítico, insuficiencia renal aguda, perforación intestinal, sangrado digestivo, choque séptico u otras.
Con respecto a la recurrencia, se indicó el tiempo de latencia entre el primer y segundo episodio; no se consignó si hubo más de dos episodios. Por último, se recolectó el dato de si hubo fallecimiento y su relación con la diarrea.
El análisis microbiológico fue publicado previamente. 8
Los datos se digitaron en el programa Excel, y para su análisis se utilizaron pruebas estadísticas descriptivas.
Resultados
La incidencia de EDACD aumentó desde noviembre de 2008 y alcanzó el pico máximo en abril de 2009. Se documentó un exceso de 216 casos sobre lo esperado en 2009. Con las medidas tomadas en el Hospital, se logró disminuir el número de casos nuevos en un 75%, en el transcurso de 8 meses, con una incidencia mensual inferior a la observada en años anteriores (Figs. 1 y 2).
De los 112 pacientes analizados (Cuadro1), 63 eran hombres (56%). La edad promedio fue de 65,33 años (DE=16.63) y el rango de edad varió entre 16 y 93 años.
Diez pacientes desarrollaron la enfermedad antes de su ingreso, o el primer día de este. Los 102 pacientes restantes (93%) fueron diagnosticados durante su hospitalización, y el tiempo promedio de aparición fue de 18,6 días, con una mediana de 14 y una moda de 5 días.
En promedio, la duración de
El 71% de los pacientes fue ingresado al servicio de Medicina Interna, el 28% a Cirugía y el 1% permaneció en Emergencias.
Solo el 9% de los pacientes no presentaba ninguna comorbilidad conocida en el momento del diagnóstico. Las comorbilidades más frecuentes fueron: HTA y DM tipo 2, con un 57,5% y un 39,8%, respectivamente. Un 29,2% asoció alguna enfermedad neuropsiquiátrica, siendo las cuatro más relevantes: evento cerebrovascular (10%), epilepsia (6%), depresión (3%) y demencia (3%); otras patologías asociadas fueron nefropatía con y sin diálisis (15%) y cáncer (10%).
Las infecciones concomitantes estuvieron presentes en 105 pacientes (93%) y fueron: infección del tracto urinario 42% (ITU), 34% bronconeumonía (BN), 25% infección de piel y tejidos blandos (IPTB), 16% bacteremia, 6% infección de vías respiratorias superiores (IVRS) y 1% de infección del sistema nervioso central.
Solo 5 personas (4%) no habían recibido algún antibiótico al momento del diagnóstico; en el resto (107, 96%) se utilizaron al menos 3 antibióticos diferentes antes de presentarse la enfermedad (dos pacientes recibieron 9 antibióticos y uno 11 antibióticos diferentes).
La duración promedio del uso de antibióticos fue de 32 días (1-96 días).
Los tres antibióticos más utilizados fueron: cefalosporinas de tercera generación, ciprofloxacina y clindamicina, en ese orden.
La fiebre se demostró en un 72% de los pacientes. El dolor abdominal estuvo presente en el 50% de los enfermos. La leucocitosis promedio fue de 19.803/mm3 (30093000 células/mm3). El promedio de formas inmaduras, particularmente las bandas, fue del 9%. Cerca del 60% presentó hipoalbuminemia. Por otro lado, el 28% tenía un antecedente reciente de cirugía.
El 12,4% de los pacientes había recibido algún laxante previo al inicio de los síntomas; el 46,9% había recibido inhibidores de la bomba de protones (IBP) como antiácido, y el 68%, inhibidores de los receptores H2. Solo en un 23% se usó sonda nasogástrica (SNG).
El tratamiento del primer episodio, en promedio, fue de 13 días por paciente.
El 87,5% de los pacientes recibió metronidazol oral en algún momento; el 16% metronidazol parenteral; el 25% vancomicina oral 125mg cada 6 hrs, y el 5,3%, vancomicina oral 500mg cada 6 hrs. El 58% de los pacientes solo recibió un medicamento para su primer episodio de EDACD. Como tratamientos alternativos se utilizaron probióticos en un 6,25%, colestiramina en un 10%, inmunoglobulina en un 3%, y colectomía en un 1%.
Con respecto a las complicaciones, se presentaron en 93 pacientes (83%), y las más frecuentes fueron: insuficiencia renal aguda (IRA) (39%), trastornos hidroelectrolíticos (18%), recurrencia choque séptico (10%) o hipovolémico (5%), sangrado digestivo alto (SDA) (5%), bacteriemia (3%), megacolon tóxico (2%) y un paciente sufrió perforación de este.
Dieciocho pacientes (16%) fallecieron y solo 7 (6%) de ellos por causa directa de
El análisis bacteriológico se realizó a 37 aislamientos de la bacteria; todos mostraron resistencia in vitro a clindamicina y a fluoroquinolonas, y sensibilidad a vancomicina y metronidazol; el 54% fue del tipo NAP1, positivos para genes que codifican para toxina A y B (tdcA, tdcB) y para toxina binaria y con deleción del gen tcdC, regulador de la transcripción de toxinas.
Discusión
Desde finales de los años 90, hospitales en diferentes partes del mundo se han visto enfrentados a una nueva epidemia:
En el estudio, la información del Comité Local para
Con estas medidas se logró una disminución significativa del número de pacientes en un corto tiempo, y las complicaciones y la letalidad fueron similares y en algunos casos menores a las reportadas en otros países.10, 11 Se logró identificar por primera vez en Latinoamérica la cepa de C. difficile NAP1, responsable de este y otros brotes en el mundo.3, 8
Los datos obtenidos en el estudio ponen de manifiesto la afectación desproporcionada de los adultos mayores, siendo el promedio de edad de 65,33 años, y la edad mediana de 67 años. Esta tendencia de la enfermedad, de afectar de forma preferente a adultos mayores de 65 años, es concordante con la bibliografía.2,12-14
Las comorbilidades de los pacientes, otro factor de riesgo, describen muy bien a la población desde un punto de vista clínico – biológico, ya que el 91% de los enfermos presentaba alguna patología asociada.
Datos del Servicio de Farmacia del HSJD mostraron que de
Las estancias hospitalarias prolongadas también son un factor de riesgo para
Entre las manifestaciones clínicas, la fiebre y el dolor abdominal fueron las más frecuentes. Con respecto a la fiebre, debe analizarse el dato con precaución, ya que podría estar relacionada con una infección concomitante.
La leucocitosis es un hallazgo común reportado en la bibliografía médica y se ha relacionado con la severidad de la infección, así como la hipoalbuminemia, la cual estuvo presente en más del 60% de los pacientes.1, 11, 18 Este último dato puede asociarse a la pérdida de proteínas por la diarrea, al comportarse esta como una enteropatía perdedora de proteínas.24
Por otro lado, 31 pacientes (28%) tenían antecedente de cirugía reciente en los tres meses previos al episodio diarreico, dato que revela algo muy similar a lo ocurrido en otros brotes, como el de Canadá.16,24
Antes de la aparición de esta nueva cepa, el tratamiento de
Desde que la cepa NAP1 se ha relacionado con esta patología, el tratamiento es más complejo y las complicaciones más frecuentes y graves,10, 17, 21 aún cuando algunos autores dudan de que la severidad obedezca exclusivamente a esta cepa.11,18,19
En nuestra experiencia y en los reportes en la bibliografía mundial,25, 26 existe consenso acerca de que en los brotes donde se vea involucrada la cepa hipervirulenta, los pacientes deben ser tratados agresivamente desde el inicio, utilizando vancomicina VO por 2-3 semanas, con lo que se disminuirá tanto la duración de la diarrea como las complicaciones. En algunas ocasiones deberá asociarse metronidazol EV, ya que la biodisponibilidad por VO de este antibiótico a nivel intestinal, no es suficientemente alta. Con este estudio no es posible concluir cuál fue el mejor esquema terapéutico, ya que fue de tipo retrospectivo.
Se ha discutido el valor de los tratamientos alternativos como probióticos, inmunoglobulina, fecaloterapia, etc., sin embargo, solo el uso de inmunoglobulina ha demostrado alguna utilidad, con base en la inmunodeficiencia demostrada en algunos pacientes con múltiples recurrencias. 27,28 Durante el brote, esta terapia se utilizó en tres pacientes con resultados satisfactorios.
Con respecto a las complicaciones, fueron similares a las reportadas en la bibliografía,2 ,5-7 y llama la atención la baja recurrencia, así como la letalidad asociada directamente a esta patología, contraria a la percepción popular externada en la prensa nacional en el momento del brote.
Los estudios bacteriológicos durante este brote 8 demostraron por primera vez en Latinoamérica la presencia de la cepa hipervirulenta de C. difficile NAP1, asociada a brotes epidémicos en varios lugares del mundo.
En conclusión, en 2008 y 2009 se presentó un brote de EDACD en el HSJD, un hospital de 700 camas para adultos, y se identificó la cepa NAP1, por primera vez en Latinoamérica, como responsable en un grupo de pacientes. Gracias a las medidas implementadas, la emergencia fue controlada satisfactoriamente si se compara con brotes ocurridos en otras latitudes, donde inclusive debió procederse con el cierre de hospitales.
La aparición de un brote tan multifactorial y complejo como el descrito en el presente estudio, debe hacer ver la realidad acerca de la calidad del servicio médico brindado a los paciente en su totalidad, y permitir identificar puntos débiles en la atención cotidiana. Eventos como este ponen a prueba la capacidad de respuesta de un hospital y su equipo humano.
Agradecimientos a
Bibliografía
1. Thielman NM y Wilson KH. Antibiotic -Associated Colitis In Mandell,
2. Freeman J, Bauer MP, Baines SD, Corver, J Fawley WN, Goorhuis B et al. The changing epidemiology of Clostridium difficile infections. Clin Microbiol Rev 2010; 23: 529-549. [ Links ]
3. Clements ACA, Soares Magalhaes, RJ Tatem, AJ Paterson, DL Riley TV. Clostridium difficile PCR ribotype 027: assessing the risks of further worldwide spread. Lancet Infect Dis 2010; 10: 395-404. [ Links ]
4.
5. McDonald CL, Killgore GE, Thompson A, Owens RC, Kazakova SV, Sambol SP et al. An Epidemic, toxin gene-variant strain of Clostridium difficile N Engl J Med 2005; 353: 2433-2441. [ Links ]
6. Kelly CP y LaMont T. Clostridium difficile-more difficult than ever. N Engl J Med 2008; 359: 1932-1940. [ Links ]
7. Gravel D Miller, M Simor, A Taylor, G Gardam, M McGeer A et al. Health care-associated Clostridium difficile infection in adults admitted to acute care hospitals in
8. Quesada-Gómez, C Rodríguez, C Gamboa-Coronado, M Rodríguez-Cavallini, E Du T Mulvey MR et al. Emergence of Clostridium difficile NAP1 in Latin America. J Clin Microbiol 2010; 48: 669-670. [ Links ]
9. Gerding D,
10. Loo V Poirier, L Miller, MA Oughton, M Libman, MD Michaud S. A predominantly clonal multi-institutional outbreak of Clostridium difficile-associated diarrhea with high morbidity and mortality. N Engl J Med 2005; 353: 2442-2449. [ Links ]
11. Hookman P y Barkin J. Clostridium difficile associated infection, diarrhea and colitis. World J Gastroenterol 2009; 15: 1554-1580. [ Links ]
12. Jagai J y Naumova E. Clostridium difficile-associated disease in the elderly.
13. Zilberberg MD, Shorr AF, Micek ST, Doherty JA y Kollef M H. Clostridium difficile-associated disease and mortality among the elderly critically ill. Crit Care Med 2009; 37: 2583-2589. [ Links ]
14. Diggs NG y Surawicz CM. Clostridium difficile infection: still principally a disease of the elderly. Therapy 2010; 7: 295-301. [ Links ]
15. Cober ED y Malani P N. Clostridium difficile infection in the “oldest” old: clinical outcomes in patients aged 80 and older. J Am Geriat Soc 2009; 57: p 659-662. [ Links ]
16. Raveh D, Rabinowitz B, Breur GS, Rudensky B y Yinnon AM. Risk factors for Clostridium difficile toxin-positive nosocomial diarrhea. Int J Antimicrob Agents 2006; 28: 231-237. [ Links ]
17. Pépin J, Valiquette L y Cossette B. Mortality attributable to nosocomial Clostridium difficile-associated disease during an epidemic caused by a hypervirulent strain in Quebec. CMAJ 2005; 173: 1037-1042. [ Links ]
18. Suneshide RH y McDonald LC. Clostridium difficile-associated disease. New challenges from an established pathogen. Clev Clin J Med 2006; 73: p 187-197. [ Links ]
19. Blondeau J M. What have we learned about antimicrobial use and the risks for Clostridium difficile-associated diarrhoea? J Antimicrob Chemother 2009; 63: 238-242. [ Links ]
20. Weiss K, Bergeron L, Bernatchez H, Goyette M, Savoie M y Thirion D. Clostridium difficile-associated diarrhoea rates and global antibiotic consumption in five Quebec institutions from 2001 to 2004. Int J Antimicrob Agents 2007; 30: 309-314. [ Links ]
21. Owens RC, Donskey CJ, Gaynes RP, Loo VG y Muto CA. Antimicrobial-associated risk factors for Clostridium difficile infection. Clin Infect Dis 2008; 46: S 19–31. [ Links ]
22. Pépin J, Saheb N, Coulombe MA, Alary ME, Corriveau SA, Leblanc M et al. Emergence of fluoroquinolones as the predominant risk factor for Clostridium difficile-associated diarrhea: a cohort study during an epidemic in
23. Saxton K,
24. Efron P y Mazuski J E. Clostridium difficile colitis. Surg Clin N Am 2009; 89: 483-500. [ Links ]
25.Bartlett JG.The case for vancomycin as the preferred drug for treatment of Clostridium difficile infection.Clin Infect Dis 2008;46: 1489-1492. [ Links ]
26. Cohen SH, Gerdin DN, Johnson S, Kelly CP, Loo V McDonald CL et al. Clinical practice guidelines for Clostridium difficile infection in adults: 2010 update by the Society for Healthcare Epidemiology of America (SHEA) and the Infectious Diseases Society of America (IDSA). Infect Control Hosp Epidemiol 2010; 31: 431-455. [ Links ]
27. Aslam S, Richard J, Hamill RJ y Musher DM. Treatment of Clostridium difficile-associated disease: old therapies and new strategies. Lancet Infect Dis 2005; 5: 549–57. [ Links ]
28. Wilcox MH. Descriptive study of intravenous immunoglobulin for the treatment of recurrent Clostridium difficile diarrhea. J Antimicrob Chemother 2004; 53: 882–884. [ Links ]
Afiliación de los autores: 1Médico Asistente de Infectología, Hospital San Juan de Dios. 2Médico Asistente de Infectología, Hospital San Juan de Dios. Profesor Asociado Escuela de Medicina UCR.
*Correspondencia a: manuel701@gmail.com
Fecha recibido: 27 de julio de 2011 Fecha aceptado: 10 de mayo de 2012











 text in
text in