Services on Demand
Journal
Article
Indicators
-
 Cited by SciELO
Cited by SciELO -
 Access statistics
Access statistics
Related links
-
 Similars in
SciELO
Similars in
SciELO
Share
Acta Médica Costarricense
On-line version ISSN 0001-6002Print version ISSN 0001-6012
Acta méd. costarric vol.54 n.1 San José Jan./Mar. 2012
Revisión
La era de la farmacogenómica: el ejemplo del clopidogrel
Farmacogenomics Era: The Clopidogrel Example
Allan Ramos-Esquivel1 Alejandro Flores-Boniche2
*Correspondencia
Resumen:
La farmacología es una rama de la medicina con crecientes y nuevas técnicas en secuenciación y epidemiología genética. Recientemente, múltiples estudios científicos han generado una interrogante sobre la posibilidad de brindar una terapia individualizada, con base en el componente genético de cada individuo. Ante esto se presenta un interés particular, cuando se plantea que dicho componente genético modifica la respuesta farmacológica a una droga ampliamente prescrita, como es el caso del clopidogrel, utilizada en casos de síndrome coronario agudo e intervención coronaria percutánea. Esta revisión discute aspectos relacionados con el mecanismo de acción del clopidogrel, y la manera en que estos procesos pueden verse afectados por las principales variaciones genéticas, traducido en distintos resultados clínicos de los pacientes.
Descriptores: clopidogrel, farmacogenómica, farmacología, genética
Abstract:Pharmacology is a branch of the medicine with growing new techniques in sequencing and genetic epidemiology. Recently, a large amount of scientific studies has brought up a question mark as for the possibility to provide an individualized therapy, based on the genetic grounds of each individual. This topic arises a particular interest, when the genetic component modifies the pharmacologic response to a widely prescribed drug, such as clopidogrel, mainly used in Acute Coronary Syndrome cases and Percutaneous Coronary Interventions. This review discusses aspects related to the mechanisms of action of clopidogrel, and the way these processes can be affected by genetic variations, altering the clinical outcomes of patients receiving this drug.
Keywords: Clopidogrel, farmacogenomics, pharmacology, genetic.
¿Qué es farmacogenómica?
La farmacogenómica es la disciplina que examina las bases genéticas de las variaciones individuales de la respuesta a los medicamentos.1 Las implicaciones de estos conocimientos afectan el desarrollo de nuevos fármacos, así como su prescripción en la práctica clínica.2
Los avances de nuevas técnicas de secuenciación y el progreso de la epidemiología genética han generado nuevos puntos de vista a innumerables áreas de la medicina tales como la farmacología. Recientemente una gran cantidad de estudios han generado la interrogante sobre la posibilidad de brindar una terapia individualizada basada en el componente genético de cada individuo, lo cual genera un interés particular cuando dicho componente genético modifica la respuesta farmacológica a una droga ampliamente prescrita como el clopidogrel. Más aún, esta variabilidad genética puede traer consigo consecuencias clínicas en términos de morbilidad y mortalidad.
Hoy en día, un creciente número de recomendaciones basadas en información farmacogenética son hechas por la Administración de Comida y Drogas de los EEUU (Food and Drug Administration; FDA), haciendo imperante la revisión de algunas de estas sugerencias, sobre todo cuando se relacionan con la enfermedad cardiovascular; principal causa de muerte del mundo desarrollado.3,4
Los determinantes genéticos de la respuesta a los diversos fármacos pueden agruparse en dos categorías, dependiendo si afectan la farmacodinamia o la farmacocinética de tal medicamento.5 Los estudios iniciales de la farmacogenética se iniciaron hace más de cincuenta años y se enfocaron a investigar las variaciones del metabolismo y eliminación de ciertas drogas.6 Más recientemente, se han hecho importantes avances sobre factores genéticos que afectan la farmacodinamia de ciertos medicamentos,7 generando un novedoso concepto de terapia personalizada, dependiendo del componente genético de cada individuo.8
El caso del clopidogrel
El clopidogrel es una tienopiridina utilizada como estándar en el tratamiento del síndrome coronario agudo (SCA). Es el fármaco de elección para la prevención de la trombosis después de una intervención coronaria percutánea (ICP) con implante de endoprótesis coronaria ("stent"),9 a la vez que ha demostrado un aumento en la sobrevida y una reducción de eventos coronarios cuando se administra solo o en combinación con aspirina, en pacientes con cardiopatía isquémica o durante un SCA.10-16
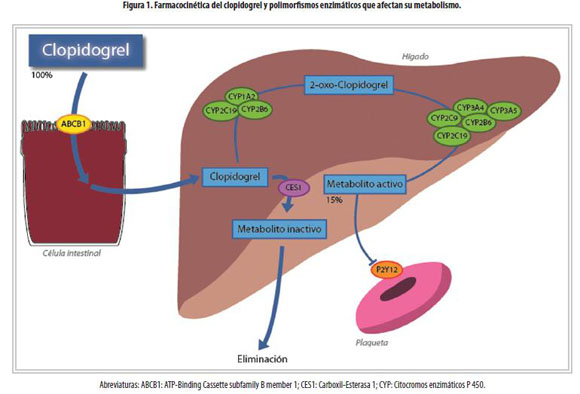
El clopidogrel es una prodroga que requiere la presencia de la glicoproteína P, codificada en el gen de multirresistencia a drogas 1 (MDR1) o ATP-Binding Cassette subfamily B member 1 (ABCB1), para su absorción.17-19 Una vez absorbida, la molécula debe transformarse a su metabolito activo a través de dos pasos; en el primero de ellos se produce el 2-oxo-clopidogrel por medio de las enzimas CYP 2C19, 2B6 y 1A2, mientras que la producción del tiol activo depende de la actividad del CYP 2C19, 3A4/5, 2B6 y 2C9.17 Finalmente, este compuesto inhibe el receptor P2Y12 de adenosín difosfato (ADP) expresado en las plaquetas, el cual, normalmente facilita la degranulación de las mismas y la expresión del receptor GP IIb/IIIa en su superficie.19-22 Únicamente el 15% de la prodroga es convertido al metabolito activo y el resto es hidrolizado por esterasas.23-26 (Figura 1)
Se ha descrito que la respuesta al clopidogrel varía ampliamente entre individuos, reportándose falta de respuesta que va desde un 4% a un 30% posterior a 24 horas de administrado el medicamento, dependiendo del método utilizado para comprobar el efecto farmacológico.27, 28
Ante la magnitud de tal variabilidad, diversos estudios han señalado a un grupo de pacientes que recibiendo las dosis usuales de clopidogrel, presentan una agregación plaquetaria diferente a otros sujetos en las mismas condiciones clínicas; mientras que otros autores sugieren que lo anterior conlleva a un riesgo aumentado de eventos cardiovasculares.29-53
No obstante, es necesario señalar que esta variabilidad no solo depende de determinantes genéticos, sino también de factores como la edad, el tabaquismo, el índice de masa corporal, comorbilidades como la diabetes mellitus, ciertas dislipidemias y la presencia de interacciones medicamentosas.54, 55
1. Variables genéticas que modifican la respuesta farmacológica del clopidogrel
Los polimorfismos genéticos son variables alélicas que se presentan en al menos un 1% de la población y constituyen la principal fuente de variedad genética entre individuos. Muchas de estas variaciones son la consecuencia de cambios en un solo nucleótido de la cadena codificante de ADN y se conocen como polimorfismos de un solo nucleótido o SNP ("Single Nucleotide Polymorphism). Las consecuencias fenotípicas de estas modificaciones se traducen en variables funcionales de las proteínas o enzimas codificadas por tal gen.
A continuación se exponen las variantes genéticas implicadas en la variabilidad clínica del clopidogrel.
a. Polimorfismos del transportador ABCB1 (MDR1)
Una vez ingerido, el clopidogrel es absorbido por las vellosidades intestinales a través del transportador ABCB1 (ATP- Binding Cassette subfamily B member 1), también denominado MDR1. Aquellos sujetos que tienen una copia (genotipo C3435T) o dos (genotipo TT) del gen ABCB1, poseen una disminución considerable de la biodisponibilidad de esta droga.18
Al ser analizadas las consecuencias clínicas de este polimorfismo, se ha llegado a resultados contradictorios. Así por ejemplo, datos retrospectivos del estudio TRITON – TIMI 38, revelan que la frecuencia del genotipo TT en pacientes con infarto agudo de miocardio se relaciona con un peor pronóstico y una menor sobrevida en aquellos pacientes asignados a recibir clopidogrel versus prasugrel;56 mientras que análisis retrospectivos del estudio PLATO indicaron que la presencia de alguno de los alelos señalados no modificaba la respuesta clínica al administrar ticagrelor o clopidogrel a pacientes con SCA.57,58
b. Polimorfismos de enzimas hepáticas:
El clopidogrel como la gran mayoría de fármacos sufre transformación enzimática a través de mecanismos de oxidación y reducción llevados a cabo por enzimas del sistema microsomal hepático portadoras del citocromo P450. Algunas variantes de tales enzimas han sido implicadas en la diversidad del efecto clínico del clopidogrel como se expone a continuación.
i. Variantes de la CYP 2C19
En la transformación del clopidogrel hacia su metabolito activo, la enzima CYP2C19 cumple un papel preponderante, dado que varios polimorfismos asociados a tal gen, generan una gran variabilidad del efecto farmacológico de tal droga.25,54,59 Esta enzima es responsable de aproximadamente un 45% del primer paso del metabolismo del clopidogrel (en la formación del 2-oxo-clopidogrel) y alrededor de un 20% del paso final en la generación del metabolito activo.17
Alrededor de 30 variaciones alélicas han sido reportadas para este gen.60 La variante CYP2C19*1 codifica para la enzima normal. Las variantes CYP2C19*2 y CYP2C19*3 codifican para proteínas defectuosas. La frecuencia de la variante CYP2C19*2 se estima en cercana al 50% de la población asiática, un 19% en hispanos, 34% en afroamericanos y 25% en caucásicos.61,62 Se ha descrito que los portadores de dos alelos defectuosos del CYP2C19*2 (homocigotos) tienen una reducción en la actividad plaquetaria más pronunciada que aquellos sujetos con solo una pérdida del alelo funcionante (heterocigotos).25
Las implicaciones clínicas de este polimorfismo son nuevamente contradictorias. Así por ejemplo, el análisis genético post – hoc del estudio CURE63 y datos prospectivos del estudio PLATO57, señalaron que el efecto del clopidogrel es independiente del genotipo CYP2C19. De forma contradictoria un análisis post-hoc del estudio TRITON- TIMI 38 señaló un aumento del riesgo de muerte de causa cardiovascular, eventos cerebrovasculares o infarto de miocardio en portadores versus no portadores de tal genotipo (hazard ratio = 1.53 IC95% 1.07 – 2.19).56
Dos metaanálisis demostraron un aumento del riesgo de trombosis de la endoprótesis coronaria en pacientes sometidos a una ICP portadores de al menos un polimorfismo disfuncional de la enzima CYP2C19 en comparación con no portadores (hazard ratio= 2.67; IC95% 1.69-4.22; P<.0001)64, así como un aumento del riesgo de eventos cardiovasculares en pacientes con el genotipo CYP2C19*2.65 Un reciente metaanálisis por otra parte, reporta que no hay una influencia consistente y sustancial de los polimorfirmos de este gen y la eficacia clínica del clopidogrel.66
Diferentes metodologías pueden explicar en parte tal divergencia de resultados; así pues, aquellos estudios que señalan un aumento de eventos clínicos toman en cuenta pacientes de alto riesgo cardiovascular que ameritan una ICP de rescate, lo cual sugiere que el efecto del genotipo sobre la respuesta clínica varía dependiendo de otros factores de riesgo.58,67 A pesar de lo anterior, estudios genómicos recientes reportan que la presencia del polimorfismo CYP2C19 solo explica el 12% de la diferente agregabilidad plaquetaria entre sujetos de una población homogénea.54
ii. Otras variantes enzimáticas de la familia CYP 450
Tal como se señala en la figura 1, otras enzimas asociadas al CYP450 participan en el metabolismo del clopidogrel. Se ha reportado una menor agregación plaquetaria en sujetos portadores del alelo CYP2B6 defectuoso, con consecuencias clínicas no bien establecidas. Por otra parte, variaciones en el alelo CYP3A5 no estuvieron asociadas con un aumento de eventos clínicos en un reciente estudio.25 De igual forma, la presencia de polimorfismos en el alelo CYP2C17 (que codifica por una proteína con mayor actividad enzimática) no se tradujo en consecuencias clínicas en dicho estudio.25
c. Polimorfismos en receptores plaquetarios
A la fecha, únicamente un estudio ha revelado efectos clínicos neutros en pacientes con polimorfismos del receptor P2Y12. Similarmente, dicho estudio no encontró relación alguna entre el riesgo de muerte de cualquier causa, eventos cerebrovasculares no fatales o infarto agudo de miocardio y la presencia de polimorfismos en el gen que codifica por la integrina beta ITGB3 que media la agregación plaquetaria a través del fibrinógeno soluble.58
2. Alternativas al clopidogrel
Diferentes estrategias se han promovido con el fin de disminuir la variabilidad en la agregación plaquetaria de los pacientes que reciben clopidogrel y evitar posibles consecuencias clínicas. Así por ejemplo, varios estudios clínicos han estudiado el efecto de una dosis de carga y/o de mantenimiento mayor a la usual, en pacientes con una respuesta subóptima al clopidogrel ya documentada o no. Sin embargo, a la fecha, no existen estudios clínicos que exploren este aumento de dosis tomando como base únicamente la presencia de un genotipo específico. Si bien es cierto que una dosis de carga de 600 mg y una dosis de mantenimiento de 150 mg diarios producen una disminución de la agregación plaquetaria mayor que las dosis usuales,52, 68-74 los beneficios clínicos netos de esta posología son poco concluyentes.75, 76
Otra alternativa explorada consiste en agregar una tercera droga junto a la aspirina y al clopidogrel, y de esta manera reducir la actividad plaquetaria residual en ciertos pacientes. De esta forma, se ha utilizado el cilostazol en pacientes sometidos a ICP con resultados nuevamente contradictorios.77,78 Similares hallazgos poco concluyentes se han obtenido cuando se añaden ácidos grasos omega-3, o inhibidores de la glicoproteína IIb/ IIIa.79-81
Finalmente, nuevos antiplaquetarios como prasugrel y ticagrelor han demostrado ser alternativas eficaces para reducir la actividad plaquetaria a mayor grado,81-84 y con menor variabilidad que el clopidogrel. El prasugrel ha demostrado tener una respuesta clínica consistente en diferentes poblaciones de pacientes, tanto en cardiópatas crónicos como en el contexto de un SCA.82, 86 Además, datos del estudio TRITON-TIMI 38,86 mostraron en un grupo de pacientes candidatos a ICP después de un SCA, una reducción de eventos isquémicos (incluida la trombosis del stent) en el grupo asignado a prasugrel en comparación con quienes recibieron clopidogrel, a pesar de un aumento de la tasa de sangrados (de ahí su contraindicación en pacientes con un evento cerebrovascular isquémico). El ticagrelor (aún no aprobado por la FDA) mostró por su parte una reducción significativa del evento primario compuesto de muertes de causas cardiovasculares, eventos cerebrovasculares e infarto de miocardio no fatal en comparación con clopidogrel sin un aumento de la tasa de sangrados.87
3. Conclusiones actuales
En la actualidad, gracias a los avances de la farmacogenómica, es posible detectar factores que explican la variabilidad de la respuesta farmacológica entre individuos. "El ejemplo del clopidogrel" nos permite corroborar la diversidad de modificaciones genéticas que podrían incidir en una mayor frecuencia de eventos clínicos.
A la fecha no existe suficiente evidencia que recomiende la implementación masiva de estudios genotípicos para modificar la respuesta clínica de un paciente que amerite el uso de clopidogrel. Sin embargo, tal relación tampoco puede descartarse, y nos encontramos a la espera de publicación de nuevos estudios. Por tal razón, la Asociación Americana del Corazón recomienda continuar apegado a las normas clínicas actuales y utilizar el "juicio clínico" para solicitar un eventual estudio genético que modifique la terapéutica empleada. Más aún, se dispone de ciertas estrategias farmacológicas como alternativas viables para los pacientes en los cuales se sospeche una falla terapéutica al clopidogrel. Finalmente, es necesario recalcar que el componente genético es solo uno de los múltiples factores que modifican la respuesta farmacológica a esta droga, y que la prevención de eventos cardiovasculares en pacientes que reciban antiplaquetarios, debe basarse en la evaluación global de los factores de riesgo, más que en un único estudio genético.
Referencias:
1. Hall IP, Pirmohamed M. Pharmacogenetics. New York: Taylor and Francis 2006. I edición. [ Links ]
2. Lee KC, Ma JD, Kuo GM. Pharmacogenomics: bridging the gap between science and practice. J Am Pharm Assoc 2010; 50: 1-17. [ Links ]
3. Frueh FW, Amur S, Mummaneni P, Epstein RS, Aubert RE, DeLucca TM, et al. Pharmacogenomic bio-marker information in drug labels approved by the United States Food and Drug Administration: prevalence of related drug use. Pharmacotherapy
2008; 28: 992–998. [ Links ]
4. Food and Drug Administration. Table of Valid Genomic Biomarkers in the Context of Approved Drug Labels. En: http://www.fda.gov/Drugs/ScienceResearch/ResearchAreas/ Pharmacogenetics/ucm083378.htm Accedido el 19 de setiembre de 2010. [ Links ]
5. Daly AK. Pharmacogenetics and human polymorphisms. Biochem J 2010; 429: 435-449. [ Links ]
6. Brodie BB, Gillette JR, La Du BN. Enzymatic metabolism of drugs and other foreign compounds. Annu Rev Biochem 1958; 27:
427–454. [ Links ]
7. Hawkins GA, Weiss ST, Bleecker ER. Clinical consequences of ADR 2 polymorphisms. Pharmacogenomics 2008; 9: 349–358. [ Links ]
8. Frueh FW. Real-world clinical effectiveness, regulatory transparency and payer coverage: three ingredients for translating pharmacogenomics into clinical practice. Pharmacogenomics 2010; 11: 657-660. [ Links ]
9. Kushner FG, Hand M, Smith S, King SB, Anderson JL, Antmann EM, et al. Focused Updates: ACC/AHA guidelines for the management of patients with ST-elevation myocardial infarction, and ACC/AHA/SCAI guidelines on percutaneous coronary intervention. Circulation 2009; 120: 2271-2306. [ Links ]
10. CAPRIE Steering Committee. A randomised, blinded, trial of clopidogrel versus aspirin in patients at risk of ischaemic events (CAPRIE). Lancet 1996; 348: 1329-1339. [ Links ]
11. Mehta SR, Yusuf S, Peters RJ, Bertrand ME, Lewis BS, Natarajan MK, et al. Effects of pretreatment with clopidogrel and aspirin followed by long-term therapy in patients undergoing percutaneous coronary intervention: the PCI-CURE study. Lancet
2001; 358: 527-533. [ Links ]
12. Steinhubl SR, Berger PB, Mann 3rd JT, Fry ET, DeLago A, Wilmer C, et al. Early and sustained dual oral antiplatelet therapy following percutaneous coronary intervention: a randomized controlled trial. JAMA 2002; 288: 2411-2420. [ Links ]
13. Yusuf S, Zhao F, Mehta SR, Chrolavicius S, Tognoni G, Fox KK et al. Effects of clopidogrel in addition to aspirin in patients with acute coronary syndrome without ST-segment elevation. N Engl J Med 2001; 345: 494-502. [ Links ]
14. Sabatine MS, Cannon CP, Gibson CM, López-Sendón JL, Montalescot G, Therroux P, et al. Addition of clopidogrel to aspirin and fibrinolytic therapy for myocardial infarction with ST- segment elevation. N Engl J Med 2005; 352: 1179-1189. [ Links ]
15. Chen ZM, Jiang LX, Chen YP, Xie JX, Pan HC, Peto R, et al. Addition of clopidogrel to aspirin in 45,852 patients with acute myocardial infarction: randomised placebo-controlled trial. Lancet 2005; 366: 1607-1621. [ Links ]
16. Sabatine MS, Cannon CP, Gibson CM, Lopez-Sendon JL, Montalescot G, Theroux P, et al. Effect of clopidogrel pretreatment before percutaneous coronary intervention in patients with ST- elevation myocardial infarction treated with fibrinolytics: the PCI- CLARITY study. JAMA 2005; 294: 1224-1232. [ Links ]
17. Marzolini C, Paus E, Buclin T, Kim RB. Polymorphisms in human MDR1 (P-glycoprotein): recent advances and clinical relevance. Clin Pharmacol Ther 2004; 75: 13-33. [ Links ]
18. Taubert D, von Beckerath N, Grimberg G, Lazar A, Jung N, Goeser T, et al. Impact of P-glycoprotein on clopidogrel absorption. Clin Pharmacol Ther 2006; 80: 486-501. [ Links ]
19. Taubert D, Kastrati A, Harlfinger S, Gorchakova O, Lazar A, von Beckerath N, et al. Pharmacokinetics of clopidogrel after administration of a high loading dose. Tromb Haemost 2004; 92: 311-316. [ Links ]
20. Furie B, Furie BC. Mechanisms of thrombus formation. N Engl J Med 2008; 359: 938-949. [ Links ]
21. Hollopeter G, Jantzen HM, Vincent D, Li G, England L, Ramakrishnan V, et al. Identification of the platelet ADP receptor targeted by antithrombotic drugs. Nature 2001; 409: 202–207. [ Links ]
22. Kurihara A, Hagihara K, Kazui M, Ozeki T, Farid NA, Ikeda T. In vitro metabolism of antiplatelet agent clopidogrel: cytochrome P450 isoforms responsible for two oxidation steps involved in the active metabolite formation. Drug Metab Rev 2005; 37(Suppl. 2): 99. [ Links ]
23. Pereillo JM, Maftouh M, Andrieu A, Uzabiaga MF, Fedeli O, Savi P, et al. Structure and stereochemistry of the active metabolite of clopidogrel. Drug Metab Dispos 2002; 30: 1288–1295. [ Links ]
24. Beitelshees AL, McLeod HL. Clopidogrel pharmacogenetics: Promising steps towards patient care?. Arterioscler Thromb Vasc Biol 2006; 26: 1681-1683. [ Links ]
25. Mega JL, Close SL, Wiviott SD, Shen L, Hockett RD, Brandt JT, et al. Cytochrome p-450 polymorphisms and response to clopidogrel. N Engl J Med 2009; 360: 354-362. [ Links ]
26. Hulot JS, Bura A, Villard E, Azizi M, Remones V, Goyenvalle C, et al. Cytochrome P450 2C19 loss-of-function polymorphism is a major determinant of clopidogrel responsiveness in healthy subjects. Blood 2006; 108: 2244-2247. [ Links ]
27. Gurbel PA, Bliden KP, Hiatt BL, OConnor CM. Clopidogrel for coronary stenting: response variability, drug resistance, and the effect of pretreatment platelet reactivity. Circulation. 2003; 107: 2908–2913. [ Links ]
28. Gurbel PA, Cummings CC, Bell CR, Alford AB, Meister AF, Serebruany VL, et al. Onset and extent of platelet inhibition by clopidogrel loading in patients undergoing elective coronary stenting: the Plavix Reduction Of New Thrombus Occurrence (PRONTO) trial. Am Heart J 2003; 145: 239–247. [ Links ]
29. Matetzky S, Shenkman B, Guetta V, Shechter M, Bienart R, Goldenberg I, et al. Clopidogrel resistance is associated with increased risk of recurrent atherothrombotic events in patients with acute myocardial infarction. Circulation 2004; 109:
3171 – 3175. [ Links ]
30. Sofi F, Marcucci R, Gori AM, Giust B, Abbate R, Gensini GF. Clopidogrel non responsiveness and risk of cardiovascular morbidity. An updated meta-analysis. Thromb Haemost 2010; 103: 841-848. [ Links ]
31. Snoep JD, Hovens MM, Eikenboom JC, van der Bom JG, Jukema JW, Huisman MV. Clopidogrel nonresponsiveness in patients undergoing percutaneous coronary intervention with stenting: a systematic review and meta-analysis. Am Heart J 2007; 154:221-231. [ Links ]
32. Muller I, Besta F, Schulz C, Massberg S, Schonig A, Gawaz M. Prevalence of clopidogrel non-responders among patients with stable angina pectoris scheduled for elective coronary stent placement. Thromb Haemost 2003; 89: 783–787. [ Links ]
33. Barragan P, Bouvier JL, Roquebert PO, Macaluso G, Commeau P, Comet B, et al. Resistance to thienopyridines: clinical detection of coronary stent thrombosis by monitoring of vasodilator stimulated phosphoprotein phosphorylation. Catheter Cardiovasc Interv 2003; 59: 295–302. [ Links ]
34. Gurbel PA, Bliden KP, SamaraW, Yoho JA, Hayes K, Fissha MZ, et al. Clopidogrel effect on platelet reactivity in patients with stent thrombosis: results of the CREST Study. J Am Coll Cardiol 2005; 46: 1827–1832. [ Links ]
35. Ajzenberg N, Aubry P, Huisse MG, Cachier A, El Amara W, Feldman LJ, et al. Enhanced shear-induced platelet aggregation in patients who experience subacute stent thrombosis: a case control study. J Am Coll Cardiol 2005; 45: 1753–1756. [ Links ]
36. Buonamici P, Marcucci R, Migliorini A, Gensini GF, Santini A, Paniccia R, et al. Impact of platelet reactivity after clopidogrel administration on drug-eluting stent thrombosis. J Am Coll Cardiol 2007; 49: 2312–2317. [ Links ]
37. Gurbel PA, Bliden KP, Guyer K, Cho PW, Zaman KA, Kreutz RP, et al. Platelet reactivity in patients and recurrent events post- stenting: results of the PREPARE POST-STENTING Study. J Am Coll Cardiol 2005; 46: 1820–1826. [ Links ]
38. Cuisset T, Frere C, Quilici J, Morange PE, Nait-Saidi L, Carvajal J, et al. Benefit of a 600-mg loading dose of clopidogrel on platelet reactivity and clinical outcomes in patients with non-ST-segment elevation acute coronary syndrome undergoing coronary stenting. J Am Coll Cardiol 2006; 48: 1339–1345. [ Links ]
39. Lev EI, Patel RT, Maresh KJ, Guthikonda S, Granada J, DeLao T, et al. Aspirin and clopidogrel drug response in patients undergoing percutaneous coronary intervention: the role of dual drug resistance. J Am Coll Cardiol 2006; 47: 27–33. [ Links ]
40. Cuisset T, Frere C, Quilici J, Barbou F, Morange PE, Hovasse T, et al. High post-treatment platelet reactivity identified low- responders to dual antiplatelet therapy at increased risk of recurrent cardiovascular events after stenting for acute coronary syndrome. J Thromb Haemost 2006; 4: 542–549. [ Links ]
41. HochholzerW, Trenk D, Bestehorn HP, Fischer B, Valina CM, Ferenc M, et al. Impact of the degree of peri-interventional platelet inhibition after loading with clopidogrel on early clinical outcome of elective coronary stent placement. J Am Coll Cardiol
2006; 48: 1742–1750. [ Links ]
42. Geisler T, Langer H, Wydymus M, Gohring K, Zurn C, Bigalke B, et al. Low response to clopidogrel is associated with cardiovascular outcome after coronary stent implantation. Eur Heart J 2006; 27: 2420–2425. [ Links ]
43. Bliden KP, DiChiara J, Tantry US, Bassi AK, Chaganti SK, Gurbel PA. Increased risk in patients with high platelet aggregation receiving chronic clopidogrel therapy undergoing percutaneous coronary intervention: is the current antiplatelet therapy adequate? J Am Coll Cardiol 2007; 49: 657–666. [ Links ]
44. Cuisset T, Frere C, Quilici J, Morange PE, Nait-Saidi L, Mielot C, et al. High post-treatment platelet reactivity is associated with a high incidence of myonecrosis after stenting for non-ST elevation acute coronary syndromes. J Thromb Haemost 2007; 97:
282–287. [ Links ]
45. Bonello L, Paganelli F, Arpin-Bornet M, Auquier P, Sampol J, Dignat-George F, et al. Vasodilator-stimulated phosphoprotein phosphorylation analysis prior to percutaneous coronary intervention for exclusion of postprocedural major adverse cardiovascular events. J Thromb Haemost 2007; 5: 1630–1636. [ Links ]
46. Angiolillo DJ, Bernardo E, Sabate M, Jimenez-Quevedo P, Costa MA, Palazuelos J, et al. Impact of platelet reactivity on cardiovascular outcomes in patients with type 2 diabetes mellitus and coronary artery disease. J Am Coll Cardiol 2007; 50:
1541–1547. [ Links ]
47. Frere C, Cuisset T, Quilici J, Camoin L, Carvajal J, Morange PE, et al. ADP-induced platelet aggregation and platelet reactivity index VASP are good predictive markers for clinical outcomes in non-ST elevation acute coronary syndrome. Thromb Haemost 2007; 98: 838–843. [ Links ]
48. Price MJ, Endemann S, Gollapudi RR, Valencia R, Stinis CT, Levisay JP, et al. Prognostic significance of post-clopidogrel platelet reactivity assessed by a point-of-care assay on thrombotic events after drug-eluting stent implantation. Eur Heart J 2008; 29: 992–1000. [ Links ]
49. Bonello L, Camoin-Jau L, Arques S, Boyer C, Panagides D, Wittenberg O, et al. Adjusted clopidogrel loading doses according to vasodilator-stimulated phosphoprotein phosphorylation index decrease rate of major adverse cardiovascular events in patients with clopidogrel resistance: a multicenter randomized prospective study. J Am Coll Cardiol 2008; 51: 1404–1411. [ Links ]
50. Patti G, Nusca A, Mangiacapra F, Gatto L, DAmbrosio A, Di Sciascio G. Point-of-care measurement of clopidogrel responsiveness predicts clinical outcome in patients undergoing percutaneous coronary intervention results of the ARMYDA-PRO (Antiplatelet therapy for Reduction of MYocardial Damage during Angioplasty-Platelet Reactivity Predicts Outcome) study. J Am Coll Cardiol 2008; 52: 1128–1133. [ Links ]
51. Marcucci R, Gori AM, Paniccia R, Giusti B, Valente S, Giglioli C, et al. Cardiovascular death and nonfatal myocardial infarction in acute coronary syndrome patients receiving coronary stenting are predicted by residual platelet reactivity to ADP detected by a point-of-care assay: a 12-month follow-up. Circulation 2009; 119: 237–242. [ Links ]
52. von Beckerath N, Kastrati A, Wieczorek A, Pogatsa-Murray G, Sibbing D, Graf I, et al. A double-blind randomized study on platelet aggregation in patients treated with a daily dose of 150 or 75 mg of clopidogrel for 30 days. Eur Heart J 2007; 28: 1814–1819. [ Links ]
53. Sibbing D, Braun S, Morath T, Mehilli J, Vogt W, Schomig A, et al. Platelet reactivity after clopidogrel treatment assessed with point- of-care analysis and early drug-eluting stent thrombosis. J Am Coll Cardiol 2009; 53: 849–856. [ Links ]
54. Shuldiner AR, O'Connell JR, Bliden KP, Gandhi A, Ryan K, Horenstein RB, et al. Association of cytochrome CYP 450 2C19 genotype with the antiplatelet effect and clinical efficacy of clopidogrel therapy. JAMA 2009; 302: 849–857. [ Links ]
55. Verstuyft C, Simon T, Kim RB. Personalized medicine and antiplatelet therapy: ready for prime time?. Eur Heart J 2009; 30:1943–1963. [ Links ]
56. Mega JL, Close SL, Wiviott SD, Shen L, Walker JR, Simon T, et al. Genetic variants in ABCB1 and CYP2C19 and cardiovascular outcomes after treatment with clopidogrel and prasugrel in the TRITON-TIMI 38 trial: a pharmacogenetic analysis. Lancet
2010; 376: 1312-1319. [ Links ]
57. Wallentin L, James S, Storey RF, Asmstrong M, Barratt BJ, Horrow J, et al. Effect of CYP2C19 and ABCB1 single nucleotide polymorphisms on outcomes of treatment with ticagrelor versus clopidogrel for acute coronary syndromes: a genetic substudy of the PLATO trial. Lancet 2010; 376: 1320-1328. [ Links ]
58. Simon T, Verstuyft C, Mary-Krause M, et al. Genetic determinants of response to clopidogrel and cardiovascular events. N Engl J Med 2009; 360: 363–375. [ Links ]
59. Collet JP, Hulot JS, Pena A, Villard E, Esteve JB, Silvain J, et al. Cytochrome P450 2C19 polymorphism in young patients treated with clopidogrel after myocardial infarction: a cohort study. Lancet 2009; 373: 309 –317. [ Links ]
60. CYP2C19 allele nomenclature. Home Page of the Human Cytochrome P450 (CYP) Allele Nomenclature Committee. http://www.cypalleles.ki.se/cyp2c19.htm. Accesado el 26 de febrero de 2011. [ Links ]
61. Luo HR, Poland RE, Lin KM, Wan YJ. Genetic polymorphism of cytochrome P450 2C19 in Mexican Americans: a cross-ethnic comparative study. Clin Pharmacol Ther 2006; 80: 33– 40. [ Links ]
62. Man M, Farmen M, Dumaual C, Teng CH, Moser B, Irie S, et al. Genetic variation in metabolizing enzyme and transporter genes: comprehensive assessment in 3 major East Asian subpopulations with comparison to Caucasians and Africans. J Clin Pharmacol 2010; 50(8): 929-40. [ Links ]
63. Paré G, Mehta SR, Yusuf S, Anand SS, Connolly SJ, Hirsh J, et al. Effects of CYP2C19 genotype on outcomes of clopidogrel treatment. N Engl J Med 2010; 363: 1704-1714. [ Links ]
64. Mega JL, Simon T, Collet JP, Anderson JL, Antman EM, Bliden K, et al. Reduced-function CYP2C19 genotype and risk of adverse clinical outcomes among patients treated with clopidogrel predominantly for PCI, A Meta-analysis. JAMA. 2010; 304: 1821-1830. [ Links ]
65. Hulot J-S, Collet J-P, Silvain J, Pena A, Bellemain-Appaix A, Barthélémy O, et al. Cardiovascular risk in clopidogrel treated patients according to cytochrome P450 2C19*2 loss-of-function allele or proton pump inhibitor coadministration: a systematic meta-analysis. J Am Coll Cardiol. 2010; 56(2): 134–143. [ Links ]
66. Bauer T, Bouman HJ, van Werkum J, Ford NF, ten Berg JM, Taubert D. Impact of CYP2C19 variant genotypes on clinical efficacy of antiplatelet treatment with clopidogrel: systematic review and meta-analysis. BMJ 2011; 343: d4588. [ Links ]
67. von Beckerath N, Taubert D, Pogatsa-Murray G, Schömig E, Kastrati A,Schömig A. Absorption, metabolization, and antiplatelet effects of 300-, 600-, and 900-mg loading doses of clopidogrel: results of the ISAR-CHOICE (Intracoronary Stenting and Antithrombotic Regimen: Choose Between 3 High Oral Doses for Immediate Clopidogrel Effect) trial. Circulation 2005; 112: 2946–2950. [ Links ]
68. Angiolillo DJ, Shoemaker SB, Desai B, Yuan H, Charlton RK, Bernardo E, et al. Randomized comparison of a high clopidogrel maintenance dose in patients with diabetes mellitus and coronary artery disease: results of the Optimizing Antiplatelet Therapy in Diabetes Mellitus (OPTIMUS) study. Circulation 2007; 115: 708–716. [ Links ]
69. Fontana P, Senouf D, Mach F. Biological effect of increased maintenance dose of clopidogrel in cardiovascular outpatients and influence of the cytochrome P450 2C19*2 allele on clopidogrel responsiveness. Thromb Res 2008; 121: 463–468. [ Links ]
70. Gladding P, Webster M, Zeng I, Farrell H, Stewart J, Ruygrok P, et al. The antiplatelet effect of higher loading and maintenance dose regimens of clopidogrel: the PRINC (Plavix Response in Coronary Intervention) trial. J Am Coll Cardiol Intv 2008; 1: 612–619. [ Links ]
71. Aleil B, Jacquemin L, De Poli F, Zaehringer M, Collet JP, Montalescot G, et al. Clopidogrel 150 mg/day to overcome low responsiveness in patients undergoing elective percutaneous coronary intervention: results from the VASP-02 (Vasodilator- Stimulated Phosphoprotein-02) randomized study. J Am Coll Cardiol Intv 2008; 1: 631–638. [ Links ]
72. Price MJ, Coleman JL, Steinhubl SR, Wong GB, Cannon CP, Teirstein PS. Onset and offset of platelet inhibition after high-dose clopidogrel loading and standard daily therapy measured by a point-of-care assay in healthy volunteers. Am J Cardiol 2006; 98: 681–684. [ Links ]
73. Montalescot G, Sideris G, Meuleman C, Bal-dit-Sollier C, Lellouche N, Steg PG, et al. A randomized comparison of high clopidogrel loading doses in patients with non–ST-segment elevation acute coronary syndromes: the ALBION (Assessment of the Best Loading Dose of Clopidogrel to Blunt Platelet Activation, Inflammation and Ongoing Necrosis) trial. J Am Coll Cardiol 2006; 48: 931–938. [ Links ]
74. DiSciascio G, Patti G, Pasceri V, Colonna G, Mangiacapra F, Montinaro A, et al. Clopidogrel reloading in patients undergoing percutaneous coronary intervention on chronic clopidogrel therapy: results of the ARMYDA-4 RELOAD (Antiplatelet therapy for Reduction of MYocardial Damage during Angioplasty) randomized trial. Eur Heart J 2010; 31: 1337–1343. [ Links ]
75. Dangas G, Mehran R, Guagliumi G, Caixeta A, Witzenbichler B, Aoki J, et al. Role of clopidogrel loading dose in patients with ST-segment elevation myocardial infarction undergoing primary angioplasty: results from the HORIZONS-AMI (Harmonizing Outcomes with Revascularization and Stents in Acute Myocardial Infarction) trial. J Am Coll Cardiol 2009; 54: 1438–1446. [ Links ]
76. Jeong YH, Hwang JY, Kim IS, Park Y, Hwang Sj, Lee SW, et al. Adding cilostazol to dual antiplatelet therapy achieves greater platelet inhibition than high maintenance dose clopidogrel in patients with acute myocardial infarction: results of the adjunctive cilostazol versus high maintenance dose clopidogrel in patients with AMI (ACCEL-AMI) study. Circ Cardiovasc Interv 2010; 3: 17–26. [ Links ]
77. Han Y, Li Y, Wang S, Jing Q, Wang Z, Wang D, et al. Cilostazol in addition to aspirin and clopidogrel improves long-term outcomes after percutaneous coronary intervention in patients with acute coronary syndromes: a randomized, controlled study. Am Heart J 2009; 157: 733–739. [ Links ]
78. Gajos G, Rostoff P, Undas A, Piwowarska W. Effects of polyunsaturated omega-3 fatty acids on responsiveness to dual antiplatelet therapy in patients undergoing percutaneous coronary intervention: the OMEGA-PCI (OMEGA-3 fatty acids after PCI to modify responsiveness to dual antiplatelet therapy) study. J Am Coll Cardiol 2010; 55: 1671–1678. [ Links ]
79. Cuisset T, Frere C, Quilici J, Morange PE, Mouret JP, Bali L, et al. Glycoprotein IIb/IIIa inhibitors improve outcome after coronary stenting in clopidogrel nonresponders: a prospective, randomized study. J Am Coll Cardiol Intv 2008; 1: 649–653. [ Links ]
80. Valgimigli M, Campo G, de Cesare N, Meliga E, Vranckx P, Furgieri A, et al. Intensifying platelet inhibition with tirofiban in poor responders to aspirin, clopidogrel, or both agents undergoing elective coronary intervention: results from the double-blind, prospective, randomized Tailoring Treatment with Tirofiban in Patients Showing Resistance to Aspirin and/or Resistance to Clopidogrel study. Circulation 2009; 119: 3215–3222. [ Links ]
81. Wiviott SD, Trenk D, Frelinger AL, O'Donoghue M, Neumann FJ, Michelson AD, et al. Prasugrel compared with high loading and maintenance-dose clopidogrel in patients with planned percutaneous coronary intervention: the Prasugrel in Comparison to Clopidogrel for Inhibition of Platelet Activation and Aggregation- Thrombolysis in Myocardial Infarction 44 trial. Circulation 2007; 116: 2923–2932. [ Links ]
82. Brandt JT, Payne CD, Wiviott SD, Weerakkody G, Farid NA, Small DS, et al. A comparison of prasugrel and clopidogrel loading doses on platelet function: magnitude of platelet inhibition is related to active metabolite formation. Am Heart J 2007; 153: e9–16. [ Links ]
83. Wallentin L, Varenhorst C, James S, Erlinge D, Braun OO, Jakubowski JA, et al. Prasugrel achieves greater and faster P2Y12receptor-mediated platelet inhibition than clopidogrel due to more efficient generation of its active metabolite in aspirin-treated patients with coronary artery disease. Eur Heart J 2008; 29: 21–30. [ Links ]
84. Gurbel PA, Bliden KP, Butler K, Antonino MJ, Wei C, Teng R, et al. Response to ticagrelor in clopidogrel nonresponders and responders and effect of switching therapies: the RESPOND study. Circulation 2010; 121: 1188–1199. [ Links ]
85. Michelson AD, Frelinger AL III, Braunwald E, Downey WE, Angiolillo DJ, Xenopoulos NP, et al. Pharmacodynamic assessment of platelet inhibition by prasugrel vs. clopidogrel in the TRITON– TIMI 38 trial. Eur Heart J 2009; 30: 1753–1763. [ Links ]
86. Wiviott SD, Braunwald E, McCabe CH, Montalescot G, Ruzyllo W, Gottlieb S, et al. Prasugrel versus clopidogrel in patients with acute coronary syndromes. N Engl J Med 2007; 357: 2001–2015. [ Links ]
87. Wallentin L, Becker RC, Budaj A, Cannon CP, Emanuelsson H, Held C, et al. Ticagrelor versus clopidogrel in patients with acute coronary syndromes. N Engl J Med 2009; 361: 1045–1057. [ Links ]
*Programa de Maestría en Farmacología. Universidad de Costa Rica.
Escuela de Medicina. Universidad de Costa Rica.
Abreviaturas: ABCB1, gen miembro 1 de la subfamilia B del cassette de unión de ATP (ATP-Binding Cassette subfamily B member 1); ICP, intervención coronaria percutánea; MDR1, gen de multirresistencia a drogas 1 (Multidrug Resistance 1); SCA, síndrome coronario agudo
*Correspondencia a: allan.ramos@ucr.ac.cr