Servicios Personalizados
Revista
Articulo
Indicadores
-
 Citado por SciELO
Citado por SciELO -
 Accesos
Accesos
Links relacionados
-
 Similares en
SciELO
Similares en
SciELO
Compartir
Acta Médica Costarricense
versión On-line ISSN 0001-6002versión impresa ISSN 0001-6012
Acta méd. costarric vol.53 no.1 San José ene. 2011
Original
(Detection of Human Respiratory Syncytial Virus subtypes A and B in hospitalized children in Costa Rica)
Doris Mora1,Wilbert Alfaro2, Lizeth Taylor1, Laya Hun1
Sección de Virología, Facultad de Microbiología, Universidad de Costa Rica.
1 Centro de Investigaciones en Enfermedades Tropicales (CIET), Facultad de Microbiología, Universidad de Costa Rica.
2 División de Inmunología y Diagnóstico Viral, Laboratorio Clínico, Hospital Nacional de Niños (HNN) Carlos Sáenz Herrera, San José- Costa Rica.
Abreviaturas: ARN, Ácido ribonucléico; IFD, inmunofluorescencia directa; HNN, Hospital Nacional de Niños; RT-PCR, Transcripción reversa y reacción en cadena de la polimerasa (por sus siglas en inglés, Reverse transcription and polimerase chain reaction); TRI, Tracto respiratorio inferior; VRS, Virus respiratorio sincicial.
Correspondencia: Laya Hun. Ruchlia.Hun @ucr.ac.cr Facultad de Microbiología. Universidad de Costa Rica
Fuente de apoyo: Vicerrectoría de Investigación, Universidad de Costa Rica. Proyecto de Investigación:VI- 803-A9-707.
Resumen
Objetivo: El virus respiratorio sincicial (VRS) es un pneumovirus de la familia Paramyxovridae, que causa enfermedad severa del tracto respiratorio inferior en neonatos y niños pequeños, especialmente en los primeros años de vida. Es responsable de constantes hospitalizaciones y visitas a los servicios de emergencias. Se han identificado dos subtipos: VRS-A y VRS-B, mediante anticuerpos monoclonales y técnicas moleculares. El objetivo de este estudio fue establecer por primera vez la circulación de ambos subtipos del VRS, en muestras positivas de niños hospitalizados durante el pico estacional de 2008, en el Hospital Nacional de Niños (HNN).
Métodos: Se analizaron 49 muestras de aspirados nasofaríngeos de niños hospitalizados, de un total de 578, de las cuales 197 fueron previamente positivas para VRS por inmunofluorescencia directa. Se realizó cultivo celular, y un RT-PCR múltiple, estandarizado en el laboratorio, para detectar VRS-A y VRS-B.
Resultados: La frecuencia del VRS fue del 34% en el HNN, para agosto y septiembre de 2008. De las 49 muestras analizadas por RT-PCR, 41 (84%) fueron positivas, 34 (83%) por el subtipo A y 7 (17%) por el B; 8 fueron negativas. Ningún paciente presentó infección mixta y no hubo diferencia entre los síntomas, la edad o el origen geográfico de los niños. El cultivo fue positivo solo en el 30% de las muestras.
Conclusión: La frecuencia del VRS para el periodo en estudio fue del 34% de las muestras analizadas en aspirados nasofaríngeos. Este es el primer reporte de la detección de los subtipos A y B del VRS, en una pequeña cohorte del HNN, confirmados por un RT-PCR múltiple estandarizado en el laboratorio.
Descriptores: Virus respiratorio sincicial humano, VRS subtipos A y B, niños hospitalizados, Costa Rica
Abstract
Aim: Respiratory syncytial virus (RSV) a Pneumovirus belonging to Paramyxovridae family is a common cause of severe lower respiratory disease in neonates and young children especially in the first years of life. It causes frequent hospitalizations and visits to the emergency rooms.
Methods: Forty nine samples from nasopharyngeal aspirates from hospitalized children, of 197 samples previously reported positive by IFA were analyzed using cell culture and a Multiplex nested RT-PCR for RSV-A and B standardized in the Virology Laboratory.
Results: Incidence of RSV was 34 % in HNN in August and September, 2008. Of 49 samples, 41(84%) were positive; 34 (83 %) for subtype A and 7 (17 %) for B, and 8 were negative. None of the patients had mixed RSVinfections and there were no evident differences in symptomatology, age or geographical origin of the children. Culture was positive only in 30 % of the samples.
Conclusions: The frequency of RSV was 34 % in the total group of samples in the study period. This is a preliminary report of the circulation of RSV subtypes A and B in a small cohort from the HNN in Costa Rica, confirmed by multiplex nested RT-PCR standardized in the laboratory.
Keywords: Respiratory Syncytial Virus, Human; RSV subtypes A and B; Child, hospitalized; Costa Rica.
Las infecciones del tracto respiratorio son las más frecuentes en niños y adultos, y son responsables de una considerable morbilidad y mortalidad en el mundo, principalmente debido a la facilidad de transmisión en la comunidad.1, 2
El virus respiratorio sincicial (VRS), un pneumovirus, miembro de la familia Paramyxovridae,3 es causa común de infección y enfermedad severa en tracto respiratorio inferior (TRI) en neonatos e infantes, especialmente en el primer año de vida, y causa constantes hospitalizaciones y visitas a la los servicios de emergencias.4,5 La infección con VRS es universal a la edad de dos años, e infecta al 70% de los niños en su primer año de vida, y casi al 100% para el tercer año,6, 7 con un pico de incidencia entre los dos y seis meses.
La severidad de la infección en infantes varía desde una infección subclínica o leve en tracto respiratorio superior (TRS), hasta una infección severa en TRI, y como consecuencia requiere hospitalización, e incluso puede producir la muerte.8 La primoinfección es raramente asintomática y se ha estimado que hasta un 40% de los niños infectados con VRS desarrollan bronquiolitis o neumonía.9 La bronquiolitis ocurre predominantemente en niños sanos, nacidos a término, y es una condición leve y autolimitada que puede manejarse en el hogar 4. Aunque cerca del 50 % de los niños se infecta en el primer año de vida,10 solo el 3% de ellos requieren hospitalización por VRS, de los cuales un 10% precisa ventilación mecánica y un 5-10% muere. Sin embargo, entre los infantes hospitalizados, se estima que el VRS es el responsable del 50-80% de las infecciones.4-6.
Las diferencias en la severidad de la infección en los niños no se pueden explicar solo por el título de anticuerpos contra el virus, por lo tanto, se plantean otros factores de riesgo, tales como diferencias del hospedero9,11,12 y defactores virales. Así, por ejemplo, estudios epidemiológicos han identificado subgrupos de infantes en los cuales el desarrollo de bronquiolitis por VRS se asocia con mayor riesgo de hospitalización y morbilidad respiratoria,9,13 entre ellos, niños nacidos prematuramente, con enfermedad pulmonar neonatal crónica, y aquellos con una enfermedad cardíaca hemodinámicamente significativa.14
El VRS también es conocido como un patógeno de importancia nosocomial, debido a que se disemina por contacto directo con secreciones respiratorias, cuyo resultado clínico puede ser causa de morbilidad y de mortalidad en población adulta, ya que generalmente la inmunidad es parcial y ocurren reinfecciones durante toda la vida. Se ha estimado que el VRS es responsable de 18 000 – 75 000 hospitalizaciones y de 90 – 1900 muertes anuales en los Estados Unidos, y existe un estimado de que un tercio del total de muertes de niños menores de 5 años son causadas por enfermedades del TRI, donde el VRS es el responsable del 27–96% de los casos hospitalizados por infecciones virales.15,16
En Costa Rica el VRS es el agente viral más frecuente en niños hospitalizados con TRI y corresponde al 15-20% del total.17 Otros países latinoamericanos como Argentina, Colombia, Honduras y México, reportan un 26,9%, un 41,7% un 33% y un 36%, respectivamente, como la misma causa de hospitalización.18
En países con climas templados, las epidemias por VRS ocurren cada año en los meses de invierno como ha sido registrado en algunos países de Suramérica, como Argentina, Brasil, Chile y Uruguay, mientras que en áreas tropicales los brotes se asocian a la época lluviosa,19,20 y en regiones subtropicales como en Colombia, Puerto Rico y Venezuela, el virus circula todo el año, con predominio durante el otoño.20,21 En Costa Rica el virus estuvo presente durante 1997 y 1998, con un pico en octubre. En 1999 el pico fue en noviembre, lo que evidencia que el virus circula mayormente en la época lluviosa.17
Dos subtipos antigénicos A y B del VRS, han sido identificados con base en la reacción frente a un panel de anticuerpos monoclonales (AcMs).4,10,22 Esta clasificación fue confirmada posteriormente por análisis de la secuencia nucleotídica.4,23,24 Se ha visto que durante una epidemia ambos subtipos pueden cocircular, pero, el subtipo A ha sido identificado más frecuentemente que el subtipo B.4,23 También se ha observado en cada epidemia, la circulación de múltiples genotipos dentro de cada subtipo, con un reemplazo del genotipo predominante cada año.23 La capacidad de diferenciar el VRS en tipos y subtipos, es útil para objetivos epidemiológicos, así como para evaluar el papel de las variaciones genéticas en las reinfecciones.25
Este estudio pretende establecer por primera vez en Costa Rica la circulación de ambos subtipos de VRS, el A y el B, en una población de niños hospitalizados durante la época lluviosa de 2008.
Métodos
Todo paciente con cuadro respiratorio que se hospitaliza en el Hospital Nacional de Niños (HNN), es analizado por ensayos de inmunofluorescencia directa (IFD)26-28 para la detección de los siguientes agentes virales: influenza A y B, parainfluenza 1, 2 y 3 (PIV1,2 y3), adenovirus, virus respiratorio sincicial (VRS) y metapneumovirus (Light Diagnostic, Temecula, Ca, USA). Del total de muestras analizadas, con resultado positivo por VRS, 49 aspirados nasofaríngeos fueron enviados a la Sección de Virología, Facultad de Microbiología, Universidad de Costa Rica. Las muestras se almacenaron a -70ºC, hasta su análisis. Datos de edad, sexo, provincia de procedencia, salón de referencia y fecha de recolección, estaban disponibles para cada muestra.
Dos mililitros de cada muestra con exceso de moco se pretripsinisaron por 10 minutos a 37ºC, con 50 µl de tripsina 0,5%, y se mezclaron hasta disolución. Se agregaron 2,5 µl de anfotericina B a 10 mg/ml, 5 µl de penicilina a 100000 U/ml y estreptomicina a 100000 µg/ml; se incubó 1 hora a 37ºC.
Tubos con un 50% de confluencia de células Hep 2C,29,30 fueron inoculados con 200 µl del aspirado nasofaríngeo pretratado. Cada tubo se incubó a 36ºC en atmósfera de un 5% CO2 por 1 hora, y se le agregó 1 ml de MEM 2% para incubarlo bajo las mismas condiciones durante 8 días. El cultivo se valoró a diario, buscando la formación de sincicios, el efecto citopático clásico del VRS. Cada tubo se agitó vigorosamente y en algunos casos se les realizaron tres ciclos de congelación y descongelación. El sobrenadante se congeló a -70ºC hasta que se realizó el análisis molecular.
EL ARN viral se extrajo con los reactivos Nucleo Spin RNAvirus (Machery Nagel), de acuerdo con las instrucciones del fabricante.
El RT-PCRI se llevó a cabo usando los siguientes iniciadores específicos: F164, G267 (Subtipo A) y G32B (Subtipo B), como ya se ha descrito31 con las siguientes modificaciones: 10 µl de ARN fueron convertidos a ADNc utilizando los reactivos Revert Aid TM H Minus kit (fermentas). Posteriormente, 2 µl del ADNc se agregaron a 2X mezcla maestra (máster mix, Fermentas) y 20 pmol de cada iniciador en un volumen final de 25 µl. La reacción se llevó a cabo en un termociclador 2400 Perkin Elmer, con el siguiente programa: 94ºC por 30 seg., 54ºC por 30 seg., 68ºC por 1 min, 10 ciclos, 94ºC por 10 seg., 54ºC por 30 seg., 68ºC por 65 seg., 25 ciclos, y 68ºC por 7 min.32 Los productos se visualizaron en un gel de agarosa al 2% con Bromuro de Etidio con un fragmento de 900 bp para el subtipo A y de 1100 bp para el subtipo B.
EL PCR anidado se llevó a cabo bajo las mismas condiciones, pero con los siguientes iniciadores: F1, G283A (subtipo A) y G52B (subtipo B), con el siguiente programa: 94ºC por 30 seg., 59ºC por 1 min., 72ºC por 1 min., 30 ciclos y 72ºC por 7 min.32 Los fragmentos resultantes corresponden a 728 bp para el subtipo A y 946 bp para el subtipo B.
Todas las muestras con resultados discordantes entre la IFD original, el cultivo, o el PCR, fueron reevaluadas por IFD contra los virus respiratorios, utilizando los reactivos mencionados de acuerdo con las instrucciones del fabricante.
Por otra parte, los ensayos moleculares se repitieron tanto en la muestra original como en el sobrenadante de cultivo.
Resultados
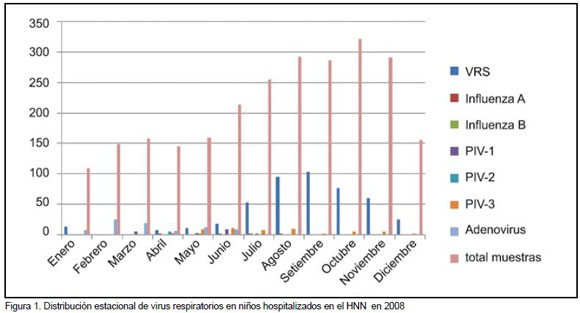
En el 2008 se analizaron 2530 muestras respiratorias por inmunofluorescencia para diagnóstico de virus respiratorios en niños hospitalizados en el HNN, y la frecuencia de todos los virus respiratorios diagnosticados se muestra en la Figura 1. La frecuencia de cada virus fue relativamente baja, pero se presentó con un pico importante y predominante para VRS en los meses de julio a noviembre, con más casos en agosto y septiembre.
Durante esos dos meses, se analizaron 578 muestras respiratorias, de las cuales 197 (34%) fueron positivas para VRS, 370 (64%) fueron negativas para todos los virus respiratorios estudiados, y 9 (1,5%) fueron positivas para PIV-3. De las 197 muestras positivas para VRS, estuvieron disponibles 49 para el análisis de subtipos: 25 de varones y 23 de niñas, con un rango de edad entre 2 meses y 3 años, 41 de ellas (84%) de menores de 1 año.
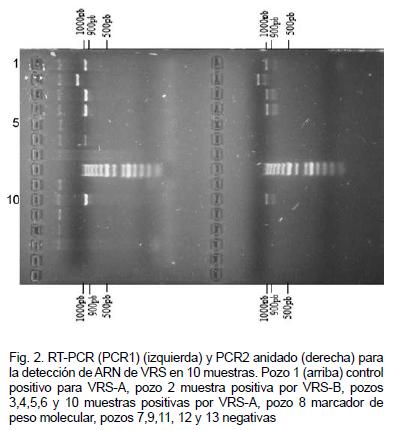
De las 49 muestras estudiadas, 41 (84%) fueron positivas para VRS por PCR anidado, mientras que 8 fueron negativas (16%). Las infecciones con el subtipo VRS-A fueron aproximadamente cuatro veces más frecuentes que las de tipo VRS-B; 34 muestras (83%) contra 7 (17%) (Figura 2). El cuadro clínico de los pacientes infectados con el subtipo A no era muy diferente de los infectados con el subtipo B, sin embargo, este último subtipo fue aislado con mayor frecuencia de niños de 6-7 meses. No se detectó infección mixta con ambos subtipos de VRS y no se observaron diferencias significativas en la procedencia geográfica de los pacientes.
De las 49 muestras inoculadas en células Hep-2, solo el 30% presentaron efecto citopático (ECP). Con el fin de confirmar el aislamiento viral, se escogieron 24, y los sobrenadantes de los cultivos celulares se analizaron por PCR, de la misma manera que las muestras originales. De estos, 18 sobrenadantes fueron positivos por lo menos por uno de los PCRs utilizados, 5 fueron negativos y uno indefinido (Figura 2, pozo 5).
Discusión
Los datos generados con este proyecto permitieron establecer el primer reporte de la circulación de ambos subtipos del VRS, el VRS-A y el VRS-B, en una población de niños hospitalizados en el HNN, en Costa Rica, en 2008, durante la época lluviosa, con un pico entre los meses de julio a noviembre, con predominio en agosto y septiembre, en donde hubo una frecuencia del 34% para VRS.
En países en vías de desarrollo se ha observado que el VRS causa hasta un 70% de infecciones en TRI y está posiblemente asociado a tasas de mortalidad de hasta un 7%; en contraste, en países desarrollados se reporta una tasa de mortalidad menor al 1%.33 La mortalidad para el HNN en ese periodo fue de un 2,5%
En este estudio, el subtipo VRS-A se encontró en el 83% de las muestras analizadas, lo cual concuerda con estudios efectuados en otros países de América Latina, tales como Argentina, Cuba y El Salvador, donde se reportan prevalencias del 62% al 91%.34-36
La presencia de ECP solo en el 30% de las muestras analizadas, se explica por la bien estudiada sensibilidad de estos virus a los cambios de temperatura, y su pérdida de inefectividad en los procesos de congelación y descongelación, de hasta un 90%. 23
Es importante recalcar que la detección de muestras positivas por VRS por medio de inmunofluorescencia directa, no implica que el virus esté viable en la muestra. El virus permanece viable para aislamiento en el paciente por menos de 10 días, mientras que las células infectadas que presentan los antígenos del virus y consecuentemente dan un resultado positivo por IFA, permanecen hasta la completa recuperación clínica del paciente.37
Como ya ha sido mencionado, el VRS tiene un genoma ARN, el cual es un ácido nucleíco muy lábil, por lo que es muy importante realizar las retro-transcripciones a ADN en un periodo no mayor a las 12 horas después de obtenida la muestra, para así evitar pérdida de material genético.23
Las diferentes condiciones ambientales que las muestras sufrieron (transporte del HNN a la UCR, y varios ciclos de congelación y descongelación) podrían explicar las 8 muestras negativas por PCR, que originalmente dieron positivo por IFA. Por otro lado, el PCR desarrollado es un PCR anidado, el cual detecta pequeñas cantidades de ARN viral, lo que explicaría la razón de que algunas muestras dieron negativo por el PCR 1 y positivas por el PCR anidado.23
Cuando se analizaron por PCR los sobrenadantes de los cultivos celulares inoculados con las muestras, ninguna de las que originalmente dieron negativas por PCR, dio positiva, lo que demuestra que la negatividad del PCR en estos casos no se debió a una baja concentración viral en la muestra. La muestra indefinida presentó un resultado repetidamente positivo en el PCR I, pero negativo en el PCR II (Figura 2, pozo 5), por lo que se estima que es una amplificación inespecífica en el primer PCR.
En conclusión, este es un reporte preliminar de la circulación de los subtipos A y B de VRS, en una pequeña cohorte de niños hospitalizados en el HNN en Costa Rica, confirmados por un RT-PCR estandarizado en el laboratorio de virología, y que fue el método que mostró una mayor sensibilidad. Es preciso realizar nuevos estudios con poblaciones más grandes durante la época pico, con el fin de determinar si existen diferencias significativas en la severidad de la infección, la edad de los pacientes y su distribución geográfica, debidas a los subtipos VRS-A y VRS-B.
Agradecimientos
Un agradecimiento especial para el Sr. Carlos Vargas y el Sr. Francisco Vega, por su excelente asistencia técnica.
Recibido: 13 de mayo de 2010 Aceptado: 21 de setiembre de 2010
Referencias
1. Lopez AD, Mathers CD, Ezzati M, Jamison DT, Murray CJ. Global and regional burden of disease and risk factors, 2001: systematic analysis of population health data. Lancet 2006; 367: 1747–1757. [ Links ]
2. Reijans M, Dingemans G, Klaassen CH, Meis JF, Keijdener J, Mulders B, Eadie K. RespiFinder: a new multiparameter test to differentially identify fifteen respiratory viruses. J Clin Microbiol 2008; 46:1232-1240. [ Links ]
3. Collins PL, Chanock RM, Murphy BR. Respiratory syncytial virus. En: Knipe DM, Howley PM, Griffin DE, Lamb RA, Martin MA, Roizman B, Straus SE, editors. Fields Virology, 4th ed. Lippincott Williams & Wilkins, Philadelphia, PA., 2001: 1443–1485. [ Links ]
4. Oliveira TFM, Freitas GRO, Ribeiro LZG, Yokosawa J, Siqueira MM, Portes SAR. Prevalence and clinical aspects of respiratory syncytial virus A and B groups in children seen at Hospital de Clinicas of Uberlandia, MG, Brazil. Mem Inst Oswaldo Cruz. 2008; 103: 417-422. [ Links ]
5. Sangare L, Curtis MP, Ahmad S. Hospitalization for Respiratory Syncytial Virus among California infants: Disparities related to race, insurance, and geography. J Pediatrics 2006; 149: 373-377. [ Links ]
6. Pelaia G, Vatrella A, Gallelli L, Renda T, Cazzola M, Maselli R. Respiratory infections and asthma. Resp Med 2006; 100: 775-784. [ Links ]
7. Ogra PL. Respiratory syncytial virus: the virus, the disease and the immune response. Paediatr Respir Rev 2004; 5(Suppl. A): S119–26. [ Links ]
8. Jansen AG, Sanders EA, Hoes AW, van Loon AM, Hak E. Influenza and respiratory syncytial virus-associated mortality and hospitalizations. Eur Respir J. 2007; 30: 1158–1166. [ Links ]
9. Janssen R, Bont L, Siezen CLE, Hodemaekers, HM, Ermers MJ, Doornbos G, Slot, C. Genetic susceptibility to respiratory syncytial virus bronchiolitis is predominantly associated with innate immune genes. J Infect Dis 2007; 196: 826-834. [ Links ]
10. DeVincenzo JP. Natural Infection of infants with respiratory Syncytial virus subgroups A and B: A study of frequency, disease severity and viral load. Pediatric Research 2004; 56: 914-917. [ Links ]
11.Somech R, Tal G, Gilad E, Mandelberg A, Tal A, Dalal I. Epidemiologic, socioeconomic, and clinical factors associated with severity of respiratory syncytial virus infection in previously healthy infants. Clin Pediatrics 2006; 45: 621-627. [ Links ]
12. Mandelberg A, Tal G, Naugolny L, Cesar K, Oron A, Houri S, Gilad E, Somekh El. Lipopolysaccharide hyporesponsiveness as a risk factor for intensive care unit hospitalization in infants with respiratory syncitial virus bronchiolitis. Clin Exp Immunol 2000; 144: 48-52. [ Links ]
13. Meissner HC. Selected populations at increased risk from respiratory syncytial virus infection. Pediatri Infect Dis J 2003; 22: S40-S45. [ Links ]
14. Fitzgerald DA. Preventing RSV bronchiolitis in vulnerable infants: the role of palivizumab. Paediatr Respir Rev 2009; 10: 143-147. [ Links ]
16.Weber M, Mulholland E, Greenwood B. Respiratory syncytial virus infection in tropical and developing countries [review]. Trop Med Int Health 3:268–280. [ Links ]
17. Salas P, Alfaro W. Variación estacional de infecciones respiratorias virales en niños hospitalizados. Rev Mex Pediat 2005; 72: 5-7. [ Links ]
18. Murguía T. Reunión de Consenso: Infecciones -Virus Sincicial Respiratorio en América Latina. NeoReviews 2006; 1:1-11. [ Links ]
19. Cane P. Molecular epidemiology of respiratory syncytial virus. Rev Med Virol 2001; 11: 103–116. [ Links ]
20. Costa LF, Yokosawa J, Mantese OC, Oliveira TF, Silveira HL, Nepomuceno LL. Respiratory viruses in children younger than five years old with acute respiratory disease from 2001 to 2004 in Uberlandia, MG, Brazil. Mem Inst Oswaldo Cruz. 2006; 101: 301-306. [ Links ]
21. Vieira SE, Gilio AE, Durigon EL, Ejzenberg B. Lower respiratory tract infection caused by respiratory syncytial virus in infants: The role played by specific antibodies. Clinics 2007; 62: 709-716. [ Links ]
22. Brandenburg AH, van Beek R, Moll HA, Osterhaus ADME, Class ECJ. G protein variation in respiratory syncytial virus group A does not correlate with clinical severity. J Clin Microbiol 2000; 38: 38493852. [ Links ]
23. Cane PA, Pringle CR. Molecular epidemiology of respiratory syncytial virus - A review of the use of reverse transcription-polymerase chain-reaction in the analysis of genetic-variability. Electrophoresis 1995; 16: 329-333. [ Links ]
24. Zlateva KT, Vijgen L, Dekeersmaeker N, Naranjo C, Van Ranst M. Subgroup prevalence and genotype circulation patterns of human respiratory syncytial virus in Belgium during ten successive epidemic seasons. J Clin Microbiol 2007; 45: 3022- 3030. [ Links ]
25. Maitreyi R, Sullender W, Prasad A, Dar L, Broor Sh. Genetic variability among group A and B respiratory syncytial virus isolates from a large referral hospital in New Delhi, India. J Clin Microbiol 2003; 41: 2311-2316. [ Links ]
26. Mlinaric-Galinovic G, Ugrcic I, Cvetkovic M. Rapid detection of respiratory syncytial virus in clinical specimens. Acta Virologica 1987; 31: 410-416. [ Links ]
27. Rovida F, Percivalle E, Zavattoni M, Torsellini M, Sarasini A, Campanini G, et al. Monoclonal antibodies versus reverse transcription-PCR for detection of respiratory viruses in a patient population with respiratory tract infections admitted to hospital. J Med Virol 2005; 75: 336-347. [ Links ]
29. Van Elden LJ, van Kraaij MG, Nijhuis M, Hendriksen KA, Dekker AW, Rozenberg-Arska M. Polymerase chain reaction is more sensitive than viral culture and antigen testing for the detection of respiratory viruses in adults with hematological cancer and pneumonia. Clin Infect Dis 2002; 34: 177-183. [ Links ]
30. Weinberg GA, Erdman DD, Edwards KM, Hall CB, Walker FJ, Griffin MR, Schwartz B New vaccine surveillance network study group. Superiority of reverse transcription polymerase chain reaction to conventional viral culture in the diagnosis of acute respiratory tract infections in children. J Infect Dis 2004; 189: 706-710. [ Links ]
31. Venter M, Collinson M, Schoub BD. Molecular epidemiological analysis of community circulating respiratory syncytial virus in rural South Africa: Comparison of viruses and genotypes responsible for different disease manifestations . J Med Virol 2002; 68: 452-461. [ Links ]
32. Visser A, Delports S, Venter M. Molecular epidemiological analysis of a nosocomial outbreak of respiratory syncytial virus associated pneumonia in a kangaroo mother care unit in south africa. J Med Virol 2008; 80:724–732. [ Links ]
33. Leung AKC, Kellner JD. Respiratory syncytial virus bronchiolitis. J Natl Med Assoc. 2005; 97: 1708-1713. [ Links ]
34. Galiano M, Palomo C, Videla C, Arbiza J, Melero J, Carballal G. Genetic and antigenic variability of human respiratoty syncytial virus (Groups Aand B) isolated oner seven consecutive Seasons in Argentina (1995 to 2001). J Clin Microbiol. 2005; 43: 2266-2273. [ Links ]
36. Valdés O, Savón C, Goyenechea A, Valdivia A, González G, Palerm L, Melero J. Diferentes patrones de circulación dentro de los subgrupos A y B del virus sincitial respiratorio humano en algunas provincias de Cuba. Rev Cub Med Trop 2004;56:94-102. [ Links ]
37. Liao RS, Tomalty LL, Majury A and Zoutman D.E. Comparison of viral isolation and multiplex real-time reverse transcription PCR for confirmation of respiratory syncytial Virus and influenza virus detection by antigen immunoassays. J Clin Microbiol 2009; 47: 527-532. [ Links ]