Servicios Personalizados
Revista
Articulo
Indicadores
-
 Citado por SciELO
Citado por SciELO -
 Accesos
Accesos
Links relacionados
-
 Similares en
SciELO
Similares en
SciELO
Compartir
Acta Médica Costarricense
versión On-line ISSN 0001-6002versión impresa ISSN 0001-6012
Acta méd. costarric vol.52 no.3 San José jul. 2010
(Update on Pneumococcal Conjugate Vaccines)
Wendy Chan-Acón1,Arturo Abdelnour1, Carolina Soley-Gutiérrez1, Adriano Arguedas-Mohs1, 2
1. Instituto de Atención Pediátrica
2. Universidad de Ciencias Médicas
Abreviaturas: PPV23, vacuna neumocócica polisacárida polivalente; PCV7, vacuna neumocócica heptavalente conjugada; ENI, enfermedad neumocócica invasora; OMA, otitis media aguda;ITT,intención de tratamiento; VT, serotipos contenidos en la vacuna; NVT, serotipos no contenidos en la vacuna
Correspondencia: Adriano Arguedas Mohs. Pediatra Infectólogo, Director Instituto de Atención Pediátrica Apartado postal 607-1150 La Uruca, San José. Correo electrónico: aarguedas@iped.net
Descriptores: neumococo, vacunas conjugadas, Streptococcus pneumoniae, vacunas
Streptococcus pneumoniae is one of the major pathogens causing invasive and non invasive infections in children younger than 5 years as well as in the elderly. Primary clinical syndromes associated with pneumococcal infections are pneumonia, bacteremia, acute otitis media and meningitis. This microorganism contributes importantly to morbidity and mortality among children under 5 years of age, it is estimated that 1,000, 000 deaths occurs per year in that age range alone, mostly from developing countries, thus becoming a serious public health problem around the globe. In year 2000 the first heptavalent conjugated pneumococcal vaccine was licensed in the United States of America, it differed from the already available polysaccharide pneumococcal vaccine, by its ability to provide an effective immune response for the protection of children under the age of 2. The efficacy of the heptavalent conjugated vaccine reported in initial clinical trials was 97, 4% against invasive pneumococcal disease related to vaccine serotypes (4, 9V, 14, 19F, 23F, 18C and 6B). Different health authorities worldwide, including the European Medicines Agency (EMEA) had approved the introduction of a 10-valent formulation which includes all 7 PCV7 serotypes plus serotypes 1, 5 and 7F; 8 serotypes are conjugated with protein D as a novel carrier, an element found in the outer core of the non-typeable Haemophilus influenzae. Another new conjugated vaccine is being assessed by several regulatory entities such as the Food and Drug Administration (FDA) and EMEA and in Chile is already approved. This 13-valent formulation includes the 10 serotypes contained in the 10-valent vaccine plus serotypes 3, 6A and 19A, all conjugated to the carrier protein CRM197. These new formulations pretend to enhance vaccine coverage against S. pneumoniae including the frequent serotypes in developing countries (1 and 5) and emerging serotypes such as serotypes 3, 6A, 17F and 9A after a decade of PCV7 immunization.
Keywords: pneumococcus, conjugate vaccines, Streptococcus pneumonia, vaccines
En el 2005, la Organización Mundial de la Salud estimó un total de 1.6 millones de muertes globales por año relacionadas con el neumococo; de las anteriores, entre 700,000 a 1,000,000 corresponden a niños menores de 5 años de edad, la mayoría provenientes de países en vías de desarrollo. Los niños menores a 2 años contribuyen desproporcionadamente a las estadísticas de mortalidad.1
Una década atrás, la única posibilidad para la prevención de las infecciones por S. pneumoniae era la vacuna neumocócica polisacárida 23-valente (PPV23), la cual tenía la gran limitante de que, en niños menores 2 años de edad, no es inmunogénica.2
En febrero de 2000, la Administración de Drogas y Alimentos de los Estados Unidos de Norte América (FDA) aprobó la vacuna neumocócica heptavalente conjugada (PCV7), con el transportador CRM197 para su uso en niños y lactantes, aportando un instrumento clave para los programas de prevención de la enfermedad neumocócica pediátrica. Esta vacuna heptavalente contiene los serotipos que con más frecuencia causaban infección invasora por S. pneumoniae en esa época en los Estados Unidos (4, 9V, 14, 19F, 23F, 18C y 6B), y luego de casi una década de su aplicación universal en ese país, la incidencia de infecciones invasoras y mucosas por este germen ha disminuido considerablemente.
Patógeno. El Streptococcus pneumoniae es un coco Gram-positivo encapsulado que se transmite por contacto directo con las secreciones respiratorias de los pacientes o de los portadores sanos. Esta bacteria forma parte de la flora normal nasofaríngea, siendo la colonización en dicha área transitoria y comúnmente asintomática. Sin embargo, en ocasiones el neumococo ingresa a estructuras adyacentes y causa infección en el oído medio o en los senos paranasales. Además, puede ser aspirado hacia los pulmones o invadir el torrente sanguíneo para dar lugar a las manifestaciones invasivas de la enfermedad.3
Epidemiología
Típicamente, las tasas de infecciones por S. pneumoniae son en particular altas en niños menores de 5 años y en personas mayores de 65 años de edad.2,3 Las tasas de incidencia de ENI, muy elevadas en determinados grupos, hacen sospechar que existen diferencias geográficas y étnicas.6-9 Existen datos que demuestran que en los países en desarrollo la incidencia de las ENI en niños de <5 años es bastante superior a la observada en los países industrializados.
La vigilancia de la ENI debe realizarse mediante sistemas con base poblacional, fundamentados en la vigilancia activa que capten todos los aislamientos de neumococo procedentes de muestras normalmente estériles, ya sea sangre, líquido cefalorraquídeo, líquido pleural, etc.10 La falta de normas para obtener hemocultivos ambulatorios en niños menores febriles, el acceso óptimo a instalaciones con capacidad de laboratorio adecuada, unida a la sobreutilización de los antibióticos, da lugar a una subestimación de la incidencia de las ENI en muchos países en desarrollo.11 Es claro que los estudios de vigilancia pasiva son fundamentales para detectar los serotipos de S. pneumoniae que afectan una determinada población con un diagnostico específico, pero es una herramienta insuficiente para detectar carga de enfermedad.12,13
Los patrones de serogrupos de neumococo asociados a la ENI difieren dependiendo de la región geográfica, y por lo tanto, también el porcentaje de los neumococos aislados que estarían cubiertos por la PCV7. A pesar de lo anterior, los siete serotipos incluidos en la PCV7, con variaciones específicas, son los más frecuentes en el nivel mundial, y a su vez son los que se asocian con mayor resistencia antimicrobiana.14
Hausdorff y colaboradores determinaron que los serotipos 14, 6, 19, 5 y 1 son los principales responsables de la ENI en términos globales. Los serogrupos representados en dicha vacuna son los responsables de casi el 90% de las ENI en niños pequeños en los Estados Unidos y Canadá, de al menos el 60% de las ENI en Europa, África, Latinoamérica y Oceanía, y el 45% en Asia. Estas diferencias se le pueden atribuir a las contribuciones que hacen juntos los serogrupos 1 y 5 a las estadísticas en Europa (8.2% de las ENI) y en Latinoamérica, Asia y África (15-20% de las ENI), mientras que en el área de Estados Unidos/Canadá y Oceanía, estos serotipos contribuyen en tan solo un 1.1% y un 3.8%, respectivamente.14,15
En Costa Rica, la incidencia de la ENI fue evaluada en un análisis retrospectivo y de vigilancia pasiva en 132 casos presentados en el Hospital Nacional de Niños (HNN), de enero de 1995 a diciembre de 2001.16 La distribución estacional mostró que la mayor parte de los episodios se presentaron al iniciar la época lluviosa con una mortalidad de un 14.4% durante el periodo de estudio, con un promedio de 2.7 muertes por año. La mortalidad en los episodios de meningitis fue del 16.1% (9 de 56), en las neumonías un 22.2% (8 de 36), y un 6.7% en los casos de septicemia (2 de 30).16 Al ser un estudio retrospectivo, las tasas de incidencia representan una subestimación de la realidad de las infecciones por S. pneumoniae, y además, no se pudo tipificar las cepas; los datos expuestos se consideran como una representación histórica de los niños hospitalizados en el HNN durante un determinado periodo, y no pueden ser utilizados como parámetro para calcular ni la carga de la enfermedad ni la cobertura vacunal.
En un estudio de vigilancia epidemiológica activa de ENI, llevado a cabo en el área metropolitana de San José, Costa Rica, durante el periodo 2007 – 2008, se obtuvieron muestras de sitios estériles en 4, 260 sujetos con edades de 28 días a menores de 36 meses, que presentaban sintomatología asociada a enfermedad neumocócica y estudios radiográficos de tórax, en aquellos con sintomatología respiratoria. Del total de cultivos analizados, 13 resultaron positivos por S. pneumoniae. La incidencia general de ENI fue de 40/ 100, 000, sin embargo, en niños con edades de 28 días a menores de 6 meses, la incidencia de ENI fue 106.6/100, 000. Los principales diagnósticos en los pacientes con cultivo positivo fueron: neumonía bacterémica (4), bacteremia (4), menigitis (2), sepsis (2) y peritonitis (1). La incidencia general de neumonía clínica y radiológica fue de 1546.3/ 100, 000 y 412.8/ 100, 0000, respectivamente con un pico en pacientes menores de 2 años (1336.7 y 354.6, respectivamente). Los serotipos aislados fueron: el 14 (23.1%), el 6A (15.4%) y los serotipos 3, 4, 6B, 7C, 9V, 15 B, 22F y 23F, que representaron un 7.7% cada uno. Los datos del estudio demuestran que la potencial cobertura con el uso de la PCV7 sería de un 53.8%, y con las vacunas 10valente y 13-valente sería de un 53.8% y un 76.9%, respectivamente. En cuanto a la sensibilidad antibacteriana, determinaron que el 100% de los aislados fueron susceptibles a la amoxicilina, levofloxacina, vancomicina y ceftriaxona, mientras que la sensibilidad a la penicilina, ampicilina y TMP/SMX reportada, fue de un 60% y de un 73.3% para la eritromicina. Los serotipos no susceptibles a la penicilina fueron en su mayoría 6A, 6B, 14 y 23F, estimándose así una cobertura de la PCV7 del 83.3% para los aislados resistentes a la penicilina.17
Publicaciones sobre la distribución de los serotipos neumocócicos en pacientes costarricenses con infecciones no invasoras, principalmente otitis media, han evidenciado que durante el periodo 1999 – 2001, el serotipo con mayores aislamientos en el líquido del oído medio en niños fue el 19F, seguido de los serotipos 6B, 9V, 14 y 3. Para el periodo 2002 -2003, el serotipo 19F continuaba siendo el más prevalente, sin embargo, su incidencia declinó del 75% en el periodo anterior, al 26.1%, posteriormente su incidencia se mantuvo estable con un 21.17%, para el periodo 2003 -2005. Durante este último intervalo se evaluó la importancia del serotipo 3 en Israel, Costa Rica y Lituania, y se llegó a la conclusión de que este serotipo está adquiriendo un papel importante en la incidencia de infecciones neumocócicas no invasoras en dichas regiones. En el país, el serotipo 3 logró desplazarse junto con el serotipo 14 para ocupar el segundo lugar, siendo solo superados por el 19F.18
Vacunas neumocócicas conjugadas
Composición. Las vacunas neumocócicas conjugadas utilizan antígenos polisacáridos que luego son conjugados a una proteína transportadora.19 La PCV7 es una solución estéril que contiene siete polisacáridos capsulares purificados del S. pneumoniae, cada uno acoplado directamente a la proteína transportadora CRM197 mediante aminación reducida. La proteína CRM197 es una variante no tóxica de la toxina diftérica aislada de cultivos de Corynebacterium diphtheriae, obtenidos en medios enriquecidos con aminoácidos y extracto de levadura. Cada dosis contiene 2µg de polisacáridos de los serotipos 4, 9V, 14, 19F y 23F; 2µg de oligosacárido del 18C; 4µg de polisacárido 6B; 20µg de CRM197 y 0.125mg de fosfato de aluminio como adyuvante.20 En la actualidad, la PCV7 es la única vacuna neumocócica conjugada disponible en Costa Rica y es comercialmente conocida como Prevenar®, marca registrada de la compañía farmacéutica Pfizer.
En enero de 2009, el Comité de Medicamentos para Uso Humano de la Agencia Europea de Medicamentos otorgó el visto bueno para comercializar en la Unión Europea la vacuna 10-valente llamada Synflorix®, elaborada por el laboratorio GlaxoSmithKline; tras esta primera aprobación, la vacuna ha sido autorizada por más de 40 países, para la prevención de enfermedades invasoras y mucosas causadas por los 10 serotipos de S. pneunoniae incluidos en la vacuna en niños de 6 meses a 2 años de edad y, además, en algunos países (Chile, Argentina, México) la vacuna ha sido aprobada para la prevención de episodios de otitis media por H. influenzae no tipificable. Las sustancias activas en la vacuna incluyen los serotipos polisacáridos 1, 4, 5, 6B, 7F, 9V, 14, 18C, 19F y 23F del S. pneumoniae. Ocho serotipos están conjugados a la proteína transportadora D derivada del Haemophilus influenzae no tipificable, mientras que los serotipos 18C y 19F, a las proteínas acarreadoras de toxoide tetánico y diftérico, respectivamente.21
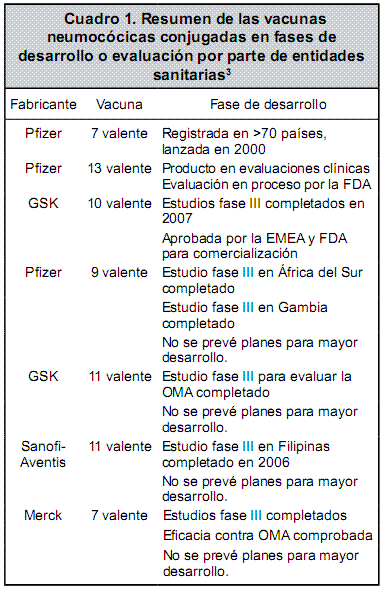
La vacuna 13-valente del laboratorio Pfizer es la próxima formulación con potencial aprobación por la FDA y la EMEA. Se considera como una variante extendida de la PCV7, pues conjuga a la proteína transportadora CRM197 todos los serotipos contenidos en la PCV7 y 6 serotipos adicionales: 1, 5, 7F, 3, 6A y 19A. Existen otras vacunas neumocócicas conjugadas en fases de desarrollo o en proceso de evaluación por las diferentes entidades reguladoras sanitarias, las cuales se resumen en el Cuadro 1.
Mecanismo inmunológico. Los polisacáridos presentes en la cápside neumocócica son antígenos de tipo T independientes. Poco después del nacimiento se desarrolla la capacidad de formar anticuerpos ante la exposición de antígenos T dependientes, mientras que la respuesta ante los antígenos T independientes se evidencia luego de los primeros dos años de vida, por lo que las vacunas polisacáridas fallan en brindar una protección satisfactoria en lactantes y niños pequeños.22 La conjugación de polisacáridos a proteínas transportadoras cambia la respuesta antipolisacárida de T independiente a T dependiente, y mejora la respuesta inmunológica que aumenta la tasa de opsonización, fagocitosis y eliminación del neumococo, desencadenando una respuesta primaria y anamnésica importante.22
PCV7. En varios estudios aleatorizados con la vacuna PCV7 se reporta que alrededor de un 82% a un 100% de los participantes alcanzaron títulos séricos por encima de los límites establecidos como mínimos para alcanzar protección.27,28-32 En niños con edades entre los 2 y los 15 meses la PCV7 no produce interacción con vacunas que contienen componentes de difteria, tétano, pertusis, polio, H. influenzae, hepatitis B, varicela, rubéola, paperas y sarampión, ya que estos mostraron niveles adecuados de protección al administrarse concomitantemente.28-33 Además, se ha observado que los serotipos 6B, 23F y 9V son menos inmunogénicos luego de haber completado el esquema de 3 dosis, no obstante, los anticuerpos para los serotipos 6B y 23F parecen elevarse luego de la administración de una dosis de refuerzo.19 Todavía no se cuenta con datos concluyentes acerca de si los serotipos 6B, 9V y 19F contenidos en la vacuna, proveen protección cruzada contra las enfermedades causadas por los serotipos 6A, 9A, 9N, 9L y 19ª.14 Los datos de inmunogenicidad de la PCV7 sugieren que esa vacuna produce una memoria inmunológica en el largo plazo y protección similar a otras vacunas conjugadas.2
PCV10. Un ensayo realizó la comparación inmunológica directa entre la PCV7 y PCV10, utilizando el porcentaje de sujetos que alcanzaron concentraciones de anticuerpos, con la técnica de ELISA de tercera generación, de al menos 0.2 µg/mL (equivalentes a 0.35 µg/mL establecidos por la OMS utilizando la técnica de ELISA de segunda generación), como criterio para determinar la no inferioridad de la vacuna PCV10. Todos los serotipos contenidos en la vacuna indujeron concentraciones de anticuerpos superiores al límite establecido en al menos el 95.4% de los sujetos vacunados, exceptuando los serotipos 6B (65.9%) y 23F (81.4%). A pesar de que no se pudo demostrar la no inferioridad para estos serotipos, se determinó que la PCV10 induce anticuerpos funcionales con actividad opsonofagocítica contra todos los serotipos, incluyendo respuestas elevadas (>92%) para los serotipos 6B y 23F. Además, se observó una marcada elevación de títulos de anticuerpos al administrar una cuarta dosis de refuerzo. Los autores concluyen que el conjunto de datos analizados sugieren que la protección brindada contra la ENI por la PCV10 es muy similar a la PCV7.34
La coadministración de la PCV10 con las vacunas de rutina infantil no mostró interferencias de tipo negativas en la inmunogenicidad aportada al transcurrir un mes de la tercera dosis. La respuesta contra paperas, rubéola, sarampión y tétano se encontró aumentada en aquellos sujetos que recibieron vacunas conjugadas con proteínas provenientes del toxoide tetánico, en el caso de la PCV10 lo anterior se explica por la conjugación del serotipo 18C a dicha proteína transportadora; también, los sujetos vacunados con la PCV7 se vieron beneficiados con un aumento en la concentración geométrica media de los anticuerpos contra la difteria, probablemente por acción de la proteína CRM197.35, 36
Seguridad. Los datos provenientes de estudios de eficacia fase III con las vacunas PCV7, PCV10 y PCV13, han demostrado cómo las tres formulaciones son seguras, y los datos de efectividad luego de millones de dosis y 9 años de uso de la vacuna PCV7, confirman estos datos, al menos con esa formulación heptavalente.3
Cuando la PCV7 es administrada conjuntamente con otra vacuna, se observa durante los primeros 2 a 4 días postvacunación, dolor en el sitio de inyección en una frecuencia del 1.0% al 37.7%, dolor que limita el movimiento en el 6.8% - 9.5%, eritema en 7.8% - 58.1%, eritema mayor a 2 cm en el 0.6% –18.2%, induración en el 1.6% – 69.4%, e induración mayor a 2 cm en el 1.2% –21.2% de los casos. Estos porcentajes son similares o menores a aquellos presentados por las vacunas concomitantes administradas al mismo sujeto.28-33, 39-41 Entre los efectos sistémicos, luego de la administración concomitante de PCV7 y las vacunas del esquema usual de inmunización en niños y lactantes, se observó un aumento de la temperatura mayor a 38ºC en un 8.2% -62% de los sujetos, somnolencia en el 0% -49%, irritabilidad en el 2.2% - 71%, y anorexia en el 0% -34.8% en los siguientes 2 a 4 días después de las aplicaciones.31-36,39-41 En el caso de la vacunación, únicamente con la PCV7 en niños mayores a 3 años de edad, los síntomas comunes fueron temperatura mayor a 38ºC en un 0.8% –46.9%, somnolencia en el 13% -52%, irritabilidad en el 18.3% -60% y anorexia en el 24.3%, luego de 3 a 7 días postvacunación.33,36,45,46 En dos estudios, los porcentajes de efectos secundarios locales después de aplicar la PCV7 sola en niños mayores de 3 años, se presentó dolor en el sitio de inyección en el 8.2% al 39.1% de los casos, el cual limita el movimiento en el 15.7%, eritema en el 24.6% - 40%, eritema mayor a 2 cm en el 17.4%, induración en el 25.4% – 35.5%, e induración mayor a 2 cm en el 9.6%.42, 43
En el caso de la PCV10, la seguridad y tolerabilidad fue valorada en 5 estudios aleatorizados y controlados, donde los sujetos recibieron la vacuna 10-valente o la vacuna 7valente, concomitantemente con las vacunas del esquema usual de inmunización. Se evaluaron 4,004 niños con edades entre las 6 y las 14 semanas. No se determinaron diferencias significativas en el perfil general de reactogenicidad entre la PCV10 y PCV7, con una incidencia e intensidad similares en las reacciones evaluadas al día 4 postvacunación. Los eventos adversos sistémicos reportados refieren somnolencia en el 39% - 61%, irritabilidad en el 46% - 82%, anorexia en el 24% - 44%, y fiebre >38 ºC en el 33% - 61% de los sujetos. Los efectos locales detectados con mayor frecuencia fueron: dolor en el sitio de inyección en el 28.7% de los casos, eritema en el 37.6%, e induración en 29.1% de los casos. Dado que no hay datos disponibles sobre la seguridad al administrar únicamente la PCV10, la evaluación sobre la ocurrencia y severidad de las reacciones mencionadas pueden verse confundida por el efecto de las vacunas coadministradas.44
Evaluaciones comparativas de la administración de tres dosis de la vacuna 13-valente o la 7-valente, en conjunto con las vacunas usuales de inmunización infantil, mostraron que la PCV13 es bien tolerada y muestra perfiles de reactogenicidad muy similares a la PCV7.38
Eficacia y efectividad. La PCV7es la única vacuna de la cual a la fecha, se pueden obtener datos de efectividad. En resumen, la conclusión de todos los estudios es que PCV7 aporta protección contra las neumonías, la otitis media, meningitis y otras manifestaciones invasoras del neumococo.2
Enfermedad neumocócica invasora. En el Northern California Kaiser Permanente Vaccine Study (NCKP), en un estudio prospectivo doble ciego realizado durante 1995 – 1999, se aleatorizaron alrededor de 37,800 niños sanos para recibir la PCV7 o una vacuna control a los 2, 4, 6, y 12-15 meses de edad, con el fin de determinar la eficacia de la vacuna contra la ENI. La eficacia de la vacuna en el análisis, según protocolo, resultó en un 97.4% (95% IC: 82.7–99.9), mientras que en el análisis de la población con intención de tratamiento (ITT por sus siglas en inglés) fue del 93.9% (95% IC: 79.6–98.5) contra la ENI relacionada con los serotipos contenidos en la vacuna (VT). La eficacia global, es decir, la prevención de la enfermedad causada o no por los serotipos de la vacuna, fue de un 89.1% (95% IC: 73.7– 95.8) en el análisis ITT.32
De 1999 a 2003, la incidencia en los Estados Unidos de Norteamérica de la ENI producto de los serotipos presentes en la PCV7 en niños menores de 5 años, se redujo de 80 casos por cada 100,000 habitantes, a 4.6, es decir, un descenso de un 94% (95% IC: 92–96).
La incidencia total de la ENI en este grupo de edad disminuyó un 75% (95% IC: 72–78); pasó de 96.7 casos en 1999 a 23.9 en 2003.45
Neumonía. La eficacia de PCV7 en la prevención de neumonía en los diferentes ensayos clínicos varía dependiendo de la definición de neumonía utilizada; para la neumonía confirmada radiológicamente los datos son consistentes para la eficacia de la vacuna. Black y colaboradores estimaron que la eficacia de la PCV7 para prevenir un primer episodio de neumonía es del 6.0% (95% IC: 1.5–11.0), mientras que la eficacia de protección contra cualquier causa de neumonía confirmada radiológicamente es del 17.7% (95% IC: 7.8–28.9).32
Al realizar una comparación de las tasas de admisiones hospitalarias en los Estados Unidos por neumonía del periodo comprendido entre 1997 y 1999, con el periodo posvacunación de 2001 a 2004 (efectividad), los investigadores reportan que para finales de 2004, la tasa de admisiones por neumonías neumocócicas en niños menores de 2 años de edad, se redujo en un 65% (p< 0.0001), mientras que para los niños con edades de 2 a 4 años, la disminución fue de un 73% (p< 0.0001). Los datos de neumonías por cualquier causa en niños menores de 2 años indicaron una disminución del 39% (95%IC: 22-52), sugiriendo así que la vacunación con la PCV7 puede prevenir las complicaciones por neumonía.46
Otitis media aguda. El estudio NCKP analizó también el impacto de la PCV7 sobre la otitis media aguda (OMA), mostrando que la eficacia contra los episodios relacionados con los serotipos de la vacuna fue de un 64.7% (p= 0.077) en el análisis ITT, mientras que se reportó una eficacia del 6.4% (95% IC: 3.9 -8.7) contra los episodios causados por cualquier patógeno. Los datos obtenidos en el estudio fueron confirmados al publicarse los resultados del ensayo multicéntrico realizado en Finlandia (FinOM), donde el grupo de investigadores reportó una eficacia de la PCV7 contra la OMA, causada por los serotipos en la vacuna de un 57% (95% IC: 44 -67) y un 6% (95% IC: 4 -16) para cualquier causa de OMA. 31
Al evaluar la necesidad de instauración de tubos de drenajes timpánicos, se estimó una reducción del 20.3% (95% IC: 3.6 -34.1) en el estudio NCKP, mientras que el estudio FinOM mostró una eficacia de un 4% (95% IC: -19 -23) durante el periodo de ensayo, sin embargo, cuando se adicionaron los datos de la fase de seguimiento de los 24 meses a los 5 años de edad de los sujetos, se demostró una reducción del 39% al 44%, en la necesidad de practicar timpanostomías.47
Una comparación realizada entre el periodo prevacunación y postvacunación en los Estados Unidos, luego de la introducción de la PCV7, evidenció una disminución en las consultas por OMA, de hasta un 20% en niños menores de 2 años. Los autores indican que es un porcentaje considerablemente mayor al obtenido en los estudios clínicos y lo atribuyen a una mayor efectividad del producto, por el efecto de inmunización de rebaño observado en poblaciones abiertas.49 La eficacia de la PCV10 para prevenir episodios de OMA causados por S. pneumoniae y H. influenzae no tipificable, y su efecto en la incidencia de dicha enfermedad, se evaluó en 4,968 participantes que se aleatorizaron para recibir tres dosis y un refuerzo de la vacuna experimental (formulación que ese entonces contenía 11 serotipos) o la vacuna control de hepatitis A, durante los 3, 4, 5 y 12-15 meses de edad. Se identificaron 333 episodios de OMA en el grupo experimental y 499 casos en el grupo control, determinándose una reducción de la incidencia total del 33.6% (95%IC: 20.8-44.3). La eficacia de la vacuna para prevenir los casos relacionados con los serotipos vacunales (VT) fue del 52.6% para un primer episodio y del 57.6% para cualquier episodio, además, se observó una reducción del 35.3% en la frecuencia de las OMA causadas por H. influenzae no tipificable, posiblemente por medio de la protección inducida por la proteína transportadora D.50 Estos datos, aunque prometedores, están siendo confirmados por diversos estudios que se llevan a cabo en América Latina y en Finlandia.
Colonización nasofaríngea. El sitio de partida del S. pneumoniae hacia los diferentes sitios estériles que llega a invadir, es la nasofaringe, de ahí la importancia de establecer el impacto de las vacunas en la colonización nasofaríngea.
En un estudio clínico donde se evaluaron niños con edades entre un año y 7, con historia de OMA recurrente, se determinó que la colonización nasofaríngea por serotipos vacunales declinó gradualmente del 46% a un 26%, en el grupo que recibió PCV7, mientras que en el grupo control el estado portador de los serotipos vacunales se mantuvo relativamente estable (58% a un 54%).51 Otros estudios efectuados en Israel en población pediátrica sana, han demostrado el mismo efecto de disminución de los serotipos vacunales luego de la aplicación de PCV7.52,53 Estudios con PCV10 y PCV13 están siendo llevados a cabo.
Inmunidad de rebaño. El fenómeno de protección indirecta como resultado de la vacunación extendida dentro de una población, se conoce como inmunidad de rebaño, protección de rebaño o inmunidad comunitaria. La protección indirecta se puede describir como la falta de susceptibilidad de una población a la colonización o invasión por un agente infeccioso, seguida de la protección directa de una proporción suficientemente grande de individuos.54 Los programas de inmunización con la PCV7 han proporcionado beneficios directos a los niños vacunados y, además, protección indirecta a la población no vacunada, entre ellos: neonatos, niños mayores, adultos y adultos mayores. Esta inmunidad comunitaria se ha observado y es apoyada por datos de diferentes estudios de vigilancia epidemiológica. Por ejemplo, para 2003, el CDC estimó en los Estados Unidos una disminución de la incidencia de ENI causada por los serotipos vacunales de un 75% en niños menores de 5 años de edad y un 31% en personas >65 años.55 Otro estudio evidenció también una reducción considerable de la incidencia de ENI en adultos mayores de 65 años de edad, al pasar de 34.5/ 100,000 en 1998-1999 a 8.2/ 100,000 en 2004.56 Una situación similar se ha documentado en los neonatos y niños pequeños que aun son muy jóvenes para recibir la vacuna, sugiriendo así que los beneficios de la PCV7 se extienden también a esa población.57 Se dice que los efectos indirectos de la vacuna neumocócica son consecuencia de la disminución de la transmisión de los serotipos vacunales y su decreciente colonización en la nasofaringe de infantes y niños pequeños.54
Serotipos de reemplazo. Cuatro años después de la introducción de la PCV7 en los Estados Unidos, se observó una dramática disminución de casos de ENI con un aumento paralelo y de mucho menor magnitud en las enfermedades invasoras causadas por los serotipos no incluidos en la vacuna PCV7 (NVT), debida probablemente a la erradicación casi completa de los serotipos incluidos en la vacuna en portadores asintomáticos, que ha dado paso a la creación de un nicho ecológico para NVT.45,58
La misma situación se advierte en la OMA, en la cual, junto a la disminución global de la cantidad de casos, se manifiesta un aumento de las infecciones producidas por los NVT como el 19A, 3 y otros patógenos, fundamentalmente el H. influenzae no tipificable. En los Estados Unidos, la proporción de otitis medias agudas atribuidas al neumococo, habría disminuido de un 47% a un 31% de todas las OMA bacterianas, mientras que las debidas a H. influenzae no tipificables, han aumentado de un 41% a un 56% y son prevalentes.59
Al realizar análisis genéticos de los S. pneumoniae recolectados luego de la introducción de la PCV7 en los Estados Unidos, se demostró que el aumento de los NVT no se debe a la emergencia de nuevos clones, sino más bien a la expansión de clones preexistentes de los NVT.60 El serotipo 19A ha tomado gran importancia, ya que su incidencia aumentada se ha observado en diferentes poblaciones; por ejemplo, en los nativos de Alaska se estima que un 28.3% de las ENI son producidas por ese serotipo.61 En un estudio realizado en Massachusetts, con datos de 2002 -2005, se identificó al serotipo 19A como la causa del 27% de las ENI en niños menores de 5 años.62 Aparentemente no existe una inmunidad cruzada entre el serotipo 19A y el serotipo vacunal 19F, el cual presenta el perfil inmunológico menos potente entre todos los serotipos contenidos en las vacunas PCV7 y PCV10,63 de este modo, la PCV13 tomaría un papel fundamental en la prevención de estas enfermedades, pues incluye el serotipo 19A en su formulación.
El reemplazo de serotipos neumocócicos es de origen y de evolución multifactorial y no necesariamente coincide con la introducción de la vacuna; por ejemplo, en países como Corea del Sur e Israel se detectó un aumento importante de aislamientos del serotipo 19A, años antes de la comercialización de PCV7, atribuyéndole este hecho, en parte, al abuso de antibióticos de vida media prolongada, como azitromicina y algunas cefalosporinas.64-66
Uso de antibióticos y resistencia antimicrobiana. La prevención de infecciones neumocócicas en niños pequeños, como resultado de la introducción de la vacuna conjugada, ha producido una disminución del uso de antibióticos. Lo anterior fue documentado en el estudio NCKP, con un reporte del 5.3% de reducción en el uso de antibióticos, en el grupo que recibió la PCV7.32
Las infecciones resistentes a antibióticos presentes alrededor del mundo son causadas principalmente por cinco de los siete serotipos contenidos en la PCV7 (6B, 9V, 14, 19F y 23F).67 Debido a la asociación entre serotipo y resistencia, se ha observado una importante reducción en la cantidad de cepas de S. pneumoniae resistentes, propiciando un menor uso de antibióticos.3
La comparación realizada en la población estadounidense de 1999 y 2004, encontró que la tasa global de la enfermedad neumocócica producto de cepas no susceptibles a la penicilina y de las infecciones relacionadas con los VT, disminuyó un 57% (IC 95%: 55-58) y un 87% (IC 95%: 8688), respectivamente. En la población de niños menores de 2 años de edad, la incidencia de ENI causada por neumococos no susceptibles a la penicilina cayó un 81% (IC 95%: 80- 82).68 Otros estudios muestran tendencias similares; en la ciudad de Atlanta se observó una disminución del 82% de episodios de ENI resistentes a macrólidos en niños menores de 2 años de edad.69
Contrariamente, se ha detectado un aumento en las tasas de incidencia de enfermedades neumocócicas resistentes a antibióticos causadas por serotipos no contenidos en la vacuna, posiblemente atribuibles al efecto de reemplazo. En 1999 los serotipos 14, 9F, 23F, 19F y 6B eran los neumococos con mayor resistencia a la penicilina, para 2005, la mayoría de los cepas penicilina resistentes pertenecían a los serotipos NVT 35B, 19A y 6B.58,70,71
Se requiere mayor información en el largo plazo para extraer conclusiones definitivas de la relación existente entre el uso de antibióticos, la inmunización y los niveles de resistencia antimicrobiana.3
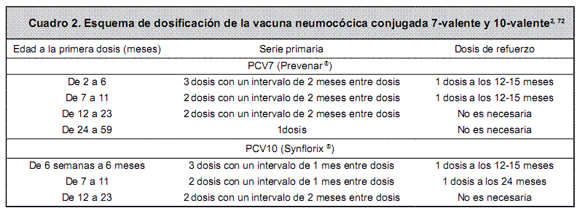
Dosis y administración. La vacuna PCV7 está recomendada para su uso en niños con edades mayores o iguales a 6 semanas y hasta los 5-9 años, mientras que la PCV10 en niños entre los 6 meses y los 2 años de edad. Cada dosis consta de 0.5mL, que se administran intramuscularmente. Las vacunas rutinarias establecidas para el rango de edad pueden ser administradas concomitantemente en jeringas y sitios de aplicación diferentes. La vacunación está contraindicada para aquellas personas con hipersensibilidad conocida a cualquiera de los componentes de la vacuna. En caso de que el niño se encuentre con algún padecimiento de moderado a severo, la inmunización puede posponerse hasta que se recupere, sin embargo, las enfermedades leves como infecciones respiratorias superiores con poca fiebre o sin ella, no son contraindicaciones para la vacunación.2,20,72
Conclusión
La vacuna PCV7 incluida en el esquema básico de inmunizaciones de los Estados Unidos, desde el año 2000, ha demostrado ser segura y tener una efectividad contra enfermedades invasoras y de mucosas, altamente significativa. Además de lo anterior, ha reducido el porcentaje de cepas de S. pneumoniae resistentes a múltiples antimicrobianos, y debido a la reducción en la portación nasofaríngea, ha tenido un efecto rebaño extraordinario, reduciendo también las infecciones por esta bacteria en personas no vacunadas mayores de 5 años de edad. Esta vacuna fue diseñada originalmente tomando en cuenta los serotipos prevalentes en los Estados Unidos, sin incorporar los serotipos 1 y 5, que son frecuentes en diversas regiones, caso de América Latina. Luego de varios años de uso, se ha detectado un leve incremento de serotipos emergentes, como el 3, 17F y 19A, lo cual ha obligado a desarrollar vacunas que los incluyan.
Dos vacunas que expanden la cantidad de serotipos incluidos en la vacuna, han sido recientemente aprobadas por entidades regulatorias, como la EMEA y Chile (PCV10 y PCV13). La aprobación de estas nuevas vacunas se ha efectuado con base en su perfil de seguridad observado en ensayos clínicos controlados, y según su actividad inmunogénica, por lo que será fundamental analizar la efectividad de ambas cuando se usen a mayor escala.
2. Centers for Disease Control and Prevention (CDC). Preventing pneumococcal disease among infants and young children: recommendations of the Advisory Committee on Immunization Practices (ACIP). MMWR 2000; 49:1-35. [ Links ]
3. World Health Organization. Detailed Review Paper on Pneumococcal Conjugate Vaccine: presented to the WHO Strategic Group of Experts on Immunization. En: www.who.int/immunization/SAGE_wg_detailedreview-pneumovaccine.pdf [ Links ]
4. Henrichsen J. Six newly recognized types of Streptococcus pneumoniae. J Clin Microbiol 1995; 33:2759-62. [ Links ] p
5. Harwell J, Brown R. The Drug-Resistant Pneumococcus. Chest 2000; 117:530-41. [ Links ]
6. Jefferson T, Ferroni E, Curtale F, Rossi PG, Borgia P. Streptococcus pneumoniae in Western Europe: serotype distribution and incidence in children less than 2 years old. Lancet Infect Dis 2006; 6:405-10. [ Links ]
7. Centers for Disease Control and Prevention. Pneumococcal disease. Epidemiology and prevention of vaccine-preventable diseases. National Immunization Program, Centers for Disease Control and Prevention, U.S. Department of Health and Human Services 2004:233-225. [ Links ]
8. Robinson K, Baughman W, Rothrock G, Barrett N, Pass M, Lexau C et al. Epidemiology of invasive Streptococcus pneumoniae infections in the United States, 1995-1998. Opportunities for prevention in the conjugate vaccine era. JAMA 2001; 285:1729-35. [ Links ]
9. OBrien KL, Shaw J, Weatherholtz R, Reid R, Watt J, Croll J et al. Epidemiology of invasive Streptococcus pneumoniae among Navajo children in the era before use of conjugate pneumococcal vaccines, 1989-1996. Am J Epidemiol 2004; 160:270-78. [ Links ]
10. Guevara M, Barricarte A, Pérez B, Arriazu M et al. La vacuna neumocócica conjugada heptavalente (Prevenar): diferencias en su efectividad en distintas poblaciones. Anales Sis San Navarra 2008; 31:171-92. [ Links ]
11. Organización Mundial de la salud. Vacuna antineumocócica conjugada para la inmunización infantil: documento de posición de la OMS. En www.who.int/immunization/Pneumococcal_conjugate_vaccine_child_SP.pdf. [ Links ]
12. Fine AM, Goldmann DA, Forbes PW, Harris SK, Mandl KD. Incorporating vaccine-preventable disease surveillance into the National Health Information Network: leveraging childrens hospitals. Pediatrics 2006; 118:1431-8. [ Links ]
13. Doyle T, Ma H, Groseclose S, Hopkins R. PHSkb: a knowledgebase to support notifiable disease surveillance.BMC Med Inform Decis Mak 2005; 5: 27. [ Links ]
14. Hausdorff WP, Bryant J, Paradiso PR, Siber GR. Which pneumococcal serogroups cause the most invasive disease: implications for conjugate vaccine formulation and use, part I. Clin Infect Dis 2000; 30:100-21. [ Links ]
15. Hausdorff WP. The roles of pneumococcal serotypes 1 and 5 in pediatric invasive disease. Vaccine 2007; 25:2406-12. [ Links ]
16. Ulloa R, Ávila ML, Herrera M, Herrera J, Arguedas A. Invasive pneumococcal disease in Costa Rican children: a seven year survey. Pediatr Infect Dis J 2003; 22:1069-74. [ Links ]
17. Arguedas A, Abdelnour A, Soley C, Jiménez E, Jiménez AL, Dagan R, et al. Active Epidemiologic Surveillance of Invasive Pneumococcal Disease (IPD) and Chest Radiograph (CXR)-Confirmed Pneumonia (CRX+Pn) in Children in San José, Costa Rica. Abstract
18. Porat N, Soley C, Marengolciene M, Greenberg D, et al. An International Serotype 3 Clone Causing Pediatric Noninvasive Infections in Israel, Costa Rica and Lithuania. Pediatr Infect Dis J 2008; 27:709-12. [ Links ]
19. Oosterhuis F, Beutels F, Van Damme P. Immunogenicity, efficacy, safety and effectiviness of pneumococcal conjugate vaccines (19982006). Vaccine 2007; 25:2194-212. [ Links ] presentado en el 2do Congreso Global Vaccine 2008. Boston, Estados Unidos de Norteamérica.
20. Agencia Europea de Medicamentos (EMEA). Ficha técnica o resumen de las características del producto: Prevenar suspensión inyectable. En .
21. European Medicines Agency. Pre-Authorisation Evaluation of Medicines for Human Use. Committee for medicinal products for human use: Summary of positive opinion for Synflorix. En
22. Stein KE. Thymus-independent and thymus-dependent responses to polysaccharide antigens. J Infect Dis 1992; 165:S49-52. [ Links ]
23. Niemann T, Kayhty H, Leroy O, Eskola J. Pneumococcal conjugate vaccination in toddlers: mucosal antibody response measured as circulating antibody-secreting cells and as salivary antibodies. Pediatr Infect Dis 1999; 18:764-72. [ Links ]
24. OBrien KL, Dagan R. The potential indirect effect of conjugate pneumococcal vaccines. Vaccine 2002; 3661:1-11. [ Links ]
25. Romero-Steiner S, Libutti D, Pais LB. Standarization of an opsonophagocyticassay for the measurement of functional antibody activity against Streptococcus pneumoniae using differentiated HL-60 cells. Clin Diagn Lab Immunol 1997; 4:415–22. [ Links ]
26. Romero-Steiner S, Frasch CE, Carlone G, et al. Use of opsonophagocytosis for serological evaluation of pneumococcal vaccines. Clin Vaccine Immunol 2006;13:165–9. [ Links ]
27. Scheifele DW, Halperin SA, Smith B, Ochnio J, Meloff K, Duarte- Monteiro D. Assessment of the compatibility of co-administered 7valent pneumococcal conjugate, DTaP. IPV/PRP-T Hib and hepatitis B vaccines in infants 2–7 months of age. Vaccine 2006; 24:2057–64. [ Links ]
28. Tichmann-Schumann I, Soemantri P, Behre U, Disselhoff J, Mahler H, Maechler G, et al. Immunogenicity and reactogenicity of four doses of diphtheria-tetanus-three component acellular pertussis-hepatitis B-inactivated polio virus Haemophilus influenzae type b vaccine coadministered with 7-valent pneumococcal conjugate Vaccine. Pediatr Infect Dis J 2005; 24:70–7. [ Links ]
29. Reinert P, Guy M, Girier B, Szelechowski B, Baudoin B, Deberdt P, et al. The safety and immunogenicity of an heptavalent pneumococcal polysaccharide conjugate vaccine (Prevenar) administered in association with a whole-cell pertussis-based pediatric combination vaccine (DTP-IPV/PRP-T) to French infants with a two-, three-, and four-month schedule. Arch Pediatr 2003; 10:1048–55. [ Links ]
30. Schmitt HJ, Faber J, Lorenz I, Schmole-Thoma B, Ahlers N. The safety, reactogenicity and immunogenicity of a 7-valent pneumococcal conjugate vaccine (7VPnC) concurrently administered with a combination DTaP-IPV-Hib vaccine. Vaccine 2003; 21:3653–62. [ Links ]
31. Eskola J, Kilpi T, Palmu A, Jokinen J, Haapakoshi J, Herva E, et al. Efficacy of a pneumococcal conjugate vaccine against acute otitis media. N Engl J Med 2001; 344:403–9. [ Links ]
32. Black S, Shinefield H, Fireman B, Lewis E, Ray P, Hansen JR, et al. Efficacy, safety and immunogenicity of heptavalent pneumococcal conjugate vaccine in children. Northern California Kaiser Permanente Vaccine Study Center Group. Pediatr Infect Dis J 2000; 19:187–95. [ Links ]
33. Choo S, Seymour L, Morris R, Quataert S, Lockhart S, Cartwright K, et al. Immunogenicity and reactogenicity of a pneumococcal conjugate vaccine administered combined with a Haemophilus influenzae type B conjugate vaccine in United Kingdom infants. Pediatr Infect Dis J 2000; 19:854–62. [ Links ]
34. Vesikari T, Wysocki J, Chevallier B, Karvonen A, Czajka H, Arsène JP, et al. Immugenicity of the 10-valent pneumococcal non-typeable Haemophilus influenzae protein D conjugate vaccine (PHiD-CV) compared to the licensed 7vCRM vaccine. Pediatr Infect Dis J 2009; 2: S66- S76. [ Links ]
35. Knuf M, Szenborn L, Moro M, Christian P, Bermal N, Bernard L, et al. Immugenicity of rotunely used childhood vaccines when coadministered with the 10-valent pneumococcal non-typeable Haemophilus influenzae protein D conjugate vaccine (PHiD-CV). Pediatr Infect Dis J 2009; 2: S97- S108. [ Links ]
36. Wysocki J, Tejedor JC, Grunert D, Konior R, García J, Knuf M, et al. Immugenicity of the 10-valent pneumococcal non-typeable Haemophilus influenzae protein D conjugate vaccine (PHiD-CV) when coadministered with different Neiseria meningitidis serogroup C conjugate vaccines. Pediatr Infect Dis J 2009; 2: S77- S88. [ Links ]
37. Kieninger D, Kueper K, Juergens C, Ahlers N, Baker S, Girdina P, et al. Safety & immunologic non-inferiority of 13-valent pneumococcal conjugate vaccine compared to 7-valent pneumococcal conjugate vaccine with routinely vaccines in healthy infants. Abstract presentado en el 2do Congreso Global Vaccine 2008. Boston, Estados Unidos de Norteamérica. [ Links ]
38. Grimpel E, Scott D, Laudat F, Baker S Gruber W, PCV13 multicenter study group. Safety and immunogenicity of a 13-valent pneumococcal conjugate vaccine given with routine pediatric vaccination to healthy infants in France. Abstract presentado en el 2do Congreso Global Vaccine 2008. Boston, Estados Unidos de Norteamérica. [ Links ]
39. Shinefield HR, Black S, Ray P, Chang I, Lewis N, Fireman B, et al. Safety and immunogenicity of heptavalent pneumococcal CRM197 conjugate vaccine in infants and toddlers. Pediatr Infect Dis J 1999;18 :757–63. [ Links ]
40. Esposito S, Pugni L, Bosis S, Proto A, Cesati L, Bianchi C, et al. Immunogenicity, safety and tolerability of heptavalent pneumococcal conjugate vaccine administered at 3, 5 and 11 months post-natally to pre- and full-term infants. Vaccine 2005; 23:1703–8. [ Links ]
41. Black SB, Cimino CO, Hansen J, Lewis E, Ray P, Corsaro B, et al. Immunogenicity and safety of measles-mumps-rubella, varicella and Haemophilus influenzae type b vaccines administered concurrently with a fourth dose of heptavalent pneumococcal conjugate vaccine compared with the vaccines administered without heptavalent pneumococcal conjugate vaccine. Pediatr Infect Dis J 2006; 25:306–11. [ Links ] 42. Scheifele DW, Halperin SA, Smith B, Ochnio J, Meloff K, Duarte- Monteiro D. Assessment of the compatibility of co-administered 7valent pneumococcal conjugate, DTaP. IPV/PRP-T Hib and hepatitis B vaccines in infants 2–7 months of age. Vaccine 2006; 24:2057–64. [ Links ]
43. De Aristegui FJ, Cos AB, Zurimendi CA, Alday EMV, Alzua RJ, De la Fuente JE, et al. Evaluation of the safety and immunogenicity of pneumococcal seven-valent conjugate vaccine (Prevenar) administered in previously unvaccinated Spanish children aged 24 to 36 months. Vaccine 2005; 23:1917–22. [ Links ]
44. Chevallier B, Vesikari T, Brzostek J, Knuf M, Bermal N, Aristegui J, et al. Safety and Reactogenicity of the 10-Valent Pneumococcal Non-typeable Haemophilus influenzae Protein D Conjugate Vaccine (PHiD-CV) When Coadministered With Routine Childhood Vaccines. Pediatr Infect Dis J 2009; 28: S109-S118. [ Links ]
45. Centers for Disease Control and Prevention (CDC). Direct and indirect effects of routine vaccination of children with 7-valent pneumococcal conjugate vaccine on incidence of invasive pneumococcal disease-United States, 1998-2003. MMMWR Morb Mortal Wkly Rep 2005; 54:893-7 [ Links ]
46. Grijalva C, Nuorti J, Arbogast P, Martin S, Edwards K, Griffin M. Decline in pneumonia admissions after routine childhood immunisation with pneumococcal conjugate vaccine in theUSA: a time-series analysis. Lancet 2007; 369: 1179–86. [ Links ]
47. Palmu A, Verho J, Jokinen J, Karma P, Kilpi T. The Seven-Valent Pneumococcal Conjugate Vaccine Reduces Tympanostomy Tube Placement in Children. Pediatr Infect Dis J 2004; 23: 732-8. [ Links ]
48. Jansen AG, Hak E, Veenhoven RH, Damoiseaux RA, Schilder AG, Sanders EA. Pneumococcal conjugate vaccines for preventing otitis media. Cochrane Database Syst Rev 2009; 15: CD001480. [ Links ]
49. Grijalva C, Poehling K, Nuorti JP, Zhu Y, Martin S, et al. National Impact of Universal Childhood Immunization With Pneumococcal Conjugate Vaccine on Outpatient Medical Care Visits in the United States. Pediatrics 2006; 118:865-73. [ Links ]
50. Prymula R, Peeters P, Chrobok V, Kritz P, Novakova E, Kaliskova E, et al. Pneumococcal capsular polysaccharides conjugated to protein D for prevention of acute otitis media caused by both Streptococcus pneumoniae and non-typeable Haemophilus influenzae: a randomized double-blind efficacy study. Lancet 2006; 367: 740-8. [ Links ]
51. Bogaert D, Veenhoven RH, Slujier M, Wannet WJ, Rijkers GT, Mitchell TJ, et al. Molecular Epidemiology of pneumococcal colonization in response to pneumococcal conjugate vaccination in children with recurrent acute otitis media. J Clin Microbiol 2005; 43: 74-83. [ Links ]
52. Shouval D, Greenberg D, Givon-Lavi N, Porat N, Dagan R. Serotype coverage of invasive and mucosal pneumococcal disease in Israeli children younger than 3 years by various pneumococcal conjugate vaccines. Pediatr Infect Dis J 2009; 28: 277-82. [ Links ]
53. Dagan R, Sikuler-Coheb M, Zamir O, Janco J, Givon-Lavi N, et al. Effect of a conjugate pneumococcal vaccine on the occurrence of respiratory infections and antibiotic use in day-care center attendee. Pediatr Infect Dis J 2001; 20: 951-8. [ Links ]
54. Isaacman D, Fletcher M, Fritzell B, Ciuryla V, Schranz J. Indirect effects associated with widespread vaccination of infants with heptavalent pneumococcal conjugate vaccine (PCV7; Prevenar). Vaccine 2007; 25: 2420-27. [ Links ]
55. Centers for Disease Control and Prevention. Direct and indirect effects of routine vaccination of children with 7-valent pneumococcal conjugate vaccine on incidence of invasive pneumococcal disease – United States, 1998-2003. MMWR 2005; 54: 893-7. [ Links ]
56. Hicks L, Harrison L, Flannery B, Hadler J, Schaffner W, el al. Incidence of pneumococcal disease due to non-pneumococal conjugate vaccine (PCV7) serotypes in the United States during the era of widespread PCV7 vaccination, 1998-2004. J Infect Dis 2007; 196: 1346-54. [ Links ]
57. Poehling K, Talbot T, Griffin M, Craig A, Whitney C, et al. Invasive pneumococcal disease among infants before and after introduction of pneumococcal conjugate vaccine. JAMA 2006; 295: 1668-74 [ Links ]
58. Pletz M, Maus U, Norbert K, Welte T, Lode H. Pneumococcal vaccines: mechanism of action, impact on epidemiology and adaption of the species. J Antimicrob Agents 2008; 32:199-206.
59. García-Sicilia J. Nuevas vacunas antineumocócicas: Más allá del neumococo.Rev Esp Quimioterap 2007; 20:119-21. [ Links ]
60. Beall B, McEllistrem MC, Gertz GE, Wedel S, Boxrud DJ, González AL, et al. Pre- and postvaccination clonal compositions of invasive pneumococcal serotypes for isolates collected in the United States in 1999, 2001, 2002. J Clin Microbiol 2006; 44:999-1017. [ Links ]
61. Singleton RJ, Hennessy TW, Bulkow LR, Hammitt LL, Zulz T, Hurlburt DA, et al. Invasive pneumococcal disease caused by nonvaccine serotypes among Alaska native children with high levels of 7-valent pneumococcal conjugate vaccine coverage. JAMA 2007; 297:1784-92. [ Links ]
62. Pelton S, Hout MA, Finkelstein JA, Bishop C, Hsu K, Kellenberg, Huang S, et al Emergence of 19A as Virulent and Multidrug Resistant Pneumococcus in Massachusetts Following Universal Immunization of Infants With Pneumococcal Conjugate Vaccine Pediatr Infect Dis J 2007;26: 468–472. [ Links ]
63. De Roux A, Schmöle-Thoma B, Siber G, Hackell J, Kuhnke A, Ahlers N, et al. Comparison of pneumococcal conjugated polysaccharide vaccines in the ederly adults: conjugate vaccine elicits improved antibacterial immune reponses and immunological memory. Clin Infect Dis 2008; 46: 1015-23. [ Links ]
64. Dagan R. Impact of pneumococcal conjugate vaccine on infections caused by antibiotic-resistant Streptococcus pneumoniae. Clin Microbiol Infect 2009; 15 Suppl 3:16-20. [ Links ]
65. Moraga F. Enfermedad neumocócica en la era vacunal y emergencia de serotipos: ¿Tendencias temporales y reemplazo de serotipos? Enferm Infecc Microbiol Clin 2009; 27: 1-4. [ Links ]
66. Dagan R, Givon-Lavi N, Leibovitz E, Greenberg D, Porat N. Introduction and proliferation of multidrug-resistant Streptococcus pneumoniae serotype 19A clones that cause acute otitis media in an unvaccinated population. J Infect Dis 2009; 199: 776-85. [ Links ]
67. Schrag SJ, Beall B, Dowell SF. Limiting the spread of resistant pneumococci: biological and epidemiologic evidence for the effectiveness of alternative interventions. Clin Microbiol Rev 2000; 13:588-601. [ Links ]
68. Kyaw MH, Lynfield r, Schaffner W, Craig AS, Hadler J, Reingold A, et al. Effect of introduction of the pneumococcal conjugate vaccine on drug resistant Steptococcus pneumoniae. N Engl J Med 2006; 354: 1455-63. [ Links ]
69. Stephens DS, Zughaier SM, Whitney CG, Baughman WS, Barker L, et al. Incidence of macrolide resistance in Streptococcus pneumoniae after introduction of the pneumococcal conjugate vaccine: population-based assessment. Lancet 2005; 365:855-63. [ Links ]
70. Richter SS, Heilmann KP, Dohrn CL, Riahi F, Beekmann SE, Doern GV. Changing epidemiology of antimicrobial-resistant Streptococcus pneumoniae in the United States, 2004-2005. Clin Infect Dis. 2009; 48:e23-33. [ Links ]
71. Farrell DJ, Klugman KP, Pichichero M. Increased antimicrobial resistance among nonvaccine serotypes of Streptococcus pneumoniae in the pediatric population after the introduction of 7-valent pneumococcal vaccine in the United States. Pediatr Infect Dis J 2007; 26:123-8. [ Links ]
 Todo el contenido de esta revista, excepto dónde está identificado, está bajo una Licencia Creative Commons
Todo el contenido de esta revista, excepto dónde está identificado, está bajo una Licencia Creative Commons













