Services on Demand
Journal
Article
Indicators
-
 Cited by SciELO
Cited by SciELO -
 Access statistics
Access statistics
Related links
-
 Similars in
SciELO
Similars in
SciELO
Share
Acta Médica Costarricense
On-line version ISSN 0001-6002Print version ISSN 0001-6012
Acta méd. costarric vol.46 n.1 San José Mar. 2004
Resumen
Se estima que de un 60 a 84% de los pacientes con cáncer desarrollan metástasis óseas. De estos un 70% experimentan síndrome s dolorosos de difícil manejo, de los cuales un 50% muere sin un adecuado alivio del dolor con una pobre calidad de vida. Por tanto, es necesario contar con medicamentos accesibles y efectivos para el manejo de esta patología.
El objetivo de este artículo es revisar la fisiopatología del dolor en hueso y describir los medicamentos que se utilizan con más frecuencia en el manejo de este tipo de dolor por cáncer. Además se presenta un algoritmo de 6 pasos que permite orientar al médico al momento de tomar una decisión terapéutica.
Descriptores: Dolor, metastásico, óseo, revisión
Recibido: 29 de setiembre de 2003
Aceptado: 20 de enero de 2004
Abreviaturas: NMDA; N-metil-D-aspatato, AINES; antiinflamatorios no esteroides.
Uno de los síndromes dolorosos mas frecuentes en los pacientes con cáncer avanzado es la metástasis ósea. 1 Este es de difícil manejo y control en la práctica clínica.
Actualmente los avances científicos en la detección y tratamiento del cáncer han prolongado la expectativa de vida en los pacientes. Contrario sucede con el fenómeno de dolor óseo en cáncer, en el cual las estrategias terapéuticas actuales no son significativamente efectivas. 2
La mayoría de tratamientos paliativos de dolor óseo son basados en estudios clínicos sobre manejo de dolor en pacientes o en modelos experimentales no bien diseñados 3 esto podría explicar por qué los medicamentos utilizados son parcialmente efectivos. 4
Hoy en día, uno de los principales obstáculos en el desarrollo de nuevos y seguros tratamientos en el control de dolor óseo es la ausencia de conocimiento en la ciencia básica de la fisiología del dolor en hueso. 2
El objetivo de este artículo es revisar los últimos avances que se han venido realizando, para entender mejor la fisiopatología y tratamiento del dolor óseo por cáncer metastásico.
Epidemiología
El dolor en pacientes con cáncer usualmente es multifactorial, puede surgir como consecuencia del proceso mismo, efectos adversos del tratamiento o ambos. 1 Por estas razones el abordaje y manejo de dicho síntoma debe ser multidisciplinario.
Se estima que de un 60 al 84% de los pacientes con cáncer desarrollan metástasis óseas. De estos un 79% experimentan síndrome s dolorosos de difícil manejo de los cuales un 50% muere sin un adecuado alivio del dolor con una pobre calidad de vida. 5
El síndrome doloroso ocurre ya sea por proliferación local tumoral o por invasión metastásica de un tumor a distancia. 6 Con frecuencia el dolor óseo metastásico traduce la presencia de un tumor en mama, tiroides, próstata, riñón pulmón o suprarenales. 7
Fisiología del dolor óseo
El dolor óseo esta asociado a la destrucción del tejido por medio de las células osteoclastos (figura 1). Normalmente, la resorción ósea osteoclástica está en equilibrio con la formación ósea mediada por los osteoblastos. 1 En procesos neoplásicos la actividad osteolítica está aumentada y se producen sustancias tales como citoquinas, factores de crecimiento local, péptidos similares a la hormona paratiroidea y prostaglandinas (figura 1). 8 También son liberados otros autacoides titulares como iones de potasio, bradicininas y factores activadores de osteoclasto. 9 Estas sustancias tisulares juegan un papel importante en la sensibilización del tejido neural frente a estímulos químicos y térmicos, 10 disminuyen los umbrales de descarga de la membrana neuronal, producen respuestas exageradas a los estímulos por encima del umbral y provocan descargas de impulsos tónicos en nociceptores normalmente silentes. 11,12
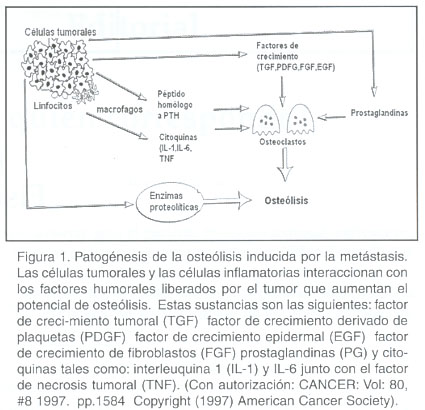
Este fenómeno de sensibilización periférica da como resultado sensibilidad anormal de la piel circundante a la presión (alodinia e hiperalgesia), dolor en músculos, tendones, articulaciones y tejidos profundos que están en contacto con el hueso. 13 Esto se limita a conseguir que las terminaciones periféricas tengan una mayor capacidad de respuesta de alarma ante una lesión.
La presencia constante del proceso nocivo, estimulando los receptores nociceptivos da la instauración de un dolor subagudo que tiende a cronificarse con el crecimiento de la metástasis ósea.
Estos estímulos prevalentes dan lugar a otro fenómeno importante denominado sensibilización central la cual comprende la amplificación anormal de las señales sensoriales de entrada al sistema nervioso central, en especial la médula espinal. 13,14 El fenómeno ocurre por la entrada persistente de estímulos a través de la fibras C 4 esto desencadena en la médula espinal un incremento temporal de la potencia de terminales sinápticos silentes. 12 En este proceso juega un papel importante el receptor de glutamato N-metil-D-aspartato (NMDA). 15 La amplificación resultante de la señal generada en las neuronas pos-sinápticas envía un mensaje al cerebro que es interpretado como dolor. 12,14 En síntesis la sensibilización central amplifica los efectos sensoriales de las entradas periféricas tanto nociceptivas (fibras C de dolor) como no nociceptivas (fibras A de tacto).
En la práctica ambos fenómenos confluyen en la génesis del dolor óseo metastásico, así la sensibilización periférica sucede de forma aguda al aparecer la lesión metastásica y los nociceptores traducen la información conduciéndola a través de las fibras aferentes mielínicas A -delta o fibras amielínicas C hacia la médula espinal, donde la información es modulada por diversos sistemas. 12 Al instaurarse el proceso subagudo 16 inicia el proceso de sensibilización central donde se empiezan a activar sinapsis sensitivas silentes. Y se produce un estado de aumento de la percepción central. Al hacerse crónico el dolor el fenómeno se torna aun más complejo pues todo aquello que está en contacto con el área de lesión se convierte en un potente generador de dolor. 13 El tacto, un movimiento muscular o articular traducen dolor, manifestándose los fenómenos de alodinia e hiperalgesia mucho más marcados. 17
Con la progresión y crecimiento de la enfermedad metastásica pueden aparecer fenómenos de compresión de nervios periféricos, raíces nerviosas o médula espinal. 18 Entonces el dolor se puede referir a otros dermatomos, complicando aun más el cuadro inicial doloroso. 19
Esta condición se convierte un factor debilitante para el paciente y al ser controlado de forma inadecuada puede desencadenar el fenómeno de dolor total detallado más adelante.
Tipos de dolor
En general el paciente con cáncer óseo metastásico experimenta tres clases principales de dolor. 20
El primer tipo es el dolor somático de inicio agudo, descrito usualmente como de carácter sordo, lancinante o pulsátil. Este tipo de dolor aumenta su intensidad al través del tiempo. 4,20
El segundo tipo es el dolor incidental, episódico o desencadenado por los movimientos del miembro afectado. Con frecuencia aparece luego de instaurado el problema primario. 20 Este es un dolor de difícil manejo y control, representa la condición más debilitante del paciente con cáncer óseo metastásico. 4
El tercer tipo es el dolor total, y nace por lo general debido a un control inadecuado del dolor físico, 21 posee un importante componente psicológico que se manifiesta con depresión, ansiedad y enojo. 22
El dolor físico experimentado y las condiciones socioculturales del individuo, 23 hacen que el dolor total sea un factor importante a considerar en un paciente con dolor óseo secundario a cáncer metastásico.
Diagnóstico
La historia clínica y el exámen físico son fundamentales en el diagnóstico de dolor. A su vez, puede complementarse con estudios de laboratorio como los son la fosfatasa alcalina, calcio sérico, calcio urinario e hidroxiprolina urinaria. 10
Los estudios por imágenes como la radiografía simple del área afectada, la gammagrafía o una tomografía axial computarizada son útiles para detectar los sitios invadidos por el tumor. 10
Se recomienda que el paciente tenga un diario de control para valorar el grado de afección, intensidad y carácter del dolor. Esto ayuda en la valoración clínica del tratamiento. 20,23
Tratamiento
El tratamiento de elección es la radioterapia 24. Se ha visto que reduce la inflamación local y a su vez el tamaño de la masa tumoral, aumenta la situación funcional y previene las fracturas patológicas y el riesgo de compresiones nerviosas o de cordón espinal. 1,25 El alivio de dolor por medio de la radioterapia puede ser significativamente duradero. 26 En pacientes que sobreviven un año o más con radioterapia 60% estarán libres de dolor. 5,26 Esta puede presentar dos tipos de efectos secundarios: sistémicos y específicos. 26
La terapia farmacológica es variable. Debe individualizarse fundamentándose en el comportamiento del dolor y las actitudes psicosociales del paciente. 2,2
Los tratamientos farmacológicos deben estandarizarse en la medida de lo posible con horarios y dosificaciones simples y menormente invasivas. 2 El médico debe tratar de cumplir con los lineamientos de la escalera analgésica de la Organización Mundial de la Salud (figura 2).

En el tratamiento de dolor en hueso los opiodes, los cuales son el pilar del manejo de dolor en cáncer de intensidad moderada a severa y pueden producir una analgesia efectiva. Los opiodes actúan por medio de su interacción con los receptores opiodes en sistema nervioso central y médula espinal. 27 Modulan la entrada nociceptiva periférica en médula espinal, activan a su vez sistemas inhibitorios descendentes del tallo cerebral y ganglios basales. En nivel central modulan la actividad del sistema límbico, modificando la respuesta emocional al estímulo nocivo. 27
En los pacientes que manifiestan una resistencia farmacológica a la terapia opioide, es necesario agregar un anti-inflamatorio no esteroidal o un coadyuvante como los corticoesteroides, los cuales pueden reducir la inflamación y el edema asociado a depósitos tumorales. 28
La terapia analgésica controlada por el paciente se utiliza de preferencia en el dolor incidental asociado a metástasis ósea. 4 La terapia analgésica controlada por el paciente otorga la facilidad de que se mantiene una analgesia basal continua y además presenta la ventaja en que el paciente puede administrarse bolos de fármaco antes de realizar algún movimiento, controlando así el dolor incidental. 4,20 Este método analgésico tiene el inconveniente de ser costoso para los servicios de salud y el paciente.
Los anti-inflamatorios no esteroidales son bastante efectivos debido a que el dolor en su mayoría se debe a un proceso inflamatorio local mediado por prostaglandinas, Reducen el dolor por medio de la inhibición de la enzima ciclooxigenasa, disminuyen la inflamación local y la de sensibilización producida por las prostaglandinas. 8,28
Los corticoesteroides se utilizan como terapia coadyuvante, disminuyen la inflamación y el edema peritumoral 1 . Asociado a esto, mejoran la calidad de vida del individuo mejorando el estado de animo, estimulando el apetito y reduciendo las náuseas 29 , efectos que se observan con frecuencia en el paciente con cáncer y que perjudican tanto la respuesta al tratamiento como la progresión de la enfermedad.
Los bifosfonatos están utilizándose como terapia coadyuvante. 30 Actúan inhibiendo la actividad osteoclástica (figura 3) causa principal del dolor óseo. Se ha visto que poseen un efecto anti-inflamatorio secundario. 30 Estudios randomizados a doble ciego de fase III con la droga pamidronato en cáncer metastásico de mama han revelado resultados prometedores con reducción significativa en la aparición de dolor. 30
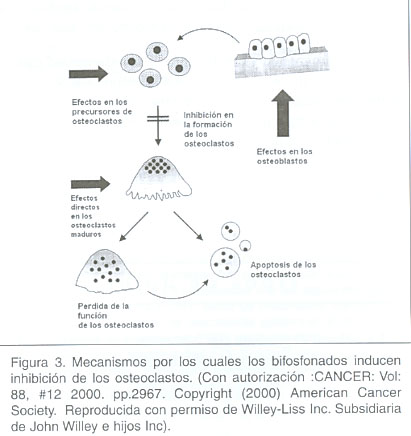
Otro coadyuvante es la hormona polipeptídica calcitonina, inhibe la actividad osteoclástica, llevando a una disminución en la resorción ósea con consecuente reducción del dolor. 31 Aunque su uso continuo se ha visto que puede inducir la producción de anticuerpos 31 disminuyendo su efecto terapéutico.
Los radioisótopos se utilizan con cierto rango de efectividad como terapia coadyuvante. Su mecanismo de acción se fundamenta en el principio de que son moléculas inestables y se degradan a otros elementos que producen radiaciones ionizantes 32. Se han utilizado el estroncio-89 y el sumarion-153, ambos tienen como órgano blanco la estructura mineral del hueso; dentro de la cual se incorporan y reducen la actividad osteoclástica. 32 Como efecto secundario se observa la supresión de médula ósea la cual revierte a las 8 semanas de tratamiento. 32
Entre los tratamientos no farmacológicos se encuentra la técnica de inyección perióstica de fenol al 5% 33 la cual induce una neurólisis local perióstica, mostrando una reducción efectiva en la percepción dolorosa ósea.
La osteoprotegerina en conjunto con los receptores activadores de factores nucleares RANK y RANKL forman parte de un sistema de citoquinas pertenecientes a la familia del factor de necrosis tumoral. 34 Este sistema ha revelado en estudios in vitro que regula la proliferación, diferenciación, fusión, activación y apoptosis del osteoclasto (figura 4).
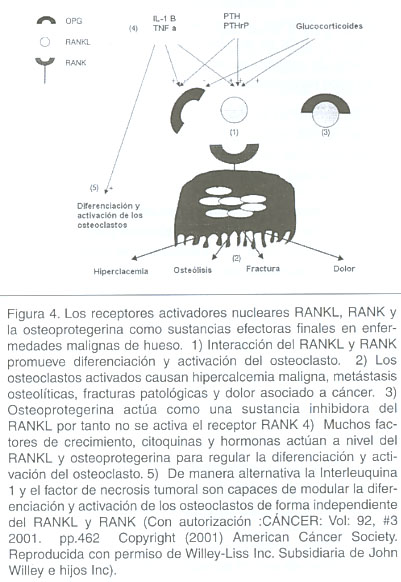
En modelos experimentales de dolor óseo con ratones a los cuales se les inyectó células carcinógenas de sarcoma, 3 el tratamiento con osteoprotegerina demostró detener la destrucción ósea inducida por el tumor y redujo la población de osteoclastos de los sitios invadidos con subsiguiente disminución del dolor óseo. 3 A su vez se observó que la osteoprotegerina previene la reorganización neuroquímica en la médula espinal inducida por el dolor crónico en dichos ratones experimentales, 3 convirtiendo la osteoprotegerina en una prometedora sustancia coadyuvante para el control del dolor óseo en cáncer. 34
Una combinación juiciosa de estas opciones puede mejorar el alivio del síntoma de dolor en los pacientes con dolor óseo secundario al cáncer. 28 Sin embargo, el fenómeno continúa siendo un reto para el profesional en ciencias de la salud y una terrible molestia para el paciente.
Algoritmo terapéutico
Al seleccionar el manejo farmacológico de un paciente con dolor óseo inducido por cáncer se deben considerar varios factores: la condición física del paciente, la expectativa de vida, la morbilidad, la localización, el tipo de dolor, los deseos y expectativas del paciente.
A continuación se presenta un algoritmo terapéutico, para el tratamiento del dolor óseo metastásico (figura 5).
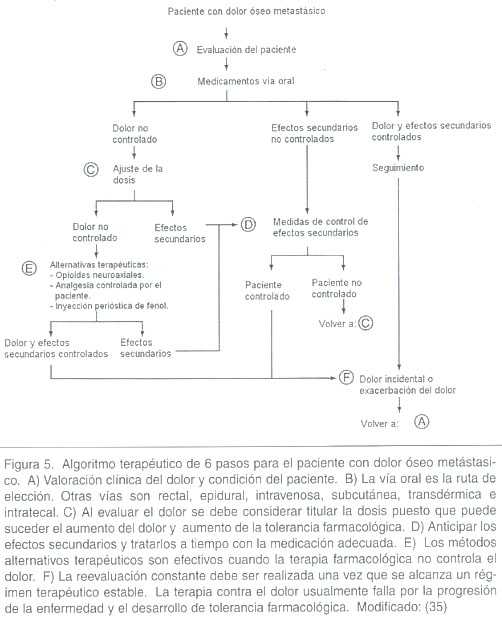
La osteoprotegerina es un nuevo medicamento que se encuentra a nivel experimental y podría ser un coadyuvante de avanzada en el tratamiento de dolor óseo metastásico.
Conclusiones
El dolor óseo por cáncer metastásico actualmente es un reto para el profesional en ciencias de la salud, debido a su incidencia progresiva en los pacientes con cáncer avanzado y su difícil control.
La génesis del dolor óseo metastásico no se ha podido entender adecuadamente por la falta de modelos experimentales adecuados.
El tratamiento farmacológico actual es parcialmente efectivo debido a que en su mayoría los medicamentos han sido evaluados en modelos experimentales no bien diseñados o aplicados en base a los resultados de estudios observacionales con pacientes.
Un algoritmo terapéutico permitiría un manejo más eficaz con un uso racional de los medicamentos que actualmente se encuentran en el mercado.
Abstract
Sixty to 84% of cancer patients develop bone metas tases. Of this 79% have difficult to treat bone pain syndromes, of which 50% die without adequate pain control. It is necessary to have accessible and effective drugs in the market to improve the quality of life in these patients.
The objective of this paper is to review the pathophysiology of bone pain and the drugs used today in the palliation of bone cancer pain. In addition a 6 step algorithmic approach is given to help the physicians engaged in the management of this condition.
Referencias
1. Payne R. Mechanisms and management of bone pain. American Cancer Society. Magazine supplement: Skeletal complications of malignancy 1997; 80: 1608-1613. [ Links ]
2. Cleeland CS, Gonin R, Hatfield AK, Edmonson JH, Blum RH, Stewart JA et. al. Pain and its treatment in outpatients with metastasic cancer. N Engl J Med 1994; 6: 592-596. [ Links ]
3. Honore P, Luger N, Sabino M, Schwei MJ, Rogers S, Mach D, et. al. Osteoprotegerin blocks bone cancer-induced skeletal pain and pain-related neurochemical changes in spinal cord. Nature 2000; 5: 521-528. [ Links ]
4. Regan J, Peng P. Neurophysiology of cancer pain. Cancer Control magazine 2000; 7: 111-119 [ Links ]
5. OMS. Palliation of bone pain in cancer: Facts and controversies report 2002; 15: 4-6. [ Links ]
6. Goltzman D. Mechanism of the Development of Osteoblastic Metastases. Magazine Supplement: Skeletal Complications of Malignancy. Cancer 1997; 80: 1581-1587 [ Links ]
7. Markman M. Clinical Trials in Oncology. En: Markman M. ed. Basic Cancer Medicine. Philadelphia: W. B. Saunders, 1997: 11-13 [ Links ]
8. Sabino M, Ghilardi J, Feia K. The involment of prostaglandins in tumorogenesis, tumor induced osteolysis and bone cancer pain. J Musc skel Neur Interact 2002; 2: 562-561. [ Links ]
9. Meyer R, Campbell J, Raja S. Peripheral neural mechanisms of nociception. En: Wall P, Melzack R. ed. Textbook of pain. Londres: Churchil Livingstone, 1994: 13-14. [ Links ]
10. Fontana A, Delmas P. Markers of bone turnover in bone metastases. Magazine Supplement: Skeletal Complications of malignancy. Cancer 2000; 88: 2952-2960 [ Links ]
11. Raja S, Meyer J, Meyer R. Peripheral mechanism of somatic pain. Anestesiology 1988; 68: 571-590. [ Links ]
12. Schimdt R, Scable H, Messlinger K, Heppelmann B, Hanesh U, Pawlak M. Silent and active nociceptors: Structure, functions and clinical implications. En: Gebhart G, Hammond D, Jensen T. eds. Progress in pain research and management. Seattle: IASP press, 1994; 2: 213250. [ Links ]
13. Niv D, Devor M. Analgesia preventiva: Se puede prevenir el dolor posoperatorio agudo? En: Abrahms B, Benzon H, Hanh M, Heaver J, Niv D, Parris W. et. al. eds. Tratamiento Práctico del Dolor. España: Harcout Brace, 2000: 1043-1044. [ Links ]
14. Woolf C. Evidence of a central component of post injury pain hyper sensitivity. Nature 1984; 308: 686-688. [ Links ]
15. Woolf C, Thompson S. The induction and maintenance of central sensibilization is dependent on N-methyl-D-aspartic acid receptor activation: Implications for treatment of post-injury pain hypersensitivity states. Pain magazine 1991; 44: 293-299. [ Links ]
16. Niv D, Devor M. Transition from acute to chronic pain. En: Arnoff G. ed. Evaluation and treatment of Chronic Pain. Baltimore: William & Wilkins, 1998: 27-45 [ Links ]
17. Willis W. Hiperalgesia and allodynia. New Cork: Raven Press, 1992:230-234 [ Links ]
18. Mercante S. Malignant Bone Pain: Pathophisiology and treatment. Pain magazine 1997; 69: 1-18. [ Links ]
19. Mauskop A, Foley K. Control of Pain. En: Harrington K. ed. Orthopedic management of methastasic bone disease. St. Louis: Mosby, 1998: 455-460. [ Links ]
20. Twycross R. Measurement of pain. En: Twycross R. Ed. Pain Relief in Advanced Cancer. Londres: Churchill Livingstone, 1994: 129-147. [ Links ]
21. Barnard D, McGarrity S. Cuidados paliativos. En: Abrahms B, Benzon H, Hanh M, Heaver J, Niv D, Parris W. et. al. ed. Tratamiento Práctico del Dolor. España: Harcout Brace, 2000: 881-902. [ Links ]
22. Doleys D, Doherty D. Evaluación piscológica y conductual. En: Abrahms B, Benzon H, Hanh M, Heaver J, Niv D, Parris W. et. al. ed. Tratamiento Práctico del Dolor. España: Harcout Brace, 2000: 429-448. [ Links ]
23. Sykes F, Johnson R, Hanks G. Difficult pain problems. En: Fallon M. O'Neill B. eds. ABC of Palliative Careo Londres: BMJ Books, 1998: 6-7 [ Links ]
24. Wizenberg M. The philosophy and economics of palliative radiotherapy for bone metastases. En; Wiess L, Gilbert H. ed. Bone Metastaseso Boston: Hall, 1981: 330-398. [ Links ]
25. Coia L, Hanks G, Martz K. Practice patterns of palliative care in United States. 1984-1985. Int J Radiat Oncol Biol Phys 1988; 14: 12611269. [ Links ]
26. Ashby M. Radiotherapy in the Palliation of Cancer. En: Patt R. Ed. Cancer Pain. Philadelphia: Lippincott Co, 1993: 235-249 [ Links ]
27. Stein C. The control of pain in peripheral tissues by opioids. N Eng J Med 1995; 332: 1685-90. [ Links ]
28. Alastair J. Wood J. Pharmacologic treatment of cancer pain. N Eng J Med 1996; 335: 1124-1131. [ Links ]
29. Bruera E. Anorexia, Cachexia and Nutrition. En: Fallon M. O'Neill B. eds. ABC of Palliative Careo Londres: BMJ Books, 1998: 19-22. [ Links ]
30. Rogers M, Gordon S, Benford H. Coxon F, Luckman S, Monkkonen J. et. al. Cellular and Mo1ecular Mechanism of action of biphosphonates. American Cancer Society. Magazine Supplement: Skeletal Complications of Malignancy 2000; 88: 2961-2978.
31. Smith J. Oncologic Emergencies. En: Patt R. ed. Cancer Pain. Philadelphia: Lippincott Co, 1993: 527-541. [ Links ]
32. Serafini A. Samarium Sm-153 Lexidoram for the palliation of bone Pain Associated with Metastases. American Cancer Society. Magazine Supplement: Skeletal Complications of Malignancy 2000; 88: 2934-2939. [ Links ]
33. Swerdlow M. Role of Chemical neurolysis and local anesthesic infiltration. En: Swerdlow M, Ventafridda V. ed. Cancer Pain. Londres: Editorial MTP, 1987: 119-122. [ Links ]
34. Hofbauer L, Neubauer A, Heufelder A. Receptor Acti vator of Nuclear Factor -B Ligand and Osteoprotegerin. Cancer 2001; 93: 460-470. [ Links ]
35. Priest J. Metastasic Cancer Pain. En: Ramamurthy S, Rogers J. eds. Pain Management. Londres: Mosby Year Book, 1990: 54-55
1 Director Centro Nacional de Control de Dolor y Cuidados Paliativos.
2 Bachiller en Ciencias de la Salud, Universidad Autónoma de Ciencias Médicas UACA.














