INTRODUCCIÓN
La endocarditis infecciosa mural (EIM) es una forma in- frecuente de infección intracardiaca que afecta al endocardio no valvular (1,2). Es una presentación poco frecuente de la endocarditis infecciosa, con una incidencia exacta desconocida (2). Según Gutiérrez et al. en el registro del Grupo de Apoyo al Manejo de la Endocarditis Infecciosa en España (GAMES) que realizaron desde 2008 al 2018, se reportaron 3767 pacientes con endocarditis infecciosa (EI), de los cuales 27 casos reportados fueron EIM (0.7% del total de casos). Es frecuente que la EI no valvular sea secundaria a trombos murales infectados, dispositivos o prótesis intracardíacos, tumores cardíacos, anomalías estructurales, incluidos defectos congénitos, o EI valvular (3,4). Otros factores de riesgo de EIM son la inmunosupresión, el abuso de drogas intravenosas y la cirugía cardiaca previa (2,3,4). Los patógenos más comunes asociados a la EIM son los estafilococos, los estreptococos e infecciones fúngicas (1,2). Dado que no hay afectación de las válvulas, el diagnóstico suele retrasarse y sólo se realiza cuando aparecen complicaciones como embolias sistémicas o pulmonares, que cubren una morbilidad y mortalidad significativas (1,5). Según la literatura, la sepsis fulminante se cita a menudo como la causa más frecuente de muerte y esto se asocia con el mal pronóstico de la EIM (1,2). En esta revisión, se describe el caso de un paciente con bacteriemia por Staphylococcus aureus diagnosticado con una EIM apical del ventrículo izquierdo.
MATERIALES Y MÉTODOS
Se presenta un caso clínico de un paciente masculino de 74 años con el diagnóstico de endocarditis mural apical. Para la elaboración del artículo se realizó la búsqueda de literatura médica, principalmente reporte de casos, en idioma inglés y español, comprendidos en los años 2006 al 2023 en bases de datos de Pubmed, Google Scholar, Elsevier y revistas científicas como Journal of American Society of Echocardiography, European Heart Journal, Journal of Ultrasound Medicine, Indian Heart Journal y Journal of Clinical Diagnosis and Research.
PRESENTACIÓN DEL CASO CLÍNICO
En la siguiente revisión se presenta un paciente masculino de 74 años, independiente para las actividades de la vida diaria, conocido con hipertensión arterial en control, quien consulta al servicio de emergencias (SEM), en Junio del 2021, con historia de un día de evolución de alteración del sensorio asociado a fiebre, vómitos, diarrea, hiporexia y debilidad de miembros inferiores. Inicialmente se aborda como sospecho- so de infección por Covid 19, por lo que se le realiza una prueba rápida mediante reacción en cadena de polimerasa (PCR), siendo negativo para este diagnóstico.
A su ingreso no presenta datos de inestabilidad hemo- dinámica y a la exploración física presenta ruidos cardiacos rítmicos sin ruidos agregados ni soplos audibles, campos pulmonares con murmullo vesicular presente bilateralmente, sin otros hallazgos patológicos. Los laboratorios iniciales presentan leucocitosis con desviación a la izquierda, trastornos hidroelectrolíticos, trombocitopenia, marcadores inflamatorios elevados, y biomarcadores cardiacos positivos. En el examen general de orina se documentan datos sugestivos de infección por lo que se inicia antibioticoterapia. Los estudios de gabinete muestran un electrocardiograma (ECG) sin datos sugestivos de isquemia miocárdica, y una radiografía de tórax (RXT) con infiltrado intersticial paracardiaco derecho y cefalización de flujo. A las 48 horas se evidencian múltiples petequias en las extremidades (Figura 1), lesiones de Janeway (Figura 2) y una lesión trombótica en falange distal del 3 dedo de la mano derecha (Figura 3), y se completan estudios con hemocultivos.
Al cuarto día de hospitalización el paciente inicia con datos de dificultad respiratoria y deterioro de su estado de conciencia, se decide colocar tubo endotraqueal, y en tomografía computarizada (TC) de cerebro se documentan dos hemorragias intraparenquimatosa izquierdas con extensión subaracnoidea (Figura 4). Además se realiza angiografía por TC (angio TC) que documenta solamente atelectasias bibasales sin datos de embolia pulmonar aguda. Los hemocultivos reportan cocos Gram positivos en racimo semejantes a Staphylococcus sp. Se decide escalonar la cobertura antibiótica a Vancomicina, y se solicita ecocardiograma.
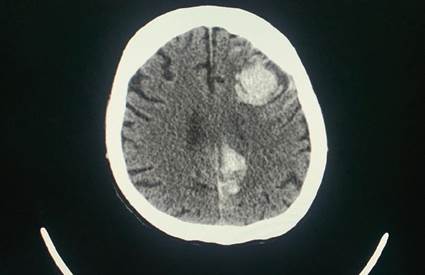
Figura 4 El plano axial del TC de cerebro reveló dos hemorragias intrapa- renquimatosas izquierdas con extensión subaracnoidea.
El ecocardiograma transtorácico (ETT) documenta una gran masa adherida al ápex del ventrículo izquierdo (Figura 5). Se decide complementar el estudio con el ecocardiograma transesofágico (ETE) que evidencia una función sistólica y función diastólica del ventrículo izquierdo conservadas, fracción de eyección del ventrículo izquierdo (FEVI) del 60%, contractilidad global conservada sin defectos segmentarios, sin datos de hipertensión pulmonar, no se visualiza vegetaciones en ninguna de las válvulas, sin embargo, se encuentra gran masa adherida al ápex izquierdo, mide 3.5 cm por 1.8 cm, móvil, que impresiona ser una vegetación mural gigante, sin evidencia de abscesos o fístulas (no corresponde a un trombo, ya que el ápex no está dilatado; Figura 6). Luego de documentar la masa intracardiaca por ETE, se realiza una nueva valoración del angio TC donde se documenta la vegetación mural nuevamente (Figura 7).
Paciente con muy mal pronóstico y evolución tórpida; fallece en centro hospitalario a los 10 días, con clínica florida y estudios que confirman diagnóstico de endocarditis infecciosa mural apical.
DISCUSIÓN
La EIM es una manifestación infrecuente de infección bacteriana o fúngica intracardiaca que afecta al endocardio no valvular y puede afectar a cualquier cámara cardiaca (4). El desarrollo de la EI se ha asociado a anomalías estructurales cardiacas valvulares o no valvulares subyacentes que dan lugar a flujos sanguíneos turbulentos que producen daño endotelial con depósitos de plaquetas y fibrina. Esta lesión, denominada endocarditis trombótica no bacteriana (ETNB), sirve de nido para la posterior adhesión de bacterias u hongos en el torrente sanguíneo (6). El mecanismo de la EIM no se conoce bien. Se han identificado varios factores de riesgo, como los jets regurgitantes de alta velocidad que causan lesiones endoteliales, las derivaciones congénitas, la inmunosupresión sistémica, las válvulas protésicas, los marcapasos y cardiopatías estructurales, como la dilatación del ventrículo derecho (4,7). En el caso clínico presentado no se documentan los factores de riesgo descritos, sin embargo, se desconoce si el paciente presentaba un estado de inmunosupresión. Los organismos causantes más frecuentes de endocarditis mural son S. aureus, Streptococcus, Candida y Aspergillus (1,4). En nuestro caso clínico, la EIM fue causada por un Staphylococcus aureus meticilino sensible (SAMS).
Es difícil establecer un diagnóstico de endocarditis mural. Los signos de embolización pueden ayudar al diagnóstico, como la embolización periférica, la formación de abscesos y fístulas, el compromiso del músculo papilar o cortical y la perforación cardiaca (4). En el caso reportado la sospecha diagnóstica fue secundaria a los fenómenos embólicos sistémicos al sistema nervioso central (SNC) y a extremidades. Por lo tanto, es necesario un alto índice de sospecha de EIM con un diagnóstico precoz. La ecocardiografía es la principal técnica de imagen para el diagnóstico de la endocarditis valvular y ha sido la principal modalidad utilizada para diagnosticar la endocarditis mural en la mayoría de los casos descritos (1,2,4). La exactitud diagnóstica de las técnicas de imagen para la detección de la vegetación mural no se ha reportado (8), sin embargo, el ETE se aproxima a tasas de sensibilidad para la detección de vegetaciones valvulares entre el 90% y el 100% (4). La ETE permitió diagnosticar la EIM en nuestro paciente, y como se describió en el reporte, a pesar de que las masas apicales se asocian con mayor frecuencia a trombos, en ausencia de trastornos de la contractilidad o dilatación no correspondía como la etiología de la masa intracardiaca (9).
Las directrices para el tratamiento de la endocarditis valvular sugieren una intervención quirúrgica precoz cuando sea clínicamente apropiado, pero la escasez de evidencia acerca de la endocarditis mural limita la orientación hacia estrategias de tratamiento recomendadas (4,8). En casos anteriores se ha descrito el fracaso del tratamiento antimicrobiano por sí solo en la resolución de la endocarditis mural (4,8,9). En un caso reportado por Uzuka et al. con una vegetación mural en ápex del ventrículo izquierdo optaron por un abordaje quirúrgico, en donde la ecocardiografía preoperatoria e intraoperatoria mostró una masa friable adherida al ápex del VI; se realizó una ventriculotomía izquierda e inclusive proponen que una opción para los pacientes enfermos con riesgos quirúrgicos elevados puede ser la atriotomía izquierda sola y/o la cirugía endoscópica mínimamente invasiva (10). En el 2023, Matsumura et al. reportaron un caso de endocarditis mural auricular izquierda refractaria secundaria a un SAMS donde recomendaron realizar precozmente la intervención quirúrgica como parte del proceso de tratamiento (11). Por la evolución tórpida en el caso reportado no se logró realizar la intervención quirúrgica.
CONCLUSIONES
La endocarditis infecciosa mural es poco frecuente, no obstante se presenta de forma similar a la endocarditis infecciosa valvular, con complicaciones de la misma gravedad. Se recomienda la ecocardiografía para confirmar el diagnóstico cuando exista un alto índice de sospecha, y este caso pone de manifiesto la importancia de una evaluación cuidadosa desde múltiples ventanas y planos de imagen, tanto transtorácica como transesofágica, para delimitar con precisión la localización de una masa intracardíaca. Por último, con respecto al tratamiento, en casos de endocarditis mural secundaria a S. aureus con alto riesgo embólico, la intervención quirúrgica precoz parece ser una estrategia terapéutica adecuada.





















