Serviços Personalizados
Journal
Artigo
Indicadores
-
 Citado por SciELO
Citado por SciELO -
 Acessos
Acessos
Links relacionados
-
 Similares em
SciELO
Similares em
SciELO
Compartilhar
Revista Costarricense de Cardiología
versão impressa ISSN 1409-4142
Rev. costarric. cardiol vol.3 no.2 San José Ago. 2001
Introducción
El electrocardiograma covencional es el registro desde la superficie corporal de la actividad eléctrica que genera el corazón durante el ciclo cardíaco que se dispersa a través de los líquidos corporales hasta la piel. La imagen obtenida resulta de la suma algebraica de todos los potenciales de acción de las fibras miocárdicas que a través del tiempo, inscriben el complejo QRS.
La velocidad de conducción de los impulsos eléctricos, o sea el tiempo que dura la despolarización secuencial de las fibras en el miocardio, normalmente es uniforme, tanto en sentido longitudinal como transversal. En presencia de una alteración anatómica o funcional (por ejemplo, un área de necrosis o bien isquemia miocárdica, respectivamente), las propiedades electrofisiológicas en esa porción de tejido varían, ocurriendo que la velocidad de conducción, el período refractario y otras propiedades sean diferentes a las del miocardio sano, diferencias que en conjunto se denominan anisotropía. Como consecuencia de la anisotropía, el impulso eléctrico podría bloquearse o conducirse lentamente en estas áreas afectadas, a diferencia de las de tejido normal, en que lo recorre a velocidad normal.
Aunque se tratara de un infarto extenso de pared anterior, los impulsos de velocidad de conducción lenta que se generan ocurren en mucho menor número que los de velocidad normal, dentro del área necrótica. Puesto que son muy pocos en relación al número total, la duración del QRS no varía. Sin embargo, si se obtiene una imagen amplificada del QRS a decenas de veces su tamaño, dichos potenciales eléctricos pueden detectarse al final del complejo QRS ya que su velocidad de conducción es más lenta y son de muy baja amplitud, dado su número (recuérdese que el voltaje del QRS se relaciona directamente a la masa de miocardio, como en su hipertrofia). Puesto que estos potenciales sólo son visibles al amplificar la imagen electrocardiográfica y aparecen al final del QRS, se han denominado "potenciales tardíos(1). Se ha postulado que cuando nacen en el tabique interventricular, más bien ocurrirían al inicio del QRS ("potenciales tempranos"),(2).
Debe recordarse que la duración del QRS sólo se prolonga cuando es despolarizado desde un punto diferente al sistema de conducción normal (la red de Purkinge) como ocurre durante bloqueo de una de las ramas del haz de His o cuando el impulso se origina en uno de los ventrículos. En estos casos, el impulso debe recorrer gran parte o toda la masa miocárdica en sentido tranversal (normalmente predomina el longitudinal), lo que implica que se conduzca muy lentamente y por tanto se prolongue la duración del QRS.
Por el mismo motivo (la anisotropía), la duración de la repolarización también varía, fenómeno llamado dispersión de la repolarización. Si una porción significativa de fibras miocárdicas se repolariza lentamente, se prolonga el intervalo QT en el electrocardiograma. La dispersión de la repolarización puede ser más o menos homogénea, en que la mayor parte de las fibras tiene un mismo grado de retardo de la repolarización (como cuando se administra un antiarrítmico como la amiodarona), o bien ser heterogénea, en la que existen marcadas diferencias en diferentes areas de tejido. En este último caso, tales diferencias en la duración del potencial de acción y del período refractario son el substrato para que se generen múltiples circuitos de reentrada en el miocardio, mecanismo que conduce a la aparición de fibrilación ventricular u otras arritmias letales. Existen diversos métodos de análisis de la dispersión del QT que han demostrado valor predictivo para estos eventos y para mortalidad.
De manera muy general, se puede decir que la prolongación del QT y su dispersión son fenómenos funcionales y dinámicos, mientras que la aparición de potenciales tardíos es más bien un marcador de substrato anatómico. Por ello, su búsqueda no debe ser excluyente. Así, los primeros son más útiles en el paciente agudo o decompensado, más proclive a fibrilación ventricular (FV), los potenciales tardíos lo son más en el paciente crónico, más proclive a taquicardia ventricular (TV). Esta requiere condiciones más estables, un substrato anatómico con severa disminución de la velociad de conducción y circuitos más o menos fijos. Dicho en otros términos, el paciente menos deteriorado pero muy "caliente" falllece con FV y el más enfermo y crónico con TV.
Así pues, la detección de potenciales tardíos ventriculares indica la presencia de un substrato anatómico responsable de una taquiarritmia ventricular. Sin embargo, su sola presencia no es el único factor que determina la aparición de TV o FV. Para ello, son necesarios otros dos elementos: el disparador o gatillo y el modulador. El disparador, usualmente son las extrasístoles ventriculares (EV) que, por ser latidos anticipados, pueden propiciar las condiciones necesarias en el circuito anatómico para que ocurra reentrada, por ejemplo, creando un area de bloqueo que previamente no existía. Esto explica por qué cuando se intentó eliminar las extrasístoles con poderosos antiarrítmicos como encainida y flecainida en el famoso estudio CAST(4) (la llamada "hipótesis de supresión") no sólo no disminuyó la muerte por eventos arrítmicos sino que aumentó, ya que estos fármacos crearon condiciones funcionales en el substrato favorables para la reentrada, aún cuando el número de EV fuera menor. También explica el bajo poder predictivo que tiene la sola detección de potenciales tardíos o la presencia de arritmia ventricular compleja en el Holter (ver más adelante). Las EV también pueden provocarse durante un estudio electrofisológico con la consiguiente inducción de taquicardia ventricular o fibrilación ventricular, lo que tiene mejor poder predictivo(5).
El tercer factor es el modulador, principalmente el sistema nervioso autónomo. También pueden ser moduladores la presencia de isquemia o las concentraciones electrolíticas, en especial de potasio. Existen varios métodos de cuantificación del tono autonómico tales como la sensibilidad barorefleja, variabilidad de la presión arterial o variabilidad de la frecuencia cardíaca. Este último es el más popular y utilizado y tiene elevada sensibilidad y especificidad para la predicción de eventos arrítmicos(6) en diversas cardiopatías.
Si se combina la detección de potenciales tardíos, la presencia de arritmia ventricular compleja y variabilidad de la frecuencia cardíaca disminuida, se puede seleccionar mejor a los pacientes con alto riesgo de eventos arrítmicos(7).
Principios técnicos
Para el registro de la señal electrocardiográfica, se colocan electródos en la superficie corporal pero se utlizan las derivaciones ortogonales, es decir, tres pares de electródos que abarquen los tres ejes del espacio, X, Y y Z. Usualmente se registran unos 200 a 400 complejos QRS en un tiempo aproximado de 5 minutos (figura 1).
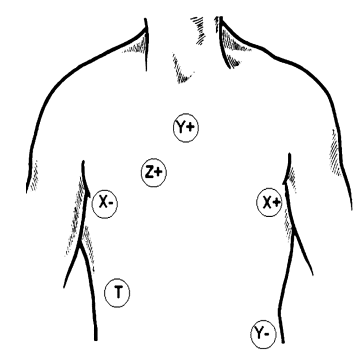
Como se mencionó, la imagen electrocardiográfica debe amplificarse varias decenas de veces para poder observar los potenciales tardíos, de ahí el nombre de "alta resolución". La amplificación de la señal electrocardiográfica a tal amplitud hace visibles diversas oscilaciones de la línea de base en el trazado electrocardiográfico (llamadas "ruido") que normalmente no se ven y que se originan sobretodo en los movimientos musculares involuntarios tales como la respiración o posturales. Para eliminar el ruido se realizan dos procedimientos: se promedia la señal, es decir, se coloca cada complejo QRS sobre el anterior, como si se colocara una transparencia sobre otra, de manera que las señales que no se repiten con la misma morfología –como el ruido, que es muy variable- se consideran ajenas al registro y se eliminan mediante algoritmos electrónicos. El segundo es el filtrado, que consiste en eliminar con los mismos métodos matemáticos, las señales cuya frecuencia sea más alta que la de los componentes usuales del complejo QRS. Toda señal sinusoidal como el QRS, en realidad es la suma algebraica de diversas señales de diferente frecuencia (ciclos/seg). Normalmente están comprendidas entre los 250 Hertz (Hz) y los 20-40 Hz, lo que permite eliminar todos los componentes ajenos a este rango. El nivel de ruido no debe ser menor de 1mV (con filtro de 25 Hz) y de 0.7 mV (con filtro de 40 Hz). Este último es el más utilizado actualmente(8).
Amplificada, promediada y filtrada, la señal puede analizarse para detectar la presencia de potenciales tardíos
El análisis puede hacerse mediante cálculos aritméticos (sumas, restas, raíz cuadrada, etc) llamados en conjunto "dominio de tiempo" o mediante análisis matemáticos complejos como la transformación rápida de Fourier, que consiste en descomponer el QRS en sus componentes de diferente frecuencia y elaborar un espectro, denominado "en dominio de frecuencia". La imagen espectral es una herramienta visual que facilita la detección de los potenciales tardíos y es más específica que el análisis en dominio de tiempo (9), (figura 3).
En dominio de tiempo, los parámetros utlilizados son:
-La duración del QRS promediado (normal hasta 114 ms). Con bloqueo de rama izquierda, el valor máximo normal es 145 ms
-La duración de la señal al final de la misma desde el momento en que mide 40 microvoltios. Se llama en inglés "low amplitud signal", (LAS) y normalmente no debe durar más 38-40 ms (con filtro de 40 MHz) o más de 32 ms (filtro de 25 MHz).
-La raíz cuadrada de la suma de la amplitud de los últimos 40 ms de la señal en cada una de las derivaciones elevada al cuadrado, expresado como x2 + y2 + z2. Se llama en inglés "root mean square" (RMS). Se consideran valores normales más de 20 mV (con filtro de 40 MHz) o más de 25 mV (filtro de 25 MHz)
En dominio de frecuencia, la señal sinusoidal se descompone en sus mútliples subcomponentes u ondas de frecuencia a través de una función matemática ("ventana") cuya suma es igual a la de la señal original. Cada componente tiene una determinada frecuencia, medida en Hz o Hz2 (el llamado "poder espectral"). Se analizan los últimos 15 ms del QRS y los siguientes 25 ms, con un ancho de banda de 0,05 a 300 Hz y un nivel de ruido que debe ser menor de 0,3 mV. Al relacionarse el poder espectral con la amplitud, medida en decibelios (dB, que es la unidad de medida del la intensidad sonora) se obtienen curvas que pueden analizarse cualitativa o cuantitativamente (figuras 2 y 3).
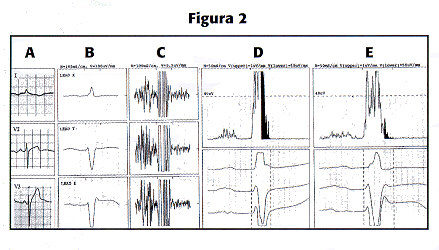
Figura 2. A. Velocidad y amplitud del electrocardiograma convencional: 25 mm/s y 0.1mV/mm. B. Se observan las tres derivaciones ortogonales pero a un velocidad de registro cuatro veces (100 mm/s) la del electrocardiograma convencional. El voltaje es el usual. C. Las mismas derivaciones pero con una sensibilidad mucho mayor: 0.0005 mV/mm, lo que amplifica el QRS a unas 200 veces la imagen normal; las oscilaciones de la línea de base corresponden al ruido. En D y E la velocidad de registro es aún mayor: 200 mm/s y la sensibilidad 0.001 mV/mm. El area sombreada es la detectada por el análisis en dominio de tiempo, D es una paciente normal, E un paciente que falleció con muerte súbita.
Cualitativamante, se estima la pendiente negativa de la curva. Normalmente ocurre una rápida caída de las frecuencias del QRS a la zona por debajo de los 40 dB (figura 3-A). En los pacientes con taquicardia ventricular (TV), la caída es más lenta, conformándose una "meseta" en la curva, antes de caer (figura 3-B).
Cuantitativamente, se pueden medir áreas de alta frecuencia como 20-50 o 60-120 y compararlas con las de baja frecuencia como 0-20 o 0-30; por ejemplo, 60-120/0-30 = 0,065. En los pacientes con TV este valor supera 110.
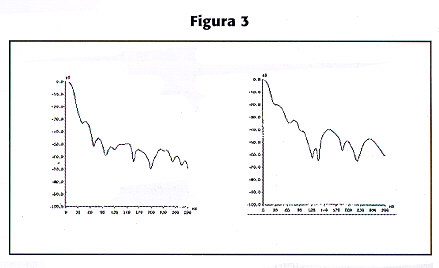
Figura 3. Análisis en dominio de frecuencia. En A se compara la frecuencia (en Hz, en las abcisas) de los diferentes componentes versus la amplitud (en dB en las ordenadas) observándose una rápida caída en la amplitud de los mismos. En B dicha disminución ocurre más allá de los 40 dB
Mapeo espectrotemporal
Consiste en la combinación de los dos métodos anteriormente expuestos, es decir, la medición de la frecuencia o poder espectral de los componentes de la señal en intervalos de tiempo.
La señal se divide en segmentos de 3 mseg o se dividen los últimos 40 ms del QRS en 16 o 32 segmentos, y se calcula la frecuencia de cada uno de los segmentos; luego se superponen los componentes de amplitud y frecuencia en función del tiempo, obteniéndose un gráfico tridimensional, que lo hace más útil para la interpretación cualitativa (10), (Figura 4). Cuantitativamente se pueden también realizar mediciones comparativas entre los segmentos.
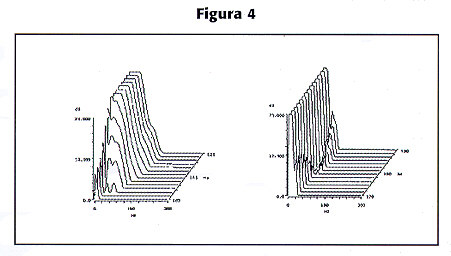
Figura 4. Mapeo espectro temporal. Los diferentes segmentos se colocan a lo largo de una línea de tiempo que en la figura corre de atrás hacia adelante. En A se observa el patrón normal, el QRS finaliza de manera más o menos rápida con la consiguiente disminución de sus componentes finales (los más frontales). En B, en un paciente con TV, obsérvese los componentes de baja frecuencia al final del QRS(10).
Aplicaciones clínicas
Cardiopatía Isquémica
La presencia de potenciales de baja amplitud se ha asociado a la presencia de un infarto previo, baja fracción de eyección (FE), TV inducible y arritmias espontáneas, lo que se correlaciona con actividad fragmentada en electrogramas intracavitarios durante el estudio electrofisiológico.
Se presentan en el 68-87% de los pacientes recuperados de paro cardiorespiratorio inesperado (muerte súbita) con antecedente de infarto de miocardio en el último año y en el 79-92% de los pacientes que tienen TV sostenida inducible en el estudio electrofisiológico (15). La sola duración del QRS es un factor independiente de mortalidad que separa a los pacientes postinfarto con y sin TV/FV por análisis multivariado (1). En forma global, se detecta potenciales tardíos en el 41% en los pacientes postinfarto, cifra que varía según el tamaño del infarto, estado de la arteria responsable y la fracción de eyección residual: sólo en 7-15% en los pacientes sin TV y con arritmia ventricular grado 0-1 de Lown.
Esta prueba tiene alta sensibilidad (>90%, tabla 1) para eventos arrítmicos, es decir, de cada diez pacientes con muerte súbita o TV/FV con infarto previo a los que previamente se les realizó el estudio, 9 tuvieron resultado positivo y uno fue un falso negativo. También su especificidad es alta (>90%, (tabla 1), es decir, de cada 10 pacientes con resultado negativo, sólo uno presentó TV/FV (un falso negativo). O sea, el estudio es sensible en detectar a casi todos los que presentarán un evento arrítmico, aunque sólo lo predice en 25% de ellos.
Su valor pronóstico es independiente de otros índices (como arritmia ventricular compleja o baja FE) para mortalidad y eventos arrítmicos. El valor predictivo positivo es bajo: 17% (rango 15-24%); o sea, de cada 100 pacientes que tiene este examen positivo, sólo 17 presentarán un evento arrítmico en el siguiente año (o bien, un 83% de probabilidad de estar libre de arritmias). En cambio el valor predictivo negativo es alto: 99%, vale decir, que con un examen de resultado negativo, el paciente tiene 99% de probabilidad que no tenga ningún evento arrítmico en el siguiente año.
Si bien la experiencia clínica con este método diagnóstico ha confirmado su utilidad en la predicción de inducibilidad de TV(15), dista de resolver el problema de la predicción de muerte súbita en los sujetos con criterios de alto riesgo. La combinacion de potenciales tardíos presentes, TV no sostenida en el registro Holter y FE <0,40 define a un grupo de pacientes postinfarto de alto riesgo para eventos arrítmicos pudiendo predecirlos hasta en 50% de los pacientes así seleccionados. En esta población está claramente demostrado el beneficio del desfibrilador implantable como prevención primaria (11,12).
Su bajo valor predictivo podría explicarse por sus limitaciones. No tiene capacidad para detectar refractariedad diferencial, que es requisito importante para reentrada, además de la conducción lenta; no detecta otros mecanismos de arritmia como por ejemplo actividad disparada, ni la modificación del substrato por isquemia, sistema nervioso autónomo u otros, o la existencia de bloqueo de entrada o salida del circuito anatómico. No se ha definido el momento óptimo para su registro, probablemente durante la segunda semana del infarto obtenga su máximo valor predictivo (13). Por supuesto, tampoco predice la ocurrencia de otras formas de muerte cardiovascular como por ejemplo, por insuficiencia cardiaca. Su utilidad es más limitada en pacientes sin infarto previo (13) y no tiene valor si la FE es >0,405.
El electrocardiograma de alta resolución se normaliza en el 18% de los pacientes a los 6 meses y 30% a los (12), presumiblemente por disminución de la isquemia en la zona perinfarto o por fibrosis, aunque debe tenerse en cuenta que la mayoría de eventos arrítmicos ocurren dentro del primer año postinfarto. Su prevalencia no se modifica con el uso de drogas antiarrítmicas, bloqueadores beta o cirugía de revascularización miocárdica, y pueden hacerse más manifiestos con drogas que prolongen la conducción, como por ejemplo, los de clase Ic (14). Probablemente disminuya su aparición si se administra un agente fibrinolítico en la etapa aguda del infarto, lo que implicaría un peor pronóstico si los potenciales persisten posteriormente(16). Su valor predictivo es independiente del sitio del infarto, aunque en pacientes con infartos anteriores o anteroseptales la actividad fragmentada puede ocurrir en la parte inicial del complejo QRS pudiendo no detectarse entonces en la región terminal del mismo, disminuyendo por tanto su sensibilidad. En presencia de bloqueo de rama del haz de His, su valor es limitado(17).
En pacientes con TV que han sido sometidos a ablación quirúrgica del substrato anatómico, la normalización del examen se asocia a baja recurrencia, mientras que si persisten los potenciales tardíos, en la mayoría recurre la arritmia o es inducible.
Otras cardiopatías
En miocardiopatía dilatada no isquémica se ha reportado baja incidencia de potenciales tardíos pese a que se trata de pacientes con alta incidencia de TV y muerte súbita(18). Aunque se ha establecido su relación con la presencia del substrato anatómico(19) y de eventos arrítmicos(18) probablemente ello se deba a baja sensibilidad de la prueba para su detección. En miocardiopatía hipertrófica la prevalancia de potenciales tardíos también es baja (20-50%) y su ausencia indicaría mejor pronóstico (20). En la miocarditis crónica por enfermedad de Chagas la prevalencia es alta (77.7%) en ausencia de bloqueo de una de las ramas del haz de His (66.6% si existe bloqueo) y predice la inducción de TV/FV21. También es alta en el sindrome de QT largo congénito (22) y en la displasia arritmogénica del ventrículo derecho (81%),(23).
En los pacientes sometidos a trasplante cardiaco, se ha relacionado la presencia de potenciales tardíos a rechazo agudo y el análisis de la onda p podría ser un predictor de rechazo (24).
En el prolapso de la válvula mitral se ha observado una mayor incidencia de potenciales tardíos pero se desconoce la importancia clínica de este hallazgo, pues se trata de una afección muy prevalente. Los pacientes que han sido sometidos a cirugía de reparación de tetralogía de Fallot, en quienes es conocido el riesgo de desarrollar taquiarritmias a largo plazo, aparecen en 23% de los casos, pero tiene también bajo poder predictivo(25).
En pacientes con historia se síncope de causa no aclarada y antecedente de infarto de miocardio, el seguimiento con electrocardiograma de alta resolución puede predecir la inducción de TV en el estudio electrofisiológico(26). En cambio, el examen no es útil en sujetos con síncope sin cardiopatía(27).
También se ha descrito la utilidad de esta prueba en pacientes con distrofia muscular de Duchenne, en la que predice daño miocárdico, eslcerosis sistémica progresiva (más que en su forma localizada, el sindrome CREST(28),enfermedad de Kawasaki para la deteccion detección no invasiva de isquemia/infarto(29), hipertensión arterial(30,31), monitoreo de toxicidad por antraciclinas(32) e incluso en la obesidad no concomitante a diabetes o hipertensión arterial(33).
En fibrilación atrial, este examen se utiliza en pacientes con ritmo sinusal y marcadores clínicos de fibrilación atrial como enfermedad reumática, hipertrofia miocárdica, dilatación del atrio izquierdo, baja FE, entre otros. Se analiza la onda p y de detectarse potenciales tardíos, se podría inferir la presencia de anisotropía atrial. Este hallazgo podría predecir entonces qué pacientes se encuentran en riesgo de presentarla a corto plazo, en especial aquellos en los que podría desencadenar descompensación aguda como en la miocardiopatía hipertrófica (34).
En conclusión, el electrocardiograma de alta resolución nos brinda información acerca de la presencia de anisotropía, mediante la detección de potenciales tardíos, traducción eléctrica de un substrato anatómico para la génesis de taquiarritmias ventriculares. Este puede ocurrir en cualquier cardiopatía y se ha demostrado su utilidad especialmente en pacientes con infarto de miocardio previo.
Referencias
1.Simson MB.: Noninvasive Identification of Patients at High Risk for Sudden Death: Signal-Averaged Electrocardiography. Circulation 1992; 1:suppl I, I-145-151. [ Links ]
2.Canciani B, Mormino P, Scanavacca G, Della Rocca F. Initial and final changes in the signal-averaged QRS in the time and frequency domain in a case of hypertrophic myocardiopathy. G Ital Cardiol 1994; 24:143-50 [ Links ]
3.Karagounis LA, Anderson J. QT dispersion predicts mortality in treated patients with life-threatening ventricular tachyarrhythmias. [Abstract] J Am Coll Cardiol 1995; 25:16A
4.The Cardiac Arrhythmia Supression Trial (CAST) Investigators. Preliminary Report: Effect of Encainide and Flecainide on Mortality in a Randomized Trial of Arrhythmia Supression after Moyocardial Infarction. N Engl J Med 1989;321: 406-412 [ Links ]
5.Dennis AR.,Richards DA.,Cody DV.,Russel PA.,Young AA.,Cooper MJ.,Ross DL.,Uther JB.: Prognostic Significance of Ventricular Tachycardia and Fibrillation induced at Programmed Stimulation and Delayed Potentials detected on the Signal-Averaged Electrocardiograms of Survivors of Acute Myocardial Infarction. Circulation 1986;74: 731-745 [ Links ]
6.Gutiérrez O. Variabilidad de la frecuencia cardiaca: Aplicaciones en cardiología. Cardiología al día 2001. En prensa [ Links ]
7.Farrel TG, Bashir Y, Cripps T, Malik M, Poloniecki J, Bennett ED, Ward DE, Camm AJ. Risk Stratification for Arrhythmic Events in Postinfarction Patients based on Heart Rate Variability, Ambulatory Electrocardiographic Variables and the Signal-averaged Electrocardiogram. J Am Coll Cardiol 1991;18:687-697 [ Links ]
8.Cain M, Anderson J, Arnsdorf F et al. ACC Consensus document on signal-averaged electrocardiography. J Am Coll Cardiol 1996;27:238-249. [ Links ]
9.Standards for Analysis of Ventricular Late Potentials Using High-Resolution or Signal-Averaged Electrocardiography: A Statement by a Task Force Committee of the European Society of Cardiology, the American Heart Association, and the American College of Cardiology. J Am Coll Cardiol 1991;17: 999-1006
10. Laiño RA, Ortega D, Vázquez A, Giniger A. Incremento de la sensibilidad del ECG de señal promediada mediante mapeo espectrotemporal en pacientes con taquicardia ventricular sostenida. Rec Arg Cardiolo 1995; 63: 111-119 [ Links ]
11.Block M, Breithardt G. The Implantable Cardioverter Defibrillator and Primary Prevention of Sudden Death. The Multicenter Automatic Defibrillator Implantation Trial and the Coronary Artery Bypass Graft (CABG)-Patch Trial. Am J Cardiol 1999; 83: 74D-78D [ Links ]
12.Buxton AE, Lee KL, Fisher JD, Josephson ME, Prystowsky EN, Hafley G, for the Multicenter Unsustained Tachycardia Trial Investigators. A randomized Study of the Prevention of Sudden Death in Patients with Coronary Artery Disease. N Engl J Med 1999; 341: 1882-90 [ Links ]
13.Thadani U.,Lian MA.,Turner J.: Late Potentials are of no Prognostic Value and Signal Averaged Electrocardiogram is of Little use in patients with coronary Artery Disease in the Absence of a Myocardial Infarction (Abstract). J Am Coll Cardiol 1994;254A [ Links ]
14.Kuchar DL., Thorburn CW, Samuel NL. Late potentials Detected After Myocardial Infarction: Natural History and Prognostic Significance. Circulation 1986;74: 1280-1289 [ Links ]
15.Turitto G, Fontaine JM, Ursell SN, Caref EB, Henkin R, El-Sherif N. Value of the Signal-Averaged Electrocardiogram as a Predictor of the Results of Programmed Stimulation in Nonsustained Ventricular Tachycardia. Am J Cardiol 1988;61:1272-1278 [ Links ]
16.Gutiérrez O. Arritmias ventriculares: clasificación y tratamiento. Rev CONAREC 1994; 3. [ Links ]
17. Brembilla-Perrot B, Terrier de la Chaise A, Jacquemin L, Beurrier D, Houplon P. The signal-averaged electrocardiogram is of limited value in patients with bundle branch block and dilated cardiomyopathy in predicting inducible ventricular tachycardia or death. Am J Cardiol 1997; 79:154-9 [ Links ]
18.Schumacher B, Tebbenjohanns J, Pfeiffer D, Jung W, Manz M, Lruderitz B. Prognostic value of signal averaged ECG in dilated cardiomyopathy with spontaneous and induced ventricular tachyarrhythmias. Z Kardiol 1995; 84:468-75 [ Links ]
19.Yamada T, Fukunami M, Ohmori M, Iwakura K, Kumagai K, Kondoh N, Tsujimura E, Abe Y, Nagareda T, Kotoh K et al. New approach to the estimation of the extent of myocardial fibrosis in patients with dilated cardiomyopathy: use of signal-averaged electrocardiography. Am Heart J 1993; 126: 626-31 [ Links ]
20.Campana M, Rolli A, Maffei ML, Callerame M, Lazzeroni E, Botti G. The clinical significance of signal-averaged electrocardiography in hypertrophic cardiomyopathy. G Ital Cardiol 1990; 20:901-5 [ Links ]
21.de Moraes AP, Moffa PJ, Sosa EA, Bellotti GM, Pastore CA, Lima EV, Chalela WA, Grupi CJ, Pileggi FJ. Signal-averaged electrocardiogram in chronic Chagas' heart disease. Rev Paul Med 1995; 113:851-7 [ Links ]
22.Tobe TJ, de Langen CD, Bink-Boelkens MT, Mook PH, Viersma JW, Lie KI, Wesseling H. Late potentials in a bradycardia-dependent long QT syndrome associated with sudden death during sleep. J Am Coll Cardiol 1992; 19:541-9 [ Links ]
23.Leclercq JF, Coumel P. Late potentials in arrhythmogenic right ventricular dysplasia. Prevalence, diagnostic and prognostic values. Eur Heart J 1993; 14 Suppl E:80-3 [ Links ]
24.Volgman AS, Winkel EM, Pinski SL, Furmanov S, Costanzo MR, Trohman RG. Characteristics of the signal-averaged P wave in orthotopic heart transplant recipients. Pacing Clin Electrophysiol 1998; 21:2327-30 [ Links ]
25.Giroud D, Zimmermann M, Adamec R, Oberhransli I, Friedli B. Ventricular late potentials and spontaneous ventricular arrhythmias after surgical repair of tetralogy of Fallot: do they have prognostic value? Br Heart J 1994; 72:580-3 [ Links ]
26.Steinberg JS, Prystowsky E, Freedman RA, Moreno F, Katz R, Kron J, Regan A, Sciacca RR. Use of the signal-averaged electrocardiogram for predicting inducible ventricular tachycardia in patients with unexplained syncope: relation to clinical variables in a multivariate analysis. J Am Coll Cardiol 1994; 23:99-106 [ Links ]
27.Brembilla-Perrot B, Beurrier D, Terrier de La Chaise A, Suty-Selton C, Demoulin S, Thiel B, Louis P. Should a signal-averaged electrocardiogram be requested in the evaluation of malaise and syncope? Arch Mal Coeur Vaiss 1995; 88:465-70 [ Links ]
28.Paradiso M, Gabrielli F, Coppotelli L, Aguglia G, Pergolini M, Leonardo M, Basili S, Alcini E, Masala C, Cordova C. Signal-averaged electrocardiography and echocardiography in the evaluation of myocardial involvement in progressive systemic sclerosis. Int J Cardiol 1996; 53:171-7 [ Links ]
29.Ogawa S, Nagai Y, Zhang J, Yuge K, Hino Y, Jimbo O, Fukazawa R, Hayashi R, Kamisago M, Seki T, Genma Y, Ohkubo T, Takechi N, Yamamoto M. Evaluation of myocardial ischemia and infarction by signal-averaged electrocardiographic late potentials in children with Kawasaki disease. Am J Cardiol 1996; 78:175-81 [ Links ]
30.Shin HH, Sagar KB, Stepniakowski K, Wetherbee JN, Egan BM. Increased prevalence of abnormal signal-averaged electrocardiograms in older patients who have hypertension with low diastolic blood pressure. Am Heart J 1993; 125:1698-703 [ Links ]
31.Prisant LM, Wylds AC, Carr AA, Gross CM, Flowers NC. Assessment of late potentials in patients with essential hypertension by the signal-averaged electrocardiogram with five year follow-up. J Hum Hypertens 1993; 7:497-503 [ Links ]
32.Mladosievircova B, Foltinova A, Bernadirc M, Petrarsova H, Hulin I. High-resolution electrocardiography in monitoring myocardial damage after therapy with anthracyclines in children. Bratisl Lek Listy 1996; 97:289-97 [ Links ]
33.Lalani AP, Kanna B, John J, Ferrick KJ, Huber MS, Shapiro LE. Abnormal signal-averaged electrocardiogram (SAECG) in obesity. Obes Res 2000; 8:20-8 [ Links ]
34.Cecchi F, Montereggi A, Olivotto I, Marconi P, Dolara A, Maron BJ. Risk for atrial fibrillation in patients with hypertrophic cardiomyopathy assessed by signal averaged P wave duration. Heart 1997; 78:44-9 [ Links ]
*Cardiólogo-Electrofisiólogo, Clínica de Arritmias, San José, Costa Rica. Profesor de Fisiología, Facultad de Medicina, Universidad Iberoamericana, San José, Costa Rica.
e-mail: oswcr@hotmail.com














