Introducción
La presencia de arsénico en aguas de consumo humano ha afectado aproximadamente a 200 millones de personas en el mundo (Baig, Sheng, Hu & Xu, 2013). La incidencia de enfermedades está asociada con daños como hiperqueratosis, callosidades en las extremidades, lesiones cutáneas, afecciones cardiovasculares, diabetes mellitus, desórdenes neurológicos e hipertensión, entre otros (Centeno, Tseng, Van der Voet & Finkelman, 2007). Debido a esto, la Agencia de Protección Ambiental de los Estados Unidos (USEPA, por sus siglas en inglés) y la Organización Mundial de la Salud (OMS) han establecido un límite máximo permisible de 10 µg/L (Henke, 2009; Cáceres, 2007). En el caso de Costa Rica, la presencia de arsénico en el agua en concentraciones mayores a ese límite se detectó desde el año 2009. Las regiones afectadas han sido los cantones de Bagaces y Cañas, en conjunto con los distritos de Aguas Zarcas y Los Chiles en la zona norte del país (AyA, 2013). En total, 12 000 personas de 23 comunidades se han visto perjudicadas (Astorga, 2013). Entre las medidas que se han tomado para atender esta situación están la interconexión con fuentes no contaminadas, el suministro de agua por medio de camiones cisterna y la instalación de filtros Kanchan (AyA, 2013). Por otra parte, a la fecha se han instalado 6 plantas de tratamiento, las cuales cuentan con lechos de adsorción que utilizan como adsorbente el dióxido de titanio.
En Latinoamérica en las últimas décadas, se ha reconocido la necesidad de implementar tecnologías para remover el arsénico, utilizando recursos naturales y locales de las zonas afectadas junto a técnicas de bajo costo, fáciles de manejar y que puedan ser mantenidas por la población local (Bundschuh et al., 2010)current information about the contamination of ground- and surface-water resources by arsenic from geogenic sources in Latin America is presented together with possible emerging mitigation solutions. The problem is of the same order of magnitude as other world regions, such as SE Asia, but it is often not described in English. Despite the studies undertaken by numerous local researchers, and the identification of proven treatment methods for the specific water conditions encountered, no technologies have been commercialized due to a current lack of funding and technical assistance. Emerging, low-cost technologies to mitigate the problem of arsenic in drinking water resources that are suitable for rural and urban areas lacking centralized water supplies have been evaluated. The technologies generally use simple and low-cost equipment that can easily be handled and maintained by the local population. Experiences comprise (i. Materiales naturales ricos en hierro, aluminio y titanio se han caracterizado por ser buenos adsorbentes de arsénico (Litter et al., 2010), al mismo tiempo que representan un bajo costo por su fácil obtención. Según la revisión bibliográfica realizada por los autores de este artículo, en Costa Rica hasta la fecha no se han realizado estudios de adsorbentes naturales para la remoción de arsénico, provenientes de las zonas afectadas, ya que solo se ha trabajado con materiales sintéticos o bien naturales, pero no con las características anteriormente mencionadas. El objetivo del presente artículo es mostrar una serie de potenciales adsorbentes naturales de bajo costo, provenientes de las regiones afectadas de Costa Rica, como posibles opciones para remover arsénico del agua.
Tecnologías para la remoción de arsénico del agua
Existe una gran cantidad de tecnologías para remover el arsénico del agua: coagulación/ floculación, oxidación/precipitación, filtración con membranas, resinas de intercambio iónico, tecnologías fotoquímicas y adsorción (Feenstra, Erkel & Vasak, 2007; Jain & Singh, 2012; Litter, Morgada &Bundschuh, 2010). No obstante, a pesar de que la mayoría de los problemas relacionados con el arsénico en Latinoamérica han sido solucionados, especialmente en áreas urbanas o en sitios con acceso a sistemas centralizados, la mayoría de estas tecnologías son costosas y sofisticadas (Litter et al., 2012).
Durante el proceso de selección de tecnología, se debe tomar en cuenta i) la incidencia de enfermedades crónicas, ii) la concentración y especialización del arsénico, iii) la composición y el volumen de agua por tratar, iv) el tamaño de la estructura en función de las eficiencias esperadas, y finalmente, v) la complejidad de la instalación y el mantenimiento de la infraestructura (Litter et al., 2010; Sorensen & McBean, 2015). Actualmente se dan casos de negligencia en el uso de este tipo de tecnologías, rechazo o abandono, en países en desarrollo, lo cual evidencia que existen otra serie de criterios que no siempre son considerados y que posiblemente determinan el éxito o el fracaso en su aplicación. Dentro de los criterios no considerados se encuentra el hecho de que muchas veces las unidades de tratamiento requieren un monitoreo muy sensible y arreglos de mantenimiento que van más allá del alcance económico. Además, el volumen, el manejo y la disposición final de los desechos generados deben ser considerados (Sorensen & McBean, 2015). Intervienen también una serie de factores culturales y políticos que juegan un papel importante en la implementación de las tecnologías para la remoción de arsénico, desde asuntos de participación comunitaria hasta cambios en las propiedades organolépticas del agua, entre otros.
En síntesis, una tecnología es considerada adecuada y sostenible bajo los siguientes criterios:
i) se utiliza equipo a pequeña escala; ii) es accesible para una población de bajos recursos; iii) el diseño es simple, por lo que la instalación y el mantenimiento pueden estar a cargo de los actores locales; iv) se utilizan energías renovables como la luz solar, y, finalmente, v) se utilizan materiales locales, por lo que no hay que transportar insumos largas distancias (Bundschuh et al., 2010; Sorensen & McBean, 2015)it has become apparent that appropriate technology is often insufficient to create lasting water infrastructure. Specifically, low sustainability of household Arsenic\u2013Iron Removal Plants (AIRPs. Por ello, la posibilidad de emplear las técnicas de adsorción mediante adsorbentes de bajo costo y adsorbentes naturales es muy alta en Costa Rica.
Remoción de arsénico basada en adsorción
El proceso de adsorción del arsénico consiste en que especies iónicas de arsénico (adsorbato) presentes en el agua se acumulan en la superficie de un sólido (adsorbente). Inicialmente, el arsénico entra en contacto con la superficie del adsorbente; seguidamente se difunde por los poros del material y finalmente el arsénico entra en los espacios capilares y los bordes de los poros (Holl & Litter, 2010). Según Henke (2009), Mohan & Pittman (2007) y Feenstra, Erkel, & Vasa (2007), la principal ventaja de la adsorción son el buen conocimiento que se tiene del método y de su funcionamiento, además de que ya se han estudiado y desarrollado diversos materiales adsorbentes que remueven exitosamente el arsénico del agua. Dichos autores concuerdan en que, en general, tanto la puesta en práctica del método como su sostenimiento son de bajo costo; no obstante, hay que considerar que este depende del tipo de adsorbente utilizado. Los mismos estudios señalan algunas desventajas, tales como la interferencia en el proceso de sustancias presentes en el agua y de variaciones del pH, lo que requiere un adecuado ajuste. Además, como en la mayoría de las tecnologías, la generación de residuos sólidos o líquidos con arsénico, cuando una vez que el adsorbente está saturado, se debe eliminar o regenerar este.
Tipos de adsorbentes
Existe una gran variedad de materiales adsorbentes que han sido estudiados, algunos de origen sintético, otros de origen natural, así como otros provenientes de residuos de procesos. Tanto las características físicas del material como el volumen y diámetro de los poros, así como el área específica y la textura del adsorbente influyen en gran medida, ya que el proceso de adsorción se da en la superficie de los materiales (Holl & Litter, 2010). Los compuestos presentes en el adsorbente van a determinar la carga de la superficie de este mismo. Adsorbentes ricos en óxidos/hidróxidos de metales, por lo general, se encuentran cargados positivamente, por lo que pueden atraer hacia su superficie los compuestos de arsénico con carga negativa (Clifford, 1999; Glocheux, Pasarín, Albadarin, Allen & Walker, 2013)
Adsorbentes sintéticos
Algunos adsorbentes sintéticos se pueden encontrar en el comercio, mientras que otros solo han sido probados en el laboratorio. El cuadro 1 muestra diversos materiales sintéticos estudiados, así como sus características de adsorción. Se presentan como materiales sintéticos no solo los elaborados artificialmente, sino también aquellos materiales naturales que han sido modificados. Estos materiales se han estudiado para la adsorción de As (V) y en su mayoría se han obtenido pH idóneos, en un rango de 7,4 - 6,5. La mayoría presentan como componente principal hierro o aluminio; esto ocasiona que, como se mencionó anteriormente, la superficie del adsorbente contenga una carga positiva, atrayendo los compuestos aniónicos del As (V). En el común de los casos se usan partículas generalmente mayores a 0,3 mm y la remoción es mayor al 85%.
Adsorbentes naturales de bajo costo
Los adsorbentes naturales representan un bajo costo si están disponibles localmente y son accesibles para la población local. Son considerados una solución emergente para poblaciones de escasos recursos por el hecho del bajo costo de los materiales, comparado con el de los materiales sintéticos, los cuales constituyen muchas veces la única opción (Bundschuh et al., 2010). No obstante, pueden significar las siguientes desventajas: eficiencia muy variable; alta generación de residuos debido a la baja capacidad de adsorción, comparada con la de los materiales sintéticos; posible crecimiento de microorganismos, y dependencia de las características del agua por tratar. Dentro de las ventajas están que pueden ser aplicados tanto en soluciones individuales como en sistemas comunitarios; además, que la operación y el mantenimiento son más sencillos, ya que no se requiere adicionar químicos, junto con el hecho de que pueden ser modificados para incrementar la eficiencia, tal como se mencionó anteriormente. El cuadro 2 resume algunos de los estudios sobre materiales naturales utilizados en la adsorción de As (V) en agua. Muchos de estos materiales presentan un alto contenido en óxidos metálicos de hierro y aluminio. Al comparar el cuadro 2 con el cuadro 1 se observa una menor capacidad de adsorción en algunos casos de un orden de magnitud de 1 o más. Otra diferencia importante es que la mayoría de estos materiales presentan tamaños de partícula mucho menores de 1 mm de diámetro, por lo que su mejor forma de aplicación es en polvo, o en su defecto, se necesita algún proceso de granulación.
Adsorbentes potenciales naturales de arsénico procedentes de Costa Rica
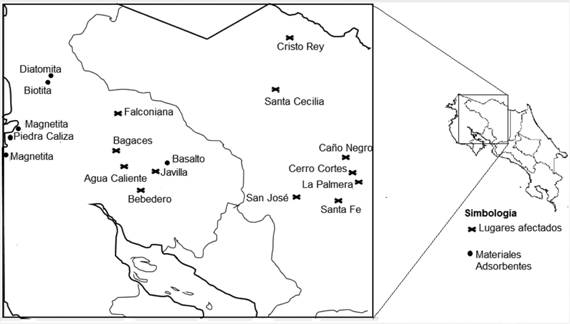
Tal y como se observa en los Cuadros1 y 2, los adsorbentes ricos en óxidos e hidróxidos de hierro, aluminio y titanio han resultado ser los más eficientes en la remoción del arsénico en agua. En este sentido, después de entrevistar a varios geólogos y consultar la literatura disponible, se preseleccionaron cinco materiales ubicados en la región Guanacasteca, los cuales presentan concentraciones altas de estos compuestos. En el Cuadro 3 se resumen las características de esos materiales, la biotita, el basalto, la diatomita, la magnetita y la piedra caliza. La Figura 1 muestra las zonas afectadas por problemas de arsénico en agua, así como los lugares donde se encuentran disponibles los posibles materiales adsorbentes seleccionados; por tanto, si después de ensayos de laboratorio, alguno de esos materiales presenta una adsorción apropiada, se estaría contando con un material de origen local para la remoción de arsénico.
Cuadro 1 Materiales sintéticos y sus características de adsorción
| Material | Capacidad de adsorción (μg/g) | Concentración inicial (μg/L) | Porcentaje remoción (%) | pH | Tamaño de partícula (mm) | Referencia |
|---|---|---|---|---|---|---|
| Hidróxido de hierro granular | 8000 | 100 μg | ~100 | 6,5 | 2-0,6 | (Badruzzaman, Westerhoff & Knappe, 2004) |
| Hidróxido de hierro granular | 8000 | 100 | ~100 | 7 | 0,6-0,25 | (Badruzzaman, Westerhoff & Knappe, 2004) |
| Laterita acidificada con ácido sulfúrico | 923,6 | 250 - 5000 | ~100 | No mayor a 7,4 | <0,075 | (Glocheux, Méndez, Albadarin, Allen & Walker, 2013) |
| Arena cubierta con óxido de hierro | 18,3 | 325 | 92,00 | No mayor a 7,4 | 0,6-0,8 | (Thirunavukkarasu et al., 2001) |
| Lodo rojo activado con tratamiento de ácido | 942 | 2500- 30 000 | >99,80 | 3,5 | <0,075 | (Altundogan, Altundogan, Tümen & Bildik, 2002) |
| Arena cubierta con hierro | ~8500 | 1600 | >85 | 7,2 | 1,8-4 | (Petrusevski, Boere, Shahidullah, Sharma & Schippers, 2002) |
| Carbón activado granular impregnado con hierro | ~5000 | 1600 | >85 | 7,2 | 1,07 | (Petrusevski et al., 2002) |
| Hidróxido de hierro granular (a 20 ᵒC) | ~1700 | 100 | 95-99 | 6,5 | 0,32-2 | (Banerjee et al., 2008)very little information is available on the kinetics and thermodynamic aspects of adsorption of arsenic compounds onto other iron oxide-based adsorbents as well. In order to gain an understanding of the adsorption process kinetics, a detailed study was conducted in a controlled batch system. The effects of temperature and pH on the adsorption rates of arsenic (V |
| Hidróxido de hierro granular (a 30 ᵒC) | ~2000 | 100 | 95-99 | 6,5 | 0,32-2 | (Banerjee et al., 2008)very little information is available on the kinetics and thermodynamic aspects of adsorption of arsenic compounds onto other iron oxide-based adsorbents as well. In order to gain an understanding of the adsorption process kinetics, a detailed study was conducted in a controlled batch system. The effects of temperature and pH on the adsorption rates of arsenic (V |
| Pómez cubierta de óxido de hierro | ~7500 | 4300 | - | 6,8 | 0,8-1,5 | (Sylvie, 2007) |
| Pómez cubierta de aluminio | - | 250 | 71 | 7,0 | 0,3 | (Nasseri & Heidari, 2012) |
Cuadro 2 Materiales naturales de bajo costo y sus características de adsorción
| Material | Capacidad de adsorción (μg/g) | Concentración inicial (μg/L) | Porcentaje remoción (%) | pH | Tamaño de partícula (mm) | Referencia |
|---|---|---|---|---|---|---|
| Laterita natural | 301,2 | 250 - 5000 | - | 7,0 | <0,075 | (Glocheux et al., 2013) |
| Ferrihidrita | 285,0 | 325 | 87,00 | 7,4 | - | (Thirunavukkarasu, Viraraghavan & Subramanian, 2001) |
| Lodo rojo natural | 513,0 | - | >99,80 | - | <0,075 | (Altundoğan, Altundoğan Tümen, & Bildik, 2002) |
| Geotita | 12400,0 | 10 000- 1 000 000 | ~100,00 | 5,5 | <0,037 | (Ladeira & Ciminelli, 2004) |
| Gibbsita | 4600 ,0 | 10000- 1 000 000 | ~100,00 | 5,5 | <0,037 | (Ladeira & Ciminelli, 2004) |
| Oxisol | 3200 ,0 | 10000- 1 000 000 | ~100,00 | 5,5 | <0,037 | (Ladeira & Ciminelli, 2004) |
| Kaolita | 230,0 | 10000- 1 000 000 | - | 5,5 | <0,037 | (Ladeira & Ciminelli, 2004) |
| Turba natural | ~0 | 5000- 300 000 | - | - | - | (Ansone, Klavins & Viksna, 2013) |
| Cenizas volátiles de carbón | - | 800 | 81,10 -95,00 | 6 y 8 | - | (Wang & Tsang, 2013) |
| Cemento hidratado | 1920,0 | 1000 | 97,00 | 7 | 1,4-3 | (Bibi, Farooqi, Hussain, & Haider, 2015) |
| Polvo de mármol | 40,0 | 1000 | 96,40 | 7 | 0,05 | (Bibi et al., 2015) |
| Polvo de ladrillo | 40,0 | 1000 | 95,30 | 8 | <0,3 | (Bibi et al., 2015) |
| Magnetita | 6,614 | 1500 | 93,33 | 6,5 | 0,1 | (Kumwenda, 2009) |
| Magnetita | 243 | 3700 | - | 8 | 12 nm | (Yean et al., 2005) |
| Magnetita | 0,965 | 500 | - | 6,1 | - | (Mayo et al., 2007) |
Cuadro 3 Adsorbentes potenciales naturales de bajo costo para la remoción de arsénico en el agua de consumo humano en Costa Rica
| Nombre | Coordenadas Lambert Norte | Descripción | Fotografía |
|---|---|---|---|
| Basalto | X= 420027.80 Y= 272734.12 | Según Denyer & Kussmaul (Denyer & Kussmaul, 2000), los basaltos son rocas ígneas muy variadas, de acuerdo a su composición química. Se pueden encontrar de tipo toleíco en la Península de Nicoya y en la Cordillera de Tilarán. Según su recopilación, el basalto toleíco presente en el Complejo de Nicoya contiene 48,1% de SiO2; 1,1% de TiO2; 13,3% de Al2O3; 0,1% de MnO, y para el caso del hierro, 7,6% de FeO y 3,2% de Fe2O3. Alvarado, Pérez, Vogel, Gröger & Patiño (2011)asymmetric, isolated Pleistocene pyroclastic cone, located in front of the Cordillera de Guanacaste, in northern Costa Rica. The cone consists of ~0.09km3 of basaltic tephra, as well as ~0.14km3 of lateral lava flows. Tephras are tholeiitic, high-alumina, olivine basalts, and represent minor degrees (\u22645% en su estudio específico sobre el Cerro Chopo (Coronación, Anunciación o Asunción), ubicado en la Cordillera de Guanacaste (ver figura 2), determinaron que el cerro presenta un alto contenido de basaltos toleícos. Además, según los análisis de sus estudios, la composición promedio en FeO en el cerro es de 9,24%, mientras que la de SiO2 es de 48,34% y la de Al2O3, de 18,05%. El color rojo del cerro se debe al contenido de óxidos de hierro (Mora, 1997). |

|
| Biotita | X=370356.51 Y=307702.14 | Es un aluminio-silicato hidratado de potasio, magnesio y hierro, (AlSi3O10), K, (MgFe)3 y (OH)2 (Denyer & Kussmaul, 2000). Estudios sobre biotita han demostrado que esta cuenta con aproximadamente 20% de FeO, entre un 3 y un 4% de TiO2, alrededor de un 15% de Al2O3 y un 0,4% de MnO (Dopico, López, Wemmer & Rapalini, 2013). Es común encontrarla en la Formación de Liberia, la cual está a los pies del volcán Rincón de La Vieja, en la vertiente occidental de la Cordillera de Guanacaste (Losilla, Rodriguez, Schosinsky & Bethune, 2001). Es especialmente abundante en las tobas blancas de los alrededores de Liberia (Denyer & Kussmaul, 2000). |

|
| Piedra caliza | X=352686.09 Y=280951.23 | La piedra caliza se compone principalmente de carbonato de calcio (calcita) CaCO3. Comúnmente se hayan impurezas de sílice, arcilla o arena, y cantidades menores de fosfato, hierro, manganeso y materia carbonácea (Guerrero, 2001). La caliza contiene aproximadamente 4% de materiales insolubles, de los cuales la octava parte corresponde a hierro (Guerrero, 2001). La calcita ha sido estudiada como adsorbente de arsénico, As (V), y se han demostrado buenos resultados en la remoción de este, los cuales han alcanzado una capacidad de adsorción en su área de 18,73 µg/m2 (Sø, Postma, Jakobsen & Larsen, 2008). Es un tipo de roca muy común en Costa Rica, con reservas abundantes en la Península de Santa Elena, Turrialba y el sur del Valle Central (Denyer & Kussmaul, 2000). En el sector de Guanacaste se puede encontrar en Nicoya, Loma Camastro, Cañas Dulces, Bagaces, Los Ángeles y Líbano. |

|
| Magnetita | X=354594.34 Y=285656.62 | La magnetita es un óxido de hierro (Fe3O4); se puede encontrar en rocas y arenas (Kumwenda, 2009). La magnetita contiene entre un 10 y un25% de TiO2 (Denyer & Kussmaul, 2000). Estudios realizados de arenas de Playa Caldera indican que la fracción de magnetita es de un 33,4%, mientras que la de TiO2, de un 8,74% (Singer, Page, Bagby, Cox & Ludington, 1990). Se ha trabajado con magnetita en tamaños nanométricos, para remover arsénico. Con un tamaño de 12 nm, se lograron capacidades de adsorción de hasta 243 µg/g (Yean et al., 2005). Sin embargo, con magnetita de tamaño natural, las capacidades de adsorción bajaron hasta 0,992 µg/g (Kumwenda, 2009). En Costa Rica, las mayores acumulaciones de magnetita se ubican en algunas playas del Pacífico y del Caribe, principalmente en las playas al norte de la península de Nicoya, entre Caldera y Tárcoles, y entre Cahuita y Puerto Viejo (Denyer & Kussmaul, 2000). |

|
| Diatomita | X=372145.96 Y=310210.03 | Es una roca sedimentaria silícea, compuesta de hierro, aluminio, amonio, metales alcalinos, y otros constituyentes menores (Vargas, n.d.)25(1-2. Contiene un porcentaje de Fe2O3 de 0,55%; además de 80,10% de SiO2, y 10,30% de Al2O3, entre otros compuestos. La diatomita se caracteriza por su alta porosidad y permeabilidad, y su baja densidad, baja conductividad térmica, baja abrasión y amplia área de superficie (Denyer & Kussmaul, 2000). Uno de los principales usos es el de medio filtrante. La diatomita en polvo presenta espacios vacíos que permiten evitar el paso de partículas pequeñas, por lo que se usa en la filtración de jugos, cervezas, vinos y productos farmacéuticos (Mathers, 1989). Se puede aplicar como una capa de soporte a través de la cual el filtrado pasa, o bien se aplica directamente al líquido, donde el polvo se mezcla capturando las partículas y aclarándolo (Mathers, 1989). Ha sido probada en la remoción de metales pesados en baja concentración, dando buenos resultados en la adsorción de plata, plomo, cromo (III), zinc y níquel, por lo cual puede ser utilizada en tratamientos terciarios de aguas residuales (Vargas, n.d.) En Costa Rica se conocen trece depósitos y prospectos de diatomita, la mayoría en la zona norte del país, especialmente en Guanacaste (Denyer & Kussmaul, 2000). El depósito más grande se encuentra en Loma Castro, cerca de Cañas Dulces, donde la reserva se estima en 5,8 millones de toneladas (Denyer & Kussmaul, 2000; Vargas, n.d.)25(1-2. |

|
Conclusiones y recomendaciones
Materiales adsorbentes ricos en óxidos/hidróxidos de metales, principalmente de hierro, titanio y aluminio, pueden adsorber arsénico. Los adsorbentes sintéticos con esta composición suelen ser mejores adsorbentes que los naturales, no obstante, estos últimos son de menor costo económico y fáciles de conseguir.
La remoción de arsénico por medio de la técnica de adsorción con materiales naturales, locales y de bajo costo representa una opción viable y atractiva para solucionar el problema de las zonas afectadas en Costa Rica.
Cerca de las zonas afectadas por la contaminación de arsénico en agua, se pueden encontrar materiales naturales ricos principalmente en hierro, aluminio, manganeso y titanio, los cuales podrían ser utilizados como adsorbentes del arsénico.
La biotita, la diatomita, la magnetita, el basalto y la piedra caliza poseen el potencial de ser adsorbentes. Sin embargo, se deben de hacer estudios específicos para determinar su capacidad de adsorción y si pueden funcionar como buenos adsorbentes.