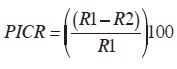Introducción
En Costa Rica, el cultivo de la cebolla (Allium cepa) es una importante fuente de recursos para los pequeños y medianos agricultores de la zona norte de Cartago, Santa Ana de San José y Bagaces de Guanacaste. Según estudios realizados, la producción se estimó en 30,000kg/ha y es una de las hortalizas que más se consumen en el país, principalmente como condimento o acompañamiento de ensaladas (Jáen & Azofeifa, 2010; MAG, 2007).
Entre los problemas que afectan esta actividad productiva, las enfermedades por hongos y bacterias ocupan uno de los principales lugares. Entre ellas se encuentran la enfermedad llamada la pudrición blanca provocada por el hongo Stromatinia cepivora, una enfermedad importante de la cebolla a nivel mundial y en Costa Rica específicamente en la provincia de Cartago (Granados, 2005, 2013; Metcalf et al., 2004).
El manejo de S. cepivora no es fácil, existen pocos cultivares comerciales de cebolla resistentes y no hay muchos fungicidas para combatirlo; estos factores hacen que el control biológico sea una buena opción contra la pudrición blanca (Metcalf et al., 2004). Uno de los aspectos más difíciles de manejar es la producción de estructuras resistentes por parte del hongo, denominadas esclerocios, que son las responsables de que el patógeno permanezca en el suelo por muchos años (Granados, 2013).
Actualmente, el control biológico de los hongos del suelo, como parte de las estrategias del manejo integrado de plagas, es una de las alternativas más prometedoras para la mejora de la calidad de los cultivos y también para reducir la dependencia de los agroquímicos y la contaminación de los suelos y el ambiente en general. Este tipo de control incide en la reducción del uso de plaguicidas y proporciona además una ventaja competitiva en el mercado (Flores et al., 2007, Granados & Wang, 2008).
Trichoderma sp es un género de hongos del suelo que incluye especies ampliamente utilizadas como agentes de control biológico en la agricultura, además de ser de fácil manejo y rápido crecimiento. Muchas cepas son conocidas por secretar metabolitos secundarios con diferentes actividades biológicas, así como por incrementar el aprovechamiento de los nutrientes por parte de las plantas. Los biofungicidas basados en este hongo comprenden más de 50 formulaciones, disponibles como productos registrados en todo el mundo. Investigaciones recientes han identificado y determinado la función de nuevos genes, enzimas y otras proteínas que producen resistencia inducida en las plantas (Infante et al., 2011; Vinale et al., 2014; Woo et al., 2006).
El objetivo de esta investigación fue evaluar el antagonismo in vitro y en campo de aislamientos de Trichoderma sp. provenientes de zonas productoras de cebolla de Cartago con respecto a S. cepivora.
Materiales y métodos
Localización y material experimental
Los experimentos y análisis se realizaron en el Centro de Investigación en Biotecnología (CIB) del Instituto Tecnológico de Costa Rica (TEC). Se emplearon bulbos de cebolla con síntomas de enfermedad de la pudrición blanca. El patógeno se identificó según la metodología descrita por Astorga et al. (2013). Trichoderma sp. se obtuvo a partir de cepas seleccionadas, conservadas a -10oC y almacenadas en el CIB, las cuales fueron previamente identificadas (Astorga et al., 2014).
Aislamiento y caracterización de Stromatinia cepivora y Trichoderma sp.
Se seleccionaron ocho fincas dedicadas a la producción intensiva de cebolla, ubicadas entre 1800 y 2100 metros sobre el nivel del mar (msnm) en la provincia de Cartago. En cada una se marcaron cinco puntos de muestreo y en cada punto se tomaron 200 g de suelo con un palín, a una profundidad de 15 cm. La muestra compuesta resultante (1 kg) se cuarteó hasta dejar 200 g como muestra total de la finca. Las ocho muestras resultantes fueron trasladadas al laboratorio de Biocontrol del CIB.
Con cada muestra se realizaron diluciones seriadas y de la dilución 104 se sembraron 0.5 ml en placas con el medio de cultivo TSM, enriquecido para el aislamiento de Trichoderma, compuesto por (g/L): 1,0 Ca (NO3)2; 0,26 KNO3; 0,26 MgSO4 7H2O; 0,12 KH2PO4; 1,0 CaCl2 2H2O; 0,05 ácido cítrico; 2,0 sacarosa; 20,0 agar; 1,0 Flint 50% WG (Trifloxystrobin); 0,005 clortetraciclina; 0,004 Captan® 80% WG, 0,0025 Previcur N (Propamocarb HCl). Las placas fueron incubadas a 25 ºC durante cuatro días, al cabo de los cuales las colonias identificadas morfológicamente se resembraron en medios PDA y CMD para su purificación. Estas cepas fueron luego identificadas según la metodología descrita por Astorga et al. (2013).
Para el aislamiento de S. cepivora se usó la técnica del tamizado húmedo. De cada muestra de suelo se tomaron 20g de suelo, se mezclaron y homogenizaron con agua destilada durante 2 minutos. Posteriormente se filtraron usando los tamices de 20 mesh (0,84 mm) y 80 mesh (0,25 mm) superpuestos (Cole Palmer®). La fracción recolectada con el tamiz de 20 mesh se descartó. La fracción recolectada con 80 mesh se lavó con agua en flujo constante durante 15 minutos. Los esclerocios presentes fueron seleccionados bajo un estereoscopio (Leyca®) a 5X y se sembraron cinco esclerocios en placas con el medio de cultivo PDA-ac (acidificado) con una solución de ácido láctico al 10%. Se incubaron durante cuatro días a 25 ºC. Los esclerocios germinados fueron resembrados en placas con el medio de cultivo PDA para su purificación e identificados según la metodología descrita por Astorga et al. (2014).
Pruebas de antagonismo in vitro
Estas pruebas se realizaron siguiendo la técnica de cultivo dual con el medio PDA-ac. En las placas de Petri se colocó un disco del patógeno y otro del biocontrolador, situados en lados opuestos a 1cm del borde (Correa et al., 2007). Posteriormente, se incubaron a 28+-10C. Las mediciones de los diámetros de los dos microorganismos se hicieron a las 120 horas.
La determinación de la capacidad del biocontrolador para combatir al patógeno se valoró mediante el porcentaje de inhibición del crecimiento radial (PICR). Este porcentaje se calculó aplicando la fórmula de Suárez et al. (2008):
donde R1 es el radio mayor (radio patógeno como testigo) y R2 es el radio menor (radio patógeno frente al biocontrolador).
Pruebas de antagonismo en campo
Se evaluaron seis parcelas, cada una de 1m de largo por 1m de ancho; tres parcelas con aplicaciones de Trichoderma sp. y tres testigos. Se contó el número de plantas sobrevivientes por parcela por mes y se le dio seguimiento durante el ciclo de cultivo.
Resultados y discusión
Identificación y caracterización de aislamientos de Trichoderma sp y S. cepivora
Se logró obtener diferentes aislamientos de Trichoderma sp de las muestras 2, 3, 4 y 8. Debido a la similitud de los morfotipos que se obtuvieron del suelo, de cada una de las fincas se seleccionó uno por muestra, para su posterior identificación. De las muestras 1, 5, 6 y 7 no se obtuvieron aislamientos. En el caso de S. cepivora se obtuvieron tres aislamientos procedentes de esclerocios de las muestras 2, 7 y 8. En las muestras de las fincas 1, 3, 4, 5 y 6 no se encontraron esclerocios. En el Cuadro 1 se detallan los aislamientos y la ubicación de las fincas de las que fueron obtenidos.
Cuadro 1 Procedencia de los aislamientos obtenidos de Trichoderma sp. y Stromatina sp. en las fincas evaluadas.
| Género del microorganismo y codificación asignada | Altitud (msnm) |
|---|---|
| Trichoderma, F2 | 2046 |
| Trichoderma, F3 | 2083 |
| Trichoderma, F4 | 1811 |
| Trichoderma, F8 | 1952 |
| Stromatinia, F2 | 2046 |
| Stromatinia, F7 | 1930 |
| Stromatinia, F8 | 1952 |
En los organismos purificados en agar CMD, la esporulación se concentra en determinadas zonas siguiendo los patrones de crecimiento asociados a la cepa (Figura 1), debido a las características nutricionales de su composición. Estos aislamientos se identificaron posteriormente como T. asperellum por sus características morfológicas.
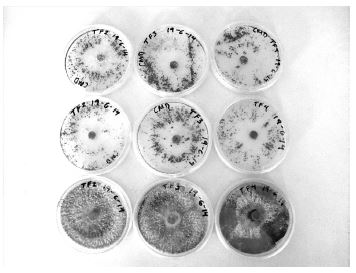
Figura 1 Cepas obtenidas de Trichoderma sp que crecieron en agar CMD (las dos filas superiores) y en agar PDA (fila inferior).
Pruebas de antagonismo in vitro
Las pruebas de antagonismo son un paso fundamental para evaluar la capacidad de un determinado microorganismo como agente de biocontrol. El porcentaje de inhibición del crecimiento radial (PICR) obtenido para cada cepa es un indicador directo de su potencial. Los resultados promedios de los valores obtenidos por las cepas aisladas, tanto del patógeno como del antagonista, establecen diferencias importantes en cuanto a susceptibilidad y agresividad.
Cuadro 2 PICR promedio medido en pruebas de cultivo dual de Trichoderma asperellum y Stromatinia cepivora.
| Aislamientos Trichoderma | Porcentaje de inhibición del crecimiento radial | |||
|---|---|---|---|---|
| Stromatinia F2 | Stromatinia F7 | Stromatinia F8 | PICR Promedio | |
| F2 | 41.09 | 54.02 | 42.97 | 46.03 |
| F3 | 41.31 | 56.40 | 48.73 | 48.81 |
| F4 | 70.02 | 50.56 | 69.73 | 63.44 |
| F8 | 68.95 | 52.47 | 72.15 | 64.52 |
| Promedio PICR | 55.34 | 53.36 | 58.39 | - |
Las cepas de T. asperellum obtenidas de las finca 4 y 8 mostraron los valores más altos de PICR. Estos valores son elevados y muestran un potencial efecto inhibitorio y parasítico contra S. cepivora, que a nivel in vitro se demuestra por la rapidez con que el microorganismo logra hacer contacto con el patógeno y detener su crecimiento (Cuadro 2).
Las cepas obtenidas de S. cepivora son afectadas por los aislamientos de Trichoderma sp. En este caso, el PICR determinado permite observar de manera indirecta la susceptibilidad del patógeno ante cada una de las cepas evaluadas. Los valores del PICR obtenidos en este caso son muy similares, sin embargo, la cepa más afectada fue la extraída de la muestra de la finca 8, donde los aislamientos del biocontrolador presentan el valor más alto.
El análisis estadístico permitió establecer la normalidad de los datos (p<0.010 en la prueba de Shapiro Wilks). En el análisis de varianza se encontraron diferencias estadísticas entre los valores del PICR de los aislamientos con respecto a Trichoderma sp (p<0.000) y con respecto a Stromatinia (p<0.000), de forma individual. Además, se determinó la existencia de interacciones entre las cepas de Trichoderma y de Stromatinia (p<0.000) (Cuadro 3). El R2 fue de 85,47% y el R2 ajustado de 83,99%. Las diferencias encontradas en los valores de PICR se muestran en el siguiente cuadro:
El análisis del valor del PICR producto de la interacción entre las cepas de Trichoderma y Stromatinia genera información importante sobre la capacidad antagónica del primero. En el Cuadro 3 se destaca que los aislamientos 4 y 8 de Trichoderma muestran el mejor efecto antagónico sobre las cepas 2 y 8 de Stromatinia. Por el contrario, las cepas 2 y 3 de Trichoderma presentan el desempeño más bajo ante los aislamientos 2 y 8 de Stromatinia. En ambos casos son las mismas cepas de Stromatinia, es decir, la diferencia en el PICR la marca la capacidad intrínseca de la cepa del biocontrolador y no la capacidad de defensa del organismo atacado.
El fenómeno de antagonismo entre hongos está mediado por una serie de mecanismos de ataque y respuesta desarrollados por el biocontrolador y el patógeno por controlar. Trichoderma sp dispone de una gran variedad de mecanismos de ataque; entre los más conocidos se encuentran el parasitismo, la antibiosis, la competencia por nutrientes y espacio, la liberación de enzimas que afectan el metabolismo de otros microorganismos, la activación de respuesta de defensa por parte de la planta, la estimulación de la germinación y el crecimiento (Infante et al., 2009; Harman, 2006; Howell, 2003; Lorito et al.; 1990). Estos mecanismos y su intensidad varían entre especies y cepas aisladas. Por lo tanto, se puede afirmar que las cepas de Trichoderma T4 y T8 presentan el mejor control contra Stromatinia.
Cuadro 3 Comparaciones establecidas del valor medio del PICR de las cepas mediante la prueba Tukey al 95% de confianza.
| Trichoderma*Stromatinia | Media PICR | Grupo |
|---|---|---|
| T8*S8 | 72,149 | A |
| T4*S2 | 70,084 | A |
| T4*S8 | 69,727 | A |
| T8*S2 | 68,955 | A |
| T3*S7 | 56,398 | B |
| T2*S7 | 54,018 | BC |
| T8*S7 | 52,466 | BC |
| T4*S7 | 50,560 | BC |
| T3*S8 | 48,729 | CD |
| T2*S8 | 42,966 | DE |
| T3*S2 | 41,308 | E |
| T2*S2 | 41,086 | E |
El potencial determinado para los aislamientos 4 y 8 de Trichoderma los ubica como buenos candidatos para la ejecución de pruebas in vivo y pruebas de producción semimasiva, con fines de inserción en planes de manejo integrado en el cultivo de cebolla. Sin embargo, en pruebas de campo se debe verificar su eficiencia y el papel de elementos como la concentración de inóculo, la dispersión, la resistencia a factores ambientales y las técnicas de aplicación.
Pruebas de antagonismo en campo
En la Figura 2 se muestran los porcentajes de supervivencia de las plantas en las parcelas en estudio, a las cuales se les aplicó Trichoderma como microorganismo antagonista del hongo S. cepivora. Se puede observar que tanto en la finca 1 como en la finca 2 el porcentaje fue mayor cuando se utilizó Trichoderma sp. como biocontrolador del hongo patógeno.
Las relaciones de organismos antagónicos, al igual que cualquier proceso patológico, están mediadas en buena parte por la genética de las respuestas de defensa de un microorganismo ante los ataques de otro. En las relaciones de plantas y microorganismos, la activación de genes P y R, cuyas proteínas modulan una serie de reacciones enzimáticas y no enzimáticas, es una de las bases de los procesos de enfermedad, susceptibilidad y resistencia.
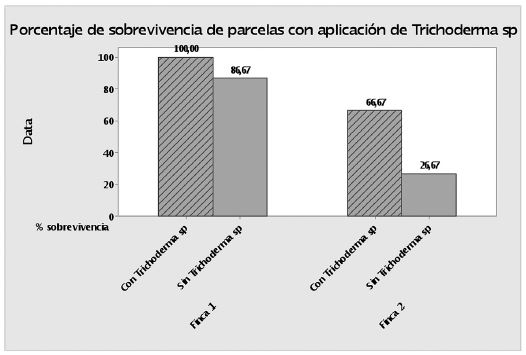
Figura 2 Porcentajes de supervivencia de plantas de las parcelas con y sin aplicación de Trichoderma.
De la misma forma, los organismos biocontroladores interaccionan con los microorganismos blanco, provocando una serie de acciones y reacciones que tienen su origen en la información genética de cada uno. En la variedad de estrategias de biocontrol, el género Trichoderma activa una serie de genes, relacionados principalmente con proteínas de reconocimiento transmembrana, formación de apresorios, producción de enzimas hidrolíticas y antibióticos (Mukherjee et al., 2012).
Cuando un hongo ha desarrollado una o varias estrategias que le permiten atacar las células de otro con éxito, es porque los mecanismos de defensa han sido superados y se establece un proceso infectivo. En este sentido, los mecanismos evolutivos de los organismos juegan un papel determinante. Sin embargo, este ataque exitoso puede tener diferentes grados de efectividad, que se deben a diferencias genéticas específicas de los microorganismos que intervienen o a factores ambientales, en el caso de pruebas in vivo. Estas diferencias específicas son las que se buscan en los programas de control biológico de plagas o enfermedades, donde, a pesar de tener aislamientos que representan una misma especie, se pueden encontrar cepas con un potencial superior (Dennis & Webster, 1971a,b; Bell et al., 1982). El hecho de que un microorganismo pueda desarrollar estrategias de biocontrol y otro organismo sea susceptible o resistente a éstas es, a la largo plazo, un reflejo de la capacidad adaptativa de cada uno (Ehler et al., 2003).
Conclusiones
T. asperellum resultó ser efectiva para controlar el hongo S. cepivora en el cultivo de la cebolla tanto en pruebas in vitro como en el campo, en las parcelas evaluadas.
La evaluación desarrollada permite disponer de cepas con poder antagónico contra S. cepivora, para aplicar en campo estrategias agroecológicas de manejo de cultivos. Lo anterior, aunado a un acompañamiento de los agricultores en el uso de biocontroladores y medidas tendientes a mantener la sanidad y la preparación del suelo, permitirá disminuir los niveles del inóculo, factor fundamental para la obtención de buenos rendimientos en los cultivos.