Introducción
El achiote (B. orellana L.) es una especie originaria del Amazonas (Record y Hess 1949, Molau 1983) que pertenece a la división Magnoliophyta y a la familia Bixacea (Thorne 1992, Eguiarte et al. 2003). Tiene mucha importancia desde los antepasados debido a su valor comercial como colorante, sus características medicinales y como parte de la cultura indígena. Actualmente el uso de la bixina, el pigmento vegetal principal del achiote se ha visto impulsado por el biocomercio sostenible, aprovechamiento de recursos ecológicos y además por ser una excelente alternativa ante los efectos carcinógenos y alergénicos ocasionados por pigmentos químicos sintéticos (Leal y Michelangeli 2010). En el 2014, el mercado mundial de carotenoides fue valorado en USD 1.5 mil millones, de lo cual el achiote tuvo una producción alrededor de 10 millones de megagramos, principalmente en Perú y Kenia, con los principales consumidores EE. UU., la Unión Europea, el Reino Unido y Dinamarca (Abdo 2015, März 2015).
Según un estudio sistemático del género, realizado por Baer (1976), reconoce 5 especies de Bixa (B. orellana, B. arborea, B. excelsa, B. platycarpa y B. urucurana), estas se distinguen por el hábito de crecimiento, como árboles o arbustos. Ambrósio et al. (2015) afirman la propuesta taxonómica de Pilger publicada por Kuntze (1925), quien clasifica a B. urucurana como una variedad de B. orellana L. para identificar así, al ancestro salvaje del achiote cultivado.
El achiote es un cultivo del Neotrópico, que puede cultivarse con facilidad desde el nivel del mar hasta los 1400 msnm, con rangos de temperatura óptima que oscilan entre 20°C y 30°C, el cultivo se adapta a amplias condiciones de precipitaciones anuales desde 600 mm hasta 2000 mm (Arce Portuguez 1999). El cultivo empieza su producción a los 2 años y a partir de los 4 años su producción es mayor y más uniforme, con una densidad de 1111 árboles, el rendimiento será de 2597 kg de semilla por hectárea por año (Quiñones Bravo y Yunda Romero 2014). La floración característica del cultivo de achiote es escalonada descendente (Arriaza Meza1990). Según Rodríguez y Enríquez (1983) la apertura de las flores inicia entre las 4:00 am y 5:00 am y el grano de polen permanece viable por un período de 10 horas a 11 horas, en las condiciones de Turrialba, Costa Rica.
Las semillas de achiote son consideradas ortodoxas, resisten la desecación y esto tiene relevancia para la conservación y almacenamiento del germoplasma (Velho Do Amaral et al. 2000). En las semillas se encuentra la bixina, cuya nomenclatura química es monometil éster del ácido norbixin dicarbónico (C25H30O4) y representa del 80% al 90% de los colorantes totales del achiote (Smith et al. 1992). El mínimo porcentaje de bixina aceptable en el mercado internacional para variedades comerciales es de 2,5% (Arce Portuguez 1984).
A nivel citogenético el achiote cuenta con un número cromosómico haploide n = 7 y un número cromosómico diploide 2n = 14 (Lombello y Pinto-Maglio 2014). Bixa orellana L. ha sido una especie domesticada, lo cual se evidencia en las diferencias con los ancestros silvestres en los contenidos variables de bixina que poseen los materiales silvestres, que sugiere, ha existido un flujo de genes responsables de esta característica desde dichos materiales hasta los cultivados (Ambrósio et al. 2015).
Actualmente, para la identificación de especies y clasificaciones taxonómicas, se ha recurrido a utilizar técnicas moleculares para respaldar los resultados, es por esto que han cobrado importancia términos como “DNA Barcoding” (código de barras de ADN). Las regiones DNA Barcoding deben tener una buena amplificación por PCR universal, poder de diferenciación entre especies, complementación entre loci, amplitud en aplicación taxonómica y análisis bioinformático (Erickson et al. 2008). Dentro de estas regiones se encuentran las secuencias espaciadoras internas transcritas (ITS) ITS1 e ITS2 que presentan una cantidad pequeña de nucleótidos como 565 pb a 700 pb en angiospermas que pueden amplificarse fácilmente por PCR y secuenciarse con iniciadores universales (Baldwin et al. 1995).
La secuenciación del ADN consiste en determinar el orden de nucleótidos que conforman el ADN en un segmento específico. Existen varios métodos para realizarlo, como el método Sanger, pirosecuenciación, secuenciación por nanoporos, entre otros (Bleidorn 2017). La comparación de las secuencias de ADN es la base del análisis bioinformático, así como el primer paso para el análisis estructural y funcional. El proceso más elemental en este tipo de comparación es la alineación de secuencias, donde se realiza una comparación mediante la búsqueda de patrones de caracteres comunes y el establecimiento de los residuos de correspondencia entre las secuencias relacionadas. Este proceso es fundamental en la búsqueda de similitudes y el alineamiento de secuencias múltiples (Meneses et al. 2011).
Para el alineamiento de secuencias múltiples, se tienen disponibles varias herramientas, el alineamiento MUSCLE es una de ellas, se basa en el algoritmo Needleman-Wunsch y se puede utilizar para alinear las secuencias de ADN o de proteínas con el objetivo de evidenciar la topología, así como su origen evolutivo (Meneses et al. 2011).
Un árbol filogenético es la representación gráfica de las relaciones genéticas existentes entre organismos; para la construcción de un árbol filogenético existen en general 2 métodos, el basado en distancias y el basado en caracteres, este último utiliza directamente las secuencias de ADN o proteínas, un ejemplo es el método Maximum Parsimony, el cual es el más popular de la sistemática cladística y se basa en reconstruir un dendrograma que represente la relación genética entre las especies en estudio, el método busca la representación que tenga el menor número de cambios genéticos con respecto a la secuencia de un ancestro común (Acero Barraza 2007).
Se debe considerar, la importancia de la conservación de la identidad genética de las accesiones en un banco de germoplasma para futuros programas de fitomejoramiento, ya que es fundamental conducir hacia la homocigosis de los cultivares, con diversos métodos: autopolinización, hermanos completos y medios hermanos (ordenados según la rapidez para obtener endogamia). Los sistemas de fitomejoramiento que conducen a la endogamia se basan en apareamientos no aleatorios, esto va en contra del equilibrio de Hardy-Weinberg (Acquaah 2012). Por tanto, también es importante conservar la heterocigosis y de esta forma mantener la diversidad genética de la especie, que es una fuente de genes para futuras necesidades en cuanto al mejoramiento del cultivo.
Como objetivo principal del proyecto se tuvo, evaluar diferencias fenotípicas y moleculares de 18 accesiones del Banco de Germoplasma de Achiote (Bixa orellana L.) de la Universidad EARTH, para demostrar por medio de un dendrograma, la topología que existe entre estas y de esta forma establecer relaciones basadas entre rasgos fenotípicos y marcadores moleculares. Con el fin de establecer una primera fase para la obtención de líneas homocigotas, se realizaron ensayos de autopolinizaciones en las distintas accesiones de achiote.
Por tanto, este proyecto procuró generar información valiosa para la conservación tanto in situ como ex situ y el manejo de la diversidad genética, por medio del uso de herramientas biotecnológicas que faciliten la implementación de programas de fitomejoramiento.
Materiales y métodos
Ubicación y descripción del banco de germoplasma. El proyecto se realizó en la Finca Académica de la Universidad EARTH, Las Mercedes, Guácimo, Limón, Costa Rica, entre las coordenadas 10°12'25'' N y 83°35'59'' O, a una elevación de 44 msnm. La temperatura promedio anual de la zona es de 25°C, con una humedad relativa promedio anual de 85% y una precipitación promedio anual de 3687 mm (Universidad EARTH 2021). El Banco de Germoplasma de Achiote (Bixa orellana L.) de la Universidad EARTH fue establecido en 1993 y cuenta con un total de 18 accesiones procedentes de Guatemala, Costa Rica y Panamá (Tabla 1), que fueron previamente seleccionadas del Banco de Germoplasma del CATIE como genotipos promisorios debido a su alto contenido de bixina.
Tabla 1 Procedencia e inventario de plantas (año 2021) de las distintas accesiones existentes en el Banco de Germoplasma de la Universidad EARTH.
| Accesión | País de procedencia | Ubicación | Inventario de plantas año 2021 |
| EARTH-FIO | Costa Rica | Guácimo | 18 |
| EARTH-1 | Costa Rica | Guácimo | 8 |
| 10707-1 | Panamá | Veraguas | 4 |
| 10707-2 | Panamá | Veraguas | 9 |
| 10707-3 | Panamá | Veraguas | 17 |
| 10752-1 | Panamá | Veraguas | 24 |
| 10752-2 | Panamá | Veraguas | 8 |
| 11395-2 | Guatemala | Izabal | 16 |
| 11549-2 | Guatemala | Petén | 15 |
| 11549-4 | Guatemala | Petén | 2 |
| 11646-2 | Guatemala | Palencia, Guatemala | 14 |
| 12300-3 | Guatemala | Retalhuleu | 12 |
| 12883-2 | Costa Rica | Cartago | 14 |
| 12887-1 | Costa Rica | Cartago | 18 |
| 12891-1 | Costa Rica | Cartago | 21 |
| 6112-2 | Guatemala | Suchitepéquez | 18 |
| 9931-1 | Costa Rica | Alajuela | 11 |
| 9932-2 | Costa Rica | Alajuela | 19 |
Caracterización fenotípica. Se seleccionaron de 2 a 5 plantas de cada accesión según la disponibilidad dentro del Banco de Germoplasma de la Universidad EARTH. Se evaluaron características morfológicas de tallo, hoja, flor y fruto de las 18 accesiones de achiote con las que cuenta la colección. Para la evaluación en campo se utilizaron descriptores generales y botánicos desarrollados por Arce Portuguez (1983), en donde se enlistan los criterios de clasificación en función de las características morfológicas (Tabla 2).
Tabla 2. Descriptores fenotípicos utilizados para la caracterización del Banco de Germoplasma de Achiote de la Universidad EARTH.
| Descriptor fenotípico | Descripción y forma de medición |
| País y lugar de procedencia | País y punto geográfico de procedencia del germoplasma. |
| Estado fisiológico | Estado de desarrollo en el que se encuentra la planta al momento de realizar la caracterización, la escala de medición es la siguiente: 3 = estado vegetativo, se observa activo crecimiento y mucho follaje; 5 = estado reproductivo, período entre la aparición de los primeros botones florales hasta la formación de más del 50% de las cápsulas; 7 = estado de fructificación: período entre la aparición de las primeras cápsulas y la madurez comercial. |
| Altura de planta (m) | Altura de la planta tomada con un clinómetro, expresada en metros desde la base del suelo hasta el ápice. |
| Diámetro de copa (m) | Diámetro de la planta expresado en metros en la parte más ancha. |
| Circunferencia del tallo (cm) | Circunferencia del tallo expresado en centímetros tomado con un flexómetro, medido a 20 cm del suelo. |
| Hábito de crecimiento | La relación entre altura (m) y diámetro de copa (m) y escala de medición es: 1 = redondeado; 2 = piramidal; 3 = ovoide; 4 = achatado; 5 = alargado.* |
| Número de panículas | Número total de panículas por planta. |
| Promedio de cápsulas por panícula | Promedio del número de cápsulas por panícula, cuantificado en una muestra de diez panículas. |
| Visibilidad de panículas | Grado de visibilidad que reflejan las panículas en la planta, se expresa: 3 = bajo; 5 = intermedio; 7 = alto.* |
| Longitud y ancho de la lámina foliar y peciolo (cm) | Longitud desde la base al ápice y ancho en la parte más ancha del limbo de la hoja expresado en centímetros. |
| Color del haz, envez y peciolo | Color obtenido a partir de la paleta de colores. |
| Color de la flor | Color de los pétalos obtenidos a partir de la paleta de colores. |
| Longitud, ancho y longitud a la parte más ancha de la cápsula (cm) | Longitud desde la base al ápice de la cápsula; ancho de la cápsula en la sección más ancha y longitud desde la base a la parte más ancha, todas las mediciones expresadas en centímetros. |
| Color de cápsula inmadura y madura | Color en estado maduro e inmaduro de la cápsula según la paleta de colores. |
| Grado de espinosidad y longitud de las espinas | El grado de espinosidad se refiere a la presencia o ausencia de espinas en la cápsula, se expresa: 0 = sin espinas; 1 = muy bajo; 3 = bajo; 5 = intermedio; 7 = alto; 9 = muy alto.* La longitud de las espinas se expresa en la siguiente escala: 1 = muy cortas; 3 = cortas; 5 = intermedias; 7 = largas; 9 = muy largas.* |
| Dehiscencia de la cápsula en madurez comercial | Se refiere a la apertura de la cápsula en punto de cosecha, se expresa: 0 = Indehiscente + = dehiscente.* |
| Número de semillas por cápsula | Cantidad de semillas por cápsula, contabilizadas y promediadas a partir de diez cápsulas. |
| Forma del ápice y base de la cápsula | La forma del ápice tomada en frutos en madurez comercial se clasifica en: 1 = redondeado; 2 = agudo; 3 = acuminado; 4 = otro.* La forma de la base tomada en frutos en madurez comercial se clasifica en: 1 = redondeada; 2 = obtusa; 3 = cordada.* |
| Forma de la cápsula | Forma del fruto tomada en madurez comercial se clasifica en: 1 = hemisférica; 2 = ovoide; 3 = cónica.* |
| Peso seco de 100 semillas (g) | Peso de 100 semillas expresado en gramos, después de secar en un horno durante 48 horas a 65°C. |
| Contenido de bixina (%) | Porcentaje de bixina que presentan las semillas, los datos fueron recolectados del proyecto de graduación desarrollado en el mismo Banco de Germoplasma de la Universidad EARTH por Villalobos (1997), quien utilizó la metodología de KALSEC (Herrera 1995). Se pesan 10 g de semilla extraída y se transfieren a un Erlenmeyer de 225 mL. Se añade 150 mL de solución extractora, la cual es compuesta de 4,42% de hidróxido de amonio, 58,64% de metanol y 37% de cloruro de metileno. Se agitan las muestras durante una hora colocadas en columnas de condensación. Después, las muestras se filtran al vacío y la solución se transfiere a un balón de fondo plano de 250 mL y se afora con acetona. Esta solución se agita y se pipetean 0,25 mL de solución uniforme que se colocan en un balón de 100 mL y se afora nuevamente con acetona. Se toman lecturas de absorbancia en el espectrofotómetro, calibrado a una longitud de 487 nanómetros (Longitud de onda a la cual el pigmento presenta mayor absorbancia según los laboratorios de KALSEC, Michigan, Estados Unidos de América). El contenido de bixina se calcula por la siguiente fórmula (61,8 es la absorbancia que reporta la bixina en estado puro, según los laboratorios de KALSEC, Michigan Estados Unidos de América): % de bixina = (Absorbancia (longitud de onda 487) *100) / 61,8. |
| Longitud y ancho de la semilla (mm) | Se refiere a la longitud desde la base al ápice y el ancho en la sección más ancha de la semilla expresados en milímetros. |
| Susceptibilidad a plagas | Se refiere al estado fitosanitario general de la planta, se clasifica como: 0 = no susceptible, 3 = poco susceptible, 5 = susceptibilidad media, 7 = susceptibilidad alta.* |
Caracterización genotípica. Se tomaron muestras foliares de una planta en campo por cada accesión, las muestras se procesaron de la siguiente manera: se pesaron 2 g de tejido que fueron colocados en tubos Falcon de 50 mL y luego se liofilizaron por 48 horas para asegurar la calidad del tejido, posteriormente se extrajo el ADN genómico y la determinación de la cantidad e integridad mediante Nanodrop y gel de electroforesis; luego se realizó el ajuste de la concentración de ADN mínimo a 50 ng.μL-1. Después la amplificación de la región ITS2 se llevó a cabo mediante la técnica PCR con imprimadores universales UniPlantF (5′-TGTGAATTGCARRATYCMG-3′) y UniplantR (5′-CCCGHYTGAYYTGRGGTCDC-3′) (Moorhouse-Gann et al. 2018). Posteriormente, se hizo la visualización de la amplificación de productos de PCR en gel de electroforesis y la limpieza de los productos con un el kit de purificación Thermo ScientificTM K0701. Para la secuenciación de la región ITS2 se utilizó el método Sanger y el kit Thermo Fisher Scientific A38073 en secuenciador ABI 3500.
Análisis de datos fenotípicos y genotípicos. Se efectuó un análisis estadístico descriptivo con el programa R para las variables fenotípicas cuantitativas analizadas. Para las relacionadas al tamaño de la cápsula, semilla y hoja, previamente en Excel se hizo un filtrado por rangos y posteriormente un análisis de frecuencias, con el fin de obtener grupos o clases de tamaño estadísticamente representativos respecto a la población.
Los electroferogramas se cargaron al programa MEGA-X donde se procedió a realizar un alineamiento de secuencias múltiple mediante el método MUSCLE, luego se realizó un árbol filogenético mediante el método Maximum Parsimony (MP), en el parámetro prueba de filogenia se añadió un soporte de Bootstrap con 1000 réplicas. Después este árbol filogenético fue condensado al 50% para incrementar el soporte estadístico de los clados y relacionarlo con las características morfológicas.
Adicionalmente, se efectuó un análisis de la relación entre los datos moleculares obtenidos a partir de la creación del dendrograma MP y las características morfológicas: color de cápsula, grado de espinosidad de la cápsula, longitud de espinas de la cápsula, número de panículas por planta por cosecha, número de cápsulas por panícula, número de semillas por cápsula, peso seco de 100 semillas (g) y contenido de bixina (%), para lo cual se elaboraron gráficas de medias clasificadas según los grupos filogenéticos.
Ensayos de autopolinización. Se realizaron ensayos de emasculación y autopolinización de botones florales previo a la antesis entre las 5:00 am a 8:00 am, los botones florales autopolinizados se cubrieron con sobres de papel de dimensiones 177 mm x 89 mm para evitar el ingreso de insectos a la flor que pudieran contaminarla con polen externo.
Resultados y Discusión
Caracterización fenotípica. El Banco de Germoplasma de la Universidad EARTH muestra diferencias marcadas en las características relacionadas al color, forma y espinosidad de la cápsula (Figura 1). Existe una relación entre el color de la cápsula y flor, cuando las cápsulas son rojas y amarillas las flores son de color rosado, cápsulas de color verde presentan coloración blanca o rosada pálida en sus flores, mientras que cápsulas de color marrón tendrán flores rosadas y violetas (Arce Portuguez 1984). Estos datos concuerdan con la caracterización fenotípica realizada en este estudio en el Banco de Germoplasma de Achiote de la Universidad EARTH, las accesiones EARTH-FIO y 12300-3 presentan flores blancas y cápsulas de color verde, mientras que el resto de los materiales presentan flores rosadas y cápsulas rojas, amarillas o cápsulas de color intermedio entre rojo y verde. El color de la cápsula tiene relevancia porque existe una alta correlación estadística entre el color de la cápsula y la susceptibilidad a plagas y enfermedades, los frutos con coloración roja y café tienen un mayor grado de susceptibilidad a Oidium spp., por otra parte, frutos de color verde y café son susceptibles al ataque de Leptoglossus zonatus (Arce Portuguez 1984).

Figura 1 Diferencias fenotípicas entre las accesiones del Banco de Germoplasma de Achiote de la Universidad EARTH.
Las variables morfológicas asociadas a la forma de la cápsula y semilla muestran diferencias fenotípicas marcadas (Tabla 3), estas características morfológicas están relacionadas con el volumen y cantidad de semillas que puede albergar un material en sus cápsulas, esto influye directamente en el rendimiento del cultivar. Adicionalmente, la presencia de espinas determina la facilidad para el manejo postcosecha de las cápsulas, donde los cultivares glabros son los deseados, para tener un proceso postcosecha más limpio. Una de las características deseadas en cultivares comerciales es la indehiscencia al punto de madurez comercial para reducir la degradación de la bixina por fotooxidación.
Tabla 3 Variables fenotípicas de las distintas accesiones del Banco de Germoplasma de Achiote de la Universidad EARTH.
| Accesión | Grado de espinosidad | Longitud de espinas | Forma del fruto | Tamaño de cápsula | Tamaño de hoja | Hábito de crecimiento | Susceptibilidad a plagas | Visibilidad de panículas |
| EARTH-1 | Alto | Largas | Ovoide | Mediano | Mediano | Ovoide | Poca | Intermedia |
| EARTH-FIO | Sin espinas | Muy cortas | Cónica | Muy pequeño | Muy pequeño | Redondeado | Alta | Alta |
| 10707-1 | Alto | Largas | Ovoide | Mediano | Mediano | Redondeado | Intermedia | Alta |
| 10707-2 | Bajo | Cortas | Cónica | Mediano | Mediano | Redondeado | Poca | Poca |
| 10707-3 | Muy alto | Largas | Ovoide | Mediano | Mediano | Ovoide | Intermedia | Alta |
| 10752-1 | Muy alto | Largas | Ovoide | Mediano | Mediano | Achatado | Poca | Intermedia |
| 10752-2 | Muy alto | Largas | Ovoide | Pequeño | Mediano | Piramidal | Intermedia | Alta |
| 11395-2 | Sin espinas | Muy cortas | Cónica | Pequeño | Mediano | Ovoide | Intermedia | Alta |
| 11549-2 | Sin espinas | Muy cortas | Cónica | Pequeño | Muy pequeño | Piramidal | Poca | Poca |
| 11549-4 | Alto | Cortas | Cónica | Pequeño | Pequeño | Ovoide | Poca | Poca |
| 11646-2 | Bajo | Largas | Ovoide | Mediano | Mediano | Redondeado | Intermedia | Intermedia |
| 12300-3 | Alto | Largas | Cónica | Grande | Mediano | Piramidal | Intermedia | Alta |
| 12883-2 | Muy alto | Muy largas | Hemisférica | Pequeño | Mediano | Achatado | Alta | Poca |
| 12887-1 | Muy alto | Muy largas | Ovoide | Mediano | Mediano | Redondeado | Alta | Alta |
| 12891-1 | Alto | Cortas | Hemisférica | Grande | Grande | Achatado | Alta | Intermedia |
| 6112-2 | Bajo | Largas | Ovoide | Mediano | Mediano | Piramidal | Poca | Alta |
| 9931-1 | Muy alto | Largas | Ovoide | Muy grande | Mediano | Redondeado | Intermedia | Intermedia |
| 9932-2 | Muy alto | Largas | Ovoide | Pequeño | Mediano | Redondeado | Intermedia | Intermedia |
En la mayoría de los casos, las accesiones que presentaron una mayor resistencia a plagas y enfermedades fueron las que no tenían espinas o que poseían un grado de espinosidad bajo o bien que presentaban espinas cortas. Por otra parte, las más susceptibles eran las que presentaban alto grado de espinosidad y espinas largas. Estos resultados concuerdan con los obtenidos por Arce Portuguez (1984) quien encontró que materiales de achiote con pocas espinas o con ausencia de ellas presentaban mayor resistencia al ataque de Leptoglossus zonatus y Lepidópteros, esto puede relacionarse con la mayor consistencia y grosor de la epidermis de la cápsula en materiales sin espinas. De igual forma accesiones como la 12891-1 con una arquitectura de planta achatada que permite poca ventilación y con hojas grandes propicia el incremento de sombra y esto favorece el desarrollo de Oidium spp.
Se presenta una amplia variabilidad genética en cuanto a las variables relacionadas al rendimiento de las accesiones (Figura 2), se tienen unas con características contrastantes, por ejemplo la accesión 11549-2 presenta valores menores para las variables número de panículas por planta (menor a 100) y número de cápsulas por panícula (menor a 10), sin embargo, posee valores más altos para las variables número de semillas por cápsula (entre 20 semillas y 50 semillas), peso de 100 semillas (3 g a 4 g) y contenido de bixina (4% a 7%), por lo que el banco de germoplasma representa una fuente de alelos para poder iniciar con programas de mejoramiento genético y proyectos de investigación acerca de la genética de la especie.
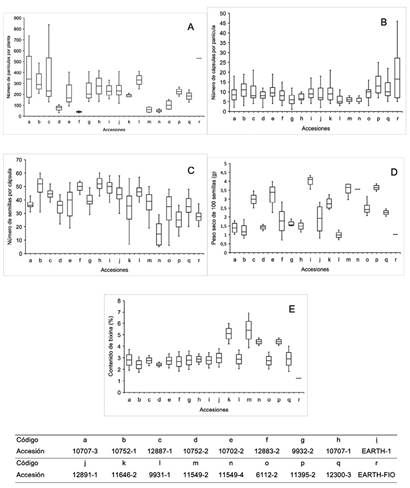
Figura 2 Diferencias fenotípicas del banco de germoplasma de la Universidad EARTH para las variables: A. Número de panículas por planta. B. Número de cápsulas por panícula. C. Número de semillas por cápsula. D. Peso seco de 100 semillas (g) E. Contenido de bixina (%).
Análisis de datos moleculares. Al analizar la tipología del dendrograma del Banco de Germoplasma de Achiote de la Universidad EARTH obtenido a partir de las secuencias de la región ITS2 (Figura 3A), es posible observar que las accesiones se agrupan en 5 clados, los cuales conservan una similitud interna con base en características fenotípicas, como grado de espinosidad y longitud de las espinas de la cápsula; en cuanto al color de las cápsulas no es notable ningún patrón de agrupación debido a que en los diferentes grupos se observó una variación de colores verde, rojo y amarillo y algunas como la 10707-3, 12883-2, 10752-2 y la 12891-1 con colores intermedios entre verde y rojo, por lo que se puede considerar una posible recombinación genética si se toma en cuenta que las accesiones fueron establecidas por semilla y que el achiote es una especie alógama.
Por su parte, el dendrograma MP condensado al 50% de la región ITS2, el cual elimina los clados con menor soporte estadístico y se enfatiza en regiones más confiables de los patrones de ramificación, lo que hace una diferenciación de las accesiones en 2 grupos filogenéticos con base en la presencia o ausencia de espinosidad (Figura 3B), donde las 11549-2, 11395-2 y EARTH-FIO son las que carecen de espinas, mientras que las otras 15 accesiones presentaron espinas. Adicionalmente se podrían analizar otras regiones del genoma a partir del ADN del cloroplasto como las regiones ndhF and trnL-F, ya que este al ser heredado de la madre, puede proporcionar secuencias de genes específicos o regiones intergénicas que son filogenéticamente informativas (Akiyama et al. 2011) y de esta forma fortalecer las relaciones entre cultivares del mismo linaje, y por tanto facilitar el estudio de relaciones de parentesco entre cultivares.
Hay que tomar en cuenta que las accesiones provienen del Banco de Germoplasma del CATIE y es posible evidenciar recombinación genética en características fenotípicas como el color de las cápsulas, que según Dequigiovanni et al. (2018) encontraron una alta correlación entre la distancia genética y distancia geográfica entre 10 poblaciones silvestres de achiote en el Amazonas, lo cual en ese estudio sugiere que la diferenciación genética se debe a la distancia geográfica.
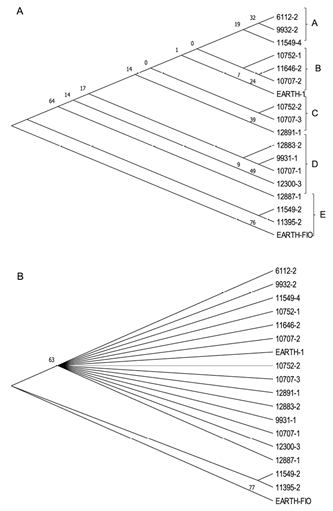
Figura 3 A. Dendrograma Maximum Parsimony (MP) de la región ITS2 del Banco de Germoplasma de Achiote de la Universidad EARTH. B. Dendrograma MP condensado al 50% de la región ITS2 para las 18 accesiones del Banco de Germoplasma de Achiote de la Universidad EARTH.
En este estudio no se encontró una asociación concluyente entre la distancia geográfica y la distancia genética de los cultivares.
Relación entre rasgos fenotípicos y datos moleculares. En cuanto a la relación entre los grupos filogenéticos (Figura 3A) y las variables cuantitativas, se evidenció que existe una relación entre los grupos filogenéticos con los rasgos morfológicos de las accesiones que conforman dichos grupos. Para la variable número de panículas por planta el grupo filogenético que presenta mayores resultados es el compuesto por las accesiones 10752-1, 11646-2, 10707-2 y EARTH-1 (Figura 4A). En el caso de la variable número de cápsulas por panícula fueron las 11549-2, 11395-2 y EARTH-FIO las que presentaron mayor media (Figura 4B). Esos resultados se deben a que en las accesiones previamente mencionadas, se observaron altos niveles de floración. La variable número de semillas por cápsula, fueron las 12883-2, 9931-1, 10707-1, 12300-3 y 12887-1 las que presentaron mayor media (Figura 4C). Estos resultados están relacionados a que esas accesiones presentan un tamaño de cápsula grande y semillas pequeñas, lo que concuerda con los resultados obtenidos por Medina et al. (2001) quienes asocian el mayor número de semillas con un mayor tamaño de cápsula. Para la variable peso seco de 100 semillas fueron las 11549-2, 11395-2 y EARTH-FIO las que presentaron mayores resultados (Figura 4D). Este grupo presentó cápsulas pequeñas, sus semillas son más grandes y por ende registran un mayor peso. Del mismo modo para la variable contenido de bixina fueron las 11549-2, 11395-2 y EARTH-FIO las que presentaron resultados más altos (Figura 4E), también es importante destacar que fue posible observar que son las accesiones sin espinas las que poseen un mayor peso de semilla y un mayor contenido de bixina (11549-2, 11395-2 y EARTH-FIO) esto puede estar relacionado con la presión de selección que se ha realizado hacia materiales cultivables con altos contenido de bixina y sin presencia de espinas que faciliten el proceso postcosecha, Ambrosio et al. (2015) mencionan que la especie no cultivada Bixa urucurana, el ancestro más cercano a Bixa orellana cuenta con espinosidad en la cápsula en ese estudio encontraron altos contenidos de bixina en poblaciones de achiote silvestre cercanas a áreas de cultivo de achiote, lo que sugiere un fuerte flujo de genes e introgresiones entre poblaciones silvestres y cultivadas.
En general el banco de germoplasma cuenta con diferentes materiales que presentan rasgos fenotípicos contrastantes por lo que este estudio sirve como base para poder iniciar con programas de mejora del cultivo,
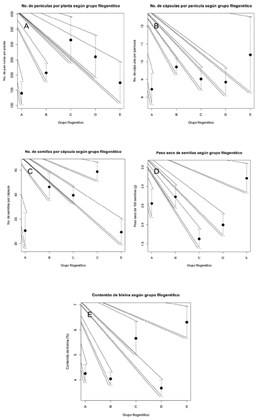
Figura 4 Relación entre grupos filogenéticos y las variables: A. Número de panículas por planta. B. Número de cápsulas por panícula. C. Número de semillas por cápsula. D. Peso seco de 100 semillas (g) E. Contenido de bixina.
Análisis de autopolinizaciones. Los resultados de los ensayos de autopolinización mostraron en promedio 33,33% de fecundación del total de 72 autopolinizaciones realizadas en 17 accesiones de achiote. En 4 (11395-2, 11646-2, 12300-3 y 6112-2) no fue posible obtener ninguna autofecundación con éxito, a pesar de ser en las que más se realizaron ensayos (Tabla 4) lo que se puede relacionar con una autoincompatibilidad genética, pues es conocido que el achiote es una especie alógama con tasas de polinización cruzada de 57% y tasas de autopolinización de 37,5% (Rivera y Flores 1988).
Tabla 4 Resultados de las autopolinizaciones realizadas y fecundación obtenida en las accesiones del Banco de Germoplasma de Achiote de la Universidad EARTH.
| Accesión | Autopolinizaciones realizadas | Autofecundaciones | Porcentaje de autofecundación |
| 10707-1 | 2 | 2 | 100,00 |
| 10707-2 | 5 | 3 | 60,00 |
| 10752-1 | 2 | 2 | 100,00 |
| 11395-2 | 9 | 0 | 0,00 |
| 11549-2 | 6 | 1 | 16,67 |
| 11549-4 | 1 | 0 | 0,00 |
| 11646-2 | 9 | 0 | 0,00 |
| 12300-3 | 10 | 0 | 0,00 |
| 12887-1 | 2 | 2 | 100,00 |
| 12891-1 | 4 | 3 | 75,00 |
| 6112-2 | 6 | 0 | 0,00 |
| 9931-1 | 5 | 4 | 80,00 |
| EARTH-1 | 5 | 3 | 60,00 |
| 12883-2 | 1 | 1 | 100,00 |
| 10707-3 | 1 | 1 | 100,00 |
| 10752-2 | 1 | 1 | 100,00 |
| EARTH-FIO | 3 | 1 | 33,33 |
| Total | 72 | 24 | 33,33 |
Una estrategia de las plantas alógamas para evitar la endogamia es la autoincompatibilidad genética, esta puede darse de distintas formas, que a nivel enzimático no exista compatibilidad entre el polen y el estigma, de modo que no se permita la emergencia del tubo polínico, también puede ser autoincompatibilidad de acción tardía y en esta puede ocurrir la penetración del tubo polínico, la descarga de gametos masculinos en sacos embrionarios e incluso la fertilización, pero de una u otra forma la embriogénesis no continuará (Seavey y Bawa 1986).
En las accesiones 11395-2, 11646-2, 12300-3 y 6112-2 que no fue posible obtener cápsula por esta vía; se observaron señales de posible fecundación durante la primera semana, pero, luego de este tiempo las cápsulas abortaban, esto puede ser un indicador de autoincompatibilidad de acción tardía en estos genotipos. Varios autores en los últimos años han presentado resultados acerca de sistemas de autoincompatibilidad de acción tardía en distintas familias como Bignoniaceae, Bombacaceae y Amarallydaceae (Bittencourt et al. 2003, Gibbs et al. 2004, Vaughton et al. 2010).
Conclusiones
El presente estudio permitió determinar la amplia variabilidad genética del Banco de Germoplasma de la Universidad EARTH aspecto que facilitó el análisis de las relaciones filogenéticas entre las 18 accesiones. Se logró observar un patrón de agrupamiento que guarda relación con la característica fenotípica espinosidad de la cápsula y además se observaron signos de recombinación genética entre los cultivares. Las accesiones sin espinas en la cápsula presentaron mayor peso seco de semillas y el contenido de bixina más alto. Adicionalmente se identificó que las que tenían espinas en su fruto presentaron un número superior de semillas por cápsula, por lo que basados en este estudio, una identificación genotípica de materiales en estados tempranos sería un factor influyente para el aumento de la productividad en las plantaciones comerciales. Este proyecto estableció una primera fase encaminada hacia la obtención de líneas homocigotas, para la conservación de la identidad genética de los cultivares de achiote como fuente de alelos en futuros programas de fitomejoramiento.















