Introducción
Los macroinvertebrados acuáticos (MIA) son uno de los grupos más representativos en los ríos y su estructura y distribución puede estar mediada por procesos bióticos como la interacción por depredación, parasitismo o competencia (Molina, Gibon, Pinto, & Rosales, 2008; Ferru & Fierro, 2015; Roldán-Pérez, 2016). Además, existen procesos y factores abióticos que determinan la abundancia y distribución de los invertebrados en los ríos (Fonnesu, Sabetta & Basset, 2005; Harinkhede & Manekar, 2016). En este aspecto, las propiedades físicas y químicas del agua pueden influir en la presencia de determinados grupos, dependiendo de la sensibilidad del organismo ante una o varias variables (Kail, Arle, & Jähnig, 2012). Por ejemplo, la concentración de oxígeno disuelto y la demanda biológica de oxígeno, puede condicionar la presencia o ausencia de macroinvertebrados acuáticos (Kubendran & Ramesh, 2016). La variación en el caudal es otro componente que cambia la distribución y abundancia de los macroinvertebrados acuáticos. Así, ante disminuciones del caudal se da un aumento de organismos que toleran bajas concentraciones de oxígeno y altas temperaturas (Extence et al. 1999). Con el aumento del caudal y el consecuente aumento en las velocidades y del oxígeno disuelto, se favorecen a aquellas especies que están adaptadas a altas velocidades y mayor fuerza de arrastre (Horrigan & Baird, 2008).
Las variaciones en las características fisicoquímicas e hidrológicas de un río son más marcadas cuando hay presencia de una actividad humana, por ejemplo, la agricultura, el urbanismo, la minería y las represas, las cuales ponen en riesgo a la integridad ecológica (Vörösmarty et al., 2010). No obstante, los cambios ambientales también proceden de manera natural producto de la escorrentía y las variaciones en el caudal (Allan & Castillo, 2007). De esta forma, dependiendo de la región, las variaciones se pueden dar de forma diaria y marcada en los ríos tropicales y van a depender ya sea por el deshielo de glaciares o por precipitaciones intermitentes, provocando cambios constantes en la estructura de los ensamblajes acuáticos (Syvitski, Cohen, Kettner & Brakenridge, 2014; Cauvy-Fraunié et al., 2016).
La relación entre los macroinvertebrados acuáticos con variables fisicoquímicas e hidrogeomorfológicas, ha permitido utilizarlos como indicadores de la condición de los sistemas acuáticos (Appalasamy, Arumugam, Sukri, & Rak, 2018; Mengzhen, et al. 2014; Sefick, Kosnicki, Paller, & Feminella, 2018). Por ejemplo, en Costa Rica, los estudios relacionados con estos organismos y su rol como bioindicadores han aumentado recientemente en programas de monitoreo de la calidad biológica del agua (Springer, 2019). Sin embargo, se desconoce en gran parte de los ríos, las variaciones en la distribución y abundancia de los macroinvertebrados acuáticos producto de las transiciones anuales y consecuentes variaciones en características fisicoquímicas e hidrológicas, que no procedan de actividades antropogénicas.
Los objetivos de este estudio fueron: 1) estudiar el cambio del ensamblaje de macroinvertebrados acuáticos en dos sitios dentro del cauce del Río Naranjo, durante los cuatro periodos hidrológicos del año; y 2) determinar la relación entre las variables fisicoquímicas, sustrato y el caudal con el ensamblaje de MIA. Nuestra hipótesis fue que, los cambios en las variables fisicoquímicas e hidrológicas al pasar de una estación climática a otra alteran la composición del ensamblaje de MIA. Con la predicción de una disminución en la abundancia al pasar de un periodo a otro y al variar los parámetros fisicoquímicos e hidrológicos. Contribuyendo a entender la variación de los MIA en el Río Naranjo, como línea base para trabajos de manejo de cuencas y posibles afectaciones por aprovechamiento del recurso hídrico o cambio del uso del suelo aguas arriba o en las cercanías.
Materiales y métodos
Para este trabajo se seleccionó la cuenca del Río Naranjo, ubicada en la vertiente del Pacífico Central de Costa Rica. Esta cuenca posee una red de drenaje de 323.39 km2, lo que corresponde a un 0.63% de la superficie nacional (Proyecto de Ley 20-098, 2018). La cuenca cuenta con poca intervención antrópica, la principal actividad a su alrededor es agrícola y no existen represas hidroeléctricas (según El Sistema Nacional de Información para la Gestión Integrada del Recurso Hídrico, del Ministerio de Ambiente y Energía de Costa Rica), lo cual le confiere el carácter de una cuenca de referencia.
Se realizaron un total de diez muestreos, hasta completar un ciclo anual donde se evaluaron los cuatro periodos hidrológicos del año (seco, lluvioso, transiciones de seco a lluvioso y de lluvioso a seco (no hubo muestreo en el mes de julio 2017 debido a un robo en el equipo y en el mes de octubre 2017 debido a la tormenta Nate). Se seleccionaron dos sitios de muestreo ambos en un tramo no mayor a los 100 metros, el primero denominado N1 (9.5120778, -84.0334194) ubicado en la cuenca media-baja a 100 m.s.n.m. y un segundo sitio, denominado N2 (9.4629111, -84.0679361), en la cuenca media a 620 m.s.n.m; ambos dentro del cauce principal del Río Naranjo (Fig. 1). El primer sitio, se caracteriza por la presencia de sistemas tipo rápidos moderados y pozas; el sustrato está dominado por cantos rodados y grava, hay contacto del cuerpo de agua con la vegetación de ribera, la cual está conformada por árboles dispersos y gramíneas. En el segundo sitio, N2, tiene mayor pendiente, predominando los sistemas tipo rápidos turbulentos, con dominancia de sustratos tipo canto rodado y roca, ambas márgenes se encuentran cubiertas con árboles y arbustos.
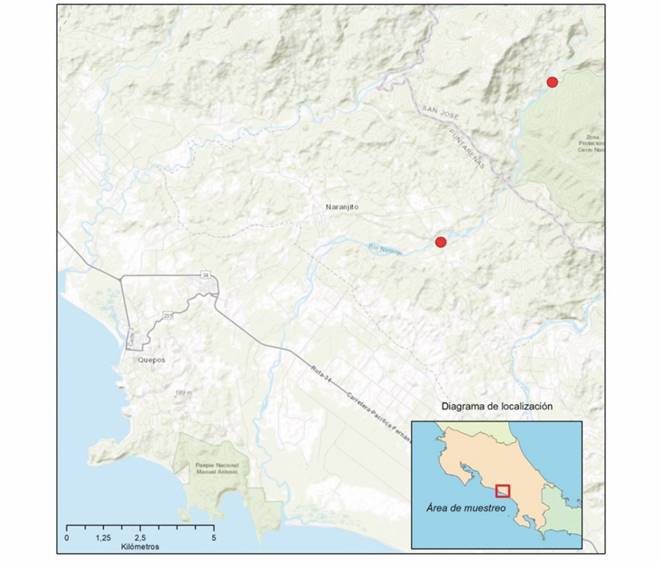
Fig. 1 Fig. 1 Zona de estudio, en el cauce principal del río Naranjo, Quepos, Costa Rica, 2017-2018. Study zone, in the main channel of the Naranjo River, Quepos, Costa Rica, 2017-2018.
En cada sitio de muestreo y por mes se recolectaron un total de diez muestras (diez réplicas por sitio), las cuales se muestrearon de manera aleatoria, de esta forma, en periodo seco y en transición de seco a lluvioso, se iniciaba en el margen izquierdo y se finalizaba en el margen derecho, mientras que en el periodo lluvioso y de transición lluvioso a seco, se iniciaba en el margen izquierdo y se iba ingresando de manera transversal al río, hasta donde se pudiera muestrear debido al aumento de caudal y corriente. De no completar las diez muestras de manera transversal, se procedía a subir o bajar como mínimo 10 metros de manera longitudinal al río y nuevamente, se ingresaba de manera transversal.
En cada microhábitat (muestra) se sumergió un velocímetro marca Global Water, se determinaba la velocidad (al 60% del fondo) y profundidad del agua. Seguidamente, se introdujo una red D de 500 micras de abertura de malla, 30 cm de ancho y 27 cm de alto, se removía el sustrato frente a la red por 35 segundos, para que los organismos fueran arrastrados y atrapados en la red. El material atrapado se depositó en una bolsa plástica debidamente rotulada con el número de microhábitat y así sucesivamente para cada réplica. El material se preservó con etanol al 85%, para su posterior separación e identificación taxonómica en el laboratorio. De igual forma en cada microhábitat evaluado se obtuvieron los valores de pH, temperatura (°C), oxígeno disuelto (mg/l) y el porcentaje de cada tipo de sustrato, catalogado como roca, canto rodado, grava, arena, limo (siguiendo la clasificación de American Geophysical Union, 2016) y los paquetes de hojas los cuales fueron clasificados como un tipo de sustrato.
En cada sitio de muestreo (una vez finalizado el muestreo de macroinvertebrados) se recolectó una muestra de agua en una botella color ámbar de 500 ml, para análisis de nitritos, nitratos, amonio, fosfatos y silicatos, que fue trasladada con hielo al laboratorio químico del Centro de Investigación en Ciencias del Mar y Limnología (CIMAR) de la Universidad de Costa Rica, mientras que, la conductividad eléctrica se midió en el campo. Los valores de nitritos, nitratos, fosfatos, silicatos y amonio se obtuvieron a través de un autoanalizador de flujo continuo marca Lachat, Modelo QuickChem 8500. El caudal del río en el momento preciso del muestreo fue obtenido a través de estaciones hidrológicas automáticas y los datos fueron brindados por el Instituto Costarricense de Electricidad (ICE).
Los macroinvertebrados acuáticos recolectados fueron identificados al menor nivel taxonómico posible, en su mayoría a género, con excepción del grupo Hidrachnidia, por medio de las claves taxonómicas: Contreras & Harris (1998), Roldán (1998), Manzo & Archangelsky (2008), Flowers & De la Rosa (2010), Ramírez (2010) y Springer (2010). Los organismos fueron depositados en la colección de Entomología Acuática del Museo de Zoología de la Universidad de Costa Rica (MZUCR).
Análisis estadístico: Para determinar diferencia de la abundancia de macroinvertebrados acuáticos por periodo hidrológico del año y entre los dos sitios, se realizó un PERMANOVA de dos vías, con distancia euclidiana. Previo al análisis se evaluó la normalidad de la abundancia y las variables ambientales. Dado que ninguna presentó normalidad se procedió a realizar pruebas no paramétricas. Con el paquete Vegan (Oksanen, 2019), se realizó un análisis de correspondencia canónica (ACC), para determinar asociaciones entre la estructura de la comunidad (géneros de macroinvertebrados acuáticos) y las variables ambientales: velocidad, profundidad, temperatura, nitritos, nitratos, fosfatos, silicatos, amonio, conductividad, tipo de sustrato y caudal (m3/s). En el análisis ACC se utilizaron variables ambientales no correlacionadas, lo cual se evaluó con el paquete ggcorrplot (Kassambara, 2019). Antes de realizar el análisis se transformó a escala logarítmica las variables, caudal, silicatos y conductividad con el fin de estandarizarlas con el resto de las variables. Seguidamente con las variables de mayor peso se aplicó una prueba de Spearman para determinar su grado de relación (positivo o negativo) y los valores de la misma fueron graficados en un mapa de calor, a través del paquete ggplot2 (Wickham, 2016). Todas las pruebas se realizaron a través del software R (R Core Team, 2019).
Resultados
Los valores más altos de fosfatos, silicatos, amonio, nitratos y de caudal se registraron durante los meses con mayores precipitaciones (Tabla 1). Únicamente los nitritos registraron su mayor concentración en el segundo muestreo correspondiente al periodo seco. La velocidad mínima y máxima registrada respectivamente en el sitio N1 fue de 0 m/s y 2.0 m/s, y en el N2 fue de 0 y 2.1m/s. El valor de oxígeno disuelto varió entre 6.8 mg/l y 8.8 mg/l en ambos sitios (Tabla 1).
TABLA 1 TABLE 1 Valores de las variables fisicoquímicas, caudal y temperatura de los sitios de muestreo en la cuenca del Río Naranjo, 2017-2018. S = sitio, Q= Caudal, C= Seco, T = Transición, L= Lluvioso, Inc=Incertidumbre, nq= no cuantificable, nd= no detectable Values of the physicochemical variables, water flow and temperature of the sampling sites in the Naranjo River basin, 2017-2018 S = site, Q= Flow, C= Dry, T= Transition, L= Rainy, Inc= Uncertainty, nq= not quantifiable, nd= not detectable
| Mes | S | Fosfatos (µmol/L) | Inc ± | Silicatos (µmol/L) | Inc ± | Amonio (µmol/L) | Inc ± | Nitritos (µmol/L) | Inc ± | Nitratos (µmol/L) | Inc ± | Q (m3/s) | Cº |
| Enero 2017 | N1 | 0.47 | 0.12 | 121.5 | 1.27 | 5.22 | 0.22 | nd | 0.4 | 1.5 | 0.37 | 8.94 | 25.37 |
| (C) | N2 | 0.18 | 0.12 | 117.75 | 1.24 | 3.92 | 0.22 | nd | 0.4 | 2.76 | 0.36 | 8.16 | 21.5 |
| Febrero | N1 | 0.54 | 0.12 | 120.75 | 1.27 | 2.72 | 0.22 | nd | 0.4 | 1.74 | 0.37 | 13.86 | 26.35 |
| (C) | N2 | nq | 0.12 | 120.9 | 1.27 | 2.83 | 0.22 | 4.15 | 0.4 | nd | 0.36 | 13.3 | 21.09 |
| Marzo | N1 | 0.22 | 0.12 | 120.03 | 1.27 | 8.24 | 0.22 | nd | 0.4 | 0.63 | 0.37 | 9.65 | 25.5 |
| (C) | N2 | 0.25 | 0.12 | 120.39 | 1.27 | 3.6 | 0.22 | nd | 0.4 | 2.68 | 0.37 | 6.99 | 21.59 |
| Abril | N1 | 0.28 | 0.12 | 112.78 | 1.27 | 3.53 | 0.22 | nd | 0.4 | 1.58 | 0.37 | 17.5 | 24.84 |
| (C) | N2 | 0.29 | 0.12 | 118.39 | 1.27 | 3.67 | 0.22 | nd | 0.4 | 0.71 | 0.37 | 16.8 | 21.97 |
| Mayo | N1 | 0.54 | 0.12 | 115.42 | 1.27 | 4.41 | 0.22 | nd | 0.4 | 3.39 | 0.37 | 27.9 | 23.9 |
| (T) | N2 | 0.48 | 0.12 | 118.73 | 1.27 | 5.11 | 0.22 | nd | 0.4 | 3.77 | 0.37 | 27.7 | 22.88 |
| Junio | N1 | 0.74 | 0.12 | 80.19 | 1.27 | 4.02 | 0.22 | 0.88 | 0.4 | 3.3 | 0.37 | 19.25 | 22.91 |
| (L) | |||||||||||||
| Agosto | N1 | 0.74 | 0.12 | 120.2 | 1.27 | 4.27 | 0.22 | 0.93 | 0.4 | 1.77 | 0.37 | 41.5 | 23.12 |
| (L) | N2 | 0.7 | 0.12 | 86.81 | 1.27 | 3.85 | 0.22 | 0.64 | 0.4 | 3.97 | 0.37 | 38 | 21.3 |
| Setiembre | N1 | 1.04 | 0.12 | 102.41 | 1.27 | 5.43 | 0.22 | 1.23 | 0.4 | 2.79 | 0.37 | 42.8 | 22.9 |
| (L) | N2 | 1.04 | 0.12 | 116.72 | 1.27 | 5.85 | 0.22 | 1.42 | 0.4 | 3.73 | 0.37 | 41.5 | 21.7 |
| Octubre | N1 | 1.05 | 0.12 | 104.86 | 1.27 | 5.29 | 0.22 | nq | 0.4 | 4.64 | 0.37 | 27.3 | 22.9 |
| (L) | N2 | 0.66 | 0.12 | 94.51 | 1.27 | 3.81 | 0.22 | nd | 0.4 | 5.9 | 0.37 | 26.8 | 21.7 |
| Noviembre | N1 | nq | 0.12 | 120.47 | 1.27 | 4.41 | 0.22 | nd | 0.4 | 4.1 | 0.37 | − | 19.2 |
| (T) | N2 | 0.31 | 0.12 | 120.81 | 1.27 | 5.43 | 0.22 | nd | 0.4 | 3.26 | 0.37 | − | 19.67 |
| Enero 2018 (S) | N1 | nq | 0.12 | 120.48 | 1.27 | 4.41 | 0.22 | nd | 0.4 | 4.1 | 0.35 | 9.5 | 21.7 |
Entre los dos sitios muestreados, se evaluaron un total de 230 muestras y se identificaron 7 742 organismos, en 75 géneros, 38 familias y 11 órdenes de macroinvertebrados acuáticos; siendo el género Camelobaetidius sp. (Ephemeroptera: Baetidae) el más abundante en ambos sitios. De igual forma, la familia Baetidae (12 géneros) y el orden Ephemeroptera, (20 géneros) presentaron la mayor riqueza taxonómica (Fig. 2 C y Fig. 2 D). En cuanto a la abundancia por orden, se observó que los más abundantes en ambos sitios fueron Ephemeroptera, Trichoptera y Diptera (Fig. 2 A y Fig. 2 B). Únicamente en el sitio N1 se registró al orden Decapoda, mientras que, el resto de los órdenes se encontraron en ambos sitios.
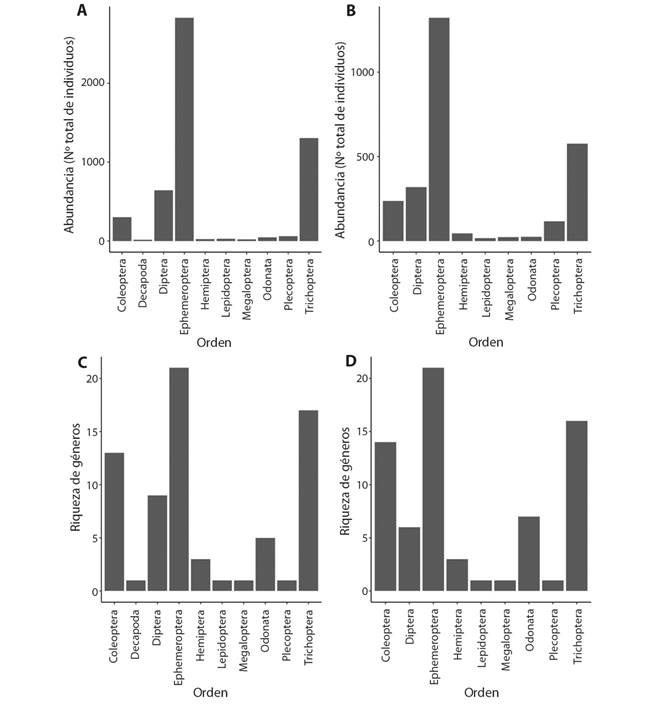
Fig. 2 Fig. 2 Abundancia y riqueza de géneros por orden de macroinvertebrados acuáticos, A) Abundancia de macroinvertebrados acuáticos en el sitio N1; B) Abundancia de macroinvertebrados en el sitio N2; C) Riqueza de macroinvertebrados acuáticos en el sitio N1; C) Riqueza de macroinvertebrados acuáticos en el sitio N2, Río Naranjo, Costa Rica, 2017-2018. Abundance and richness of genera by order of aquatic macroinvertebrates, A) Aquatic macroinvertebrate abundance in the site N1; B) Aquatic macroinvertebrate abundance in the site N2; C) Aquatic macroinvertebrate richness in the site N1; D) Aquatic macroinvertebrate richness in the site N2, Naranjo River, Costa Rica, 2017-2018.
Para ambos sitios de muestreo, la abundancia de macroinvertebrados acuáticos varió según el periodo del año, de esta forma, se observó una mayor abundancia durante el periodo seco, mientras que, durante la transición de seco a lluvioso, se registró la menor abundancia de organismos (PERMANOVA, F=174.989; p=0.001; Fig. 1). Además, no hubo diferencia significativa en la abundancia de macroinvertebrados acuáticos entre los sitios (PERMANOVA, F= 2.1547; p=0.07) (Fig. 3).
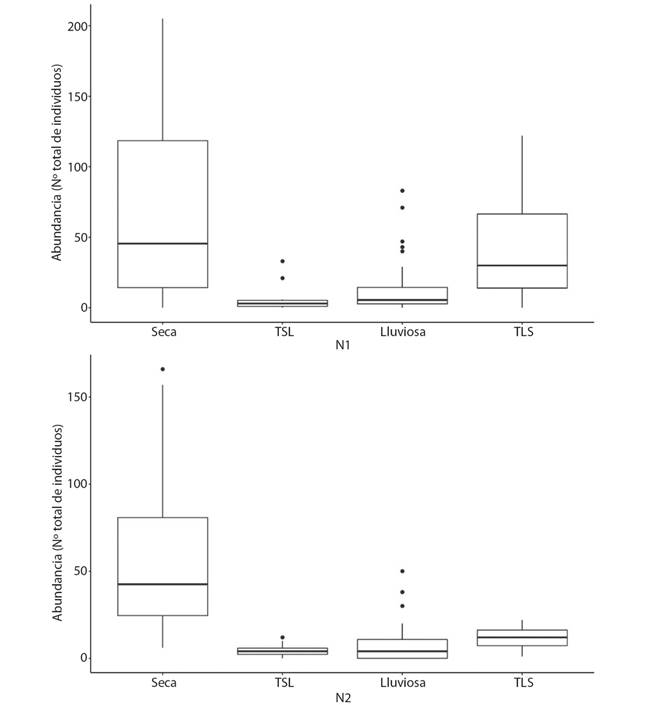
Fig. 3 Fig. 3 Abundancia de macroinvertebrados acuáticos registrada en los cuatro periodos del año, en los dos sitios de muestreo en el río Naranjo, Costa Rica, 2017-2018, TSL: transición seca a lluviosa; TLS: transición lluviosa a seca. Aquatic macroinvertebrate abundance in the four periods of the year, in the two sampling sites in the Naranjo River, Costa Rica, 2017-2018, TSL: dry to wet transition; TLS: wet to dry transition.
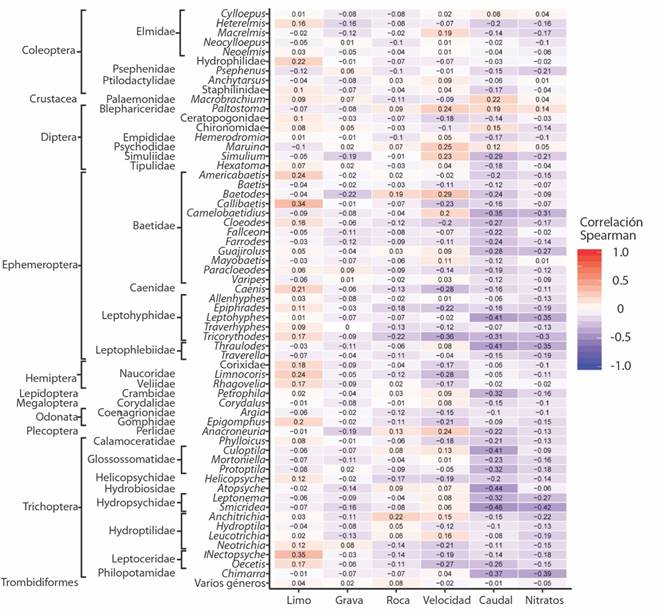
El ACC indicó que la varianza entre las variables ambientales y biológicas puede ser explicada por los 2 primeros ejes en un 65%. El primer eje presentó una relación positiva con el sustrato limo (0.45) y la arena (0.39) y negativa para las variables velocidad del agua (0.87) y el sustrato roca (-0.37). El segundo eje mostró una relación positiva con el caudal (0.79) y los nitratos (0.58) y negativa para el sustrato canto rodado (-0.41). De esta forma y como ejemplo, algunos organismos tales como Paltostoma sp. (Diptera: Blephariceridae), Limonia sp. (Diptera: Tipulidae) y Maruina sp. (Diptera: Psychodidae), presentaron una relación con las variables caudal y los nitratos. Los géneros Callibaetis sp. y Paracloeodes sp. (Ephemeroptera: Baetidae), Epigomphus sp. (Odonata: Gomphidae) y Hetaerina sp. (Odonota:Calopterygidae) tienen afinidad por los sustratos grava, limo y arena. Se observó una relación con la velocidad del agua en los géneros Simulium sp. (Diptera: Simuliidae) y Anacroneuria sp. (Plecoptera: Perlidae) (Fig. 4).
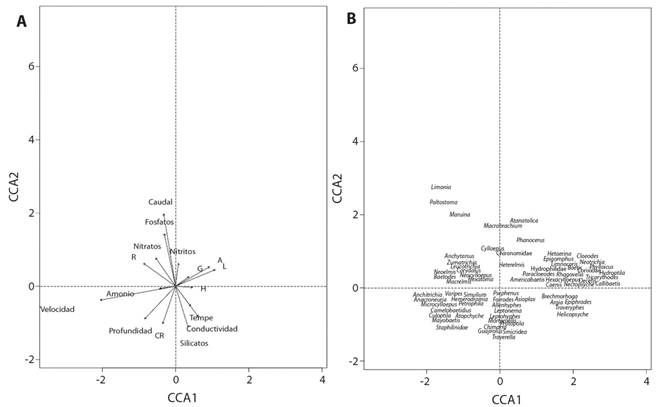
Fig. 4 Fig. 4 Ordenación construida por el análisis de correspondencia canónica para los dos sitios de muestreo, A) ordenación de las variables físico, químicas e hidrológicas, B) ordenación de los géneros de macroinvertebrados acuáticos, Río Naranjo, Costa Rica, 2017-2018. Ordination plots constructed by canonical correspondence analysis for the two sampling places, A) Ordination of the physical, chemical and hydrological variables, B) ordination of the aquatic macroinvertebrates genera, Naranjo River, Costa Rica, 2017-2018.
La mayoría de los géneros presentaron una tendencia negativa ante un incremento del caudal y de los nitratos según la prueba de Spearman, únicamente los géneros Macrobrachium sp. (Decapoda: Palaemonidae), Paltostoma sp., Maruina sp. y la familia Chironomidae (Diptera) respondieron de manera positiva (aunque con una relación débil) al aumento del caudal. Aumentos en la velocidad del agua y del sustrato roca generan una tendencia positiva (aunque débil) para el género Baetodes sp. (Ephemeroptera: Baetidae). Mientras que géneros como Callibaetis sp., Americabaetis sp. (Epehemeroptera: Baetidae), Nectopsyche sp. (Trichoptera: Leptoceridae) y la familia Hydrophilidae (Coleoptera), respondieron de manera positiva ante aumentos del sustrato limo (Fig. 5).
Discusión
El presente estudio evidencia las variaciones en los ensamblajes de macroinvertebrados acuáticos durante los cuatro periodos del año, así como en las condiciones fisicoquímicas e hidrológicas en el Río Naranjo. Independientemente del período, el orden Ephemeroptera fue el más abundante. El cambio en el caudal del río pudo ser el principal factor en la disminución en la abundancia de macroinvertebrados acuáticos debido a que la mayoría de los organismos respondieron de manera negativa ante el aumento del volumen de agua.
La alta abundancia del orden Ephemeroptera en ambos sitios puede deberse a que es uno de los órdenes acuáticos con mayor cantidad de familias y géneros, logrando colonizar los distintos hábitats que se originan en el río (Suhaila, Che & Nurul, 2014). Además, la abundancia del género Camelobaetidius sp. puede deberse a que este es generalista en la selección del hábitat y ante cambios en las condiciones fisicoquímicas (Forero-Céspedes, Gutiérrez, & Reinoso-Flórez, 2016). En el caso del orden Trichoptera, su representatividad en el Río Naranjo, se debió a las larvas de los géneros Leptonema sp. y Smicridea sp. (Hydropsychidae), los cuales por su capacidad de construir refugios en sustratos como piedras, roca, grava y macrófitas les permite colonizar una mayor variedad de hábitats (Serna, Tamaris-Turizo & Gutiérrez, 2015; Springer, 2010).
La abundancia en el orden Diptera en ambos sitios, se debió a la familia Chironomidae. Los representantes de esta familia pueden colonizar una gran variedad de macro y microhábitats, como, rápidos, pozas, madera sumergida, arena, grava, canto rodado y raíces; como también utilizar los sedimentos finos para generar refugios tubulares (Pinder, 1995; Oviedo-Machado & Reinoso-Flórez, 2018).
El género Macrobrachium (Decapoda: Palaemonidae), fue registrado únicamente en el sitio correspondiente a cuenca media-baja, y por su comportamiento migratorio, se esperaba registrarlo en ambos sitios de muestreo, ya que según Bauer (2011), estos organismos pueden recorrer hasta varios kilómetros a lo largo de su etapa de vida. Su ausencia en el sitio N2 podría deberse a la temperatura del agua, ya que García, Becerril, Vega & Espinosa (2013) sugieren que algunas especies de Macrobrachium son afectados en su tasa metabólica por las variaciones en la temperatura. Aun así, su ausencia en el sitio N2 es incierta y se deberían realizar estudios sobre la distribución altitudinal de estos crustáceos en la cuenca del Río Naranjo.
Por otra parte, las fluctuaciones en la abundancia de macroinvertebrados acuáticos entre los periodos del año son probablemente parte del dinamismo de la comunidad o bien consecuencia de los disturbios, por lo que se espera que existan variaciones temporales en la misma (McCord & Kuhl, 2013). A pesar de los cambios que se dan entre los periodos del año, la comunidad puede ser resiliente en el sentido de que, la configuración original se restablece rápidamente después de las perturbaciones climatológicas e hidrológicas (Mesa, 2012).
La mayor abundancia durante el periodo seco se puede deber a que, ante la disminución de caudal se reduce la fuerza de arrastre, la corriente y el movimiento de sustratos de menor tamaño (Allan & Castillo, 2007). Estas condiciones permiten el asentamiento de organismos que pueden sobrevivir a bajas velocidades y a la vez se mantiene el ensamblaje de organismos de hábitats rápidos y turbulentos (Worrall et al., 2014; Dunbar et al., 2010; Extence, Balbi & Chadd, 1999), mientras se mantenga un caudal que permita la formación de dichos hábitats.
La relación contrapuesta entre los sustratos limo y arena con la velocidad del agua se debe a que, al disminuir la velocidad se disminuye el arrastre de sustratos de distintos tamaños. De esta forma en las pozas y en las orillas de los ríos, se acumulan los sustratos de menor tamaño como lo son la grava y el limo (Leopold, Wolman, & Miller, 1992). Mientras que en las zonas con mayor turbulencia y fuerza de arrastre predominan los sustratos de mayor tamaño como el canto rodado y la roca (Leopold et al.,1992). De igual forma, debido a la velocidad del agua y al tipo de sustrato se van a registrar distintos macroinvertebrados acuáticos (Degani et al., 1993; Duan, Wang, & Tian, 2008; Schoen, Merten, & Wellnitz, 2013), en este caso relacionados al limo y a la arena, según el ACC (Fig. 4B), por ejemplo, se encuentran géneros como Limnocoris sp. (Hemiptera: Naucoridae), Epigomphus sp. (Odonata; Gomphidae), Nectopsyche sp. (Trichoptera: Leptoceridae), Caenis sp. (Ephemeroptera: Caenidae) y la familia Hydrophilidae (Coleoptera), todos estos frecuentemente reportados a bajas velocidades y en sustratos finos (Flowers & de la Rosa, 2010; Oliva, 2014; Hanh, et al. 2018; Rodrigues & Sites, 2019).
La relación -aunque débil- entre algunos géneros con el aumento de la velocidad se debe a sus adaptaciones fisiológicas y morfológicas. En el caso de organismos como Baetodes sp. (Ephemeroptera: Baetidae) y Anacroneuria sp. (Plecoptera: Perlidae) cuentan con uñas fuertes en forma de gancho en cada par de patas y cuerpos aplanados (Flowers & de la Rosa, 2010), mientras que Paltostoma sp. (Diptera: Blephariceridae), Simulium sp. (Diptera: Simuliidae) y Maruina sp. (Diptera: Psychodidae) poseen ventosas para aferrarse al sustrato y evitar ser arrastrados por la corriente (Gil & Da Santos, 2016; Hamada, Oliveira, Pepinelli, & Ribeiro, 2014). De igual forma, estos mismos organismos presentaron una respuesta positiva para el sustrato tipo roca (Fig. 5), ya que existe una relación entre la velocidad del agua y el tipo de sustrato (Allan & Castillo, 2007). Con forme aumenta el tamaño del sustrato, aumenta la turbulencia y se reduce la profundidad del agua (Hill, Maddock, & Bickerton, 2013). Mientras que, y como se mencionó anteriormente, en sustratos como la grava, la velocidad suele ser menor y por esta razón los organismos considerados reófilos, presentaron valores negativos para este tipo de sustrato con la prueba de Spearman.
La mayoría de los macroinvertebrados acuáticos respondieron de manera negativa al aumento del caudal, esto debido a que conforme aumenta el volumen de agua, aumenta la profundidad y la fuerza de arrastre (Gordon, McMahon, & Finlayson 2004) y no todos los organismos registrados en el Río Naranjo cuentan con características para sobrevivir ante estas condiciones. De esta forma, durante el periodo lluvioso y con mayor aumento de caudal, se registraron principalmente a los géneros Maruina sp., Paltosotoma sp., Anacroneuria sp. y Baetodes sp., por sus adaptaciones anteriormente citadas; también los géneros Anchitrichia sp. (Trichoptera: Hydroptilidae) y Petrophila sp. (Lepidoptera: Crambidae) ya que construyen refugios de seda para evitar ser arrastrados por la corriente (Springer, 2010; Tuskes & Mcgowan-Tuskes, 2019).
Por último, durante el periodo lluvioso es normal que las condiciones fisicoquímicas e hidráulicas fluctúen y estas pueden variar de mayor a menor escala dependiendo del tipo de actividades humanas que se encuentren en su alrededor (Gao & Ruan, 2017). Harding, Young, Hayes, Shearer & Stark (1999), mencionan que, un aumento en la concentración de nitratos puede causar una disminución de los organismos más sensibles como Ephemeroptera, Plecoptera y Trichoptera (EPT). Sin embargo, en el Río Naranjo, se mantuvo la presencia de estos ordenes durante todo el año de muestreo, dando a entender que la variación de nitratos no fue lo suficientemente grave como para afectarlos o que las especies presentes tienen un grado de tolerancia flexible a esta variable.
Las variaciones fisicoquímicas y de caudal registradas en el Río Naranjo, permiten variar el ensamblaje de macroinvertebrados acuáticos, entre periodos, por lo que, se observa es una condición típica de ríos tropicales con una disminución en la abundancia durante los meses con mayores precipitaciones (Zamora, 2015). Así, se puede concluir que el caudal del río puede ser el principal factor que genera la variación en la abundancia de macroinvertebrados acuáticos en el Río Naranjo. A la vez se resalta que estas variaciones son naturales y por ende se deben mantener, junto con la preservación del bosque de ribera a lo largo del río, para evitar que a futuro las fluctuaciones en los ensamblajes de macroinvertebrados acuáticos se den por condiciones antrópicas.
Declaración de ética: los autores declaran que están de acuerdo con esta publicación; que no existe conflicto de interés de ningún tipo; y que ha cumplido con todos los requisitos y procedimientos éticos y legales pertinentes. Todas las fuentes de financiamiento se detallan plena y claramente en la sección de agradecimientos. El respectivo documento legal firmado se encuentra en los archivos de la revista.












 uBio
uBio