Una de las regiones del noroeste de México que cuenta con el mayor número de cuencas hidrológicas es el Estado de Sinaloa, con un total de once ríos de tercer orden que drenan hacia el Golfo de California y el océano Pacífico (Tamayo & West, 1964; INEGI, 1995). En ese conjunto de corrientes epicontinentales se tienen registradas 71 especies de peces (Miller et al., 2005), de las cuales 15 son reportadas como endémicas del noroeste de México (Espinosa-Pérez et al., 1993; Miller et al., 2005). En esta misma área geográfica, los límites de las regiones biogeográficas Neártica y Neotropical quedan debidamente expresados a través del componente ictiológico dentro de cada cuenca, dominando formas neárticas en la parte alta, formas neotropicales en la parte media, y formas de derivación marina en la parte baja (Miller et al., 2005).
El Río Presidio, localizado en el sur del Estado de Sinaloa, es uno de los sistemas hidrológicos cuyas aguas, en su parte media, han sido recientemente represadas (abril de 2009) por la construcción de la presa Picachos, lo que posiblemente tendrá efectos sobre la distribución y abundancia de la ictiofauna nativa y otra biota asociada, debido a los cambios en los niveles de flujo y la interrupción de los eventos de migración reproductiva de especies diádromas (e.g., Agonostomus monticola Bancroft, 1834).
Jordan (1895) en su obra sobre los peces de Sinaloa, reportó 18 especies para las localidades de Villa Unión y Presidio en el Río Presidio, aportando la descripción de tres nuevas especies: Poeciliopsis presidionis (Jordan & Culver, 1895), Pseudophallus starksii (Jordan & Culver, 1895) y Atherinella crystallina (Jordan & Culver, 1895).
Aunque existen registros puntuales de diferentes especies de peces presentes en la cuenca del Río Presidio de Sinaloa (e.g., Jordan, 1895; Álvarez del Villar, 1970; Castro-Aguirre et al., 1976; Castro-Aguirre et al., 1999; Miller et al., 2005), ninguno ha evaluado en un contexto espacial y temporal, la composición íctica de este ecosistema.
Considerando la escasa información que existe sobre la ictiofauna dulceacuícola del Estado de Sinaloa y, en especial del Río Presidio, se realizó una evaluación de la composición y abundancia espacio-temporal de la fauna íctica en la parte media y baja de la cuenca, previo a la construcción de la presa Picachos que finalizó en julio de 2009.
Materiales y métodos
Área de estudio: El presente estudio se realizó en el periodo entre abril 2008 y febrero 2009, en las cuencas media y baja del Río Presidio que se localiza en el Estado de Sinaloa, México (23º35´ - 23º04´ N y 106º18´ - 106º05´ W). Este río, de 167 km de longitud, nace en la Sierra Madre Occidental en el Estado de Durango y desemboca en el estero El Ostial, cerca de Villa Unión, Municipio de Mazatlán. Su área de cuenca es de 5 450 km2 y su descarga media anual es de 1 779 millones de m3 (Tamayo & West, 1964; De la Lanza & GarcíaCalderón, 1991).
El clima de la región donde se ubica la cuenca del Río Presidio es cálido sub-húmedo, con una temperatura media anual de 24 ºC y la precipitación varía de los 800 a 1 200 mm (García, 2004). El suelo es de origen aluvial con un alto porcentaje de arena y conglomerados de reciente depósito en las márgenes del río. La cubierta vegetal dominante es selva baja caducifolia, la cual se extiende desde la parte media de la sierra donde existen bosques de encino y asociaciones de pino-encino, hasta la costa donde se presentan importantes áreas de manglar y vegetación halófila (Vega-Aviña, 2002; Sicairos-Avitia et al., 2003).
Muestreos ictiológicos y de parámetros físico-químicos: Diez sitios entre la parte media y baja del Río Presidio fueron seleccionados para este estudio (Fig. 1), en los cuales se realizaron seis muestreos de peces durante el periodo de abril 2008 a febrero 2009 (19-20 abril, 17-18 mayo, 9-10 agosto, 13-14 septiembre, 7-8 noviembre, y 11-12 febrero) . Dichos sitios fueron clasificados en dos secciones de acuerdo con su altitud en metros sobre nivel medio del mar (msnm), como: 1) la parte media representada por las localidades de Los Humayes (LH,150 msnm), Los Copales (LC, 128 msnm), Las Iguanas (LI, 102 msnm), La Cortina (LCO, 83 msnm), El Recodo (ER, 56 msnm) y la Derivadora Siqueros (DS, 33 msnm); y 2) la parte baja representada por El Walamo (EW, 4 msnm), Barrón-Ostial (BO, 2 msnm), El Botadero (EB, 5 msnm) y Las Garzas (LG, 3 msnm). Los peces fueron capturados con atarrayas de luz de malla de ¼” (altura 2.5 m), ½” (altura 2.5 m) y 2½” (altura 3 m), un chinchorro de arrastre (4 x 2 m y luz de malla de 1/8”) y una red tipo Surber (bolsa de 100 cm de longitud y luz de malla de 500 micras, conectada a un marco de acero inoxidable de 60 x 40 cm) para muestreo en hábitats con fondos de canto rodado. El esfuerzo de recolecta en cada sitio y fecha de muestreo fue de 20 a 25 lances con atarraya, así como 40 a 45 minutos de muestreo con chinchorro de arrastre y de 40 a 45 minutos con la red de fondo (Surber).
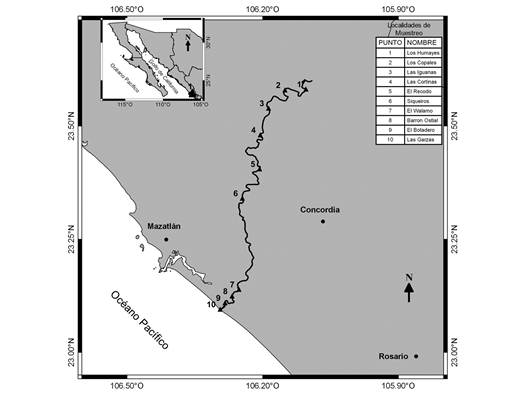
Fig. 1 Localidades de muestreo de peces en el Río Presidio, Sinaloa, México, de abril 2008 a febrero 2009. Fig. 1. Fish sampling sites along the Rio Presidio, Mazatlán, Sinaloa, Mexico, during April 2008 to February 2009.
Los organismos capturados fueron fijados en formaldehído al 10 % y posteriormente preservados en alcohol isopropílico al 50 %. La determinación taxonómica de los especímenes fue con ayuda de las claves de identificación de Fischer et al. (1995), Castro-Aguirre et al. (1999) y Miller et al. (2005); mientras que la identificación de Awaous banana fue basada en Watson (1996) y Diapterus brevirostris en González-Acosta et al. (2007). El arreglo sistemático y nomenclatura de las especies sigue lo establecido por Page et al. (2013).
El material ictiológico fue depositado en la Colección Ictiológica de la Universidad Autónoma de Baja California (UABC) y en la Colección de Peces del Laboratorio de Conservación de la Fauna Silvestre de la Facultad de Biología de la Universidad Autónoma de Sinaloa (UAS). En el Cuadro 2 se ofrece el número de catálogo de especímenes selectos de cada especie.
La clasificación ecogeográfica se elaboró con base en los criterios establecidos por Myers (1951) modificada por Castro-Aguirre et al. (1999). Mientras que las afinidades zoogeográficas de las especies del componente marino fueron basadas en Briggs (1974), y aquéllas de las especies de estirpe continental en Darlington (1963) y Miller et al. (2005).
Durante los muestreos de peces se midieron las siguientes variables físico-químicas del agua con ayuda de un equipo multianalizador Hydrolab Scout DS5: temperatura (°C), potencial de hidrógeno, oxígeno disuelto (mg/l), salinidad (‰) y turbidez (NTU).
La similitud de especies espacio-temporal de la comunidad íctica se realizó el coeficiente de similitud de Jaccard, calculado mediante la expresión: CCJ= c/ [a + b - c], donde “a” y “b” son el número de especies en las localidades 1 y 2, respectivamente, y “c” el número de especies compartidas entre ambas localidades. Para este análisis se aplicó el algoritmo de agrupamiento de pares promediados ponderados y la métrica de distancia de Chebychev, con ayuda del paquete Statistica 6.0 (StatSoft, Inc., Tulsa, OK, 2002).
Un análisis de componentes principales fue procesado para determinar las variables ambientales y bióticas que mejor explican la variación en la composición y riqueza de especies de la parte media y baja del río de estudio, considerando la altitud la como variable suplementaria y las localidades como la variable de agrupamiento.
Resultados
Parámetros fìsico-químicos: Los valores promedio, mínimos y máximos de los parámetros físico-químicos del agua medidos en las diferentes localidades del muestreo ictiológico se presentan en el Cuadro 1. La salinidad presentó pequeñas variaciones desde la parte alta (0.11 ‰ = Los Humayes) hacía la parte baja de la cuenca (0.14 ‰ = Barrón-Ostial), con incrementos significativos más río abajo en las localidades cercanas a la planicie costera (El Botadero, 31.4 ‰; y Las Garzas, 32.7 ‰), mismas que se caracterizan por la prevalecen condiciones marinas de tipo oligohalino y eurihalino.
Cuadro 1 Promedio e intervalo de parámetros físico-químicos del agua determinados por sitio de muestreo en la cuenca media y baja del Río Presidio, Mazatlán, Sinaloa, México, abril 2008-febrero 2009
| Localidad | Oxígeno disuelto (mg/l) | pH | Temperatura °C | Salinidad (‰) | Turbidez (NTU) |
|---|---|---|---|---|---|
| Los Humayes | 7.6 (3.4-9.7) | 8.5 (7.7-8.9) | 24.3 (20.8-28.4) | 0.11 (0.11-0.13) | 1.7 (0.8-2.7) |
| Los Copales | 8.5 (5.5-10.0) | 8.8(8.4-9.3) | 26.3 (23.0-29.8) | 0.12 (0.10-0.13) | 1.8 (1.0-2.8) |
| Las Iguanas | 8.4 (5.0-10.4) | 8.7 (8.3-9.2) | 26.3 (22.8-31.0) | 0.12 (0.12-0.13) | 1.7 (0.7-3.0) |
| La Cortina | 6.2 (4.4-6.9) | 8.1 (8.0-8.4) | 26.842 (23.0-32.7) | 0.13 (0.12-0.13) | 7.3 (4.2-12.5) |
| El Recodo | 8.7 (4.6-12.2) | 8.7 (8.3-9.1) | 26.7 (24.1-29.9) | 0.13 (0.10-0.13) | 6.6 (2.1-10.7) |
| Siqueros | 6.8 (4.9-9.1) | 8.2 (7.9-8.3) | 23.6 (21.8-25.5) | 0.12 (0.10-0.13) | 11.1 (5.7-17.0) |
| El Walamo | 3.7 (3.4-4.1) | 8.4 (8.2-8.6) | 26.6 ( 26.4-26.7) | 0.13 (0.13-0.14) | 17.2 (12.2-22.1) |
| Barrón-Ostial | 5.9 (4.6-7.1) | 8.9(8.4-9.2) | 26.5 (25.3-27.5) | 0.14 (0.13-0.16) | 26.6 (23.7-30.9) |
| El Botadero | 7.2 (4.4-9.5) | 7.8 (7.7-8.0) | 28.2 (25.7-29.7) | 31.4 (23.4-37.3) | 23.0 (21.1-34.1) |
| Las Garzas | 3.7 (2.6-5.1) | 7.5 (7.4-7.7) | 26.0 (24.0-27.9) | 32.7 (23.3-39.3) | 14.4 (8.2-20.6) |
Composición y diversidad espacio-temporal: Se capturó un total de 4 101 organismos que corresponden a 40 especies, 32 géneros y 19 familias de teleósteos (Cuadro 2). El número de especies fue mayor para las familias Gerreidae (5) y Poeciliidae (4), mientras otras familias como Mugilidae, Lutjanidae, Eleotridae y Gobiidae, presentaron tres especies cada una.
Table 2 Clasificación taxonómica, derivación ecológica, afinidad biogeográfica y registro curatorial de las especies ícticas recolectadas en el Río Presidio, Mazatlán, Sinaloa; abril 2008-febrero 2009

Clasificación ecogeográfica: 1B Habitante permanente del conjunto estuarino-lagunar, 2A Especie del componente marino eurihalino, 2B Especie del componente marino estenohalino, 3A Especie catádroma, VI Especie vicaria, 1C Especie dulceacuícola primaria, y 2C Especie dulceacuícola secundaria. Clasificación zoogeográfica: NT Neotropical, NA Neártica, TR Tropical, AN Anfiamericana, AA Anfiatlántica, CT Circumtropical y EX Exótica.
La mayor riqueza de especies se registró en las localidades de la parte baja del río como El Botadero y Las Garzas con 31 y 21 especies, respectivamente (Cuadro 3). En las localidades de la parte media del río la riqueza específica osciló entre 9 (Los Humayes) y 15 (Derivadora Siqueros). A nivel temporal, la mayor riqueza de especies se presentó en los meses de secas, con valores entre 25 (abril) y 33 (mayo), lo cual contrasta con la menor riqueza de 22 y 23 especies registrada en los meses de lluvia de agosto y septiembre, respectivamente (Cuadro 4).
Cuadro 3 Abundancia de especies ícticas por localidad de muestreo en las partes media (LH a ER) y baja (DS a LG) del Río Presidio, Mazatlán, Sinaloa; abril 2008-febrero 2009
| Taxa | LH | LC | LI | LCO | ER | DS | EW | BO | EB | LG | Total | %N |
|---|---|---|---|---|---|---|---|---|---|---|---|---|
| Anchoa analis | 0 | 0 | 0 | 0 | 0 | 0 | 0 | 0 | 206 | 108 | 314 | 7.7 |
| Lile stolifera | 0 | 0 | 0 | 0 | 0 | 0 | 5 | 0 | 244 | 184 | 433 | 10.6 |
| Dorosoma smithi | 0 | 0 | 0 | 0 | 0 | 37 | 0 | 0 | 0 | 0 | 37 | 0.9 |
| Ictalurus cf. pricei | 1 | 25 | 2 | 2 | 1 | 0 | 0 | 0 | 0 | 0 | 31 | 0.7 |
| Ariopsis guatemalensis | 0 | 0 | 0 | 0 | 0 | 1 | 11 | 0 | 31 | 12 | 55 | 1.3 |
| Ariopsis seemani | 0 | 0 | 0 | 0 | 0 | 0 | 0 | 0 | 2 | 2 | 4 | 0.1 |
| Mugil cephalus | 0 | 0 | 0 | 0 | 0 | 0 | 5 | 87 | 63 | 10 | 165 | 4.0 |
| Mugil curema | 0 | 0 | 0 | 0 | 0 | 0 | 0 | 10 | 10 | 8 | 28 | 0.7 |
| Agonostomus monticola | 16 | 10 | 36 | 20 | 85 | 20 | 15 | 0 | 0 | 0 | 202 | 4.9 |
| Atherinella crystallina | 38 | 38 | 35 | 8 | 54 | 44 | 0 | 0 | 23 | 0 | 240 | 5.9 |
| Hyporhamphus rosae | 0 | 0 | 0 | 0 | 0 | 0 | 0 | 0 | 4 | 0 | 4 | 0.1 |
| Poecilia butleri | 10 | 99 | 17 | 12 | 36 | 16 | 0 | 0 | 11 | 0 | 201 | 4.9 |
| Poeciliopsis latidens | 30 | 140 | 5 | 1 | 21 | 2 | 0 | 0 | 0 | 0 | 199 | 4.9 |
| Poeciliopsis presidionis | 0 | 77 | 35 | 2 | 42 | 7 | 0 | 0 | 0 | 0 | 163 | 4.0 |
| Poeciliopsis prolifica | 0 | 0 | 1 | 4 | 0 | 0 | 0 | 0 | 0 | 0 | 5 | 0.1 |
| Centropomus robalito | 0 | 0 | 0 | 0 | 0 | 0 | 0 | 0 | 11 | 7 | 18 | 0.4 |
| Centropomus nigrescens | 0 | 0 | 0 | 0 | 0 | 1 | 8 | 0 | 9 | 1 | 19 | 0.5 |
| Caranx vinctus | 0 | 0 | 0 | 0 | 0 | 0 | 0 | 0 | 1 | 0 | 1 | 0.02 |
| Selene brevoorti | 0 | 0 | 0 | 0 | 0 | 0 | 0 | 0 | 3 | 3 | 6 | 0.2 |
| Lutjanus novemfasciatus | 0 | 0 | 0 | 0 | 0 | 0 | 0 | 0 | 1 | 0 | 1 | 0.02 |
| Lutjanus colorado | 0 | 0 | 0 | 0 | 0 | 0 | 0 | 0 | 4 | 2 | 6 | 0.2 |
| Lutjanus argentiventris | 0 | 0 | 0 | 0 | 0 | 0 | 0 | 0 | 2 | 2 | 4 | 0.1 |
| Diapterus brevirostris | 0 | 0 | 0 | 0 | 0 | 0 | 0 | 0 | 30 | 6 | 36 | 0.9 |
| Eucinostomus entomelas | 0 | 0 | 0 | 0 | 0 | 0 | 0 | 0 | 4 | 0 | 4 | 0.1 |
| Eucinostomus currani | 0 | 0 | 0 | 0 | 0 | 0 | 0 | 0 | 16 | 2 | 18 | 0.4 |
| Eugerres axillaris | 0 | 0 | 0 | 0 | 0 | 0 | 0 | 0 | 150 | 31 | 181 | 4.4 |
| Gerres cinereus | 0 | 0 | 0 | 0 | 0 | 0 | 0 | 0 | 53 | 28 | 81 | 2.0 |
| Haemulon sexfasciatum | 0 | 0 | 0 | 0 | 0 | 0 | 0 | 0 | 5 | 1 | 6 | 0.2 |
| Cynoscion squamipinnis | 0 | 0 | 0 | 0 | 0 | 0 | 0 | 0 | 2 | 0 | 2 | 0.1 |
| Ophioscion scierus | 0 | 0 | 0 | 0 | 0 | 0 | 0 | 0 | 3 | 0 | 3 | 0.1 |
| Cichasoma beani | 9 | 52 | 31 | 15 | 34 | 17 | 3 | 0 | 0 | 0 | 161 | 3.9 |
| Oreochromis aureus | 16 | 72 | 70 | 22 | 134 | 38 | 3 | 11 | 7 | 4 | 377 | 9.2 |
| Dormitator latifrons | 0 | 0 | 0 | 0 | 0 | 34 | 14 | 104 | 50 | 0 | 202 | 4.9 |
| Eleotris picta | 0 | 0 | 1 | 9 | 3 | 4 | 0 | 120 | 0 | 1 | 138 | 3.4 |
| Gobiomorus maculatus | 0 | 0 | 0 | 16 | 15 | 70 | 20 | 113 | 27 | 0 | 261 | 6.4 |
| Awaous banana | 29 | 58 | 51 | 11 | 65 | 13 | 16 | 125 | 2 | 0 | 370 | 9.0 |
| Gobionellus microdon | 0 | 0 | 0 | 0 | 0 | 0 | 0 | 2 | 2 | 1 | 5 | 0.1 |
| Sicydium multipunctatum | 2 | 17 | 17 | 0 | 2 | 0 | 0 | 4 | 0 | 0 | 42 | 1.0 |
| Citharichthys gilberti | 0 | 0 | 0 | 0 | 0 | 0 | 5 | 0 | 3 | 3 | 11 | 0.3 |
| Achirus mazatlanus | 0 | 0 | 0 | 0 | 0 | 14 | 4 | 6 | 26 | 17 | 67 | 1.6 |
| Total | 151 | 588 | 301 | 122 | 492 | 318 | 109 | 582 | 1 005 | 433 | 4 101 | |
| % N | 3.68 | 14.34 | 7.34 | 2.97 | 12 | 7.75 | 2.66 | 14.2 | 24.5 | 10.6 | ||
| Número de especies | 9 | 10 | 12 | 12 | 12 | 15 | 12 | 10 | 31 | 21 | 40 |
LH = Los Humayes, LC = Los Copales, LI = Las Iguanas, LCO = La Cortina, ER = El Recodo, DS = Derivadora Siqueros, EW = El Walamo, BO = El Barrón-Ostial, EB = El Botadero y LG = Las Garzas.
LH = Los Humayes, LC = Los Copales, LI = Las Iguanas, LCO = La Cortina, ER = El Recodo, DS = Derivadora Siqueros, EW = El Walamo, BO = El Barrón-Ostial, EB = El Botadero and LG = Las Garzas.
Cuadro 4 Abundancia mensual de peces en la parte media y baja del Río Presidio, Mazatlán, Sinaloa; abril 2008-febrero 2009
| Especie | Abr.* | May.* | Ago.+ | Sep.+ | Nov.* | Feb.* | Total | (%N) |
|---|---|---|---|---|---|---|---|---|
| Anchoa analis | 62 | 224 | 15 | 5 | 0 | 8 | 314 | 7.7 |
| Lile stolifera | 60 | 214 | 90 | 0 | 25 | 44 | 433 | 10.6 |
| Dorosoma smithi | 10 | 2 | 10 | 15 | 0 | 0 | 37 | 0,9 |
| Ictalurus cf. pricei | 0 | 0 | 3 | 2 | 25 | 1 | 31 | 0,8 |
| Ariopsis guatemalensis | 7 | 2 | 7 | 3 | 28 | 8 | 55 | 1,3 |
| Ariopsis seemanni | 0 | 2 | 0 | 2 | 0 | 0 | 4 | 0,1 |
| Mugil cephalus | 9 | 18 | 10 | 17 | 40 | 71 | 165 | 4,0 |
| Mugil curema | 0 | 0 | 0 | 10 | 6 | 12 | 28 | 0,7 |
| Agonostomus monticola | 18 | 38 | 2 | 7 | 22 | 115 | 202 | 4,9 |
| Atherinella crystallina | 89 | 62 | 28 | 12 | 10 | 39 | 240 | 5,9 |
| Hyporhamphus rosae | 0 | 0 | 0 | 0 | 2 | 2 | 4 | 0,1 |
| Poecilia butleri | 21 | 52 | 2 | 42 | 46 | 38 | 201 | 4,9 |
| Poeciliopsis latidens | 0 | 13 | 0 | 0 | 21 | 165 | 199 | 4,9 |
| Poeciliopsis presidionis | 0 | 43 | 21 | 30 | 14 | 55 | 163 | 4,0 |
| Poeciliopsis prolifica | 4 | 1 | 0 | 0 | 0 | 0 | 5 | 0,1 |
| Centropomus robalito | 6 | 8 | 0 | 2 | 1 | 1 | 18 | 0,4 |
| Centropomus nigrescens | 1 | 1 | 0 | 4 | 13 | 0 | 19 | 0,5 |
| Caranx vinctus | 0 | 0 | 1 | 0 | 0 | 0 | 1 | 0,02 |
| Selene brevoorti | 6 | 0 | 0 | 0 | 0 | 0 | 6 | 0,2 |
| Lutjanus novemfasciatus | 0 | 1 | 0 | 0 | 0 | 0 | 1 | 0,02 |
| Lutjanus colorado | 2 | 2 | 0 | 0 | 1 | 1 | 6 | 0,2 |
| Lutjanus argentiventris | 0 | 1 | 1 | 1 | 0 | 1 | 4 | 0,1 |
| Diapterus brevirostris | 0 | 6 | 30 | 0 | 0 | 0 | 36 | 0,9 |
| Eucinostomus currani | 1 | 0 | 0 | 0 | 17 | 0 | 18 | 0,4 |
| Eucinostomus entomelas | 0 | 4 | 0 | 0 | 0 | 0 | 4 | 0,1 |
| Eugerres axillaris | 6 | 132 | 0 | 0 | 35 | 8 | 181 | 4,4 |
| Gerres cinereus | 0 | 20 | 0 | 0 | 50 | 11 | 81 | 2,0 |
| Haemulon sexfasciatum | 0 | 5 | 0 | 0 | 0 | 1 | 6 | 0,2 |
| Cynoscion squamipinnis | 0 | 0 | 0 | 0 | 2 | 0 | 2 | 0.5 |
| Ophioscion scierus | 0 | 3 | 0 | 0 | 0 | 0 | 3 | 0,1 |
| Cichlasoma beani | 38 | 35 | 11 | 19 | 31 | 27 | 161 | 3,9 |
| Oreochromis aureus | 70 | 121 | 47 | 34 | 66 | 39 | 377 | 9.2 |
| Dormitator latifrons | 10 | 10 | 15 | 50 | 14 | 103 | 202 | 4,9 |
| Eleotris picta | 3 | 2 | 2 | 1 | 5 | 125 | 138 | 3,4 |
| Gobiomorus maculatus | 17 | 64 | 17 | 8 | 20 | 135 | 261 | 6,4 |
| Awaous banana | 65 | 52 | 87 | 15 | 6 | 145 | 370 | 9,0 |
| Gobionellus microdon | 1 | 1 | 1 | 2 | 0 | 0 | 5 | 0,1 |
| Sicydium multipunctatum | 4 | 15 | 0 | 2 | 9 | 12 | 42 | 1,0 |
| Citharichthys gilberti | 1 | 2 | 1 | 0 | 2 | 5 | 11 | 0,3 |
| Achirus mazatlanus | 11 | 21 | 4 | 1 | 28 | 2 | 67 | 1,6 |
| Total | 522 | 1 177 | 405 | 284 | 539 | 1 174 | 4 101 | |
| % N | 12.72 | 28.70 | 9.88 | 6.93 | 13.14 | 28.62 | ||
| Número de especies | 25 | 33 | 22 | 23 | 27 | 27 | 40 |
Meses de lluvia (+) y de secas (*). Rainy (+) and dry (*) months.
Las especies con mayor abundancia relativa fueron Lile stolifera (10.6 %), Oreochromis aureus (9.2 %), A. banana (9.0 %), Anchoa analis (7.7 %), Gobiomorus maculatus (6.4 %) y Atherinella crystallina (5.9 %), las cuales conjuntan el 48.8 % del total de los ejemplares capturados durante el estudio (Cuadro 3). La abundancia en la captura por evento de muestreo fue mayor en febrero y mayo con 1 177 y 1 174 individuos, respectivamente (Cuadro 4); sitios como El Botadero, Las Iguanas, BarrónOstial y El Recodo contribuyeron con el 65 % de la captura total.
El cíclido exótico O. aureus, mostró amplia presencia a través del gradiente altitudinal en el río (2 a 150 msnm), mientras que otras especies como A. banana se registró en nueve sitios con altitudes entre 5 y 150 msnm (Cuadro 3). Otras especies de amplia distribución fueron A. crystallina, A. monticola y P. butleri que concurrieron en siete sitios entre los 4 y 150 msnm. En lo que respecta a especies restringidas a la parte media del río, destacan I. cf. pricei, P. latidens, P. presidionis y P. prolifica, en altitudes entre 33 y 150 msnm (Cuadro 3).
En relación con la similitud de especies entre sitios de muestreo, los resultados mostraron una menor distancia (< 15 %) en localidades de la parte media de la cuenca, especialmente entre La Cortina y Los Humayes, así como entre Las Iguanas, Los Copales y El Recodo (16 %) (Fig. 2). Por periodo de muestreo y a un nivel de corte del 45 % de disimilitud, dos grupos son formados; el primero por los meses de agosto y septiembre 2008 que corresponden al periodo de lluvias, y el segundo grupo integrado por dos subgrupos (abril y mayo 2008, agosto 2008 y febrero 2009) que corresponden al periodo de secas (Fig. 3). Los meses de agosto 2008 y febrero 2009 registraron una menor distancia de enlace (24 %).
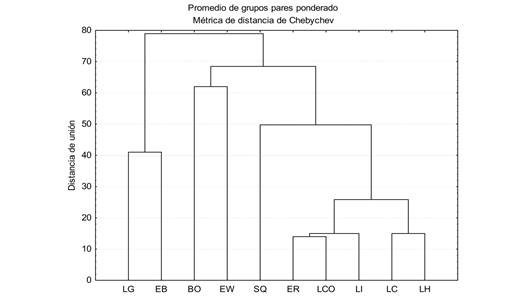
Fig. 2 Dissimilarity of fish species by sampling site in the Rio Presidio, Mazatlán, Sinaloa, during April 2008 to February 2009. LH = Los Humayes, LC = Los Copales, LI = Las Iguanas, LCO = La Cortina, ER = El Recodo, DS = Derivadora Siqueros, EW = El Walamo, BO = El Barrón-Ostial, EB = El Botadero and LG = Las Garzas.
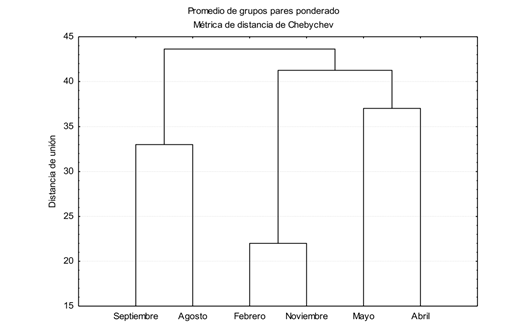
Fig. 3 Similarity of fish species by month of sampling in the lower and middle Río Presidio, Mazatlán, Sinaloa, during April 2008 to February 2009.
En el análisis de componentes principales (Fig. 4) indica que el primer componente explicó el 58.3 % de la variación, aportando una mayor contribución las variables de riqueza de especies (0.220) y salinidad (0.215) (Cuadro 5). El segundo componente explicó el 21.4 % de la variación, donde las variables con mayor contribución fueron la temperatura (0.299) y abundancia total de las especies (0.273).
Cuadro 5 Contribución de variables basadas en correlaciones sobre los atributos de altitud y de riqueza de especies ícticas, en la parte baja y media del Río Presidio, Sinaloa, México. Los dos valores más significativos en cada factor se indican en negrillas
| - | Factor 1 | Factor 2 | Factor 3 | Factor 4 | Factor 5 |
|---|---|---|---|---|---|
| Oxígeno | 0.141796 | 0.198335 | 0.097340 | 0.020820 | 0.239245 |
| pH | 0.163199 | 0.186844 | 0.038498 | 0.015649 | 0.078258 |
| Temperatura | 0.057787 | 0.299124 | 0.000351 | 0.630411 | 0.001746 |
| Salinidad | 0.220115 | 0.006372 | 0.065040 | 0.000446 | 0.131279 |
| Turbidez | 0.104062 | 0.033570 | 0.692374 | 0.029731 | 0.066792 |
| Riqueza de Especies | 0.214841 | 0.003037 | 0.074414 | 0.018521 | 0.359392 |
| Abundancia Total | 0.098201 | 0.272718 | 0.031983 | 0.284421 | 0.123289 |
La riqueza de especies y la salinidad mostraron un mayor grado de asociación (Fig. 4), mostrando un mayor número de especies en aquellas localidades de la parte baja del río donde la salinidad se incrementa por la influencia de flujos de marea y favorece la mayor incursión de especies de estirpe marina o “periféricas”. De igual manera, ambas salinidad y riqueza de especies tuvieron una relación inversa con la altitud. Por su parte, la temperatura y la abundancia total de las especies mostraron una relación directa (Fig. 4).
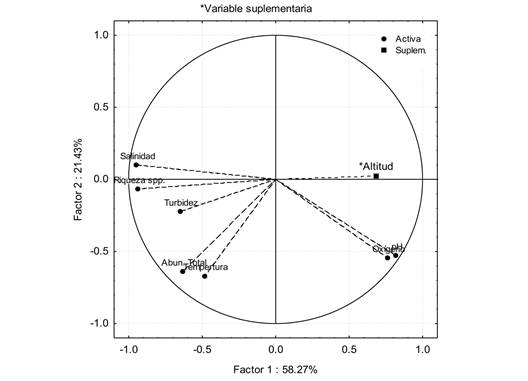
Fig. 4 Projection of the active variables and supplementary variable (altitude) on the factor-plane (1x2), derived from principal component analysis for the fish fauna in the middle and lower Río Presidio, Sinaloa, Mexico (April 2008 to February 2009).
Derivación ecológica y consideraciones zoogeográficas: De acuerdo a los resultados, respecto a la derivación ecológica de las especies registradas para el Río Presidio, la mayoría de los taxa corresponden al componente marino-eurihalino (17 especies = 43 %; Cuadro 2) En menor proporción estuvieron representadas las especies del componente marino estenohalino con siete taxa (18 %), seguidas por elementos dulceacuícolas secundarios y elementos permanentes del conjunto estuarino-lagunar, ambos con seis especies (15 %) cada uno. Por su parte, los elementos vicarios estuvieron representados solamente por dos especies (5 %, A. crystallina y D. smithi), el componente dulcecacuícola primario por Ictalurus cf. pricei (2 %) y, finalmente, el catádromo por A. monticola (2 %; Cuadro 2).
Zoogeográficamente, seis especies del conjunto neotropical están representadas en la cuenca media del Río Presidio (A. crystallina, P. butleri, P. latidens, P. presidionis, P. prolifica y C. beani); mientras que las dos especies vicarias en la parte medida de esta cuenca (D. smithi e I. cf. pricei) son de afinidad neártica. Las 31 especies restantes estuvieron representadas por elementos de derivación marino-eurihalina o periférica, de las cuales 27 son afines a la región del Pacífico oriental tropical (Cuadro 2). En esta última región se distribuyen 18 especies en las provincias SinusCaliforniana, Mexicana y Panámica (Cuadro 2), de las cuales siete extienden su distribución hacia la provincia Sandieguina (Caranx vinctus, Lutjanus argentiventris, L. colorado, L. novemfasciatus, E. currani, E. picta y A. banana). Otras especies como Hyporhamphus rosae, habitan dentro de las provincias Sandieguina, Sinus-californiana y Mexicana; mientras que A. analis, su distribución abarca las provincias Sinus-californiana y Mexicana, pero no alcanza a la provincia Panámica.
Por otro lado, especies como A. monticola y G. cinereus representaron elementos anfiamericanos; en tanto que M. cephalus y M. curema, constituyeron los únicos elementos circumtropicales y anfiatlánticos, respectivamente. La única especie exótica, O. aureus, es de afinidad etiópica.
Discusión
A través del estudio ictiológico de la cuenca media y baja del Río Presidio, se registró un total de 40 especies, cifra que constituye el 56 % de las especies ícticas reportadas para las aguas continentales del Estado de Sinaloa (Jordan, 1895; Álvarez del Villar 1970; CastroAguirre et al., 1999; Miller et al., 2005).
Es importante destacar que la mayoría de las especies registradas (n= 39) son nativas del Río Presidio (sensuMiller et al., 2005), donde sobresalen endemismos de tipo regional o compartido para el Estado de Sinaloa: D. smithi, A. crystallina, P. latidens, P. presidionis, P. prolifica y C. beani (Van der Heiden & Plascencia-González, 2002). Una de éstas, Poeciliopsis latidens es considerada de acuerdo a la Norma Oficial Mexicana [NOM-059-2010] (DOF 2010), como una especie amenazada.
Sólo una especie exótica fue registrada, el cíclido O. aureus, que presentó alta abundancia y amplia distribución en el área de estudio, y que muestra un patrón similar en otras cuencas hidrológicas del Estado de Sinaloa (Ruiz-Campos et al., 2014).
En términos de la abundancia (numérica) de las especies, sobresalió la presencia de aquellas que exhibieron un comportamiento gregario al momento de su captura: L. stolifera, O. aureus, A. banana, A. analis, G. maculatus y A. crystallina. La mayor abundancia mensual de organismos en de febrero y mayo, podría ser atribuida a la disminución de nivel y flujo del río durante el periodo de estiaje, situación que favorece el hacinamiento de los peces y facilita de este modo su captura. Las familias con mayor riqueza de especies fueron aquellas características de los sitios costeros con ambientes de tipo oligohalino e hiperhalino o eurihalino como El Botadero y Las Garzas (32 especies de manera combinada), que favorecen la incursión de especies de estirpe marina (eurihalinas y estenohalinas), en respuesta a la elevada producción primaria y heterogeneidad ambiental de estos ecosistemas (YáñezArancibia et al., 1980; González-Acosta et al., 2017); así como por el uso que hacen de estas áreas como zonas de crianza y reclutamiento (González-Acosta et al., 2015).
Con base en la clasificación ecogeográfica de las especies que habitan las lagunas costeras y sistemas fluvio-estuarinos del Estado de Sinaloa, Castro-Aguirre et al. (1999), reportaron la existencia de 226 especies, de las cuales 107 están presentes en la región sur. Esta riqueza íctica se apoya en estudios de exploración concentrados únicamente en la laguna Huizache-Caimanero y estuario de Mazatlán (Castro-Aguirre et al. 1999), los cuales tienen flujo permanente de agua y una mayor superficie en comparación con la zona de estuario del Río Presidio, cuya desembocadura es obstruida durante el periodo de estiaje por una barra arenosa que impide el flujo de agua y con ello la dispersión de muchas especies que incursionan temporalmente o de manera esporádica a los ambientes estuarinos. Dicha situación provocó una reducción en el número de especies registradas (un total de 32) en la parte baja de la cuenca del río; de las cuales, 23 son de interés comercial (Fischer et al., 1995) y son aprovechadas por la población pesquera local.
Por su parte, la riqueza de especies fue mayor en la zona baja de la cuenca, en las localidades de El Botadero y Las Garzas, en las cuales se registró la presencia de especies de derivación marino eurihalina o periféricas procedentes del litoral costero. La mayor riqueza de especies en sitios próximos a la desembocadura al mar es un patrón característico en los sistemas fluvio-estuarinos del Pacífico mexicano (Castro-Aguirre et al., 1999; GonzálezAcosta et al., 2017).
A nivel temporal, la composición íctica en el área de estudio fue influenciada por las condiciones hidrológicas que fueron contrastantes en el ecosistema, donde el periodo de lluvias corresponde a agosto y septiembre y el resto de los meses al período de secas o estiaje. La incursión de especies marino eurihalinas a la parte baja del río se incrementó durante el estiaje, como frecuentemente ocurre en muchos ecosistemas fluvio-estuarinos de México (Castro-Aguirre et al., 1999).
En relación a la clasificación ecogeográfica de las especies según su tolerancia a la salinidad y su distribución zonal a través del río, en este estudio se incluyeron dos tipos de ecosistemas (dulceacuícola y marino oligohalino-polihalino); esto se reflejó en los resultados, ya que los peces presentes en la parte media del Río Presidio, están representados en su mayoría por elementos dulceacuícolas del tipo secundario (seis especies), los cuales tienen una poca a moderada tolerancia a la salinidad (Myers, 1951; Miller, 1966; Miller et al., 2005).
La especie D. smithi, ubicada dentro del componente vicario por Castro-Aguirre et al. (1999), se encontró solo en un sitio (Derivadora Siqueros), mismo que le aportó condiciones necesarias para el completo desarrollo de esta especie, que por sus características morfológicas requiere de zonas de corriente y de mayor profundidad. Las especies de eleótridos (D. latifrons, E. picta y G. maculatus) se comportaron como invasores eurihalinos en el área de estudio, encontrándose en salinidades de 0.1 a 23 ‰. Estas mismas especies, junto con el gobio A. banana forman parte del componente complementario en los ambientes dulceacuícolas de la Península de Baja California [cf. A. tajasica en Ruiz-Campos et al. (1999) y RuizCampos et al. (2003)]. Dentro de la cuenca del Río Presidio, el componente dulceacuícola secundario estuvo representado por especies de las familias Cichlidae y Poeciliidae, mientras que el componente primario por la familia Ictaluridae. En este último caso, la única especie aquí representada fue I. cf. pricei, misma que se encontró en los sitios de la parte media de la cuenca.
Con base en la distribución de especies a través de la parte media y baja del Río Presidio, fue notable una zonación que se representa de la siguiente manera, en la parte baja de este río (localidades de El Walamo, Barrón-Ostial, El Botadero, Las Garzas y Derivadora Siqueros) por especies marinas de tipo eurihalino; y en la parte media por especies dulceacuícolas como P. butleri, P. latidens, P. presidionis, P. prolifica y el exótico O. aureus.
La mayoría de las especies registradas en el área de estudio son de estirpe marina, las cuales poseen ámbitos de distribución que incluyen la Región del Pacífico oriental, específicamente dentro de las provincias Sandieguina, Sinus-Californiana, Mexicana y Panámica (Briggs, 1974); aunque no todas esas especies se ubicaron de forma restringida en las cuatro provincias biogeográficas antes citadas, en todos los casos se distribuyen en al menos dos de éstas; por ejemplo, A. analis solo se distribuye dentro de las provincias Sinus-californiana y Mexicana (Van der Heiden & Plascencia-González, 2002). Asimismo, las especies pertenecientes a las familias Poeciliidae, Atherinopsidae y Cichlidae, son derivadas de grupos de estirpe sudamericana, particularmente de la región amazónica, que históricamente se han dispersado hacia las regiones tropicales del continente (De la Vega-Salazar, 2003; Miller et al., 2005). Otras especies como A. monticola y G. cinereus se distribuyen tanto en la vertiente del Pacífico como del Golfo de México (Castro-Aguirre et al., 1999), mientras que M. cephalus y M. curema son formas de distribución circumtropical y anfiatlántica, respectivamente.
Finalmente, se establece que el estudio sobre la distribución y abundancia espaciotemporal de la ictiofauna de la parte media y baja del Río Presidio, previo a la construcción de la Presa Picachos, servirá de base y referencia para evaluar los futuros impactos de esta obra hidráulica sobre las comunidades de peces nativos, especialmente del componente catádromo que utiliza estos biotopos como parte importante de su ciclo de vida.












 uBio
uBio 

