Revista de Biología Tropical
versão On-line ISSN 0034-7744versão impressa ISSN 0034-7744
Rev. biol. trop vol.56 no.2 San José Jun. 2008
María del Tránsito Borraz-Argüello1, Gerardo Santos-López1*, Verónica Vallejo-Ruiz1, Irma Herrera-Camacho2 & Julio Reyes-Leyva1*
1. Laboratorio de Biología Molecular y Virología, Centro de Investigación Biomédica de Oriente, IMSS, HGZ No. 5, Km. 4.5 Carretera Federal Atlixco-Metepec, 74630 Metepec, Puebla, México. Fax 52 244 44 40 122; maraboa2000@yahoo.com.mx, gerardo.santos.lopez@gmail.com, veronica.vallejor@imss.gob.mx, julio.reyes@imss.gob.mx.
2. Centro de Química, Instituto de Ciencias, Benemérita Universidad Autónoma de Puebla, Puebla, México; pherrera@siu.buap.mx.
Abstract: Biological characterization of three natural isolates of the porcine rubulavirus (Mexico). Porcine rubulavirus (PoRV) produces a neurological and reproductive syndrome in pigs called the blue-eye disease, known only from Mexico. Several isolates were grouped by the main symptoms presented during outbreaks: a) neurotropic in piglets, b) broadly neurotropic in piglets and gonadotropic in adults, and c) gonadotropic in adults. We studied some biological properties of three strains, which fall in one of each virus group: La Piedad Michoacán (LPM) and Producción Animal Cerdos 1 (PAC1) and 3 (PAC3), respectively. The analyzed viral properties are mainly related with the trans-membrane hemagglutinin-neuraminidase (HN) and fusion (F) proteins, such as cytopathic effect, hemolysis, hemagglutinating (HA) and neuraminidase (NA) activities. In the infection assays PAC1 strain presented the highest fusogenicity level; however, the most cytolytic strain was PAC3. In addition, HA and NA activities and viral genome of PAC3 strain was detected in supernatants during cell infection earlier than in the other two strains, which shows that PAC3 virions release from the host cell earlier than LPM and PAC1. Experimental determination in purified viruses shows that PAC3 presented a higher HA and NA activities; however, PAC1 shows other interesting properties, such as a high thermostability of HN and differences about substrate profile respect to LPM and PAC3. Our data suggest that NA activity is associated with the virulence of RVP. Rev. Biol. Trop. 56 (2): 487-499. Epub 2008 June 30.
Key words: Blue eye disease, LPMV, hemagglutinin-neuraminidase, Paramyxoviridae, Rubulavirus, virulence.
El Rubulavirus porcino (RVP), también conocido como virus de La Piedad, Michoacán (LPMV) es un paramixovirus causante de la enfermedad del ojo azul de los cerdos y hasta ahora ha sido informado sólo en México. Fue detectado por primera vez en granjas del Estado Michoacán, México, en 1980. Esta enfermedad se caracteriza por un complejo de signos respiratorios, neurológicos y reproductivos, acompañados por opacidad de la córnea (Stephano 1993).
Los aislamientos virales están típicamente asociados con determinados signos; por ejemplo, las cepas denominadas paramixovirus del ojo azul (POA, 1980), La Piedad Michoacán (LPM, 1984) y POA2 (1988) son causantes principalmente de meningoencefalitis y neumonía en cerdos neonatos; mientras que las cepas denominadas Producción Animal Cerdos 2 (PAC2, 1990) y 3 (PAC3, 1993), de la Facultad de Veterinaria de la Universidad Nacional Autónoma de México (UNAM) fueron aislados en brotes donde básicamente se registraron fallas reproductivas. En estos últimos casos se observaron abortos, mortinatos y disminución en la fertilidad de las hembras; mientras que en machos se presentó epididimitis, orquitis y atrofia testicular. Otros aislamientos, tales como PAC1 (1990), PAC4 (1993) y PAC5 (1994) se recuperaron de granjas donde se presentaron signos respiratorios severos y meningoencefalitis en cerdos neonatos y también signos reproductivos en cerdos adultos (Reyes-Leyva et al. 2002).
El RVP posee seis genes, que codifican proteínas altamente conservadas en la familia Paramyxoviridae. La nucleocápside está constituida por el ARN genómico y la nucleoproteína (NP), a la cual se asocian la fosfoproteína (P) y una proteína de alto peso molecular (L). En la envoltura viral se encuentran las proteínas de matriz (M), la de fusión (F) y la hemaglutinina- neuraminidasa (HN) (Sundqvist et al. 1990, Santos-López et al. 2004a).
La HN es la principal proteína involucrada en el inicio de la infección, reconoce al receptor en la membrana de la célula hospedera (actividad hemaglutinante, HA), que es un ácido neuramínico unido a glicoproteínas o glicolípidos en la membrana celular; coopera con la proteína F para fusionar las membranas celular y viral; paso importante para el ingreso del genoma viral en la célula. La HN tiene también actividad de neuraminidasa (NA), la cual consiste en la remoción de residuos de ácido siálico de la progenie viral, para evitar la autoagregación y que también está involucrada en la liberación de la progenie viral de la célula hospedera (Lamb y Kolakofsky 2001).
Hasta ahora se han reportado sólo algunas diferencias en signos clínicos de varias cepas del RVP, sin embargo, otros estudios de índole bioquímica, genética e inmunológica son necesarios para contestar algunas preguntas acerca de variabilidad y la posible evolución del RVP. Por estas razones, el objetivo del presente trabajo es la investigación de algunas propiedades biológicas que podrían estar relacionadas con los signos clínicos. Para ello, se seleccionaron tres aislamientos virales que difieren en sus manifestaciones clínicas y se compararon en estudios in vitro. De esta manera, se incluyeron en el estudio las cepas LPM, PAC1 y PAC3, cada una ubicada en diferente grupo viral. Se evaluó el efecto citopático en cultivo celular y se determinó la actividad HA y NA tanto en sobrenadantes de células infectadas como en viriones purificados. Finalmente, la relevancia de los datos obtenidos se discute y relaciona con la virulencia del RVP.
Material y métodos
Virus y células. Las cepas virales PAC1 (1991) y PAC3 (1992) se aislaron en el Departamento de Producción Animal "Cerdos" de la Facultad de Medicina Veterinaria de la UNAM (Ramírez-Mendoza et al. 1997, Reyes-Leyva et al. 2002). La cepa prototipo LPM fue obtenida en 1984 por Moreno-López et al. (1986). Los virus se replicaron en células PK-15 (riñón de cerdo), que se mantuvieron en Medio Mínimo Esencial de Eagle (MEM) suplementado con 5% de suero de bovino neonato (SBN) y con los antibióticos penicilina (100 U/ml) y estreptomicina (100 mg/ml) (Reyes-Leyva et al. 1997). Los medios y suplementos de cultivo se obtuvieron de Sigma-Aldrich (San Luis, E.U.A.). Los aislamientos virales se caracterizaron como RVP mediante inhibición de la hemaglutinación, usando un suero hiper-inmune anti-RVP y mediante transcripción inversa acoplada a la reacción en cadena de la polimerasa (RT-PCR).
Titulación viral. La capacidad de infección de cada inóculo viral se determinó en dosis infectantes en cultivo celular al 50% (DICC50), de acuerdo con el método de Kärber (Blake y O´Connell 1993).
Detección del virus mediante RT-PCR. El ARN total de los sobrenadantes infectados se extrajo mediante el método de fenol-cloroformo, usando el reactivo comercial Trizol (Invitrogen, Carlsbad, E.U.A.), de acuerdo con las instrucciones del fabricante; el volumen utilizado de sobrenadante viral fue de 300 µl mientras que de Trizol fue de 600 µl. El ensayo de RT-PCR se llevó acabo usando el juego de reactivos SuperScript One-Step RT-PCR with Platinum Taq (Invitrogen) y los iniciadores P-LPM1 (5-CCAGTCCGAGG TTCATCAT-3) y P-LPM2(5-TGCGGCCCTCGATTGCTTT-3) para obtener un producto de 395 pb del gen P. El programa consistió en: 55°C/30 min (transcripción inversa), 94°C/2 min (para inhibir la enzima RT y desnaturalizar los ácidos nucleicos), seguido por 35 ciclos de 94°C/30 s, 55°C/30 s y 72°C/40 s; se agregó un período de extensión final a 72ºC/5 min.
Ensayos de infección. Las células PK-15 se cultivaron en placas de 6 pozos (9.6 cm2/ pozo; Nunc, Illinois, EUA). Cada virus fue inoculado utilizando dosis de 100 DICC50 (diluidas en MEM) por pozo e incubado durante 1 hr a 37 ºC, después de lo cual, los inóculos virales se retiraron y se agregó MEM nuevo con 5% de SBN. Los pozos infectados y una serie de pozos sin infectar se revisaron periódicamente mediante microscopia de contraste de fases para observar y cuantificar el efecto citopático. Los sobrenadantes de las células en cultivo se extrajeron y analizaron para determinar las actividades HA y NA o para someterse a extracción de ARN para ensayos de RT-PCR. Cada ensayo fue realizado al menos tres veces para obtener confiabilidad en los datos.
Purificación de virus. Los viriones presentes en los sobrenadantes se concentraron por centrifugación a 31,000xg/l hr/4 °C usando el rotor SS-34 (Sorvall, Newtown, E.U.A.). Los sedimentos se re-suspendieron en PBS (fosfato de sodio 0.1 M (Sigma)/cloruro de sodio 0.15 M (Sigma), pH 7.3) y se sometieron a ultracentrifugación a 100,000xg/4 hr/4ºC en un colchón de sacarosa (Sigma) al 45% usando el rotor SW-28 (Beckman, Palo Alto, E.U.A.). Los viriones sedimentados se lavaron con PBS mediante otra centrifugación a 31,000xg/l hr/4 °C, se resuspendieron en PBS y se guardaron a -70 ºC hasta su uso (Reyes-Leyva et al. 2007).
Ensayos de hemaglutinación. Las propiedades hemaglutinantes se determinaron en microplacas de 96 pozos de fondo redondo (Nunc) mediante diluciones dobles seriadas de los virus purificados o sobrenadantes virales en PBS (25 µl en total). A estas diluciones se agregaron 25 µl de suspensiones de eritrocitos de varias especies al 1% en PBS y se incubó a 4 °C. La hemaglutinación se analizó visualmente para determinar los títulos en unidades hemaglutinantes (UHA), que se definen como el inverso de la última dilución en que los virus fueron capaces de aglutinar (Reyes-Leyva et al. 1997). Una vez aglutinados los eritrocitos se determinó el tiempo de elución (sedimentación) mediante observación directa cada 10 min. Las unidades de elución se definieron como el número de UHA eluidas por hora (UHE).
Determinación de la actividad de neuraminidasa. Los virus purificados o sobrenadantes virales se incubaron en presencia de sialil-lactosa (Sigma) o fetuína sérica bovina (Sigma) como sustratos a 37 ºC en una solución amortiguadora de acetato de sodio 0.1 M (Merck, Darmstad, Alemania) a pH 3.5 durante 30 min. El ácido neuramínico liberado se determinó mediante un microensayo modificado del método del ácido tiobarbitúrico, usando una curva de ácido neuramínico puro, de acuerdo con el protocolo publicado previamente (Santos-López et al. 2004b).
Ensayos de hemólisis. La actividad hemolítica de los virus se determinó mediante la incubación de una suspensión de eritrocitos de carnero al 3% con cada una de las cepas virales (16 UHA). Las réplicas (triplicados) de la mezcla virus-eritrocito se incubaron durante 1, 2 y 3 hr a 37 ºC. La mezcla se centrifugó a 500xg/5 min y la densidad óptica (DO) del sobrenadante (175 µl) se determinó en una placa de de microensayo a 450 nm. Como testigo negativo se utilizó PBS y su valor de DO se extrajo a los valores de DO de cada muestra. Los títulos de hemólisis se reportaron en porcentaje, asumiendo como 100% la DO de una solución de NaCl 75 mM, utilizada como testigo positivo.
Estabilidad térmica de la proteína HN. Para explorar algunas diferencias fisicoquímicas entre las tres proteínas HN, los viriones purificados se pre-incubaron a diferentes tiempos y temperaturas para después determinar las actividades HA y NA. Las actividades residuales de HA y NA se reportaron en porcentaje respecto a un testigo no preincubado, los títulos de elución se reportaron en UHE residuales.
Análisis estadísticos. Para comparar de manera confiable los valores obtenidos en los distintos métodos analíticos para las tres cepas virales se realizaron pruebas de análisis de varianza (ANOVA) utilizando el sistema de acceso gratuito disponible en el sitio electrónico: http://home.ubalt.edu/ntsbarsh/Businessstat/
otherapplets/ANOVA.htm. Las diferencias se consideraron estadísticamente significativas para valores de p = 0.05.
Resultados
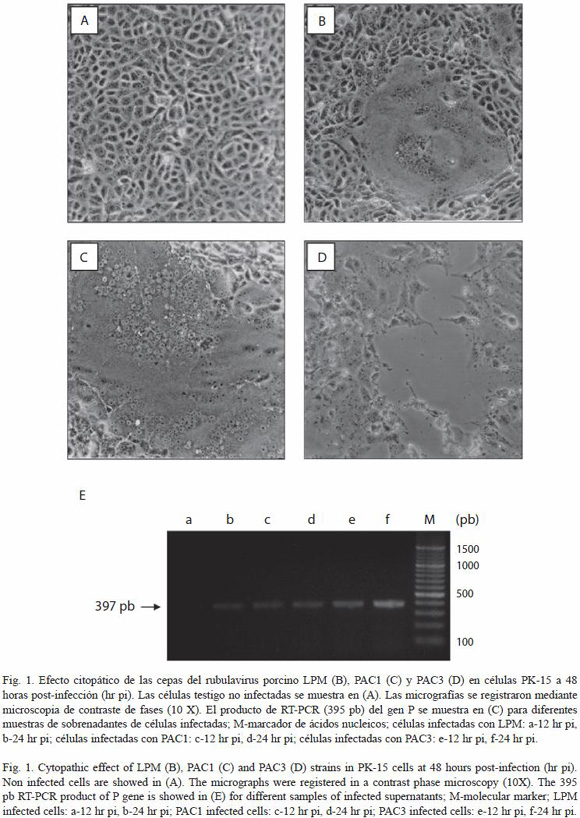
Efecto citopático (ECP). Los efectos típicos de los paramixovirus en cultivo celular, la formación de sincicios y la citólisis se observaron durante la infección con cada una de las cepas virales. La Figura 1A a 1D muestra el ECP a las 48 horas post-infección (pi) para cada una de las cepas virales estudiadas. Los primeros sincicios fueron evidentes, mediante la microscopia de contraste de fases, en la infección con LPM entre las 12 y 14 hr pi, con PAC1 entre las 18 y 20 hr pi y con PAC3 hasta aproximadamente las 24 hr pi. Aunque PAC1 mostró sincicios después de LPM, el crecimiento de los mismos (medido por el número de núcleos incluidos en el sincicio) fue registrado en menor tiempo. De tal manera, las células infectadas con PAC1 mostraron sincicios entre 60 y 80 núcleos a 48 hr pi, mientras que LPM mostró sincicios que incluían entre 40 y 50 núcleos y PAC3 sincicios de sólo 20 a 30 núcleos a este mismo tiempo (Cuadro 1). El otro cambio visible mediante microscopia de contraste de fases fue la lisis celular, la cual se presentó de manera inversa a la fusión celular. Los primeros focos de lisis se registraron en la infección con PAC3 a las 16-18 hr pi, alcanzando casi el 50% de lisis a las 72 hr pi. En contraste, las cepas PAC1 y LPM indujeron el 50% de lisis hasta las 96 y 120 hr pi, respectivamente. La lisis total de las células infectadas se observó en el mismo orden a las 96, 120 y 148 hr pi, aproximadamente (Cuadro 1).
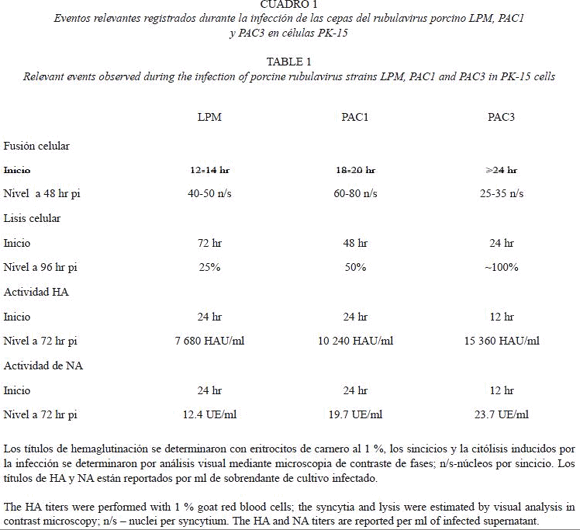
Actividades de la proteína HN durante la infección en cultivo celular. El seguimiento de las actividades HA y NA en cultivo celular se llevó a cabo de 0 a 120 hr pi. La actividad HA se detectó en el sobrenadante viral a las 12 hr pi en la infección con PAC3, mientras que en las infecciones con LPM y PAC1 se detectó hasta las 24 hr pi. El valor máximo de la HA se observó en todos los ensayos de infección a las 72 hr pi (Cuadro 1), el cual se conservó hasta las 120 hr pi (dato no mostrado). Por otro lado, las células infectadas con PAC3 presentaron valores detectables de NA a las 12 hr pi, mientras que para LPM y PAC1 se registró hasta las 24 hr pi. La actividad se incrementó significativamente hasta las 72 hr pi (Cuadro 1) y presentó variaciones menores hasta las 120 hr pi (dato no mostrado). Ambas actividades de la cepa PAC3 se observaron como los valores más altos a los largo del experimento.
Detección del ARN viral en los sobrenadantes de cultivos infectados. La presencia del genoma viral se detectó mediante RT-PCR a las 12 hr pi para los tres virus, sin embargo, el producto de RT-PCR fue más intenso para el caso del sobrenadante de PAC3, tanto a las 12 como a las 24 hr pi (Figura 1E). De hecho el producto de RT-PCR para LPM a las 12 hr pi prácticamente no es visible en el gel (carril a, Figura 1E). Estos resultados, a pesar de que el ensayo de RT-PCR realizado no es estrictamente cuantitativo, fueron reproducibles y confirman la salida más rápida de la progenie viral en las células infectadas con PAC3.
Perfiles de hemaglutinación de las cepas virales. Se incubaron eritrocitos de diferentes especies con 100 TCID50 de cada virus purificado (Figura 2A). Los más altos valores de aglutinación se alcanzaron con los eritrocitos de carnero para los tres virus (PAC3:128, PAC1: 86; LPM: 64 UHA). Con eritrocitos de pollo PAC1 y PAC3 tuvieron títulos altos de 64 y 128 UHA, respectivamente, en contraste, LPM presentó un título bajo de sólo 3 UHA. Otras diferencias se observaron con los eritrocitos de conejo, ya que PAC1 y PAC3 mostraron el mismo título (8 UHA) mientras que LPM no aglutinó estas células. En el caso de los eritrocitos humanos tipo O, fueron mejor aglutinados por PAC1 (32 UHA), los ensayos para LPM y PAC3 presentaron títulos de sólo 8 UHA.
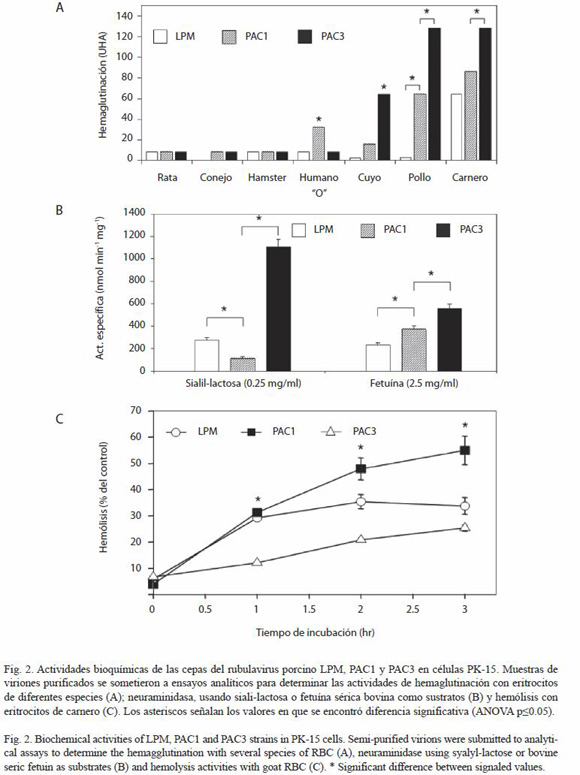
Actividad de neuraminidasa. La cepa PAC3 mostró la mayor actividad de NA (1 103.4 nmol min-1 mg-1), que representa más de cuatro veces la de LPM (275.9 nmol min-1 mg-1) y cerca de 10 veces la de PAC1 (114.9 nmol min-1 mg-1) usando sialil-lactosa como sustrato (0.25 mg/ml). Cuando se utilizó fetuína como sustrato (2.5 mg/ml), las cepas presentaron un patrón diferente. Aunque PAC3 presentó también la mayor actividad (557.6 nmol min-1 mg-1), el valor intermedio correspondió a PAC1 (370.6 nmol min-1 mg-1) y el más bajo a LPM (233.2 nmol min-1 mg-1) (Figura 2B).
Ensayos de hemólisis. La actividad hemolítica de los paramixovirus está relacionada directamente con sus propiedades fusogénicas (proteína F), por lo cual es una técnica semicuantitativa para evaluar la promoción de la fusión de un virus. Para estos ensayos se usaron los eritrocitos que presentaron mayores títulos de aglutinación (carnero) en suspensión al 3% y el mismo título de hemaglutinación (16 UHA) para cada virus. La cepa PAC1 presentó el título más alto de hemólisis, luego LPM y finalmente PAC3 (Figura 2C). Así, a las 3 hr de incubación de la mezcla virus/eritrocitos, PAC1 (55%) presentó más del doble de absorbancia que PAC3 (25%) y casi 1.5 veces más que LPM (34%).
Termoestabilidad de las actividades de la proteína HN
Hemaglutinación. Todas las cepas mantuvieron el 100% de su actividad hemaglutinante (8 UHA) después de los diferentes tratamientos térmicos (pre-incubación) entre 37-60 ºC por períodos de 10-60 min. La actividad HA de la cepa LPM se eliminó completamente después de la pre-incubación a 70 ºC/10 min, mientras que la actividad de PAC1 y PAC fue más resistente, conservándo sus 8 UHA aún después de este tratamiento. La actividad de PAC3 se eliminó cuando se pre-incubó el virus a 70 ºC/20 min y la de PAC1 hasta que el tiempo de incubación a esta temperatura se llevó a 30 min (Figura 3A).
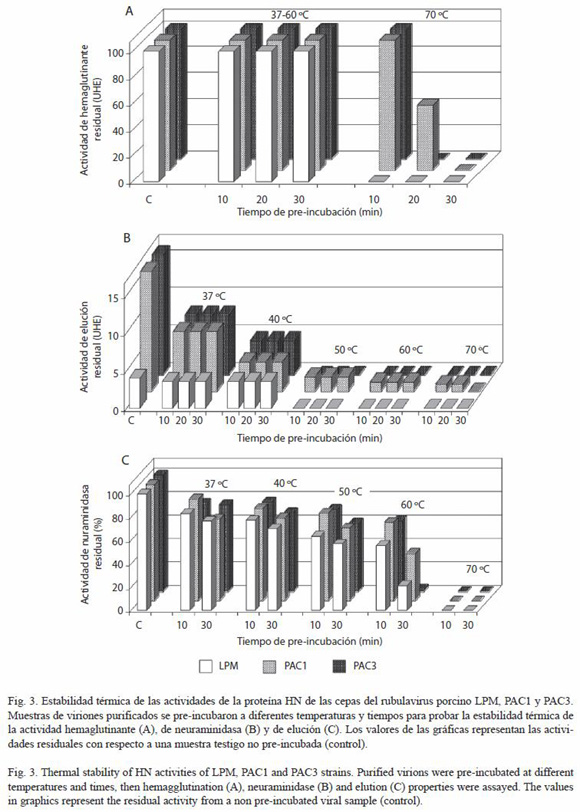
Elución. Debido a las diferencias en la actividad de neuraminidasa de las tres cepas, las 8 UHA de PAC1 y PAC3, las cuales eluyeron a las 0.5 hr, presentaron 16 UHE (es decir, 8 UHA/0.5 hr), mientras que las 8 UHA de LPM, que tomaron 2 hr en eluir se calculó en 4 UHE (es decir, 8 UHA/2 hr). Este patrón se conservó después de los pre-tratamientos térmicos con cada virus (Figura 3B). Lo que se puede observar también es que la actividad de elución es algo más sensible que la HA, ya que la preincubación a 50 ºC por 10 min fue suficiente para eliminar la actividad de elución de las cepas LPM y PAC3, aunque conservan aún su actividad HA (Figura 3A y 3B). La actividad de elución de PAC1 se conservó durante más tiempo y a temperaturas más altas que para las otras dos cepas, ya que aún se observó este proceso después de la incubación a 70 ºC/20 min.
Neuraminidasa. La actividad residual después de 10 min de pre-incubación fue similar para cada cepa, manteniéndose alrededor de 80% a 37 y 40 ºC, bajando en más de 20% cuando la temperatura se incrementó a 60 ºC. La actividad NA de las tres cepas se eliminó completamente cuando se realizó la incubación a 70 ºC durante 10 min (Figura 3C). Por otro lado, cuando los virus se pre-incubaron durante 30 min, el patrón de descenso en la actividad fue similar a 37, 40 y 50 ºC pero cerca de 10% menor que en los ensayos de 10 min. Cuando las enzimas se pre-incubaron a 60 ºC/30 min, la actividad más alta fue para PAC1, que retuvo cerca de 41% de su actividad original, mientras que LPM presentó 22% y PAC3 sólo 2%. Las diferencias encontradas, analizadas por separado, ya sea para 10 o 30 min, no son estadísticamente significativas entre los tres virus hasta las incubaciones de 60 ºC, tanto para 10 como para 30 min de pre-incubación (ANOVA p=0.05), en las que se muestra que la cepa con mayor termoestabilidad es PAC1.
Discusión
Debido a las diferencias en los cuadros clínicos con que se presenta los brotes de la enfermedad del ojo azul (Reyes-Leyva et al. 2002), se seleccionaron tres cepas virales que difieren en sus manifestaciones clínicas (LPM, PAC1 y PAC3) para estudiar algunas de sus propiedades biológicas.
Mediante microscopia se observó que en las primeras horas, las células infectadas por la cepa LPM presentaron una mayor actividad de fusión celular. Sin embargo, en las células infectadas por PAC1 se presentó un crecimiento más rápido en el tamaño de los sincicios, llegando a duplicar el número de núcleos por sincicio causados por LPM a las 48 hr pi. Los ensayos de hemólisis correlacionan con estos datos ya que la cepa de mayor actividad fue PAC1, seguida por LPM y por PAC3. La actividad de fusión, dependiente principalmente de la proteína F, ha sido relacionada directamente con la actividad hemolítica, tanto que la proteína F fue llamada proteína de hemólisis por muchos años (Scheid y Choppin 1974, Devireddy et al. 1999).
En contraste, la lisis celular en el cultivo se observó primero en la infección por PAC3, a las 18 hr pi. Los primeros focos de lisis aparecieron más tarde en la infección con las otras dos cepas: hasta las 48 hr pi (PAC1) y 72 hr pi (LPM). De acuerdo con estos datos, ambos efectos citopáticos parecen ser características distintivas entre estas cepas, ya que la aparente virulencia de PAC3 in vitro, debido a la citólisis, es notablemente más alta que las de LPM y PAC1, mientras que esta última es la que presenta un mayor potencial de fusión celular.
Por otro lado, durante el seguimiento de la infección, la cepa PAC3 fue la primera en presentar las actividades HA y NA y siempre con los títulos más altos. Esto sugiere la existencia de una relación directa entre las actividades de la proteína HN y la virulencia. Tal relación se ha discutido en estudios con otros virus de la familia, como los virus de parainfluenza (Moscona and Peluso 1991, 1992; Huberman et al. 1995, Porotto et al. 2001), donde se sugiere que virus deficientes en actividad NA inducen mayor fusión celular, mientras que virus con actividades altas de NA son menos fusogénicos, porque la actividad enzimática elimina el receptor de las células vecinas y esto reduce la infección viral célula-célula. También se ha postulado que las dos actividades de la proteína HN, hemaglutinación y neuraminidasa, se encuentran equilibradas en las variantes naturales, tanto en paramixovirus como en ortomixovirus; es decir, que si por alguna mutación se causa una ganancia en actividad HA, también se eleva la actividad de NA y, viceversa; ambas actividades pueden disminuir de manera coordinada (Solórzano et al. 2000).
El virus con mayor actividad enzimática (PAC3) induce sincicios de manera más lenta que las otras cepas pero por otro lado, la lisis celular comienza en una etapa más temprana de la infección, lo cual podría favorecer la salida de viriones al medio así como una mejor distribución de los mismos en la monocapa celular, causando mayores daños en menos tiempo. Recientemente nuestro grupo ha reportado un proceso similar en la infección de dos clonas obtenidas de la cepa vacunal Urabe AM9 del virus de la parotiditis (Santos-López et al. 2006, Reyes-Leyva et al. 2007). Una de las clonas virales, denominada HN-G1081, induce un mayor nivel de fusión celular en células Vero (riñón de mono) y posee un más bajo nivel de neuraminidasa que la otra clona denominada HN-A1081. Este hecho podría estar relacionado con la virulencia, ya que virus con genotipo HN-A1081 han sido asociados directamente con la meningitis post-vacunal. Es posible que la neuraminidasa sea un factor para el virus que le permita un mayor grado de movilidad y pueda migrar hacia distintos sitios dentro del organismo.
En otros trabajos se ha demostrado que virus con actividad baja en NA tienden a formar auto-agregados o pueden permanecer por tiempo indefinido unidos a glicoconjugados en la membrana de la célula hospedera, retardando la salida de la progenie viral, lo cual disminuye la difusión de los viriones en el medio y por lo tanto el daño, en contraste, los virus con alta actividad de NA pueden dispersarse mejor en el medio y llegar a lugares alejados del sitio inicial de infección (Yamamoto-Goshima et al. 1994, Liu et al. 1995). Con estos antecedentes, en el caso del RVP, la neuraminidasa puede estar involucrada en la infección sistémica de cerdos adultos, lo cual es observado en ciertas cepas, tales como PAC1 y PAC3 (Reyes-Leyva et al. 2002).
La lisis de las células infectadas por PAC3 se observó antes que la aparición de los sincicios. Esto puede asociarse con la salida temprana de los viriones respecto a las otras dos cepas, lo cual es apoyado por los ensayos de RT-PCR. Sin embargo, PAC1 es un aislamiento obtenido de un brote neurológico y reproductivo que incluyó cerdos de todas las edades, en contraste con los hallazgos clínicos de la infección por PAC3, que involucró principalmente signos reproductivos en adultos durante la infección natural y también durante una infección experimental (Ramírez-Mendoza et al. 1997, Reyes-Leyva et al. 2002). Este hecho sugiere que las actividades HA y NA, así como el efecto citopático en cultivo celular no son suficientes para establecer el grado de virulencia entre estos dos aislamientos, sobre todo considerando que PAC1 es la cepa más virulenta in vivo.
En busca de otras diferencias entre los aislamientos del RVP, se investigaron otros aspectos de la funcionalidad de HN. La cepa PAC1 posee una actividad relativa más alta cuando el sustrato es fetuína que cuando es sialil-lactosa comparada con LPM o PAC3. Esto sugiere que en la fetuína existe algún factor que podría influenciar la conformación de la HN de la cepa PAC1 para aumentar su nivel catalítico con respecto a la pequeña molécula de sialillactosa, es decir, que a pesar de que en ambos casos, la enzima podría actuar directamente sobre un trisacárido muy similar, ya que la fetuína contiene cadenas de carbohidratos que terminan en sialil-lactosa, esta glicoproteína podría tener ventaja mediante alguna interacción independiente del sitio activo de la HN que promueva su actividad enzimática.
Otros estudios que sugieren diferencias estructurales son los de termoestabilidad. Se demostró que la HN del RVP es una proteína altamente termoestable, hecho que ya se había explorado para la cepa LPM (Reyes-Leyva et al. 1999, Santos-López et al. 2004b). Es importante apuntar que PAC1 mostró un nivel más alto de resistencia a la temperatura, lo cual también sugiere que su HN posee características diferentes a las de LPM y PAC3, que le permiten mantener un mínimo de su estructura funcional después del tratamiento térmico. Estas probables diferencias pueden influir también en otros aspectos funcionales de los virus, tales como el tropismo viral o la susceptibilidad celular durante la infección. Sin embargo la especificidad y afinidad de la proteína, así como otros parámetros bioquímicos deben ser estudiados con mayor detalle.
Las propiedades analizadas en este estudio apuntan hacia la variabilidad entre las distintas cepas virales aisladas en diferentes lugares y años, sin embargo es importante reforzar los hallazgos con un mayor número de cepas asociadas con cada patología. Es posible que se estén registrando eventos de variabilidad genética y antigénica, sobre todo porque la proteína HN es el elemento más antigénico (Hernández et al. 1998) y la presión de selección puede originar cambios tanto en la superficie expuesta como en las diferentes propiedades biológicas de esta proteína multifuncional. De tal manera, resulta importante la investigación de mutaciones en éste y otros genes y estudiar los efectos funcionales, así como el escape a la respuesta inmune del hospedero. Estas tareas ya están siendo abordadas por nuestro grupo de investigación.
Resumen
El Rubulavirus porcino causa un síndrome neurológico y reproductivo en cerdos, hasta ahora reportado sólo en México. Los virus aislados se agrupan de acuerdo con los síntomas principales observados durante los brotes en: a) neutrópicos en lechones, b) neurotrópicos en lechones/gonadotrópicos en adultos y c) gonadotrópicos en adultos. En este trabajo se estudiaron tres cepas: La Piedad Michoacán (LPM) y Producción Animal "Cerdos" 1 (PAC1) y 3 (PAC3), ubicadas respectivamente en cada grupo. Las propiedades estudiadas se relacionan principalmente con dos proteínas de la envoltura viral, la hemaglutinina-neuraminidasa (HN) y la proteína de fusión (F). Se cuantificaron el efecto citopático y las actividades de hemólisis, hemaglutinación (HA) y neuraminidasa (NA). En cultivo celular la cepa PAC1 presentó una mayor actividad fusogénica, sin embargo PAC3 presentó la mayor actividad citolítica. La cepa PAC3 fue la primera en ser detectada en sobrenadante de células infectadas (HA, NA y genoma), lo que muestra que sus viriones son liberados al medio antes que las otras dos cepas. PAC3 tuvo las actividades más altas de HA y NA, sin embargo, PAC1 presentó una mayor termoestabilidad en estas actividades de HN y un perfil de substrato algo distinto de los observados para LPM y PAC3. Estos datos sugieren que la actividad de NA está relacionada con la virulencia del RVP.
Palabras clave: Enfermedad del ojo azul, LPMV, hemaglutinina-neuraminidasa, Paramyxoviridae, Rubulavirus, virulencia.
Referencias
Blake, K. & S. O´Connell. 1993. Virus culture, p. 81-122. In D.R. Harper (ed) Virology, Lab Fax. Bios Scientific, Oxford, Inglaterra. [ Links ]
Devireddy, L.R., Raghavan, S. Ramachandran & M.S. Shaila. 1999. The fusion protein of peste des petits ruminants virus is a hemolysin. Arch. Virol. 44:1241-7. [ Links ]
Hernández, J., J. Reyes-Leyva, R. Zenteno, H. Ramírez, P. Hernández-Jáuregui & E. Zenteno. 1998. Immunity to porcine rubulavirus infection in adult swine. Vet. Immunol. Immunopathol. 64:367-81. [ Links ]
Huberman, K., R.W. Peluso & A. Moscona. 1995. Hemagglutinin-neuraminidase of human parainfluenza 3: role of the neuraminidase in the viral life cycle. Virology 214: 294-300. [ Links ]
Lamb, R.A. & D. Kolakofsky. 2001. Paramyxoviridae: the viruses and their replication, p. 1177-1204. In D.M. Knipe & P.M. Howley (eds). Fields Virology. Lippincott, Williams & Wilkins, Filadelfia, Pensilvania, E.U.A. [ Links ]
Liu, C., M.C. Eichelberger, R.W. Compans & G.M. Air. 1995. Influenza type A virus neuraminidase does not play a role in viral entry, replication, assambly or budding. J. Virol 69:1099-106. [ Links ]
Moreno-Lopez, J., P. Correa-Giron, A. Martinez & A. Ericsson. 1986. Characterization of a paramyxovirus isolated from the brain of a piglet in Mexico. Arch. Virol. 91:221-31. [ Links ]
Moscona, A. & R.W. Peluso. 1991. Fusion properties of cells persistently infected with human parainfluenza virus type 3: participation of hemagglutinin-neuraminidase in membrane fusion. J. Virol. 65:2773-2777. [ Links ]
Moscona, A. & R.W. Peluso. 1992. Fusion properties of cells infected with human parainfluenza virus type 3: receptor requirements for viral spread and virusmediated membrane fusion. J. Virol. 66: 6280-6287. [ Links ]
Porotto, M., O. Greengard, N. Poltoratskaia, M.A. Horga & A. Moscona. 2001. Human parainfluenza virus type 3 HN-receptor interaction: effect of 4-guanidinoNeu5Ac2en on a neuraminidase-deficient variant. J. Virol. 75:7481-8. [ Links ]
Ramírez-Mendoza, H., P. Hernandez-Jauregui, J. Reyes-Leyva, E. Zenteno, J. Moreno-Lopez & S. Kennedy. 1997. Lesions in the reproductive tract of boars experimentally infected with porcine rubulavirus. J. Comp. Pathol. 117:237-52. [ Links ]
Reyes-Leyva, J., B. Espinosa, J. Hernández, R. Zenteno, V. Vallejo, P. Hernández-Jáuregui & E. Zenteno. 1997. Neua3-Gal glycoconjugate expresion determines cell susceptibility to the porcine rubulavirus LPMV. Comp. Bioch. Physiol. 118B:327-332. [ Links ]
Reyes-Leyva, J., B. Espinosa, G. Santos, R. Zenteno, J. Hernandez, V. Vallejo & E. Zenteno. 1999. Purification and characterization of the hemagglutinin-neuraminidase of Porcine rubulavirus LPMV. Glycoconj. J. 16:517-22. [ Links ]
Reyes-Leyva, J., G. Santos-López, J. Hernández, B. Espinosa, M.T. Borraz-Arguello, H. Ramírez, V. Vallejo & E. Zenteno. 2002. Mecanismos moleculares de la patogenia viral: Estudios con el Rubulavirus porcino, p. 99-127. In A. Cea Bonilla, I.P. del Arenal Mena, H. Riveros Rosas, E. Vázquez Contreras (eds). Mensaje Bioquímico, Vol XXVI. UNAM, México, D.F., México. [ Links ]
Reyes-Leyva, J., R. Baños, M. Borraz-Argüello, G. Santos-López, N. Rosas, G. Alvarado, I. Herrera, V. Vallejo & J. Tapia-Ramírez. 2007. Amino acid change 335 E to K affects the sialic-acid-binding and neuraminidase activities of Urabe AM9 mumps virus hemagglutininneuraminidase glycoprotein. Microbes Infect. 9:234-40. [ Links ]
Santos-López, G., J. Hernández, M.T. Borraz-Argüello, H. Ramírez-Mendoza, V. Vallejo & J. Reyes-Leyva. 2004a. Estructura y función e implicaciones patológicas de las proteínas del Rubulavirus porcino. Rev. Vet. Med. 36:119-136. [ Links ]
Santos-López, G., E. Flores, R. Baños, I. Herrera-Camacho & J. Reyes-Leyva. 2004b. Purification of Porcine rubulavirus attachment protein by isoelectric focusing. Prot. Expr. Purif. 35:120-125. [ Links ]
Santos-López, G., C. Cruz, N. Pazos, V. Vallejo, J. Reyes-Leyva & J. Tapia-Ramírez. 2006. Two clones obtained from Urabe AM9 mumps virus vaccine differ in their replicative efficiency in neuroblastoma cells. Microbes Infect. 8:332-9. [ Links ]
Scheid, A. & P.W. Choppin. 1974. Identification of biological activities of paramyxovirus glycoproteins. Activation of cell fusion, hemolysis, and infectivity of proteolytic cleavage of an inactive precursor protein of Sendai virus. Virology 57:475-90. [ Links ]
Solorzano A, Zheng H, Fodor E, Brownlee GG, Palese P, Garcia-Sastre A. 2000. Reduced levels of neuraminidase of influenza A viruses correlate with attenuated phenotypes in mice. J. Gen. Virol. 81:737-42. [ Links ]
Stephano, H.A. 1993. Blue Eye diseases, p. 237-241. In A.D. Leman, B.F. Straw, W.L. Mengeling, A.D. Allaire & D.J. Taylor (eds). Swine Diseases. Iowa State University, Ames, E.U.A. [ Links ]
Sundqvist, A., M. Berg, P. Hernández-Jáuregui, T. Linné, J. Moreno-López. 1990. The structural proteins of a porcine paramyxovirus (LPMV). J. Gen. Virol. 71:609-613. [ Links ]
Yamamoto-Goshima, F., K. Maeno, T. Morishita, M. Ueda, Y. Fujita, K. Nakajima & S. Yoshii. Role of neuraminidase in the morphogenesis of influenza B virus. J. Virol. 68:1250-1254. [ Links ]












 uBio
uBio 

