La leishmaniasis mucocutánea es una zoonosis transmitida por la picadura de un flebótomo o mosquito hembra de tres géneros frecuentes: Flebótomus en el Viejo Mundo, y Lutzomya y Psychodopygus en el Nuevo Mundo.1,2Dentro del mosquito adquiere la forma de promastigoto y cuando es inoculado en el ser humado en las células del sistema reticuloendotelial, la de amastigota. La leishmaniasis del nuevo mundo es causada por Leishmania b. braziliensis y Leishmania b. panamensis.
El hombre originalmente no pertenece al ciclo de transmisión de este parásito, pero la irrupción del hábitat boscoso y de su ecosistema, ha convertido al ser humano en un huésped accidental.1 La globalización, el aumento de extranjeros que visitan los bosques nacionales, el aumento de la población con el desarrollo y la expansión de la economía, hacen que el hombre invada cada vez más los bosques en donde viven los vectores de la leshmania.3 El tratamiento de elección tradicional ha sido el empleo de los antimoniales pentavalentes, como el antimoniato de meglumina (Glucantime®) y el estibogluconato de sodio (Pentostam®), pero sus efectos secundarios, como la cardiotoxicidad, hacen que algunas personas con cardiopatía de fondo no sean candidatas al uso de este tratamiento y, por tal razón, buscan el uso de nuevas opciones terapéuticas.
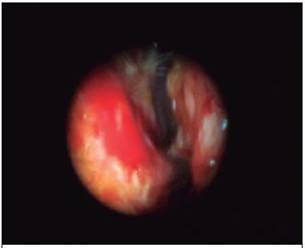
Figura 1: Endoscopia nasal realizada en el Servicio de ORL del Hospital de Grecia, que muestra una mucosa nasal enrojecida, con múltiples ulceraciones superficiales de color blanco.
Se presenta a continuación un caso de leishmaniasis mucocutánea tratada con miltefosine (Impávido®), en un paciente cuyas enfermedades de fondo contraindicaban el uso de Glucantime®.
Presentación del caso
Paciente masculino de 78 años, vecino de Naranjo de Alajuela, agricultor, casado y católico, con antecedentes familiares de hipertensión arterial y cáncer gástrico en la madre, sin antecedentes patológicos o quirúrgicos de importancia, y conocido con antecedentes patológicos de hipertensión arterial, diabetes mellitus tipo 2, fibrilación atrial de adecuada respuesta ventricular crónica, anticoagulado e historia de un evento cerebrovascular isquémico sufrido hace 4 años; tratamiento actual con: enalapril, glibenclamida, digoxina y warfarina.
Se presenta a la consulta de Otorrinolaringología (ORL) del Hospital de Grecia, con una ulceración superficial con bordes elevados de color violáceo y fondo de úlcera con costras hemáticas en el hélix del oído derecho; se le realiza una endoscopía en la cual se observa múltiples ulceraciones en la mucosa nasal con desviación del septo nasal y una presbiacusia.
Se decide envío de un frotis y cultivo por Leishmania de la dermatosis, y referencia al Servicio de Dermatología del mismo centro. Al ser visto por el dermatólogo del Hospital se determina realizarle una biopsia escisional para tinción por hematoxilina y eosina, con el fin de descartar posible proceso tumoral versus proceso infeccioso. Tiempo posterior llega el resultado de la biopsia con el diagnóstico de dermatitis granulomatosa infecciosa inespecífica. Se interroga a fondo al paciente, quien revela que 1 año antes del inicio de los síntomas había sido picado por un mosquito en San Carlos, de manera que con esa historia y el reporte histopatológico, se procede con el envío y coordinación de una reacción de Montenegro al Hospital México, la cual se reporta positiva. Con dicha evidencia se realiza una biopsia por el servicio de ORL en la mucosa nasal, para hacer una reacción en cadena de la polimerasa (PCR, por sus siglas en inglés) por Leishmania, la cual se efectuó en el Hospital Nacional de Niños, y fue reportada positiva por Leishmania panamensis.
El caso se discutió en la sesión general del Servicio de Dermatología del Hospital México, donde se decide, por la condición del paciente y sus padecimientos de fondo, tratamiento con miltefosine 1 comprimido cada 12 horas por un periodo de 2 meses. Tras el primer mes de tratamiento se realiza, por parte del especialista de ORL, una biopsia en la mucosa nasal, con el propósito de efectuar una nueva PCR por Leishmania, la cual fue reportada negativa en el Hospital Nacional de Niños.
Discusión
La leishmaniasis mucocutánea en el nuevo mundo es una enfermedad que puede ser producida por: Leishmania (V) braziliensis, Leishmania (V) panamensis, Leishmania amazonensis, Leishmania (V) guyanensis,4 cuya transmisión se realiza por medio del mosquito del género Phlebotomus en el Viejo Mundo, y Lutzomyia o Psychodopygus en el Nuevo.4 Dentro del mosquito el protozoario se encuentra en la forma de promastigoto y al ser inoculado en la piel, posteriormente es fagocitados por macrófagos y se transforma en amastigoto.3
Las lesiones cutáneas clínicamente se observan como nódulos, luego se ulceran y forman placas con una úlcera crateriforme con fondo necrótico y borde violáceo, a menudo cubiertas de costras adherentes,4 como en el caso de este paciente, cuya lesión se encontró en el hélix del oído derecho, sitio de inoculación por el mosquito transmisor. La diseminación del parásito de la Leishmania del nuevo mundo, de la lesión primaria en piel a la mucosa, puede ocurrir en meses o años después de la aparición de la lesión cutánea primaria,3 tal y como se reporta en este paciente, pues ocurre en un periodo de 8 meses. La anatomía vascular de las cavidades nasales y específicamente del septo nasal, favoreció el depósito de parásitos -en este caso la Leishmania-; el depósito de parásitos interfirió con el aporte vascular de las estructuras cartilaginosas, lo que llevó a un deterioro de la estructura comprometida y produjo primero lesiones ulcerosas, y en segunda instancia, lesiones excrementes cicatrizales; dicho proceso fue el resultado a largo plazo de una leishmaniasis cutánea no tratada5 (Figura 1).
Entre los diagnósticos diferenciales de la leishmaniasis cutánea se encuentran: esporotricosis, micobacteriosis típica y atípica, úlceras por infecciones bacterianas y traumáticas, carcinoma basocelular, epidermoide o melanomas; en cuanto a la afección de la mucosa nasal se puede diferenciar con rinoescleroma, lepra lepromatosa, paracoccidioidomicosis, granulomatosis de wegener, carcinoma y linfomas nasofaríngeos.6,4El diagnóstico se basó en la historia epidemológica, el frotis y cultivo de lesiones mucocutáneas en medio de Novy-MacNeal-Nicolle (NMN) o Schneider’s, con la demostración del parásito cuya sensibilidad es muy baja (50%), esto se demostró en tanto el resultado fue negativo; la Leishmania, que es una reacción de hipersensibilidad retardada (reacción de Montenegro) dio positiva en el paciente, por ser no alérgico, y la biopsia para histología de una muestra de piel para tinción por hematoxilina y eosina, con células gigantes multinucleadas y células linfohistiocíticas que concordaron con la muestra enviada, a pesar de que fue negativo el hallazgo de amastigotos intracelulares (cuerpo de Leishman-donovan) o extracelulares; este factor diagnóstico siempre dependerá de la experiencia y habilidad para reconocer el parásito por parte del patólogo; la técnica de detección molecular como la PCR por Leishmania, que ofrece una especificidad y sensibilidad superior a los métodos anteriores,4,7-9fue positiva por Leishmania panamensis en este caso, afirmando lo descrito en la bibliografía mundial.
El tratamiento de elección son los antimoniales pentavalentes, como el antimoniato de N-metil-glucamina (Glucantime®) y el estibogluconato de sodio (Pentostam®), entre cuyos efectos secundarios se encuentran: dolor musculoesqulético, náuseas, vómitos, diarrea y dolor abdominal, cefalea, fiebre, exantema, eritema y urticaria. Esto no se utilizó en el paciente, debido al tratamiento de fondo asociado, ya que en un anticoagulado, la inyección intramuscular se asocia a hematomas y dolor de leve a moderado en el sitio de la aplicación,10 y debe tomarse en cuenta que en la institución se dispone solo del Glucantime® de aplicación intramuscular. Las reacciones en casos de inyecciones intravenosas son: flebitis, tromboflebitis y edema en sitios de inserción del catéter; además, se ha reportado aumento entre leve y moderado, de las enzimas hepáticas y pancreáticas.10 Siempre que se desee aplicar los antimoniales pentavalentes se debe considerar las comorbilidades del paciente, ya que entre las anormalidades electrocardiográficas se encuentran la prolongación del intervalo QT y alteraciones en la repolarización ventricular, con afección de la onda T y segmento S-T en el electrocardiograma,10,11y para evitar cualquier complicación debido al medicamento, por la fibrilación auricular crónica de base que tiene el paciente, se evitó utilizarlo. Otra opción terapéutica como la pentamidina, que interfiere con la síntesis del ADN del protozoario, y cuyos efectos secundarios suelen ser: hipoglicemia, hipotensión, cefalea, incremento del nitrógeno ureico y creatinina, diabetes, pancreatitis, leucopenia con alteraciones de la onda T y segmento S-T en el electrocardiograma,3 por obvias razones no se consideró.
El uso de anfotericina B, que en muchos países industrializados se considera como tratamiento de segunda opción, actúa sobre el ergosterol, que es un esteroide presente en la Leishmania, causando un incremento en la permeabilidad de la membrana celular, produciendo una entrada de iones dentro del parásito y provocando la muerte.3 Su nefrotoxicidad y efectos secundarios hacen de esta una droga de uso intrahospitalario;3,2al analizar el caso del paciente, su edad avanzada y el hecho de estar lejos de la familia, se determinó que la posibilidad de un cuadro depresivo que aumentaría la polifarmacia y la estancia hospitalaria, por lo que tampoco se consideró esta opción.
El miltefosine como tratamiento para la leishmaniasis fue empleado desde el inicio como un agente antineoplásico, hasta que en la India, en 1998, se usó para tratar la leishmaniasis visceral. Hoy se utiliza en: Etiopía, India, Colombia, Bolivia y Guatemala, para el tratamiento de la leishmaniasis cutánea; a pesar de sus efectos secundarios gastrointestinales, leve elevación de transaminasas y creatinina y teratogenicidad, que la hacen una droga que debe evitarse o emplearse con mucha cautela en mujeres de edad reproductiva, se convierte una de las opciones terapéuticas mejor toleradas.12 En estudios realizados en Brasil con miltefosine (Impávido®), no se observó amastigotos en ratones tratados con dosis mayores de 30mg/ kg/día por 21 días, y para confirmar la cura de estos, se midió la carga parasitaria en sus tejidos a los 250 días de terminado el ciclo de miltefosine, por medio de la PCR. La cura clínica completa se obtuvo a dosis mayores de 30mg/kg/día,12 opción que al analizar las comorbilidades, el tratamiento y la recepción de la cura en el hogar, fue la alternativa más viable para el paciente.











 texto em
texto em 


